第五章相平衡
- 格式:doc
- 大小:65.00 KB
- 文档页数:12

第五章相平衡§5.1 引言相平衡是热力学在化学领域中的重要应用之一。
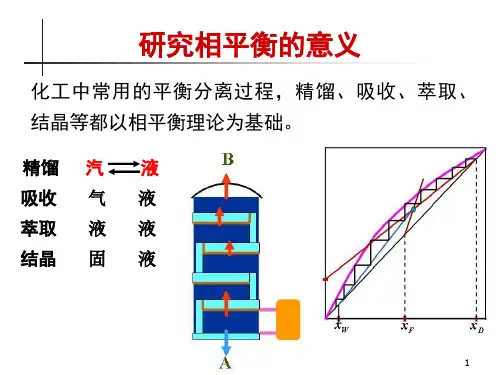
化工中很多分离提纯过程,例如精馏、吸收、结晶、萃取等,都涉及到物质在不同相中的分配,它们主要利用物质的挥发性或溶解度等方面的差异,以达到分离提纯的目的,相平衡亦可为此提供理论依据。
因此研究相平衡有着重要现实意义。
一、相(phase)体系内部物理和化学性质完全均匀的部分称为相。
相与相之间在指定条件下有明显的界面。
(1)气体,不论有多少种气体混合,只有一个气相。
(2)液体,按其互溶程度可以组成一相、两相或三相共存。
(3)固体,一般有一种固体便有一个相。
两种固体粉末无论混合得多么均匀,仍是两个相(固体溶液除外,它是单相)。
体系中相的总数用Φ表示。
二、相变物质从一个相流动到另一个相的过程,称为相变化,简称相变。
相变包括气化(boil)、冷凝(condensation)、熔化(melt)、凝固(freeze)、升华(sublimation)、凝华以及晶型转化等。
三、相图(phase diagram)将多相体系的状态随组成、温度、压力等强度性质的改变而发生的过程用图形表示,称为相图。
根据组成相的物态不同分为气-液相图、液-液相图和液-固相图。
根据用途不同可将相图分为温度-蒸汽压图(T-p图,P314 图5.1)、蒸汽压-组成图(p-x图,P318 图5.3):恒定温度,研究P-x,y之间的关系。
称为压力组成图。
温度-组成图(T -x 图,P321 图5.5):在恒定压力下表示二组分系统气-液平衡时温度与组成关系的相图。
研究T-x ,y 之间的关系。
和温度-蒸汽压-组成图(T -p -x 图,P322 图5.6),T-x-y ,x-y ,p-x-y 相图等。
四、自由度(degrees of freedom )确定平衡体系的状态所必须的压力、温度和浓度等独立强度性质的数目称为自由度,用字母f 表示。
如果已指定某个强度性质,除该性质以外的其它强度性质数称为条件自由度,用*f 表示。





第五章 相平衡一、本章基本要求1.掌握相、组分数和自由度的意义。
2.了解相律的推导过程及其在相图中的应用。
3.了解克劳修斯—克拉珀龙方程式的推导,掌握其在单组分两相平衡系统中的应用。
4.掌握各种相图中点、线及面的意义。
5.根据相图能够画出步冷曲线,或由一系列步冷曲线绘制相图.6.掌握杠杆规则在相图中的应用.7.结合二组分气液平衡相图,了解蒸馏与精馏的原理。
8.对三组分系统,了解水盐系统的应用,相图在萃取过程中的应用及分配定律的应用。
二、 基本公式和内容提要(一)基本公式相律的普遍形式:f K n =-Φ+ 克拉珀龙方程:mm d ln d V T H T p ∆∆= 克劳修斯—克拉珀龙方程的各种形式:微分式: 2m vap d ln d RT H T p ∆= vap m H ∆与温度无关或温度变化范围较小vap m H ∆可视为常数,定积分:vap m 211211ln ()H p p R T T ∆=- 不定积分式:vap mln H p C RT ∆=-+ 特鲁顿规则:K)J/(mol 88b mvap ⋅≈∆T H杠杆规则:以系统点为支点,与之对应的两个相点为作用点,有如下关系:1122()()n x x n x x -=-其中n 1 、n 2 分别表示平衡两相的摩尔数,x 、x 1、x 2分别表示系统的组成及其对应的平衡两相的组成。
(二)内容提要1.单组分系统 单组分系统相律的一般表达式为:f =1-Φ+2=3-Φ图5-1 水的相图可见单组分系统最多只能有三相平衡共存,并且最多有两个独立变量,一般可选择温度和压力。
水的相图为单组分系统中的最简单相图之一。
图5—1中三条曲线将平面划分成固、液及气相三个区.单相区内f =2。
AB 、AD 和AE 分别表示气液、气固和固液两相平衡线。
两相共存时f =1.虚线AC表示应该结冰而未结冰的过冷水与水蒸气平衡共存。
A 点为三相点,这时f =0,水以气、液、固三相共存。

第五章相平衡(Phase equilibrium)相平衡、热平衡和化学平衡是热力学在化学领域中的重要应用,也是化学热力学的主要研究对象。
相平衡研究对生产和科学研究具有重大的实际意义。
例如在化学研究和化学生产过程的分离操作中,经常会遇到各种相变化过程,如蒸发、冷凝、升华、溶解、结晶和萃取等,这些过程及到不同相之间的物质传递。
相平衡研究是选择分离方法、设计分离装置以及实现最佳操作的理论基础。
除了分离以外,相平衡及其基本理论还广泛应用于冶金、材料科学、地质矿物学、晶体生长等学科中,对这些部门的科研和生产有着重要的指导意义。
相平衡研究多相体系相变化规律,是热力学基本原理在化学领域中的重要应用。
“相律”是根据热力学原理推导出来的,以统一观点处理各种类型多相平衡的理论方法十分严谨明确。
它表明一个多相平衡体系的组分数、相数以及自由度之间的关系,可以帮助我们确定体系的平衡性质以及达平衡的必要条件。
然而,相律也有其局限性,它只能对多相平衡作定性描述。
可指明特定条件下平衡体系至多的相数以及为保持这些相数所必具的独立变量数。
但究竟是哪些相共存?哪些性质可作为独立变量以及它们之间的定量关系如何等问题,相律均无能为力。
这方面知识仍有待从实验中确定。
本章着重讨论各种相平衡体系所遵守的一个普遍规律----相律,以及各种基本类型的相图,具体分析体系的相平衡情况与温度、压力和组成等因素的关系,并举例说明其实际应用§5.1相律一、基本术语1、相:体系中物理性质和化学性质完全均匀的一部分称为相物质从一个相转移到另一个相的过程称为相变化过程,而相平衡状态就是相变化过程的极限,此时宏观上投有任何物质在相间传递。
此处“完全均匀”,是指体系中的物质在分子水平上的均匀混合的状态,此时即便是由多种物质构成的体系,但其物理性质和化学性质都达到了完全均匀的程度,用一般的仪器已分不出其界面了,形成一个均相体系。
多相体系中,相与相之间存在明显的界面,称为相界面。

第五章 相平衡一、本章基本要求1.掌握相、组分数和自由度的意义。
2.了解相律的推导过程及其在相图中的应用。
3.了解克劳修斯-克拉珀龙方程式的推导,掌握其在单组分两相平衡系统中的应用。
4.掌握各种相图中点、线及面的意义。
5.根据相图能够画出步冷曲线,或由一系列步冷曲线绘制相图。
6.掌握杠杆规则在相图中的应用。
7.结合二组分气液平衡相图,了解蒸馏与精馏的原理。
8.对三组分系统,了解水盐系统的应用,相图在萃取过程中的应用及分配定律的应用。
二、 基本公式和内容提要(一)基本公式相律的普遍形式:f K n =-Φ+ 克拉珀龙方程:mm d ln d V T H T p ∆∆= 克劳修斯-克拉珀龙方程的各种形式:微分式: 2m vap d ln d RT H T p ∆= vap m H ∆与温度无关或温度变化范围较小vap m H ∆可视为常数, 定积分:vap m 211211ln ()H p p R T T ∆=- 不定积分式:vap mln H p C RT ∆=-+ 特鲁顿规则:K)J/(mol 88b mvap ⋅≈∆T H杠杆规则:以系统点为支点,与之对应的两个相点为作用点,有如下关系:1122()()n x x n x x -=-其中n 1 、n 2 分别表示平衡两相的摩尔数,x 、x 1、x 2分别表示系统的组成及其对应的平衡两相的组成。
(二)内容提要1.单组分系统 单组分系统相律的一般表达式为:f =1-Φ+2=3-Φ图5-1 水的相图可见单组分系统最多只能有三相平衡共存,并且最多有两个独立变量,一般可选择温度和压力。
水的相图为单组分系统中的最简单相图之一。
图5-1中三条曲线将平面划分成固、液及气相三个区。
单相区内f =2。
AB 、AD 和AE 分别表示气液、气固和固液两相平衡线。
两相共存时f =1。
虚线AC表示应该结冰而未结冰的过冷水与水蒸气平衡共存。
A 点为三相点,这时f =0,水以气、液、固三相共存。
第五章相平衡一、单选题1.体系中含有H2O、H2SO4·4H2O、H2SO4·2H2O、H2SO4·H2O、H2SO4,其组分数K为:()(A) 1 (B) 2 (C) 3 (D) 42.在410 K,Ag2O(s)部分分解成Ag(s)和O2(g),此平衡体系的自由度为:()(A) 0 (B) 1 (C) 2 (D)-13.某平衡体系含有NaCl(s)、KBr(s)、K+(aq)、Na+(aq)、Br-(aq)、Cl-(aq)、H2O,其自由度为:()(A) 2 (B) 3 (C) 4 (D) 54.一个水溶液包含n个溶质,该溶液通过一半透膜与纯水相平衡,半透膜仅允许溶剂水分子通过,此体系的自由度为:()(A)n(B) n-1 (C)n+1 (D)n+25.绝热条件下,273.15K的NaCl加入273.15K的碎冰中,体系的温度将如何变化? ()(A)不变(B)降低(C)升高(D)不能确定6.下图中,从P点开始的步冷曲线为:图 17.图1中,生成固体化合物的经验式为:()(A) CCl4·C4H10O2(B) CCl4·(C4H10O2)2(C) (CCl4)2·C4H10O2(D) CCl4(C4H10O2)38.图1中,区域H的相态是:()(A)溶液(B)固体CCl4 (C)固体CCl4+溶液(D)固体化合物+溶液9.在通常情况下,对于二组分物系能平衡共存的最多相为: ( )(A) 1 (B) 2 (C) 3 (D) 410. CuSO4 与水可生成CuSO4·H2O, CuSO4·3H2O , CuSO4·5H2O三种水合物,则在一定温度下与水蒸气平衡的含水盐最多为: ( )(A) 3种(B) 2种(C) 1种(D)不可能有共存的含水盐11. CuSO4 与水可生成CuSO4·H2O, CuSO4·3H2O , CuSO4·5H2O三种水合物,则在一定压力下和CuSO4水溶液及冰共存的含水盐有: ( )(A) 3种(B) 2种(C) 1种(D)不可能有共存的含水盐12.如图所示,物系处于容器内,容器中间的半透膜AB只允许O2通过,当物系建立平衡时,则物系中存在的相为: ( )(A) 1气相,1固相(B) 1气相,2固相(C) 1气相,3固相(D) 2气相,2固相13.如上题插图,当达渗透平衡时,该体系的自由度为: ( )(A) 1 (B) 2 (C) 3 (D) 414. CaCO3(s), CaO(s), BaCO3(s), BaO(s)及CO2(g)构成的平衡物系,其组分数为: ( )(A) 2 (B) 3 (C) 4 (D) 515.由CaCO3(s), CaO(s), BaCO3(s), BaO(s)及CO2(s)构成的平衡体系其自由度为: ( )(A)f =2 (B)f = 1 (C)f = 0 (D)f = 316.三相点是: ( )(A)某一温度,超过此温度,液相就不能存在(B)通常发现在很靠近正常沸点的某一温度(C)液体的蒸气压等于25℃时的蒸气压三倍数值时的温度(D)固体、液体和气体可以平衡共存时的温度和压力17.某一固体在25℃和p∅压力下升华,这意味着: ( )(A)固体比液体密度大些(B)三相点的压力大于p∅(C)固体比液体密度小些(D)三相点的压力小于p∅18.碘的三相点处在115℃和12kPa上,这意味着液态碘: ( )(A)比固态碘密度大(B)在115℃以上不能存在(C)在p∅压力下不能存在(D)不能有低于12kPa的蒸气压19.N2的临界温度是124K,室温下想要液化 N2,就必须: ( )(A)在恒温下增加压力(B)在恒温下降低压力(C)在恒压下升高温度(D)在恒压下降低温度20.对于与本身的蒸气处于平衡状态的液体,通过下列哪种作图法可获得一直线: ( )(A)p对T(B) lg(p/Pa) 对T (C) lg(p/Pa) 对1/T(D) 1/p对lg(T/K)21.当克劳修斯_克拉贝龙方程应用于凝聚相转变为蒸气时,则: ( )(A)p 必随T 之升高而降低(B)p 必不随T 而变(C)p必随T之升高而变大(D)p随T之升高可变大或减少22.水的三相点附近,其蒸发热和熔化热分别为44.82和5.994kJ·mol-1。
则在三相点附近冰的升华热约为: ( )(A)38.83 kJ·mol-1 (B)50.81 kJ·mol-1(C)-38.83 kJ·mol-1(D)-50.81 kJ·mol-123.在0℃到100℃的范围内液态水的蒸气压p与T的关系为:lg(p/Pa)=-2265k/T+11.101, 某高原地区的气压只有59995Pa,则该地区水的沸点为: ( )(A) 358.2K (B) 85.2K (C)358.2℃ (D) 373K24.固体六氟化铀的蒸气压p与T的关系式为lg(p/Pa) = 10.65 - 2560/(T/K),则其平均升华热为: ( )(A)2.128 kJ·mol-1(B)49.02 kJ·mol-1(C)9.242 kJ·mol-1(D) 10.33 kJ·mol-125.二元合金处于低共熔温度时,物系的自由度: ( )(A)f = 0 (B)f = 1 (C)f = 3 (D)f = 226.区域熔炼技术主要是应用于: ( )(A)制备低共熔混合物(B)提纯(C)制备不稳定化合物(D)获得固熔体27.已知苯一乙醇双液体系中,苯的沸点是353.3K, 乙醇的沸点是351.6K, 两者的共沸组成为:含乙醇47.5%(摩尔分数),沸点为341.2K。
今有含乙醇77.5%的苯溶液,在达到气、液平衡后,气相中含乙醇为y2,液相中含乙醇为x2。
问:下列结论何者正确? ( )(A)y2 >x2 (B)y2 =x2 (C)y2<x2 (D)不确定28.如上题,若将上述溶液精馏,则能得到: ( )(A)纯苯(B)纯乙醇(C)纯苯和恒沸混合物(D)纯乙醇和恒沸混合物29.当用三角形坐标来表示三组分物系时,若某物系其组成在平行于底边BC的直线上变动时,则该物系的特点是: ( )(A) B的百分含量不变(B) A的百分含量不变(C) C的百分含量不变(D) B和C的百分含量之比不变30.如图所示,当物系点在通过A点的一条直线上变动时,则此物系的特点是:( )(A) B和C的百分含量之比不变(B) A的百分含量不变(C) B的百分含量不变(D) C的百分含量不变31. H2O-NaCl-Na2SO4的三元系中,Na2SO4和H2O能形成水合物Na2SO4·10H2O(D),在DBC区中存在的是: ( )(A)水合物D和溶液(B)水合物D和Na2SO4及NaCl三相共存(C)水合物D、NaCl和组成为G的溶液(D)纯NaCl,纯Na2SO4和水溶液32. H2O-KNO3-NaNO3的相图如下,则BEC相区内是: ( )(A)纯NaNO3和其饱和溶液(B)纯KNO3和其饱和溶液(C)含有NaNO3和KNO3的不饱和溶液和溶液的单相区(D) KNO3,NaNO3和组成为E的饱和溶液三相共存33.三液系的相图如下,把相图分为三个相区:I,II,III。
每个相区所存在的相数为:( )(A) I区1,II区1,III区1(B) I区1,II区3,III区2(C) I区2,II区2,III区2(D) I区1,II区2,III区1二、多选题1.哪一种相变过程可以用来提纯化学药品? ( )(A)凝固 (B)沸腾 (C)升华 (D)其中任一种2.某一物质X在三相点时的温度是20℃,压力是2p∅。
下列哪一种说法是正确的: ( )(A)在20℃以上X能以液体存在(B)在20℃以下X能以固体存在(C)在25℃,p∅下液体X是稳定的(D)在25℃时,液体X和固体X有可能具有相同的蒸气压3.在相图上,当体系处于下列哪一点时存在二个相: ( )(A)恒沸点(B)熔点(C)临界点(D)低共熔点4.液氦(I) 液氦(II)是属于二级相变,对这类相变特征的描述,哪一点是正确的: ( )(A)无相变热(B)相变时无熵变化(C)相变时两相的密度相同(D)相变时两相的热容相同5.如图,下面哪一种表述是正确的:(A)有稳定化合物形成(B)有不稳定化合形成(C) C6H10O有晶型转变(D)有三个低共熔点6.在CHCl3 - C6H10O相图(上题图)中,下面表述哪一种是正确的?(A) 265.15K 下,两个液相与固体化合物平衡共存(B) 220.53K 下,两个环已酮与液相平衡共存(C) 194.62K 下,两个固体化合物与液相平衡共存(D) 199.45K 下,固体环已酮与两个固体化合物平衡共存三、填空题1. 40公斤乙醇和60公斤水的混合物在某温度成气液两相平衡,乙醇在气、液相中的重量百分数分别为60%和20%,那么气相混合物的重量W气 ___ W液(液相混合物重量)。
2. CO2的三相点为216.15K, 5.1×p∅,可见固体CO2(干冰)升华的压力范围是p___ 5.1×p∅。
3.在H2和石墨的体系中,加一催化剂,H2和石墨反应生成n种碳氢化合物,此体系的独立组分数为____。
4. NaCl(s)和含有稀HCl的NaCl饱和水溶液的平衡体系,其独立组分数是_______。
5.在p∅压力下,NaOH与H3PO4的水溶液达平衡,则此体系的自由度数为________。
6. NiO(s)与Ni(s),H2O(g), H2(g), CO2(g)及CO(g)呈平衡,则该体系的独立组分数为______,自由度数为_______。
7. 含有KNO3和NaCl的水溶液与纯水达渗透平衡时,其组分数为____,相数为______,自由度数为______。
8. 如上图,环已酮C6H10O的熔点是 K,C6H10O·CHCl3的熔点____K,(CHCl3)2·C6H10O的转熔温度是____K,C6H10O ,C6H10O·CHCl3与液相的平衡共存温度是____K。
四、是非题1.等温等容条件下,B在α、β两相中达平衡,有μB α = μBβ。
2.二元体系两相平衡,平衡压力仅取决于平衡温度。
3.根据相律,单组分体系相图只能有唯一的一个三相共存点。
4.液态CO2在p∅压力下的任何温度,都是不稳定的。
(CO2三相点压力为5.11×p∅)。
5.在一个密封的钟罩内,一个烧杯盛有纯液体苯,另一烧杯盛有苯和甲苯溶液,长时间放置,最后两个烧杯内溶液浓度相同。