实验2药物片剂的质量检查
- 格式:ppt
- 大小:5.80 MB
- 文档页数:35

片剂质量检查的主要内容一、介绍片剂质量检查是药品生产与质量管理中的关键环节之一。
通过对片剂的质量参数进行检查,可以确保片剂符合药典标准和药品注册要求,保障药品的安全有效性。
本文将详细介绍片剂质量检查的主要内容。
二、外观检查外观检查是片剂质量检查中的首要任务,其主要目的是评估片剂表面的形状、颜色、气味和质地等,以确定是否存在明显的缺陷。
外观检查通常包括以下方面的检查:1. 外观特征•形状:片剂应该有规则的形状,如圆形、长方形、椭圆形等。
•尺寸:片剂的尺寸如直径、厚度等应符合药典标准要求。
•颜色:片剂的颜色应符合药典标准,并且应该均匀一致。
•气味:片剂应该无明显的异味,如有异味可能表示片剂质量存在问题。
•质地:片剂的表面应该光滑,无凹凸、裂纹等缺陷。
2. 标志和标签•片剂应有清晰、完整、准确的标志和标签,包括产品名称、规格、批号、生产日期等信息。
•标志和标签上的文字应清晰易读,不应有涂改的痕迹。
3. 包装•片剂的包装应完整,无明显破损。
•包装材料应符合药典标准,没有异味、污染等问题。
三、物理性质检查物理性质检查主要是对片剂的物理特性进行评估。
常见的物理性质检查包括:1. 抗压强度•使用片剂硬度仪测试片剂的抗压强度,以评估片剂的硬度是否符合要求。
2. 崩解时间•通过浸泡崩解仪测试片剂的崩解时间,以评估片剂的释药速度。
3. 可分散性•对两种不同溶剂中的片剂进行观察,评估片剂的可分散性。
四、化学成分检查化学成分检查是片剂质量检查的核心内容之一,它用于评估片剂中所含药物的含量、纯度等关键参数。
常见的化学成分检查方法包括:1. 含量测定•通过药典要求的方法测定片剂中所含药物的含量,以评估片剂的质量是否符合要求。
2. 相对物质含量•检测片剂中相对物质的含量,如溶出物、杂质等,以评估片剂的相对纯度。
3. 有害物质检查•检测片剂中是否存在有害物质,如重金属、残留溶剂等,以保证片剂的安全性。
五、溶出度检查溶出度检查主要用于评估片剂中药物的溶出速度和溶出度。

片剂装量差异检查实验报告片剂装量差异检查实验报告一、引言片剂是常见的固体制剂形式之一,其装量差异对于药物的治疗效果和安全性具有重要影响。
进行片剂装量差异检查实验是确保药物质量合格的重要步骤。
本报告旨在详细描述片剂装量差异检查实验的方法、结果和讨论。
二、实验目的本实验的目的是通过测定不同批次片剂的装量,评估其装量差异,并分析可能导致差异的因素。
三、实验方法1. 实验仪器和试剂准备a. 仪器:电子天平、显微镜。
b. 试剂:待测片剂样品。
2. 样品准备a. 随机选择不同批次的片剂样品,每批次选择10个样品。
b. 将样品放置在密封容器中,避光保存。
3. 实验步骤a. 打开电子天平,将称量盘清洁干燥。
b. 将待测片剂样品取出并放置在称量盘上。
c. 使用电子天平测定每个样品的质量,并记录下来。
d. 将测定的质量数据进行统计分析。
四、实验结果本次实验共选择了5个不同批次的片剂样品,每个批次选取10个样品进行测定。
测得的片剂质量数据如下表所示:批次样品1 样品2 样品3 样品4 样品5 样品6 样品7 样品8 样品9 样品10A 50.2 49.8 50.0 49.9 50.1 49.7 50.3 50.049.9 50.1B 49.5 49.6 49.8 49.7 49.9 50.1 49.6 49.850.0 50.2C 50.3 50.2 50.0 49.9 49。
7 ,,,,,,。
,.,.,.,.,.,。
,。
,。
,。
,。
,。
,。
,。
,。
,。
,.,..,.....,......,.....,.......,.......,.......,.......,..,...,...,...,...,.,D ,...,,.......,,,,,,.................,,,,,,,,,,,,,,,....................................................E .....................................................................................................五、数据分析与讨论1、装量差异分析a) 对于每个批次的样品,计算其平均质量和标准偏差。

片剂的质量控制与评价一、引言片剂是一种常见的固体制剂形式,广泛应用于临床药物治疗中。
为了确保片剂的质量和疗效,需要进行严格的质量控制和评价。
本文将详细介绍片剂的质量控制与评价的标准和方法。
二、外观质量控制与评价1. 外观要求:片剂应具有一致的形状、颜色和光泽。
无明显的裂纹、破碎、磨损、污染等缺陷。
2. 外观检查方法:使用肉眼对片剂进行观察,检查是否符合外观要求。
3. 外观评价标准:根据国家药典或企业内部标准,对片剂的外观进行评价,如合格、不合格等。
三、重量控制与评价1. 重量要求:片剂的重量应符合规定的范围。
2. 重量检查方法:使用电子天平对一定数量的片剂进行称重,计算平均重量,并与规定的标准进行比较。
3. 重量评价标准:根据国家药典或企业内部标准,对片剂的重量进行评价,如合格、不合格等。
四、硬度控制与评价1. 硬度要求:片剂的硬度应符合规定的范围,以确保片剂在包装和携带过程中不易破碎。
2. 硬度检查方法:使用硬度计对一定数量的片剂进行测试,记录测试结果,并与规定的标准进行比较。
3. 硬度评价标准:根据国家药典或企业内部标准,对片剂的硬度进行评价,如合格、不合格等。
五、含量均匀性控制与评价1. 含量均匀性要求:片剂中的药物成分应均匀分布,确保每片剂中含有相同的药物含量。
2. 含量均匀性检查方法:取一定数量的片剂,将药物成分提取,使用合适的分析方法进行测定,并计算出含量的标准差。
3. 含量均匀性评价标准:根据国家药典或企业内部标准,对片剂的含量均匀性进行评价,如合格、不合格等。
六、溶出度控制与评价1. 溶出度要求:片剂中的药物成分应在一定时间范围内达到规定的溶出度。
2. 溶出度检查方法:使用适当的溶出度试验方法,将片剂置于溶液中,通过测定溶出液中的药物浓度来评估溶出度。
3. 溶出度评价标准:根据国家药典或企业内部标准,对片剂的溶出度进行评价,如合格、不合格等。
七、稳定性控制与评价1. 稳定性要求:片剂应在规定的保存条件下保持稳定性,确保药物成分不会发生显著的降解或变化。



一、实训目的本次实训旨在通过药学制剂片的制备过程,使学生掌握片剂的基本制备工艺,了解片剂的质量要求,提高学生对药学制剂的实际操作能力,培养严谨的工作态度和团队协作精神。
二、实训时间2023年X月X日至2023年X月X日三、实训地点XX药学实验室四、实训内容1. 片剂的制备原理2. 片剂的常用辅料3. 片剂的制备工艺4. 片剂的质量检查5. 片剂的包装与储存五、实训过程1. 片剂的制备原理在实训开始,首先由指导老师介绍了片剂的制备原理,包括片剂的压缩成型原理、粘结原理以及片剂的稳定性等。
2. 片剂的常用辅料了解了片剂的制备原理后,我们学习了片剂的常用辅料,如稀释剂、粘合剂、崩解剂、润滑剂等,并了解了它们在片剂制备中的作用。
3. 片剂的制备工艺接下来,我们进入了片剂的制备工艺实训。
实训步骤如下:(1)称量:准确称取主药和辅料,并按比例混合均匀。
(2)制粒:将混合好的物料进行湿法制粒,制成一定规格的颗粒。
(3)干燥:将制得的湿颗粒进行干燥,防止颗粒结块和变质。
(4)整粒:将干燥后的颗粒进行整粒,去除细粉和过大颗粒。
(5)压片:将整粒后的颗粒进行压片,制成片剂。
(6)包衣:根据需要,对片剂进行包衣处理。
4. 片剂的质量检查在片剂制备完成后,我们对片剂进行了质量检查,包括外观检查、含量测定、崩解度测定、溶出度测定等,确保片剂的质量符合要求。
5. 片剂的包装与储存最后,我们学习了片剂的包装与储存方法,以确保片剂在运输和储存过程中的稳定性。
六、实训总结通过本次实训,我们掌握了片剂的基本制备工艺,了解了片剂的质量要求,提高了实际操作能力。
以下是本次实训的几点体会:1. 片剂的制备过程要求严格,每个步骤都需要细心操作,以保证片剂的质量。
2. 在制备过程中,要注重辅料的选择和配比,以保证片剂的成型性和稳定性。
3. 片剂的质量检查是确保药品安全的重要环节,需要严格按照规定进行。
4. 团队协作在实训过程中至关重要,每个人都要明确自己的职责,共同完成任务。

片剂的质量控制与评价一、引言片剂作为一种常见的固体制剂形式,广泛应用于药物治疗中。
为了确保片剂的质量和疗效,需要进行严格的质量控制与评价。
本文将介绍片剂的质量控制与评价的相关内容,包括质量控制的标准、检测方法以及评价指标等。
二、质量控制标准1. 药典标准:片剂的质量控制通常依据药典标准进行。
药典标准包括国家药典、美国药典、欧洲药典等,其中国家药典是我国药物质量控制的法定标准。
片剂的质量控制标准应包括外观、含量、溶解度、溶出度、均匀度、稳定性等指标。
2. 工艺标准:片剂的制备工艺应符合相关的标准要求。
工艺标准应包括原料药的选择和检验、制剂工艺的设计和验证、包装材料的选择和检验等。
工艺标准的制定应考虑到片剂的特点和目标产品的要求。
三、质量控制方法1. 外观检查:外观是片剂质量的直观表现,应符合药典标准中规定的要求。
外观检查包括片剂的颜色、形状、尺寸、表面光滑度等方面。
2. 含量测定:片剂的含量应符合药典标准中规定的要求。
常用的含量测定方法有高效液相色谱法、紫外分光光度法、气相色谱法等。
含量测定应选择适合的方法,并进行合适的验证。
3. 溶解度测定:片剂的溶解度是其药物释放的重要指标之一。
常用的溶解度测定方法有旋光度法、离子选择电极法、分光光度法等。
溶解度测定应考虑片剂的特点和目标产品的要求。
4. 溶出度测定:片剂的溶出度是其药物释放速度的重要指标之一。
常用的溶出度测定方法有流动体法、离子选择电极法、高效液相色谱法等。
溶出度测定应选择适合的方法,并进行合适的验证。
5. 均匀度检查:片剂的均匀度是指剂型中药物含量的均匀分布程度。
常用的均匀度检查方法有荧光法、红外光谱法、显微镜法等。
均匀度检查应考虑片剂的特点和目标产品的要求。
6. 稳定性研究:片剂的稳定性是指在一定条件下,药物在制剂中的质量和疗效的保持程度。
稳定性研究应包括加速试验、长期试验和温度湿度试验等。
稳定性研究的结果应与药典标准进行比较和评价。
四、评价指标1. 合格率:片剂的合格率是指符合质量控制标准的片剂所占的比例。


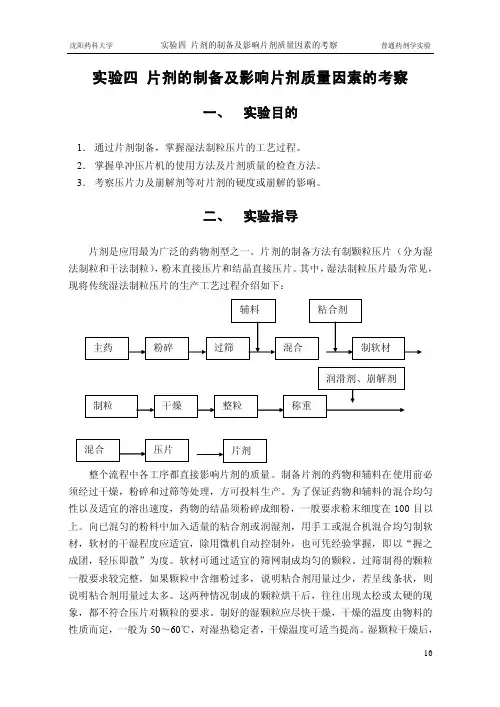
实验四片剂的制备及影响片剂质量因素的考察一、实验目的1.通过片剂制备,掌握湿法制粒压片的工艺过程。
2.掌握单冲压片机的使用方法及片剂质量的检查方法。
3.考察压片力及崩解剂等对片剂的硬度或崩解的影响。
二、实验指导片剂是应用最为广泛的药物剂型之一。
片剂的制备方法有制颗粒压片(分为湿法制粒和干法制粒),粉末直接压片和结晶直接压片。
其中,湿法制粒压片最为常见,现将传统湿法制粒压片的生产工艺过程介绍如下:整个流程中各工序都直接影响片剂的质量。
制备片剂的药物和辅料在使用前必须经过干燥,粉碎和过筛等处理,方可投料生产。
为了保证药物和辅料的混合均匀性以及适宜的溶出速度,药物的结晶须粉碎成细粉,一般要求粉末细度在100目以上。
向已混匀的粉料中加入适量的粘合剂或润湿剂,用手工或混合机混合均匀制软材,软材的干湿程度应适宜,除用微机自动控制外,也可凭经验掌握,即以“握之成团,轻压即散”为度。
软材可通过适宜的筛网制成均匀的颗粒。
过筛制得的颗粒一般要求较完整,如果颗粒中含细粉过多,说明粘合剂用量过少,若呈线条状,则说明粘合剂用量过太多。
这两种情况制成的颗粒烘干后,往往出现太松或太硬的现象,都不符合压片对颗粒的要求。
制好的湿颗粒应尽快干燥,干燥的温度由物料的性质而定,一般为50~60℃,对湿热稳定者,干燥温度可适当提高。
湿颗粒干燥后,需过筛整粒以便将粘结成块的颗粒散开,同时加入润滑剂和需外加法加入的崩解剂并与颗粒混匀。
整粒用筛的孔径与制粒时所用筛孔相同或略小。
压片前必须对干颗粒及粉末的混合物进行含量测定,然后根据颗粒所含主药的量计算片重。
()测得值干颗粒中主药百分含量标示量每片应含主药量片重=根据片重选择筛目与冲膜直径,其之间的常用关系可参考表1。
根据药物密度不同,可进行适当调整。
表1 根据片重可选的筛目与冲膜的尺寸 筛目数片重 冲膜直径(mg ) 湿粒 干粒 (mm ) 50 18 16-20 5-5.5 100 16 14-20 6-6.5 150 16 14-20 7-8 200 14 12-16 8-8.5 300 12 10-16 9-10.5500 10 10-12 12制成的片剂需按照中国药典规定的片剂质量标准进行检查。

片剂性状检测实验报告本实验旨在通过对片剂性状的检测,了解片剂的外观特征、尺寸和质地等因素对片剂的质量造成的影响,以及对片剂质量的评估和判定。
实验原理:片剂性状检测是指通过观察和测量片剂的外观特征和尺寸,初步判断片剂的质量好坏。
片剂的外观特征主要包括片剂的形状、颜色、光洁度、花纹、表面缺陷等,尺寸包括片剂的直径、厚度、重量、硬度等。
质地是指片剂在水中的溶解速度,是片剂的重要品质指标之一。
实验步骤:1. 准备样品:从药房或药厂购买不同品牌的片剂样品。
2. 外观检查:检查片剂的形状、颜色、光洁度、花纹、表面缺陷等。
3. 尺寸测量:使用卡尺测量片剂的直径、厚度。
4. 质地检测:将片剂放入500ml水中,观察其溶解速度。
实验结果与讨论:1. 外观检查:观察不同品牌的片剂外观特征,发现有的片剂形状规则,光洁度高,无明显表面缺陷;而有的片剂形状不规则,颜色不均匀,表面有明显的气泡或凹陷等缺陷。
这些差异可能是由于制造过程中的操作技术、原料品质、机器设备等因素引起的。
同时,片剂的外观特征也会影响患者对药品的接受程度,因此片剂外观检查是片剂质量评估的重要标准之一。
2. 尺寸测量:对片剂的直径和厚度进行测量。
测量结果显示,不同品牌的片剂在直径和厚度上存在一定的差异。
片剂的尺寸与其溶解速度、服药方便性等有直接关系。
比如片剂直径较大的片剂,溶解速度可能较慢,效果不佳,服用不方便。
因此,片剂的尺寸也是评估片剂质量的重要指标之一。
3. 质地检测:将片剂放入500ml水中,观察其溶解速度。
溶解速度较快的片剂可能是制剂工艺成熟,原料药提取纯度高,片剂质量良好的标志。
而溶解速度较慢的片剂可能是制剂工艺不当,原料药提取不纯等因素导致的。
质地检测结果可以初步判断片剂的质量好坏,但不能完全代表片剂的疗效和稳定性,需进一步进行其他指标的检测。
结论:通过对片剂进行外观特征、尺寸和质地的检测,可以初步评估片剂的质量好坏。
而片剂的质量则是影响药物疗效和患者用药顺利程度的重要因素。
片剂制备实验报告实验七阿司匹林片的制备试验七片剂第一部分片剂制备与部分质量检查一实验目的1.通过阿司匹林片剂制备,掌握湿法制粒压片的工艺过程.2.了解单冲与11 冲压片机的基本构造,使用和保养.3.考察压片力及崩解剂等对片剂的硬度或崩解的影响.4.掌握片剂的质量检查方法.二实验原理片剂系指将药物与适宜的辅料通过制剂技术制成的片状制剂.片剂是应用最为广泛的药物剂型之一.片剂的制备方法有制颗粒压片(分为湿法制粒和干法制粒),粉末直接压片和结晶直接压片.其中,湿法制粒压片最为常见,除对湿,热不稳定的药物之外, 多数药物采用湿法制粒压片.其制备要点如下:(1)原料药与辅料应混合均匀.含量小或含有毒剧药物的片剂, 可根据药物的性质用适宜的方法使药物分散均匀.(2)凡具有挥发性或遇热分解的药物, 在制片过程中应避免受热损失.(3)凡具有不适的臭和味,刺激性,易潮解或遇光易变质的药物, 制成片剂后, 糖衣或薄膜衣.对一些遇胃液易破坏或需要在肠内释放的药物, 制成片剂后应包肠溶衣.为减少某些药物的毒副作用, 或为延缓某些药物的作用, 或使某些药物定位释放, 可通过适宜的制剂技术制成控制药物溶出速率的片剂.1.传统湿法制粒压片的生产工艺流程:图7-1 传统湿法制粒压片的生产工艺流程2.制备要点(1)原料粉碎混合整个流程中各工序都直接影响片剂的质量.制备片剂的药物和辅料在使用前必须经过干燥,粉碎和过筛等处理,方可投料生产.为了保证药物和辅料的混合均匀性以及适宜的溶出速度,药物的结晶须粉碎成细粉,一般要求粉末细度在100目以上.(2)制软材向已混匀的粉料中加入适量的粘合剂或润湿剂,用手工或混合机混合均匀制软材,软材的干湿程度应适宜,除用微机自动控制外,也可凭经验掌握,即以握之成团,轻压即散为度.(3)制颗粒软材可通过适宜的筛网制成均匀的颗粒.过筛制得的颗粒一般要求较完整,如果颗粒中含细粉过多,说明粘合剂用量过少,若呈线条状,则说明粘合剂用量过太多.这两种情况制成的颗粒烘干后,往往出现太松或太硬的现象,都不符合压片对颗粒的要求.(4)烘干制好的湿颗粒应尽快干燥,干燥的温度由物料的性质而定,一般为50~60℃,对湿热稳定者,干燥温度可适当提高.(5)整粒湿颗粒干燥后,需过筛整粒以便将粘结成块的颗粒散开,同时加入润滑剂和需外加法加入的崩解剂并与颗粒混匀.整粒用筛的孔径与制粒时所用筛孔相同或略大.(6)颗粒质量检查颗粒质量检查包括颗粒含水量检查与颗粒中主药含量测定两部分.(7)计算片重片重计算主要有以下两种方法:a压片前必须对干颗粒及粉末的混合物进行含量测定,然后根据颗粒所含主药的量计算片重.b按颗粒重量计算片重, 照此公式计算片重,投料时应计入原料的损耗.干颗粒重+ 压片前加入的辅料量片重=应压片数(8)压片根据片重选择筛目与冲膜直径,其之间的常用关系可参考表1.根据药物密度不同,可进行适当调整.表7-1 根据片重可选的筛目与冲膜的尺寸筛目数片重冲膜直径(mg) 湿粒干粒(mm)50 18 16-20 5-5.5100 16 14-20 6-6.5150 16 14-20 7-8200 14 12-16 8-8.5300 12 10-16 9-10.5500 10 10-12 123.片剂质量检查制成的片剂需按照中国药典规定的片剂质量标准进行检查.检查的项目,除片剂的外观应完整,光洁,色泽均匀,硬度适当,含量准确外,必须检查重量差异和崩解时限.对有些片剂产品药典还规定检查溶出度和含量均匀度,并规定凡检查溶出度的片剂,不再检查崩解时限,凡检查含量均匀度的片剂,不再检查重量差异.另外,在片剂的制备过程中,所施加的压片力不同,所用的润滑剂,崩解剂等的种类不同,都会对片剂的硬度或崩解时限产生影响.(1)外观片剂外观应完整光洁,色泽均匀.(2)片重差异片重差异直接影响片剂的剂量准确性.片剂重量差异的限度规定如下:平均重量0.30以下重量差异限度为±7.5%,0.30g或0.30g以上的为±5%.(3)硬度片剂应有足够的强度,以免在包装,运输等过程中破碎或被磨损,以保证剂量准确.片剂的硬度与其贮运后外形的完整性有关, 生产厂家一般均将硬度片剂的内控指标之一.另外,一般还同时进行片剂脆碎度检查.(4)崩解度片剂服用后,必须破碎成小颗粒,形成较大的比表面积,以利于药物的溶出.崩解是溶出的前提条件.(5)溶出度药物从崩解后的颗粒中溶出后才能吸收而发挥治疗作用.对于一些难溶性药物的片剂,溶出是吸收的限速过程.因此片剂的溶出度是体外和生产中重要的质量指标.三仪器与试剂1.实验仪器乳钵( 中号), 烧杯(400mi ) , 普通天平,电子天平,电炉, 搪瓷盘(31 ×41cm), 尼龙筛(80目,14 目与16 目), 烘箱, 单冲压片机, 冲头(12mm 和9mm),水分测定仪,片剂四用仪, 溶出仪等.2.实验试剂乙酰水杨酸( 粒状结晶), 非那西丁, 咖啡因, 淀粉, 滑石粉, 硬脂酸镁,乙醇, 蒸馏水等.四实验内容1. 阿司匹林片的制备处方(100 片用量)乙酰水杨酸30.0g淀粉7.0g酒石酸0.2g滑石粉q.s淀粉浆(15% ) q.s100片(2)制法:乙酰水杨酸粉碎过筛:乙酰水杨酸适量置研钵中用力研磨成细粉,过80目筛得乙酰水杨酸细粉.15% 淀粉浆的制备:称取酒石酸0.2g 溶于少量蒸馏水中与15% 淀粉浆混匀.取乙酰水杨酸细粉与3g淀粉混匀, 加适量淀粉浆制成软材, 过16 目筛制粒, 颗粒于40~60 ℃干燥后, 再经14 目筛整粒, 将此颗粒与剩余的4g干淀粉和滑石粉(5%)混匀后压片( 用12mm 孤面冲头) .(3)用途: 解热镇痛药2.复方乙酰水杨酸片( 复方阿司匹林片) 的制备(1)处方每片用量(g) 300 片用量(g )乙酰水杨酸( 粒状结晶) 0.2268 68.04非那西丁( 细粉) 0.1620 48.6咖啡因( 细粉) 0.0350 10.5淀粉0.066 19.8淀粉浆(17% ) 0.088 约26.4滑石粉0.04 12.0(2)制法将非那西丁,咖啡因与7.8g 淀粉混匀, 加淀粉浆制成均匀的软材,通过l4~16 目筛制粒, 湿粒70 ℃干燥, 测定含水量, 干粒过14 自筛整粒.将此颗粒与乙酰水杨酸结晶混合,加剩余的12g 干淀粉和滑石粉后, 充分混匀, 压片( 用12mm 平面冲头) .(3)用途解热镇痛药.用于发热,头痛,神经痛,牙痛等.3.干颗粒含水量测定本实验用红外线水分快速测定仪测定复方乙酰水杨酸片的干颗粒含水量.颗粒含水量对片剂成形及质量均有很大影响,通常所含水分应在1-3%.4.压片按颗粒重量计算片重干颗粒重+ 压片前加入的辅料量片重=应压片数单冲压片机的安装与调试单冲压片机是实验室常用的小型压片机械, 构造简单, 使用方便, 其安装与调试过程如下:首先装好下冲头, 旋紧下冲固定螺丝.旋动片重调节器, 使下冲在较低的部位.再将模圈装入模板, 旋紧模圈固定螺丝, 然后仔细地将模板固定在机座上( 冲头的周边锋利部位容易因碰撞而损坏, 故在整个装拆过程中都应小心) .调节出片调节器, 使下冲头上升到恰与模圈相齐平.再装上冲并旋紧上冲固定螺丝, 转动压力调节器, 使上冲处在压力低的部位, 缓慢地用手摇转压片机的转轮使上冲逐渐下降, 观察其是否正好在冲挠的中心位置.如不在中心位置, 应上升上冲头(不得将上冲强制地冲入模孔,更不应使上下冲相撞),稍微松动一点模板固定螺丝,移动模板位置直至上冲头恰好阿在模圈模孔的中心位置.旋紧固定螺丝,装好饲料靴和加料斗,加入颗粒.用手旋转轮,如感到不易旋转时,不得用力硬转,应小心倒转少许,然后旋转压力调节器使适当上升减小压力.称其平均片重,调节片重调节器,使压出的片剂有一定的硬度.在上述一切操作均较顺利后,开动电机进行试压,检查片重和崩解时间,达到要求后方可正式压片.图7-2小型单冲压片机图7-3 压片机主要组成小型单冲压片机是一种台式电动连续冲压机(无电时也可手摇压片),能将各种颗粒状,晶体状或者流动性好的粉状原料压制成圆片状,圆柱状,球状,凸面,凹面和其他各种几何形状的产品(如方形,三角,椭圆,囊形等),还可压制带有文字,商标,图案的产品,本机只装一付冲模,物料的充填深度,压制厚度均可调节,也即是产品的重量,厚度及硬度均可调节,只要更换不同的模具就可压制不同的产品. 主要技术参数(YP-1.5型):最大压制压力1.5吨,最大压制直径14毫米,最大充填深度12毫米,最大生产能力6000片/小时,电机功率250瓦(1400转/分),220伏(380伏)/50赫兹,外形尺寸580×450×625毫米,重量:70公斤.压片机主要组成如下①加料器——加料斗,饲粉器;②压缩部件——一副上,下冲和模圈;③调节器——压力调节器,片重调节器,推片调节器.压力调节器连在上冲杆上,用以调节上冲下降的深度,下降越深,上,下冲间的距离越近,压力越大,反之则小;片重调节器连在下冲杆上,用以调节下冲下降的深度,从而调节模孔的容积而控制片重;推片调节器连在下冲,用以调节下冲推片时抬起的高度,使恰与模圈的上缘相平,由饲粉器推开.单冲压片机的压片过程:上冲抬起,饲粉器移动到模孔之上;下冲下降到适宜深度,饲粉器在模上摆动,颗粒填满模孔;饲粉器由模孔上移开,使模孔中的颗粒与模孔的上缘相平;上冲下降并将颗粒压缩成片,此时下冲不移动;上冲抬起,下冲随之抬起到与模孔上缘相平,将药片由模孔中推出;饲粉器再次移到模孔之上,将膜孔中的片剂推开,同时进行第二次饲粉,如此反复近行.压片机有一定转向,不得反向运转,否则将会损坏机件.单冲压片机压制的硬度不高,切忌为提高硬度而盲目增加压力,在过高压力下,压力调节器中心活动螺旋杆很容易弯曲损坏.压片机的保养压片完毕,用毛刷刷去药粉,用废纱头揩拭机件,使压片机干燥清洁,最后加好润滑油.下次使用前仍应用手缓缓转动转轮,仔细观察压片机是否有故障,当一切正常后,方可开启使用.若需拆卸时,拆下的次序与安装的次序恰好相反.(4)压片圆形片剂直径5-12mm的糖衣片,素片,薄膜包衣片,斜边平片普通冲模.圆形片剂直径小于5或大于12mm的素片,薄膜包衣片,斜边平片特殊冲模.任意圆形片剂直径的单双面刻文字,图形,商标冲模.非圆形的几何形状片剂冲模(如椭圆形,囊形,菱形,心形,三角形,月牙形,动物形状,水果形状等).图7-4片剂冲模图7-5异形片剂冲模图7-5 各种形状片剂6.片剂质量检查本实验检查重量差异,硬度,脆碎度,崩解时限和溶出度.(1)重量差异检查法取药片20片,精密称定总重量,求得平均片重后,再分别精密称定各片的重量.每片重量与平均片重相比较(凡无含量测定的片剂,每片重量应与标示片重比较)超出重量差异限度(见表7-2)的药片不得多于2片,并不得有1片超出限度1倍.结果列于表1. 表7-2 重量差异限度平均片重重量差异限度0.30g以下0.30g或0.30g以上±7.5%±5%(2)硬度检查法: 片剂应有适宜的硬度,以免在包装,运输过程中破碎或磨损,因此片剂硬度是反映片剂生产工艺水平,控制片剂质量的一项重要指标.正确反映和测试片剂硬度,对于片剂的生产和科研,保证临床用药的准确性等方面均具有不容忽视的实际指导意义.硬度检查采用破碎强度法,采用片剂智能硬度仪进行测定.方法如下:将药片径向固定在两横杆之间,其中的活动柱杆借助弹簧沿水平方向对片剂径向加压,当片剂破碎时,活动柱杆的弹簧停止加压,仪器刻度盘所指示的压力即为片的硬度.测定3~6片,取平均值.结果列于表2.图7-6 YD-20智能硬度仪YD-20智能硬度仪是用于测量片剂硬度的一种药检仪器,测量范围: 硬度10~200N;分辨率0.1N;精度±1.5%;直径2.0~25.0mm;分辨率0.01mm;精度±0.06mm;度量单位: 硬度N; Kgf(Kilopond,1Kgf=9.81N);Sc(Strocobb1Kgf=1.43Sc);测量方式: 手动单片/自动连续(测量片数最大为100片)(3)脆碎度检查法:取药片,按中国药典2000年版二部附录X G项下检查法,置片剂四用测定仪脆碎度检查槽内检查,记录检查结果.结果列于表3.检查方法及规定如下:片重为0.65g或以下者取若干片,使其总重量约为6.5g;片重大于0.65g者取10片.用吹风机吹去脱落的粉末,精密称重,置圆筒中,转动100次.取出,同法除去粉末,精密称重,减失重量不得过1%,且不得检出断裂,龟裂及粉碎的片.(4)崩解时限检查法:应用片剂崩解测定仪进行测定.测定装置崩解仪的主要结构为一能升降的金属支架和下端镶有金属筛网的吊篮,并附有的塑料挡板.吊篮内置 6 支玻璃管, 玻璃管长77.5mm, 内径21.5mm, 壁厚2.0mm筛孔内径 2.0mn, 挡板直径为20.7mm, 厚9.5mm, 相对密度 1.18~1.20 . 采用吊篮法,方法如下:取药片6片,分别置于吊篮的玻璃管中,每管各加一片,开动仪器使吊篮浸入37±1.0℃的水中,按一定的频率(30-32次/min)和幅度(55±2mm)往复运动.从片剂置于玻璃管开始计时,至片剂破碎并全部固体粒子都通过玻璃管底部的筛网(Φ2mm)为止,该时间即为该片剂的崩解时间,应符合规定崩解时限(一般压制片为15min).结果列于表4.另有规定外, 取药片 6 片, 分置吊篮的 6 支玻璃管中, 启动升降机件, 各片均应l5分钟内全部溶化或崩解成碎粒, 并通过筛网.如残存有小颗粒不能全部通过筛网时, 应另取 6 片复试, 并在每管加入药片后随即加入挡板各一块, 依法检查,应符合规定.糖衣片,浸膏片或薄膜衣片的崩解时限, 按上述方法检查, 应在 1 小时内全部溶散崩解并通过筛网.如有l 片不能全部通过筛网, 应另取 6 片复试, 均应符合规篇二:安乃近片剂的制备实验报告(西南大学药学院)安乃近片剂的制备与质量检查李昀松樊洁(西南大学药学院,重庆400715)摘要:目的研究安乃近片剂的制备工艺,并对制得的安乃近片剂进行质量检查。
片剂的质量控制与评价一、引言片剂是一种常见的制剂形式,广泛应用于药物治疗中。
为确保片剂的质量和疗效,需要对其进行严格的质量控制和评价。
本文将详细介绍片剂的质量控制与评价的标准格式。
二、质量控制1. 原料药的质量控制原料药是片剂的主要成分,其质量直接影响片剂的质量。
质量控制包括以下方面:- 外观检查:原料药应符合规定的外观要求,如颜色、形状等。
- 纯度检查:对原料药进行纯度检测,包括含量测定、杂质检查等。
- 溶解度检查:检测原料药的溶解度,确保其能够在制剂过程中充分溶解。
- 稳定性检查:对原料药进行稳定性测试,判断其在储存和使用过程中的稳定性。
2. 辅料的质量控制辅料是片剂中除原料药外的其他成分,对片剂的质量也有重要影响。
质量控制包括以下方面:- 纯度检查:对辅料进行纯度检测,确保其不含有有害物质。
- 物理性质检查:检测辅料的物理性质,如颗粒度、流动性等。
- 稳定性检查:对辅料进行稳定性测试,判断其在储存和使用过程中的稳定性。
3. 制剂工艺的质量控制制剂工艺是指制备片剂的具体工艺过程,质量控制包括以下方面:- 工艺参数控制:控制制剂工艺中的各项参数,如搅拌时间、干燥温度等。
- 制剂过程监控:对制剂过程进行实时监控,确保各个步骤按照要求进行。
- 制剂工艺验证:对制剂工艺进行验证,确保其能够稳定可靠地制备出符合要求的片剂。
三、质量评价1. 外观评价外观是片剂的重要指标之一,其评价包括以下方面:- 形状评价:评估片剂的形状是否符合规定要求,如圆形、椭圆形等。
- 色泽评价:评估片剂的颜色是否符合规定要求,如白色、黄色等。
- 表面光滑度评价:评估片剂表面的光滑度是否符合规定要求。
2. 物理性质评价物理性质是片剂的重要指标之一,其评价包括以下方面:- 厚度评价:评估片剂的厚度是否符合规定要求,如厚度均匀性等。
- 硬度评价:评估片剂的硬度是否符合规定要求,如质地硬度、断裂性等。
- 可分性评价:评估片剂的可分性,即是否容易分割成相等的剂量。