杂化轨道理论PPT课件
- 格式:ppt
- 大小:7.40 MB
- 文档页数:65


•杂化轨道理论基本概念•s-p 杂化轨道•p-d 杂化轨道•d-f 杂化轨道•杂化轨道理论与分子构型关系•杂化轨道理论在化学领域应用•总结与展望目录01杂化轨道理论基本概念原子轨道与杂化轨道原子轨道杂化轨道sp 杂化sp2杂化sp3杂化030201杂化类型及特点杂化轨道形成过程激发原子中能量相近的不同类型原子轨道在成键过程中重新分配能量和确定空间方向,组成数目相等的新的原子轨道。
杂化重新组合后的原子轨道称为杂化原子轨道,简称杂化轨道。
成键杂化后的原子轨道能量相等、成分相同,仅空间方位不同。
杂化轨道成键时,要满足原子轨道最大重叠原理。
02s-p杂化轨道s-p杂化原理及类型s-p杂化原理s-p杂化类型根据参与杂化的s和p轨道数目不同,可分为sp、sp²、sp³等类型。
s-p杂化实例分析乙烯分子中的C=C双键炔烃分子中的C≡C三键s-p杂化性质总结s-p杂化轨道具有方向性和饱和性01s-p杂化影响分子构型和性质02s-p杂化与化学键稳定性0303p-d杂化轨道p-d杂化原理及类型p-d杂化原理p-d杂化类型p-d杂化实例分析实例一PCl5分子。
磷原子中的3个p轨道和1个d轨道发生杂化,形成5个sp3d杂化轨道,分别与5个氯原子形成共价键。
这种杂化解释了PCl5分子的三角双锥构型。
实例二SF6分子。
硫原子中的3个p轨道和2个d轨道发生杂化,形成6个sp3d2杂化轨道,分别与6个氟原子形成共价键。
这种杂化解释了SF6分子的八面体构型。
化学键性质p-d 杂化轨道中的电子分布和键合情况决定了分子的化学键性质,如键长、键角、键能等。
这些性质与分子的稳定性和反应性密切相关。
几何构型p-d 杂化轨道形成的分子具有特定的几何构型,如三角双锥、八面体等,这些构型与参与杂化的轨道数目和类型密切相关。
光学性质p-d 杂化轨道对分子的光学性质也有影响,如吸收光谱、发射光谱等。
这些性质与分子中的电子跃迁和能级结构有关。








史上最易理解杂化轨道理论(图解)•杂化轨道理论基本概念•s-p杂化轨道•p-p杂化轨道•d-p杂化轨道目•杂化轨道理论与分子构型关系•总结与展望录01杂化轨道理论基本概念原子轨道与杂化轨道原子轨道描述电子在原子核外空间出现概率的分布函数,即电子云形状。
常见的原子轨道有s、p、d、f等。
杂化轨道由同一原子中能量相近的不同类型原子轨道混合起来形成的一组新轨道。
杂化后的轨道具有与原轨道不同的形状、能量和对称性。
sp2杂化由1个ns 和2个np 轨道杂化形成3个sp2杂化轨道,呈平面三角形,如BF3、SO3等分子。
sp 杂化由1个ns 和1个np 轨道杂化形成2个sp 杂化轨道,呈直线型,如CO2、BeCl2等分子。
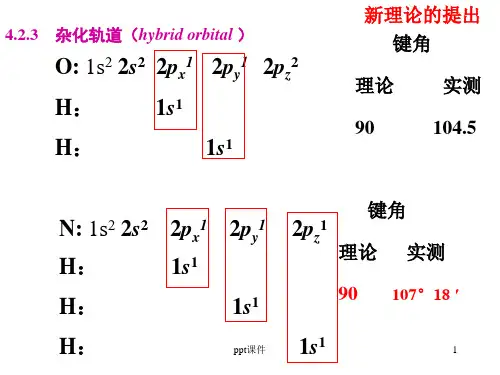
sp3杂化由1个ns 和3个np 轨道杂化形成4个sp3杂化轨道,呈正四面体型,如CH4、NH3等分子。
d2sp3杂化由1个nd2、1个ns 和3个np 轨道杂化形成6个d2sp3杂化轨道,呈正八面体型,如SF6等分子。
dsp2杂化由1个nd 、1个ns 和2个np 轨道杂化形成4个dsp2杂化轨道,呈平面正方形,如PtCl42-等分子。
杂化类型及特点参与杂化的原子轨道能量应相近,这样有利于电子在杂化后的新轨道中的重新分布和稳定。
能量相近原则最大重叠原则对称性匹配原则原子轨道在杂化过程中应尽可能重叠,以增强成键能力和降低体系能量。
原子轨道在杂化时,其对称性应与分子的对称性相匹配,以确保整个分子的稳定性。
030201杂化轨道形成原因02s-p杂化轨道原子在成键过程中,为了降低能量和增加稳定性,会将能量相近的s轨道和p轨道进行混合。
s-p杂化轨道是由s轨道和p轨道线性组合而成的新轨道,具有特定的形状、方向和能量。
在s-p杂化过程中,原子会重新分配电子云密度,使得杂化轨道更适应于成键。
s-p杂化原理及过程以甲烷(CH4)为例,碳原子的2s和2px, 2py, 2pz轨道进行sp3杂化,形成四个等价的sp3杂化轨道。