乙炔炔烃
- 格式:ppt
- 大小:1.79 MB
- 文档页数:15

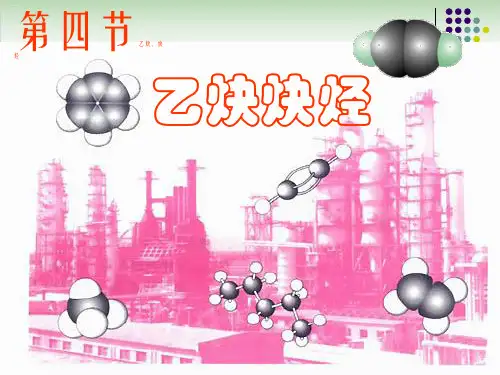
乙炔炔烃【重点】1.乙炔的结构和化学性质2.炔烃的通式和性质【重点讲解】一、乙炔的结构、实验室制法和化学性质:1.结构(1)四式:分子式:C2H2电子式:结构式:H-C≡C-H结构简式:CH≡CH(2)空间构型:直线型,呈对称结构故为非极性分子。
(3)键参数:键长:1.20×10-10m(比单键和双键都短)键角:180°键能:812kJ/mol(不等于三个单键键能之和,分子中有两个键比较弱)2.实验室制法:(1)药品:电石(CaC2碳化钙)和水(2)装置:固+液→气(不加热)与H2、CO2、H2S制取装置相似(3)反应原理:(4)收集:由于乙炔的分子量(26)略小于空气的平均分子量,故不用排气法收集;乙炔微溶于水,可用排水取气法收集。
(5)注意事项:a.原理和特点:尽管它是用块状固体与液体反应且不需加热,但实验室不能用启普发生器其原因有三点:①该反应较剧烈,不易控制。
②反应放出的大量热,易损坏启普发生器(受热不均而炸裂)。
③反应后生成的石灰乳是糊状,可夹带少量CaC2进入启普发生器底部,堵住球形漏斗和底部容器之间的空隙,使启普发生器失去作用。
b.因此实验室一般用简易装置制备乙炔。
一般情况下用电石得的乙炔气中夹杂着H2S、PH3、AsH3等特殊臭味的气体,可用CuSO4溶液或NaOH溶液除去杂质气体。
c.为得到平稳乙炔气流,控制反应速度,可用饱和食盐水代替水,用分液漏斗控制流速,并加棉花,防止泡沫喷出。
3.化学性质:(1)氧化反应:a.可燃性:2C2H2+5O24CO2+2H2O(液)+2600kJ现象:火焰明亮、带浓烟, 燃烧时火焰温度很高(>3000℃),用于气焊和气割。
其火焰称为氧炔焰。
b.被KMnO4氧化:能使紫色酸性高锰酸钾溶液褪色。
(2)加成反应:可以跟Br2, H2, HX等多种物质发生加成反应。
如:现象:溴水褪色或Br2的CCl4溶液褪色所以可用酸性KMnO4溶液或溴水褪色区别烷烃。

乙炔炔烃课件一、乙炔概述乙炔,化学式为C2H2,是一种无色、易燃、有刺激性气味的烃类化合物。
在常温常压下,乙炔是一种气体,但可以通过压缩或冷却的方式转化为液态。
乙炔分子由两个碳原子和两个氢原子组成,分子结构为直线型,碳原子之间通过三键连接,属于炔烃类化合物。
乙炔的相对分子质量为26.04,密度约为1.17kg/m³,沸点为-84℃,熔点为-103℃。
乙炔在空气中的爆炸极限为2.5%-80%,与空气混合时容易发生爆炸。
二、乙炔的制备1.电石法:电石(CaC2)与水反应乙炔,是目前工业上主要的乙炔制备方法。
反应方程式为:CaC2+2H2O→C2H2+Ca(OH)2。
该反应放热,产生的乙炔气体需经过净化、干燥等处理,才能用于后续的化学反应。
2.煤焦油裂解法:将煤焦油加热至700℃左右,通过热裂解反应乙炔。
该方法在20世纪初曾广泛用于乙炔的生产,但由于环境污染和资源浪费等问题,逐渐被电石法所取代。
3.天然气部分氧化法:将天然气与氧气混合,在高温、高压条件下进行部分氧化反应,乙炔。
该方法的优点是原料来源广泛,但设备投资较高。
4.石油裂解法:在石油裂解过程中,部分烃类化合物经高温裂解乙炔。
该方法在石油化工领域得到广泛应用。
三、乙炔的化学性质1.加成反应:乙炔分子中的三键容易发生加成反应,如与氢气、卤素、水等反应。
加成反应是乙炔在工业上的重要应用之一。
2.聚合反应:乙炔可以通过聚合反应聚乙炔,聚乙炔是一种导电聚合物,具有广泛的应用前景。
3.氧化反应:乙炔可以与氧气发生氧化反应,二氧化碳和水。
乙炔燃烧时,火焰明亮,温度较高,可用于焊接、切割金属等。
4.酸碱反应:乙炔分子中的三键容易与路易斯酸发生反应,形成加成产物。
乙炔还可以与碱金属反应,乙炔基金属化合物。
四、乙炔的应用1.金属焊接与切割:乙炔与氧气混合燃烧,产生的火焰温度高达3200℃,可用于焊接和切割金属。
2.化工原料:乙炔是合成许多重要化学品的重要原料,如聚乙烯醇、聚氯乙烯、氯丁橡胶等。


高二化学乙炔炔烃知识点炔烃是烃类化合物中的一类,具有双键或三键的碳链结构。
在炔烃中,我们重点学习的是乙炔。
乙炔(C2H2)是一种有机化合物,也被称为乙炔气。
乙炔是无色、有刺激气味的气体,具有高燃烧性和不稳定性。
在化学中,乙炔是非常重要的一种物质,具有广泛的应用。
本文将介绍乙炔炔烃的相关知识点。
一、乙炔的物理性质乙炔是无色气体,具有特殊的气味。
它的密度比空气小,能够溶于乙炔解气器中的有机溶剂。
乙炔的熔点为-80.8℃,沸点为-84℃。
乙炔可以被液化,并且在常温下可以被压缩。
由于乙炔是不稳定的,容易聚集形成爆炸性的混合物,因此在储存和使用乙炔时需要特别谨慎。
二、乙炔的制取方法乙炔的制取方法主要有两种:一种是通过煤炭焦化产生的煤气制取乙炔,另一种是通过石油cracking过程中的副产物制取乙炔。
其中较为常用的是通过煤炭焦化产生的煤气制取乙炔的方法。
该方法是将煤气经过净化处理后,再通过加热去饱和来制取乙炔。
三、乙炔的化学性质1. 燃烧性:乙炔具有高燃烧性,能与空气中的氧气发生剧烈反应,产生大量的热和光。
乙炔的燃烧反应是一个放热反应,释放出的热量可以使石棉变红并熔化。
乙炔燃烧生成的产物有水和二氧化碳。
2. 加氢反应:乙炔可以与氢气发生加氢反应,生成乙烯,并放出大量的热量。
这个反应是一个吸热反应,需要在催化剂的存在下进行。
3. 反应性:由于乙炔中碳原子上的双键非常活泼,因此乙炔具有较高的反应活性。
它可以与卤素直接反应,生成相应的卤代烃。
乙炔还可以通过加成反应生成醇、醛、酮等化合物。
四、乙炔的应用领域1. 焊接和切割:乙炔可以与氧气在高温条件下进行燃烧,产生高温火焰,因此被广泛应用于金属焊接和切割的行业。
乙炔的高温火焰可以熔化金属,并将其焊接在一起,同时也可以切割金属。
2. 化学合成:乙炔是有机化学合成中的重要原料。
它可以通过加成反应合成醇、醛、酮等化合物,也可以通过聚合反应生成聚乙炔等高分子化合物。
3. 实验室研究:由于乙炔的独特性质,它在实验室中被广泛用于研究和分析。




43乙炔炔烃一、乙炔的分子组成与结构:1、分子式:C2H22、结构式:H—C≡C—H3、结构简式:CH≡CH4、电子式:H C C H5、空间结构:线形分子,键角为180 °其二氯代物只有一种且为非极性分子。
拓展:凡是叁键周围的4个原子都在一条直线上.如HCN二、物理性质:纯净的乙炔是无色、无臭气体,比空气轻,微溶于水,易溶于有机溶剂。
三、乙炔的化学性质:1、乙炔的氧化反应:①燃烧:现象(火焰明亮,产生浓烟,产物为水及二氧化碳),有何应用?(鉴别乙烯、乙炔)及氧炔焰。
点燃前须验纯。
②由于“—C≡C—”的存在,乙炔可被酸性KMnO4溶液氧化并使其褪色思考:等物质的量乙烷、乙烯、乙炔分别在足量氧气中燃烧,放出的热量谁最多?为什么?谁火焰温度最高?为什么?(乙烷最多,含H原子最多,但火焰温度最高的是乙炔,因为含H原子最少,生成的水最少,水气化吸收的热量最少)2、加成反应逐步加成炔烃的加成反应是由于“—C≡C—”的不饱和性引起的,其加成可以控制条件使其仅停留在加1mol的反应物,当然也可以使叁键与2mol反应物发生加成反应.①加X2(其中可以使溴水褪色). Br2CHBr2CHBr2(溴水的CCl4溶液褪色)注:乙炔使Br2的CCl4溶液褪色与使Br2水褪色现象的不同之处是:使Br2的CCl4溶液褪色后形成均匀液体;使Br2水褪色后得到上下分层的液体,上层为水状,下层为油状。
②加HCl: HCl CH2=CHCl(氯乙烯)③加H2: 2H2CH3CH3④加H2O: (工业制乙醛的方法) H2O CH3CHO(乙醛)思考:如何制取CH2―CHCl? (先将CH=CH与HCl加成,注意条件,再将加成产物与Br2加成)Br Br3、加聚反应:2CH≡CH CH2=CH—C≡CH 3CH≡CHn CH≡CH CH2=CH2四、乙炔的制法1、工业制法:从石油裂解气中分离;利用电石与水作用。
2、实验室制法:①药品:电石与饱和食盐水。
第十讲 乙炔 炔烃【知识要点】定义:链烃分子里含有 的不饱和烃称为炔烃1.分子里只有一个碳碳三键的炔烃的分子通式:2.炔烃的物理性质:(1)碳原子数小于等于4的炔烃常温常压下为气体,其他的炔烃常温常压下为液体或固体。
(2)炔烃的密度比水的密度小。
(3)炔烃不溶于水溶于有机溶剂(4)炔烃随着分子里碳元素数目增加,熔沸点增高。
3.炔烃的化学性质(1)加成反应:炔烃在一定条件下与溴水,卤素单质,氢气,卤化氢,氰化氢等发生加成反应:(2)氧化反应:在空气中燃烧:酸性高锰酸钾溶液褪色。
与酸性KMnO4 溶液反应:是(3)聚合反应:在特殊条件下,炔烃能够发生加聚反应生成高聚物。
3.最简单的炔烃:乙炔 结构式 :(1)乙炔的性质和实验室制法(2):原理:为何不用启普发生器:反应剧烈、大量放热及生成桨状物为何用饱和食盐水: 减缓反应速率疏松棉花的作用: 防止粉末堵塞导管收集方法: (3)化学性质:【经典例题】例题:1、下列描述CH3—CH=CH—C≡C—CF3分子结构的叙述中,正确的是( )(A)6个碳原子有可能都在一条直线上 (B)6个碳原子不可能都在一条直线上(C)6个碳原子有可能都在同一平面上 (D)6个碳原子不可能都在同一平面上例题2、两种气态烃的混合气共1mol,在空气中燃烧得到1.5molCO2和2molH2O。
关于该混合气的说法合理的是( )A.一定含甲烷,不含乙烷 B.一定含乙烷,不含甲烷C.一定是甲烷和乙烯的混合物 D.一定含甲烷,但不含乙烯例题3、下列混合气体中,比乙烯的含碳质量分数高的是( )A、CH4 、C3H6B、C2H6、C4H8C、C2H2、C3H6D、C2H6、C3H8例题4、等物质的量的乙烷、乙烯、乙炔完全燃烧消耗氧气的物质的量之比为( )A、1:1:1B、30:35:42C、5:4:3D、7:6:5例题5、某炔烃与过量H2充分加成后得到的化合物的结构简式为CH3-CH-CH2-CH2-CH3,此炔烃的结构简式CH3为 或 。
考点43乙炔炔烃1.复习重点1.乙炔的分子结构、化学性质、实验室制法;2.炔烃的组成、结构、通式、通性。
2.难点聚焦一、乙炔分子的结构和组成分子式电子式结构式C2H2 H-C≡C-H 乙炔分子的比例模型二、乙炔的实验室制法CaC2+2H2O C2H2↑+Ca(OH)2乙炔可以通过电石和水反应得到。
实验中又该注意哪些问题呢?[投影显示]实验室制乙炔的几点说明:①实验装置在使用前要先检验气密性,只有气密性合格才能使用;②盛电石的试剂瓶要及时密封,严防电石吸水而失效;③取电石要用镊子夹取,切忌用手拿电石;④作为反应容器的烧瓶在使用前要进行干燥处理;⑤向烧瓶里加入电石时,要使电石沿烧瓶内壁慢慢滑下,严防让电石打破烧瓶;⑥电石与水反应很剧烈,向烧瓶里加水时要使水逐滴慢慢地滴下,当乙炔气流达到所需要求时,要及时关闭分液漏斗活塞,停止加水;电石是固体,水是液体,且二者很易发生反应生成C2H2气体。
很显然C2H2的生成符合固、液,且不加热制气体型的特点,那是不是说就可以用启普发生器或简易的启普发生器来制取乙炔呢?⑦实验室中不可用启普发生器或具有启普发生器原理的实验装置.......................作制备乙炔气体的实验装置。
主要原因是:a.反应剧烈,难以控制。
b.当关闭启普发生器导气管上的活塞使液态水和电石固体分离后,电石与水蒸气的反应还在进行,不能达到“关之即停”的目的。
c.反应放出大量的热,启普发生器是厚玻璃仪器,容易因受热不均而炸裂。
d.生成物Ca(OH)2微溶于水,易形成糊状泡沫,堵塞导气管与球形漏斗。
该如何收集乙炔气呢?乙炔的相对分子质量为26,与空气比较接近,还是用排水法合适。
熟悉和体会有关乙炔气体制备的注意事项及收集方法,并由两名学生上前按教材图5—14乙炔的制取装置图组装仪器,检查气密性,将电石用镊子小心地夹取沿平底烧瓶内壁缓慢滑下,打开分液漏斗的活塞使水一滴一滴地缓慢滴下,排空气后,用排水法收集乙炔气于一大试管中。