[理化生]乙炔炔烃
- 格式:ppt
- 大小:1.54 MB
- 文档页数:33


高二化学乙炔炔烃知识点炔烃是烃类化合物中的一类,具有双键或三键的碳链结构。
在炔烃中,我们重点学习的是乙炔。
乙炔(C2H2)是一种有机化合物,也被称为乙炔气。
乙炔是无色、有刺激气味的气体,具有高燃烧性和不稳定性。
在化学中,乙炔是非常重要的一种物质,具有广泛的应用。
本文将介绍乙炔炔烃的相关知识点。
一、乙炔的物理性质乙炔是无色气体,具有特殊的气味。
它的密度比空气小,能够溶于乙炔解气器中的有机溶剂。
乙炔的熔点为-80.8℃,沸点为-84℃。
乙炔可以被液化,并且在常温下可以被压缩。
由于乙炔是不稳定的,容易聚集形成爆炸性的混合物,因此在储存和使用乙炔时需要特别谨慎。
二、乙炔的制取方法乙炔的制取方法主要有两种:一种是通过煤炭焦化产生的煤气制取乙炔,另一种是通过石油cracking过程中的副产物制取乙炔。
其中较为常用的是通过煤炭焦化产生的煤气制取乙炔的方法。
该方法是将煤气经过净化处理后,再通过加热去饱和来制取乙炔。
三、乙炔的化学性质1. 燃烧性:乙炔具有高燃烧性,能与空气中的氧气发生剧烈反应,产生大量的热和光。
乙炔的燃烧反应是一个放热反应,释放出的热量可以使石棉变红并熔化。
乙炔燃烧生成的产物有水和二氧化碳。
2. 加氢反应:乙炔可以与氢气发生加氢反应,生成乙烯,并放出大量的热量。
这个反应是一个吸热反应,需要在催化剂的存在下进行。
3. 反应性:由于乙炔中碳原子上的双键非常活泼,因此乙炔具有较高的反应活性。
它可以与卤素直接反应,生成相应的卤代烃。
乙炔还可以通过加成反应生成醇、醛、酮等化合物。
四、乙炔的应用领域1. 焊接和切割:乙炔可以与氧气在高温条件下进行燃烧,产生高温火焰,因此被广泛应用于金属焊接和切割的行业。
乙炔的高温火焰可以熔化金属,并将其焊接在一起,同时也可以切割金属。
2. 化学合成:乙炔是有机化学合成中的重要原料。
它可以通过加成反应合成醇、醛、酮等化合物,也可以通过聚合反应生成聚乙炔等高分子化合物。
3. 实验室研究:由于乙炔的独特性质,它在实验室中被广泛用于研究和分析。

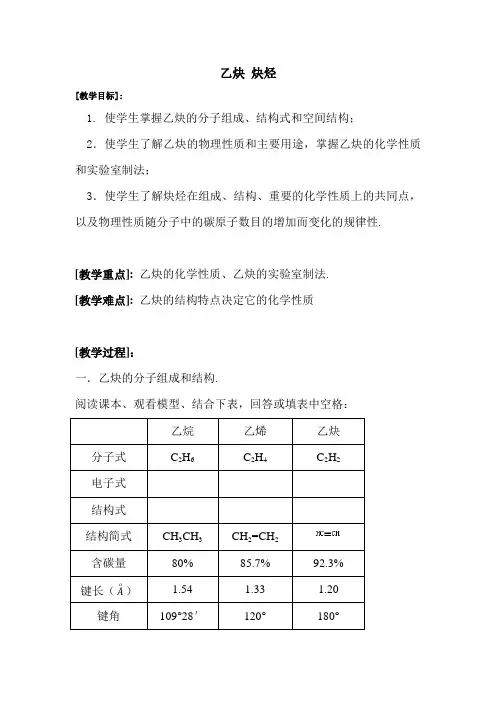
乙炔炔烃[教学目标]:1. 使学生掌握乙炔的分子组成、结构式和空间结构;2.使学生了解乙炔的物理性质和主要用途,掌握乙炔的化学性质和实验室制法;3.使学生了解炔烃在组成、结构、重要的化学性质上的共同点,以及物理性质随分子中的碳原子数目的增加而变化的规律性.[教学重点]:乙炔的化学性质、乙炔的实验室制法.[教学难点]:乙炔的结构特点决定它的化学性质[教学过程]:一.乙炔的分子组成和结构.阅读课本、观看模型、结合下表,回答或填表中空格:[讨论]:1.乙炔分子中碳原子的四个价键是怎样得到满足的?2.从叁键的键能、键长与双键及单键的比较,说明叁键中叁个楗的键能是否一样?由此请推测乙炔的化学性质和乙烯、乙烷比如何?[推测]:乙炔中有两个键较易断裂,因此它的化学性质比较活泼.二.乙炔的实验室制法.1. 原理:CaC2 + 2H2O → C2H2↑ + Ca(OH)23C + CaO −−高温 CaC2 + CO↑−→2.装置:固+液→气(类似于制H2、CO2,但不能用启普发生器.)3.除杂:常用碱液洗气,以除去 PH3、H2S等.(思考:可否用强氧化剂洗气?)控速:常用浓食盐水代替水,以降低反应速率.三.乙炔的性质.1.物理性质:无色、无味的气体;密度为d标=1.16g/L;微溶于水,易溶于某些有机溶剂(如丙酮).2.化学性质:[推测]:乙炔分子里的三个碳碳键的键能是不一样的,其中有两个键较易断裂,因而其化学性质类似于乙烯.即可被强氧化剂氧化,易发生加成反应.[演示实验5-7,5-8,5-9]模仿乙烯的化学性质,自我立出乙炔化学性质的提纲.(1).氧化反应.①.燃烧:2C2H2+5O2−−点燃4CO2+2H2O−→现象:明亮程度乙炔>乙烯>甲烷;烟的多少: 乙炔>乙烯>甲烷.②.被强氧化剂氧化:可使酸性高锰酸钾溶液褪色.(2).加成反应.①.跟卤素的加成:+Br 2→CHBr=CHBr (1,2-二溴乙烯)CHBr=CHBr+Br→CHBr2CHBr2 (1,1,2,2-四溴乙烷)②.跟氢气的加成:+H2−−催化剂 CH2=CH2−→CH2=CH2+H2−−催化剂CH3CH3−→③.跟卤化氯的加成:+HCl−−催化剂CH2=CHCl (氯乙烯)−→氯乙烯的加聚n CH2=CHCl−−催化剂[-CH2-CHCl-]n (聚氯乙烯)−→[讨论]:试列表对比乙烷、乙烯、乙炔的有关化学性质及反应现象.四.乙炔的用途:工业上用氧炔焰来焊接或切割金属.五.炔烃.1.结构特点和通式:链烃分子里含有碳碳三键的不饱和烃,叫炔烃.组成结构:均含有三键、组成上相差一个CH2原子团.炔烃的通式:C n H2n-2(n≥2)2.物理性质:碳原子数小于或等于4的烯烃在常温下是气态,熔沸点随碳原子数目的增加而增大.3.化学性质:跟乙炔相类似.(1).燃烧时火焰较烯烃明亮(含碳量高).(2).分子里含有不饱和的三键,容易发生氧化、加成和聚合反应.4.炔烃的命名:类似于烯烃.[课堂练习]:1.写出C5H8的链烃的同分异构体的结构简式并命名.解析:1-戊炔;2-戊炔;3-甲基-1-丁炔;1,3-戊二烯;1,4-戊二烯;2-甲基-1,3-丁二烯.2.分析分子中碳原子的空间相对位置.分析:6个碳原子有可能在同一平面上,但不在同一直线上.3.工业上电石(碳化钙)是由生石灰和焦炭在电炉中加高温而制得,同时有CO生成.试写出工业上用石灰石、焦炭、食盐(电解食盐水可生成NaOH、H2、Cl2)、水等为原料制取聚氯乙烯的有关反应的化学方程式.分析:制备物质的过程(路线)一般按“逆向思维,顺向作答”来思考解答.。





第69节 乙炔炔烃一、乙炔的分子结构乙炔分子(如图13-26所示)的不饱和度比乙烯多1个,两个碳原子间有三个共用电子对,通常称为叁键。
实验表明乙炔分子中C=C 叁键的键能是812kJ/mol ,叁键的键长是101.2010-⨯m ,所有的原子处在一条直线上。
二、乙炔的物理性质纯的乙炔是没有颜色,没有气味的气体,而由电石制备的乙炔中常混有PH 3和H 2S 等杂质而发出特殊难闻的臭味。
乙炔微溶于水,易溶于有机溶剂。
三、乙炔的化学性质反应放出的乙炔经检验,确认纯净后,在导管口点燃,观察气体燃烧的现象(参见图13-27);然后把一冷而干燥的小烧杯倒扣在火焰上方,片刻后可看到烧杯内壁上出现水滴,迅速倒转烧杯,向烧杯中注入少量澄清的石灰水,振荡,观察石灰水的变化乙炔燃烧时发出光亮而带浓烟的火焰,放出大量的热。
乙炔在氧气中燃烧时产生的氧炔焰的温度很高(可达3000℃以上),可用来切割和焊接金属。
222222C H (g)5O (g)4CO (g)2H O(1)2600kJ +→++点燃把纯净的乙炔通入盛有酸性KMnO 4溶液的试管中,观察溶液颜色的变化。
乙炔易被氧化剂氧化,能使酸性高锰酸钾溶液褪色。
把纯净的乙炔通入盛有溴水的试管中,观察溴水的颜色变化(参见图13-28)。
乙炔能使溴水褪色。
反应的化学方程式为:乙炔也能与H 2反应,先生成乙烯,进而生成乙烷。
1N 222CH CH H CH CH ≡+→= 222CH CH H =+在150℃~160℃时,在HgCl 2作催化剂的条件下,乙炔能与氯化氢发生加成反应,生成氯乙烯。
氯乙烯是重要的化工原料。
2HgCl 2CH CH HCl CH CHCl ∆−−→≡+=− 乙炔在第一步加成后得到的烯烃的衍生物仍能发生加成、取代、加聚等反应,因此乙炔是种重要的基本有机原料。
四、乙炔的实验室制备如图13-29所示,在圆底烧瓶中放人几小块电石。
轻轻旋开分液漏斗的活塞,使水(或用饱和食盐水)缓慢地滴下,并用排水集气法收集气体乙炔(C 2H 2)可由电石制备,故又称电石气:22222CaC 2H O C H Ca(OH)+→↑+(电石,块状)五、炔烃链烃分子中含有碳碳叁键的不饱和烃叫做炔烃。

乙炔炔烃课件一、乙炔概述乙炔,化学式为C2H2,是一种无色、易燃、有刺激性气味的烃类化合物。
在常温常压下,乙炔是一种气体,但可以通过压缩或冷却的方式转化为液态。
乙炔分子由两个碳原子和两个氢原子组成,分子结构为直线型,碳原子之间通过三键连接,属于炔烃类化合物。
乙炔的相对分子质量为26.04,密度约为1.17kg/m³,沸点为-84℃,熔点为-103℃。
乙炔在空气中的爆炸极限为2.5%-80%,与空气混合时容易发生爆炸。
二、乙炔的制备1.电石法:电石(CaC2)与水反应乙炔,是目前工业上主要的乙炔制备方法。
反应方程式为:CaC2+2H2O→C2H2+Ca(OH)2。
该反应放热,产生的乙炔气体需经过净化、干燥等处理,才能用于后续的化学反应。
2.煤焦油裂解法:将煤焦油加热至700℃左右,通过热裂解反应乙炔。
该方法在20世纪初曾广泛用于乙炔的生产,但由于环境污染和资源浪费等问题,逐渐被电石法所取代。
3.天然气部分氧化法:将天然气与氧气混合,在高温、高压条件下进行部分氧化反应,乙炔。
该方法的优点是原料来源广泛,但设备投资较高。
4.石油裂解法:在石油裂解过程中,部分烃类化合物经高温裂解乙炔。
该方法在石油化工领域得到广泛应用。
三、乙炔的化学性质1.加成反应:乙炔分子中的三键容易发生加成反应,如与氢气、卤素、水等反应。
加成反应是乙炔在工业上的重要应用之一。
2.聚合反应:乙炔可以通过聚合反应聚乙炔,聚乙炔是一种导电聚合物,具有广泛的应用前景。
3.氧化反应:乙炔可以与氧气发生氧化反应,二氧化碳和水。
乙炔燃烧时,火焰明亮,温度较高,可用于焊接、切割金属等。
4.酸碱反应:乙炔分子中的三键容易与路易斯酸发生反应,形成加成产物。
乙炔还可以与碱金属反应,乙炔基金属化合物。
四、乙炔的应用1.金属焊接与切割:乙炔与氧气混合燃烧,产生的火焰温度高达3200℃,可用于焊接和切割金属。
2.化工原料:乙炔是合成许多重要化学品的重要原料,如聚乙烯醇、聚氯乙烯、氯丁橡胶等。

【高中化学】高中化学必修二知识点总结:乙炔炔烃【高中化学】高中化学必修二知识点总结:乙炔炔烃
1、乙炔结构特点:
①2个c原子和2个氢原子处在同直线。
②分子里的c≡c键里有两个是不稳定的键
2、乙炔的性质:
(1)物理性质:乙炔又名电石气。
纯乙炔是无色、无臭味的气体,因含ph3、h2s等杂质而有臭味;微溶于水,易溶于有机溶剂。
(2)乙炔的化学性质和用途:
①氧化反应:
1)可燃性:空气中,光亮火焰,存有浓烟;乙炔在o2里冷却时,产生的氧炔焰的温度很高(3000℃以上),需用去研磨和冲压金属。
2)可被kmno4溶液氧化
②加成反应:可以并使溴水退色;
从乙炔和hcl可制得聚氯乙烯塑料。
3、乙炔的制法:实验室制法:
药品:电石、水(通常用饱和食盐水)
原理:cac2+2h2o→c2h2↑+ca(oh)2
装置:固+液→气收集:排水法
注意事项:①反应太快,故用分液圆柱形掌控搅拌的速率。
②用饱和状态食盐水替代水,减慢反应速率。
③排洪法搜集(无法采用排在空气法,因其密度与空气吻合。
)。