第六章1沉淀重量法案例
- 格式:ppt
- 大小:1.37 MB
- 文档页数:56









实验一沉淀重量法测定氯化钡中钡含量一、预习要点1. 重量分析法的分类、原理和特点;2. 沉淀的分类及晶形沉淀析出条件的控制;3. 沉淀的溶解度概念、影响溶解度的因素。
二、实验目的1. 了解重量法测定BaCl2·2H2O中钡的含量的原理和方法;2. 掌握晶形沉淀的制备、过滤、洗涤、灼烧及恒重等的基本操作技术。
三、实验原理重量分析法是通过称量物质的质量进行分析的方法。
测定时,通常先用适当的方法使被测组分与其他组分分离,然后称重,由称得的质量计算该组分的含量。
重量分析法具有准确度高,不需标准溶液的优点,但操作繁琐,耗时长。
重量分析法分为挥发法、电解法和沉淀法三类。
沉淀重量法是利用沉淀反应使待测组分以微溶化合物的形式沉淀出来,再使之转化为称量形式进行称量。
BaSO4晶形沉淀重量法是通过控制适当的条件,使Ba2十与SO42-反应,形成晶形沉淀。
晶形沉淀的沉淀条件是“稀、热、慢、搅、沉”五字原则。
沉淀经过滤、洗涤、烘干、炭化、灰化、灼烧后,以BaSO4形式称量,既可用于测定Ba2十,也可用于测定SO42-的含量。
硫酸钡重量法一般在0.05 mol·L-1左右盐酸介质中进行沉淀,它是为了防止产生BaCO3,BaHPO4,BaHAsO4沉淀以及防止生成Ba(OH)2共沉淀。
同时,适当提高酸度,增加BaSO4在沉淀过程中的溶解度,以降低其相对过饱和度,有利于获得较好的晶形沉淀。
用BaSO4重量法测定Ba2十时,一般用稀H2SO4作沉淀剂。
为了使BaSO4沉淀完全,H2SO4必须过量。
由于H2SO4在高温下可挥发除去,故沉淀带下的H2SO4不致引起误差,因此沉淀剂可过量50%—l00%。
四、实验用品H2SO4 1mol·L-1、HCl 2 mol·L-1、HNO3 2 mol·L-1、AgNO3 0.1 mol·L-1、BaCl2·2H2O A.R、瓷坩埚 25mL 2-3个、定量滤纸慢速或中速、淀帚一把、玻璃漏斗两个。

沉淀重量法对沉淀形式和称量形式的要求
教学要点:根本概念
重量分析法〔沉淀法〕对沉淀形式的要求
重量分析法〔沉淀法〕对称量形式的要求
沉淀剂的选择
一、根本概念
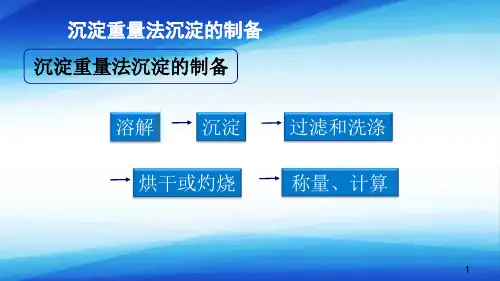
1、沉淀重量法
利用沉淀反响将待测组分以难溶化合物形式沉淀下来,经过滤、洗涤、烘干、灼烧后,转化成具有确定组成的称量形式,称量并计算被测组分含量的分析方法。
2、沉淀形式
往试液中参加适当的沉淀剂,使被测组分沉淀出来,所得的沉淀称为沉淀形式。
3、称量形式
沉淀经烘干或灼烧后,得到称量形式,然后再由称量形式的化学组成和重量,便可算出被测组分的含量。
二、重量分析法〔沉淀法〕对沉淀形式的要求
1、沉淀的溶解度必须很小,这样才能保证被测组分沉淀完全。
Ksp <10-8
2、沉淀应易于过滤和洗涤。
颗粒较大的沉淀好于较小的沉淀。
颗粒大的晶形沉淀比同质量的颗粒小颗粒沉淀具有较小的总外表
积,易于洗净。
3、沉淀力求纯洁,尽量防止其它杂质的沾污。
4、沉淀应易于转化为称量形式。
三、重量分析法〔沉淀法〕对称量形式的要求
1、称量形式必须有确定的化学组成,否那么无法计算分析结果。
2、称量形式必须十分稳定,不受空气中水分、CO2和O2等的影响。
3、称量形式分子量要大,在称量形式中被测组分的百分含量要小,这样可以提高分析准确度。
四、沉淀剂的选择
1、沉淀剂应选择性高,而且应为易挥发、易分解,便于灼烧除去。
2、沉淀剂应具有特效性。
有机沉淀剂:具有较大分子量和选择性,具有较小的溶解度,带有鲜艳的颜色和便于洗涤的结构。
其所形成的沉淀只需要烘干即可称量。