实验六电离平衡和沉淀平衡.
- 格式:ppt
- 大小:93.00 KB
- 文档页数:11


实验六:电导法测弱电解质的电离平衡常数一、实验目的:1、掌握惠斯登电桥法测定电导的原理。
2、学会实验测量的操作技术。
3、学会图解法求算解离度,了解电导测定的应用。
二、实验原理:电解质溶液的导电能力由电导G来量度,它是电阻的倒数,即:电导的单位是“西门子”,符号为“S”,。
将电解质溶液放入两平行电极之间,若两电极距离为l,电极面积为A,则溶液的电导为:式中电导率,其物理意义是l=1m,A=1m2时溶液的电导,其单位为S·m-1。
定义电导池系数则通常将一个电导率已知的电解质溶液注入电导池中,测其电导,根据上式即可求出K cell。
在研究电解质溶液的导电能力时,经常使用摩尔电导率,其定义为:式中c为电解质溶液的浓度,的单位是:S·m2·mol-1。
对于弱电解质(例如醋酸)来说,由于其电导率很小,所以测得的溶液的电导率应包括水的电导率,即电解质溶液是由正、负离子的迁移来传递电流的,在弱电解质溶液中,只有解离部分的离子才对电导有贡献,而在无限稀释的溶液中,电解质全部解离,其摩尔电导率是正、负离子的极限摩尔电导率之和。
即式中ν+,ν-分别为正、负离子的化学计量数,可查表得到。
与的差别来自两个因素,一是电解质的不完全电离,二是离子间的相互作用。
若溶液中离子浓度很低,彼此相隔较远,相互作用力可以忽略,则与之间的关系可表示为:(推导)式中α为弱电解质的解离度。
醋酸在水溶液中有下列平衡:其解离平衡常数为(推导)将代入上式整理可得此式称为奥斯特瓦尔德(Ostwald)稀释定律。
改写成线性方程为:以对作图得一直线,斜率为,截距为,由此可求得和(推导) :整理可得:电解质溶液的电导通常利用惠斯登(Wheatston)电桥测量,但测量时不能用直流电源,因直流电流通过溶液时,导致电化学反应发生,不但使电极附近溶液的浓度改变引起浓差极化,还会改变两极的本质。
因此必须采用较高频率的交流电,其频率通常选为1000Hz。


电离平衡公开课教案教学设计课件资料第一章:电离平衡基本概念1.1 电离与电离平衡介绍电离的定义和特点解释电离平衡的概念和意义举例说明电离平衡的存在1.2 离子浓度与电离平衡常数介绍离子浓度的概念和计算方法解释电离平衡常数的概念和意义举例说明电离平衡常数的计算和应用第二章:电离平衡的移动2.1 影响电离平衡的因素介绍温度对电离平衡的影响解释浓度对电离平衡的影响探讨压力对电离平衡的影响2.2 电离平衡的移动方向解释勒夏特列原理探讨电离平衡的移动方向和条件举例说明电离平衡的移动现象第三章:酸碱理论中的电离平衡3.1 酸碱电离与电离平衡介绍酸碱的定义和特点解释酸碱电离平衡的概念和意义举例说明酸碱电离平衡的应用3.2 酸碱平衡与pH值介绍pH值的定义和计算方法解释酸碱平衡的概念和意义探讨pH值与酸碱电离平衡的关系第四章:溶胶电离平衡4.1 溶胶的定义和特点介绍溶胶的概念和分类解释溶胶电离平衡的概念和意义举例说明溶胶电离平衡的应用4.2 溶胶电离平衡的移动探讨溶胶电离平衡的移动方向和条件举例说明溶胶电离平衡的移动现象解释溶胶的稳定性和聚沉现象第五章:电离平衡在实际应用中的例子5.1 离子交换树脂的电离平衡介绍离子交换树脂的概念和应用解释离子交换树脂的电离平衡原理举例说明离子交换树脂的电离平衡应用5.2 缓冲溶液的电离平衡介绍缓冲溶液的概念和特点解释缓冲溶液的电离平衡原理探讨缓冲溶液的pH值调节应用第六章:盐类的水解与电离平衡6.1 盐类水解的基本概念介绍盐类水解的定义和特点解释盐类水解的原理和意义举例说明盐类水解的应用6.2 盐类水解的类型和规律探讨不同类型的盐类水解反应解释盐类水解的规律和影响因素举例说明盐类水解的计算和应用第七章:酸碱滴定与电离平衡7.1 酸碱滴定的基本原理介绍酸碱滴定的定义和目的解释酸碱滴定的原理和步骤举例说明酸碱滴定实验的操作和结果分析7.2 酸碱滴定与电离平衡的应用探讨酸碱滴定在电离平衡测定中的应用解释滴定曲线和滴定终点的关系举例说明酸碱滴定在实际中的应用案例第八章:溶胶的电泳与电离平衡8.1 溶胶电泳的基本原理介绍溶胶电泳的定义和原理解释溶胶电泳的机制和影响因素举例说明溶胶电泳的应用8.2 溶胶电泳与电离平衡的关系探讨溶胶电泳与电离平衡的联系和影响解释电泳现象在电离平衡研究中的应用举例说明溶胶电泳在实际中的应用案例第九章:电离平衡在环境科学中的应用9.1 环境中的电离平衡问题介绍环境科学中电离平衡的重要性解释环境中的电离平衡问题和影响因素举例说明环境中的电离平衡应用案例9.2 电离平衡在环境监测和治理中的应用探讨电离平衡在环境监测和治理中的作用解释电离平衡相关技术和方法的应用举例说明电离平衡在环境保护领域的应用案例第十章:电离平衡的实验设计与分析10.1 电离平衡实验设计的基本原则介绍电离平衡实验设计的重要性和原则解释实验设计的步骤和注意事项举例说明电离平衡实验设计的案例10.2 电离平衡实验结果的分析与解读探讨电离平衡实验结果分析的方法和技巧解释实验数据的处理和结果解读举例说明电离平衡实验结果的应用和启示重点和难点解析一、电离平衡的基本概念:理解电离平衡的定义和特点,以及电离平衡常数的概念和意义。

教育·现场基于化学核心素养的教学设计———以“电离平衡”一课为例文|张旭波针对“电离平衡”,教师将带领学生穿越微观的化学领域,深入探讨溶液中的离子行为,并揭开化学反应平衡的神秘面纱。
电离平衡是一门扣人心弦的科学,与日常生活中无数的现象密切相关,也是许多重要化学反应的前提和基础。
大家是否好奇在溶液中发生的那些微小的离子变化,以及它们是如何影响我们周围的环境?在这个过程中,学生会通过理论知识的学习,深入了解电离平衡的概念,还将通过实验感受电离平衡的神奇之处。
本文通过人教版高中化学选择性必修1第3章第1节“电离平衡”课的教学设计,探讨了如何在课堂上培养学生的核心素养,并引导学生进行深入探究和学习,帮助学生掌握所学知识。
一、教材分析“电离平衡”是高中化学教学中的重要一课,深入研究在溶液中发生的离子行为和相应的平衡状态。
在该课的教学过程中,学生将逐渐理解电离平衡对化学反应造成的影响,探究其中的规律和原理。
首先,教材从电离平衡的基本概念入手,引导学生认识溶液中离子的生成和消失过程。
通过学习电离方程式,学生将逐渐领悟弱电解质和强电解质之间的差异,以及它们在水溶液中的离子产生规律。
其次,教材详细介绍了影响电离平衡的因素,包括温度、浓度、压力等对平衡位置的影响,学生根据理论学习和实验操作,可以深刻理解这些因素是如何影响电离平衡的,从而掌握实际应用中的相关技能。
再次,教材还通过案例分析,将电离平衡的知识和实际生活、工业生产联系起来,以拓宽学生的视野,激发他们的学习兴趣,并帮助他们更容易理解抽象的理论概念,以此加深对电离平衡的认知。
最后,教材还强调了数学在电离平衡中的重要性,通过计算离子浓度等实际问题,培养学生的数理思维和解决问题的能力。
(见表1)表1内容具体描述基本概念引导学生认识溶液中离子的生成和消失过程,通过学习电离方程式理解弱电解质和强电解质在水溶液中的离子产生规律。
影响因素详细介绍影响电离平衡的因素,包括温度、浓度、压力等,学生通过理论学习和实验操作深刻理解这些因素如何调控电离平衡。


竭诚为您提供优质文档/双击可除解离平衡实验报告篇一:《水溶液中的解离平衡》实验报告二、实验步骤(一)同离子效应1、取两只小试管,0.1mol/LhAc溶液及1滴甲基橙,混合均匀,溶液呈红色。
在一试管中加入少量naAc(s),观察指示剂颜色变化指示剂变黄。
hAc=h++Ac-naAc=na++Ac—2、取两只小试管,各加入5滴0.1mol/Lmgcl2溶液,在其中以支试管中再加入5滴饱和nh4cl溶液,然后分别在这两支试管中加入5滴2mol/Lnh3·h2o,观察两试管发生的现象有何不同?何故?mgcl2=mg2++2cl-mg2++2oh—=mg(oh)2↓nh4cl解离出的cl-使mgcl2解离平衡向左移动减小了溶液中mg2+的浓度,因而在入5滴饱和nh4cl溶液,然后(二)在这支试管中加入5滴2mol/Lnh3·h2o无白色沉淀生成。
缓冲溶液的配制1、用1mol/LhAc溶液和1mol/LnaAc溶液配置ph=4.0的缓冲溶液10mL.应该如何配制?配好后,用ph试纸测定其ph值,检验其是否符合要求.ph=pKa+lgcAc-/chAc4=4.75+lgcAc-/chAclgcAc-/chAc=-0. 75cAc-/chAc=0.178VAc-/10-VhAc=0.178VAc-=1.51mLVhAc= 8.59mL2、将上述缓冲溶液分成两等份,在一分中加入1mol/Lhcl溶液1滴,在另一分中加入1mol/Lnaoh溶液,分别测定其ph值。
3、取两只试管,各加入5毫升蒸馏水,用ph试纸测定其ph值。
然后分别加入1mol/Lhcl1滴和1mol/Lnaoh1滴,再用ph试纸测定其ph值。
与“2”进行比较。
(三)盐的水解1、在三只小试管中分别加入1毫升0.1mol/Lna2co3,nacl,及Al2(so4)3溶液,用ph试纸测定它们的酸碱性。
解释其原因,并写出有关反应程式。

竭诚为您提供优质文档/双击可除解离平衡实验报告篇一:《水溶液中的解离平衡》实验报告二、实验步骤(一)同离子效应1、取两只小试管,0.1mol/LhAc溶液及1滴甲基橙,混合均匀,溶液呈红色。
在一试管中加入少量naAc(s),观察指示剂颜色变化指示剂变黄。
hAc=h++Ac-naAc=na++Ac—2、取两只小试管,各加入5滴0.1mol/Lmgcl2溶液,在其中以支试管中再加入5滴饱和nh4cl溶液,然后分别在这两支试管中加入5滴2mol/Lnh3·h2o,观察两试管发生的现象有何不同?何故?mgcl2=mg2++2cl-mg2++2oh—=mg(oh)2↓nh4cl解离出的cl-使mgcl2解离平衡向左移动减小了溶液中mg2+的浓度,因而在入5滴饱和nh4cl溶液,然后(二)在这支试管中加入5滴2mol/Lnh3·h2o无白色沉淀生成。
缓冲溶液的配制1、用1mol/LhAc溶液和1mol/LnaAc溶液配置ph=4.0的缓冲溶液10mL.应该如何配制?配好后,用ph试纸测定其ph值,检验其是否符合要求.ph=pKa+lgcAc-/chAc4=4.75+lgcAc-/chAclgcAc-/chAc=-0. 75cAc-/chAc=0.178VAc-/10-VhAc=0.178VAc-=1.51mLVhAc= 8.59mL2、将上述缓冲溶液分成两等份,在一分中加入1mol/Lhcl溶液1滴,在另一分中加入1mol/Lnaoh溶液,分别测定其ph值。
3、取两只试管,各加入5毫升蒸馏水,用ph试纸测定其ph值。
然后分别加入1mol/Lhcl1滴和1mol/Lnaoh1滴,再用ph试纸测定其ph值。
与“2”进行比较。
(三)盐的水解1、在三只小试管中分别加入1毫升0.1mol/Lna2co3,nacl,及Al2(so4)3溶液,用ph试纸测定它们的酸碱性。
解释其原因,并写出有关反应程式。
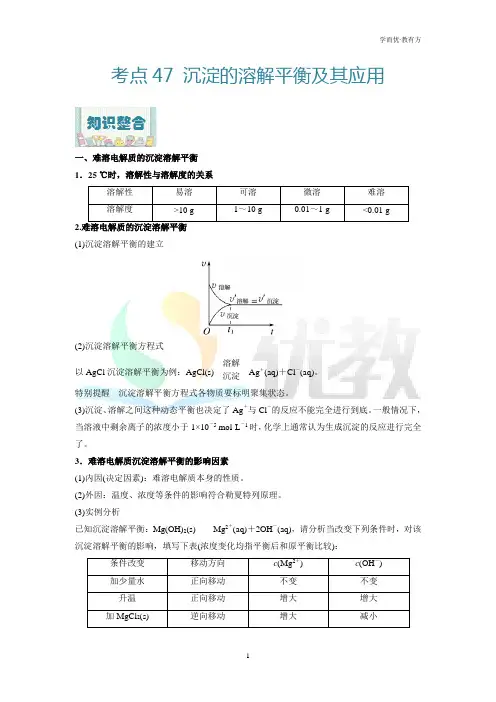
考点47 沉淀的溶解平衡及其应用一、难溶电解质的沉淀溶解平衡1.25 ℃时,溶解性与溶解度的关系溶解性易溶可溶微溶难溶溶解度>10 g 1~10 g 0.01~1 g <0.01 g 2.难溶电解质的沉淀溶解平衡(1)沉淀溶解平衡的建立(2)沉淀溶解平衡方程式以AgCl沉淀溶解平衡为例:AgCl(s)溶解沉淀Ag+(aq)+Cl-(aq)。
特别提醒沉淀溶解平衡方程式各物质要标明聚集状态。
(3)沉淀、溶解之间这种动态平衡也决定了Ag+与Cl-的反应不能完全进行到底。
一般情况下,当溶液中剩余离子的浓度小于1×10-5 mol·L-1时,化学上通常认为生成沉淀的反应进行完全了。
3.难溶电解质沉淀溶解平衡的影响因素(1)内因(决定因素):难溶电解质本身的性质。
(2)外因:温度、浓度等条件的影响符合勒夏特列原理。
(3)实例分析已知沉淀溶解平衡:Mg(OH)2(s)Mg2+(aq)+2OH-(aq),请分析当改变下列条件时,对该沉淀溶解平衡的影响,填写下表(浓度变化均指平衡后和原平衡比较):条件改变移动方向c(Mg2+) c(OH-)加少量水正向移动不变不变升温正向移动增大增大加MgCl2(s) 逆向移动增大减小加盐酸正向移动增大减小加NaOH(s) 逆向移动减小增大特别提醒大多数电解质溶解度随温度的升高而增大,但有许多例外,如Ca(OH)2,温度越高,溶解度越小。
二、溶度积常数1.概念难溶电解质的沉淀溶解平衡常数称为溶度积常数,简称溶度积,符号为K sp,K sp的大小反映难溶电解质在水中的溶解能力。
2.表达式A mB n(s)m A n+(aq)+n B m-(aq)K sp=c m(A n+)·c n(B m-)。
如:Fe(OH)3(s)Fe3+(aq)+3OH-(aq)K sp=c(Fe3+)·c3(OH-)。
3.影响因素溶度积K sp值的大小只与难溶电解质本身的性质和温度有关。

篇一:《水溶液中的解离平衡》实验报告二、实验步骤(一)同离子效应1、取两只小试管,0.1mol/lhac溶液及1滴甲基橙,混合均匀,溶液呈红色。
在一试管中加入少量naac(s),观察指示剂颜色变化指示剂变黄。
ha c = h++ ac- naac = na++ ac—2、取两只小试管,各加入5滴0.1mol/lmgcl2溶液,在其中以支试管中再加入5滴饱和nh4cl 溶液,然后分别在这两支试管中加入5滴2mol/lnh3·h2o,观察两试管发生的现象有何不同?何故? mgcl2 = mg2++ 2cl- mg2++ 2oh—= mg(oh)2↓nh4cl解离出的cl-使 mgcl2解离平衡向左移动减小了溶液中mg2+的浓度,因而在入5滴饱和nh4cl溶液,然后在这支试管中加入5滴2mol/lnh3·h2o无白色沉淀生成。
(二)缓冲溶液的配制1、用1mol/lhac溶液和1mol/lnaac溶液配置ph=4.0的缓冲溶液10ml.应该如何配制?配好后,用ph试纸测定其ph值,检验其是否符合要求.ph = pka + lgcac-/chac 4 = 4.75 + lgcac-/chac lgcac-/chac = -0.75 cac-/chac =0.178 v ac-/10-vhac =0.178 v ac- = 1.51 ml vhac =8.59ml2、将上述缓冲溶液分成两等份,在一分中加入1mol/lhcl溶液1滴,在另一分中加入1mol/lnaoh溶液,分别测定其ph值。
3、取两只试管,各加入5毫升蒸馏水,用ph试纸测定其ph值。
然后分别加入1mol/lhcl1滴和1mol/lnaoh1滴,再用ph试纸测定其ph值。
与“2”进行比较。
(三)盐的水解1、在三只小试管中分别加入1毫升0.1mol/lna2co3,nacl,及al2(so4)3溶液,用ph试纸测定它们的酸碱性。

实验六 电导法测定乙酸电离平衡常数报告人: 同组人: 实验时间2021年06月12日一.实验目的:1.掌握电导、电导率、摩尔电导率的概念以及它们之间的相互关系。
3.掌握电导法测定弱电解质电离平衡常数的原理。
二.实验原理:1.电离平衡常数K c 的测定原理在弱电解质溶液中,只有已经电离的局部才能承担传递电量的任务。
在无限稀释的溶液中可以认为弱电解质已全部电离,此时溶液的摩尔电导率为∞∧m ,可以用离子的极限摩尔电导率相加而得。
而一定浓度下电解质的摩尔电导率∧m 与无限稀释的溶液的摩尔电导率∞∧m 是有区别的,这由两个因素造成,一是电解质的不完全离解,二是离子间存在相互作用力。
二者之间有如下近似关系:∞∧∧=mm α 〔1〕式中为弱电解质的电离度。
对AB 型弱电解质,如乙酸〔即醋酸〕,在溶液中电离到达平衡时,其电离平衡常数K c 与浓度c 和电离度α的关系推导如下:CH 3COOH →CH 3COO - + H +起始浓度 c 0 0 平衡浓度 c (1-α) c α c α 那么aca K c -=12〔2〕以式〔1〕代入上式得:)(Λm m2ΛΛΛc K m m c -=∞∞ 〔3〕因此,只要知道∧m ∞和∧m 就可以算得该浓度下醋酸的电离常数K c 。
将式〔2〕整理后还可得:〔4〕m m 1/Λm 作图可得一条直线,由直线斜率可测出在一定浓度范围内c K 的平均值。
2.摩尔电导率∧m 的测定原理电导是电阻的倒数,用G 表示,单位S 〔西门子〕。
电导率那么为电阻率的倒数,用k 表示,单位为G·m -1。
摩尔电导率的定义为:含有一摩尔电解质的溶液,全部置于相距为1m 的两个电极之间,这时所具有的电导称为摩尔电导率。
摩尔电导率与电导率之间有如下的关系。
∧m = κ/c 〔5〕式中c 为溶液中物质的量浓度,单位为mol·m -3。
在电导池中,电导的大小与两极之间的距离l 成反比,与电极的面积A 成正比。