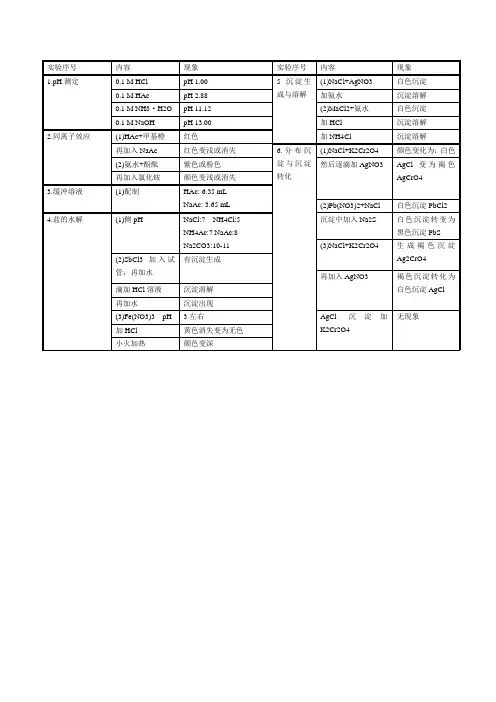
实验二 电离平衡与沉淀反应共30页
- 格式:ppt
- 大小:2.17 MB
- 文档页数:30


新乡医学院无机化学实验课教案首页授课教师姓名及职称:新乡医学院化学教研室年月日实验 电离平衡和沉淀溶解平衡一、实验目的1.了解同离子效应对电离平衡的影响;2.学习缓冲溶液的配制并了解其缓冲原理及应用;3.了解盐的水解及其影响因素;4.理解沉淀的生成及溶解的条件;二、实验原理1. 同离子效应:HAcH ++Ac -同离子效应能使弱电解质的电离度降低,从而改变弱电解质溶液的pH 值。
PH 值的变化可借助指示剂变色来确定。
2. 缓冲溶液:能抵抗外加少量强酸、强碱或水的稀释而保持溶液pH 基本不变。
3. 盐的水解:Ac -+H 2OHAc +OH - NH 4++H 2O NH 3·H 2O +H + 盐类水解程度的大小,主要由盐类的本性决定。
此外还受温度、盐的浓度和酸度等因素的影响。
根据同离子效应,向溶液中加入H +或OH -离子就可以防止它们的水解。
另外,由于水解反应是吸热反应,加热可促使盐类水解。
4. 沉淀-溶解平衡:AB(s) A +(aq)+B -(aq)利用沉淀的生成可以将有关离子从溶液中除去,但不可能完全除去。
][][][HAc Ac H K a -+⋅=lg •=,Ac HAc HAc a c c pK pH 盐酸c c pK HAc a lg •=,在沉淀平衡中,同样存在同离子效应,若增加A +或B -的浓度,平衡向生成沉淀的方向移动,有沉淀析出。
根据溶度积规则可判断沉淀的生成或溶解,当Q i =sp B A K c c >•+ 时,则有沉淀析出;Q i =sp B A K c c =•+时,溶液达到饱和,但仍无沉淀析出;Q i =sp B A K c c <•+时,溶液未饱和,没有沉淀析出。
如果在溶液中有两种或两种以上的离子都可以与同一种沉淀剂反应生成难溶盐,沉淀的先后次序是根据所需沉淀剂离子浓度的大小而定。
所需沉淀剂离子浓度小的先沉淀出来,所需沉淀剂离子浓度大的后沉淀出来,这种先后沉淀的现象,称为分步沉淀。


电离平衡与沉淀反应的实验报告实验报告:电离平衡与沉淀反应引言:电离平衡是化学反应中重要的概念之一,它描述了离子化合物在溶液中的电离程度。
在本实验中,我们将探究电离平衡与沉淀反应之间的关系,以及如何通过控制反应条件来影响电离平衡和沉淀反应。
材料与方法:1. 实验材料:氯化银(AgCl)固体、稀盐酸(HCl)溶液、稀硝酸(HNO3)溶液、溴化钾(KBr)固体、溴水溶液、乙醇(C2H5OH)溶液、氢氧化钠(NaOH)溶液、硝酸钠溶液(NaNO3)、玻璃棒、试管、移液管等。
2. 实验步骤:a. 实验一:电离平衡实验1) 准备两个试管A和B,各加入一定量的氯化银固体。
2) 向试管中分别加入一定量的稀盐酸溶液。
3) 观察试管中溶液的颜色和混浊度变化,并记录观察结果。
b. 实验二:沉淀反应实验1) 准备两个试管C和D,向每个试管中加入适量的溴化钾固体。
2) 向试管C中加入溴水溶液,向试管D中加入乙醇溶液。
3) 观察两个试管内是否出现沉淀,并记录观察结果。
c. 实验三:影响沉淀反应的因素1) 准备两个试管E和F,向试管E中加入一定量的氯化银固体,向试管F中加入一定量的溴化钾固体。
2) 向试管E中加入适量的稀盐酸溶液。
3) 向试管F中加入适量的稀硝酸溶液。
4) 观察两个试管内是否出现沉淀,并记录观察结果。
结果与讨论:1. 实验一的结果显示,向含有氯化银固体的试管中加入稀盐酸溶液后,溶液的颜色变为白色,并出现浑浊度增加的现象。
这是因为氯化银在水中电离产生了银离子(Ag+)和氯离子(Cl-),银离子与盐酸中的氯离子结合形成了白色的氯化银沉淀。
2. 实验二的结果显示,向含有溴化钾固体的试管中分别加入溴水溶液和乙醇溶液后,在溴水溶液中出现了橙黄色的溴水溶液,而在乙醇溶液中观察不到明显的颜色变化。
这是因为溴水溶液中的溴离子(Br-)与试管中的溴化钾固体中的钾离子(K+)结合,形成了橙黄色的溴化钾沉淀。
而乙醇溶液中溴离子溶解度较高,无法形成明显的沉淀。
单片机课程设计报告基于MEGA16单片机温度检测系统-------张坤张磊黄大明(作品图)一,系统设计目的,用途,功能1,目的。
通过基于MEGA16芯片和DS18B20温度传感器控制温度,熟悉芯片的使用,温度传感器的功能,实验电路板的焊接,数码显示管的使用,汇编语言的设计。
锻炼团队合作能力,动手设计能力以及发现问题并且解决问题的能力。
2,用途。
温度是工业控制中主要的被控参数之一。
随着电子技术和微型计算机的迅速发展,微机测量和控制技术得到了迅速的发展和广泛的使用。
单片机具有处理能强、运行速度快、功耗低等优点,使用在温度测量和控制方面,控制简单方便,测量范围广,精度较高。
本文设计了一种基于MEGA16单片机的温度测量和控制装置,能对环境温度进行测量,在温度过高时,蜂鸣器发出蜂鸣声,有利于保障工业控制中的安全性。
并且能根据温度给定值给出调节量,控制执行机构,实现调节环境温度的目的。
3,功能.DS18b20温度传感器温度的精确度高达0.1度,在许多工业控制中已经足够。
可以满足从-55摄氏度到+125摄氏度测量范围,在一秒内把温度转化成数字,测得的温度值的存储在两个八位的RAM中,单片机直接从中读出数据转换成十进制就是温度,使用方便。
从用途上讲,该单片机类似于温度计,但用途又不仅仅集限于温度计,由于蜂鸣器的使用,编写程序后,超过预设温度后,蜂鸣器发出蜂鸣声,为工业控制的安全保驾护航。
二,硬件设计思想和电路原理图下图为温度传感器驱动电路图104电容硬件连接图如上.三,详细说明如何使用硬件单元1,七段数码管型号是LG5641AH(共阴极)的使用。
该显示管总共有12 个引脚,包括a-g和dp以及四个位选g1-g4。
将a-f分别和ATmega芯片的PB1-PB6连接,g1-g4分别和PD0-PD3连接。
2,蜂鸣器的连接。
蜂鸣器的两个引脚分别和ATmega芯片的PC2,PC1连接,其中,前者接负极,后者接正极。
3,DS18B20温度传感器的连接。

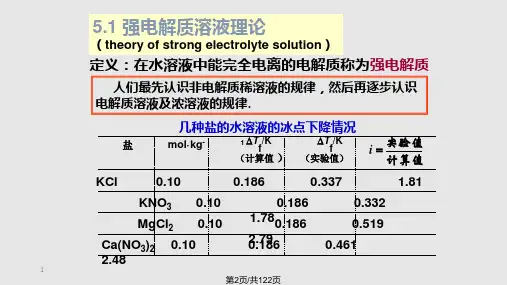
电离平衡和沉淀反应一、实验目的和原理实验目的:1)、通过电解质强弱的比较,巩固PH概念,掌握酸碱指示剂和试纸的用法;2)、了解盐类水解作用及水解平衡移动;3)、了解沉淀的生成与转化,沉淀溶解的各种方法的实验,掌握溶度积规则及沉淀转化所必需条件并掌握离心分离操作。
实验原理:1)、电解质有强弱之分,他们的电离度大小也有不同。
电解质在水溶液中的电离使水溶液呈相应的PH。
2)、弱电解质在水溶液中存在着离子化和分子化的可逆平衡。
在一平衡体系中加入含有相同离子的强电解质,促使弱电解质的电离平衡向分子化的方向移动,电离度降低,这种效应为同离子效应。
3)、由弱酸(或弱碱)及其盐的混合溶液组成的缓冲溶液,对外加的少量酸、碱或水都有一定的缓冲作用,即加少量的酸、碱水后溶液的酸度基本不变。
4)、盐类的水解使溶液使溶液呈现相应的PH。
水解反应是中和反应的逆反应,温度升高促使进水解反应的进行,加入酸或碱则使水解收到抑制或促进。
5)、在难溶电解质中,若相应的离子浓度幂的乘积大于该溶液电解质的溶度积时。
则该难容电解质会以沉淀析出。
反之,难容电解质的沉淀溶解。
二、实验注意事项1)、酚酞为碱性指示剂,甲基橙为酸性指示剂2)、试剂取用时注意操作,三、主要仪器与药品仪器:试管、酒精灯、试管夹药品:NaOH(0.1mol/L)、NH3·H2O(0.1mol/L)、HAC(0.1mol/L)、HCl(0.1mol/L)、NaCl(0.1mol/L) Na2S(0.1mol/L)、NaAc(0.1mol/L)四、实验过程及原始数据记录强电解质与弱电解质用PH试纸测定溶液的PH:0.1mol/LNaOH,PH=14;0.1mol/LNH3·H2O,PH=9;;蒸馏水:PH=7;0.1mol/LHAc,PH=3;0.1mol/LHCl.PH=1,按PH从小到大排序:0.1mol/LHCl<0.1mol/LHAc<蒸馏水<0.1mol/LNH3·H2O<0.1mol/LNaOH盐类的水解1)、用PH试纸测定浓度为0.1mol/L溶液PH:NaCl=8;PH =9;NaAc=102)、取少量NaAc固体于试管中,加水溶解,滴一滴酚酞溶液,溶液颜色变为浅红,加热溶液,溶液颜色加深。

实验五电离平衡与沉淀反应一、实验目的:1、通过实验加深对同离子效应、盐类的水解作用及影响盐类水解的因素;2、掌握酸碱指示剂及pH试纸的使用方法;3、通过实验加深对难溶电解质的多相离解平衡及溶度积规则;4、学会离心机的操作方法。
思考题:1、在实验室中配制3BiCl 时不能将3BiCl 直接溶于去离子水中,因为3BiCl 会产生水解,形成↓BiOCl 白色沉淀,为了抑制其水解,应事先在烧杯中加入少量的HCl ,再加入3BiCl ,最后才加入水使之溶解即可。
2、使用试纸的正确方法是:把试纸放在一干燥清洁的点滴板上,再用玻棒沾取待测的溶液,滴在试纸上,观察试纸的颜色变化并与pH 比色卡比较。
pH 处。
(2) 用PH=6.86的标准缓冲溶液定位,对于测定酸性溶液的pH ,用PH=4.00的标准缓冲溶液调节斜率至4.00。
(3) 将电极放入待测液中,即可得溶液的pH 值。
每次校对或测定溶液的pH 值前,需用蒸馏水冲洗电极头部,再用滤纸吸干水。
4、解:∵ 12421012.1)(-⨯=CrO Ag K SP θ 1441077.1)(-⨯=PbCrO K SPθ而混合后: 3106.100.51.004.02/)(-+⨯=⨯⨯=θc Ag c32106.100.51.004.02/)(-+⨯=⨯⨯=θc Pb c则产生↓42CrO Ag 至少需要24224]/)([)(]/)([θθθc Ag c CrO Ag K c CrOc SP +-=723121038.4)106.1(1012.1---⨯=⨯⨯=则产生↓4PbCrO至少需要22424]/)([)(]/)([θθθc Pbc PbCrO K c CrOc SP +-=123141031.7106.11017.1---⨯=⨯⨯=∵ ++--<Ag Pb CrOc CrOc )()(24242∴ 先产生黄色的4PbCrO 沉淀,再产生砖红色的42CrO Ag 沉淀。



本文部分内容来自网络整理,本司不为其真实性负责,如有异议或侵权请及时联系,本司将立即删除!== 本文为word格式,下载后可方便编辑和修改! ==电离平衡实验报告篇一:《水溶液中的解离平衡》实验报告二、实验步骤(一)同离子效应1、取两只小试管,0.1mol/LHAc溶液及1滴甲基橙,混合均匀,溶液呈红色。
在一试管中加入少量NaAc(s),观察指示剂颜色变化指示剂变黄。
HA c = H++ Ac- NaAc = Na++ Ac—2、取两只小试管,各加入5滴0.1mol/LMgCl2溶液,在其中以支试管中再加入5滴饱和NH4Cl溶液,然后分别在这两支试管中加入5滴2mol/LNH3·H2O,观察两试管发生的现象有何不同?何故? MgCl2 = Mg2++ 2Cl- Mg2++2OH—=Mg(OH)2↓NH4Cl解离出的Cl-使 MgCl2解离平衡向左移动减小了溶液中Mg2+的浓度,因而在入5滴饱和NH4Cl溶液,然后在这支试管中加入5滴2mol/LNH3·H2O无白色沉淀生成。
(二)缓冲溶液的配制1、用1mol/LHAc溶液和1mol/LNaAc溶液配置pH=4.0的缓冲溶液10mL.应该如何配制?配好后,用pH试纸测定其pH值,检验其是否符合要求.PH = pKa + lgCAc-/CHAc 4 = 4.75 + lgCAc-/CHAc lgCAc-/CHAc = -0.75CAc-/CHAc =0.178 V Ac-/10-VHAc =0.178 V Ac- = 1.51 mL VHAc =8.59mL2、将上述缓冲溶液分成两等份,在一分中加入1mol/LHCl溶液1滴,在另一分中加入1mol/LnaOH溶液,分别测定其pH值。
3、取两只试管,各加入5毫升蒸馏水,用pH试纸测定其pH值。
然后分别加入1mol/LHCl1滴和1mol/LnaOH1滴,再用pH试纸测定其pH值。
与“2”进行比较。
电离平衡实验报告实验目的,通过实验探究电离平衡的原理,了解电离平衡的影响因素及其在实际应用中的意义。
实验仪器及材料,电离箱、电离室、电离室内的气体、电离室外的气体、电压控制器、电流计、电压表、电流表、温度计等。
实验原理,电离平衡是指在电场作用下,正负离子的产生速率与它们的重组速率相等的状态。
电离平衡的建立需要满足两个条件,一是电场强度足够大,使得气体分子电离;二是电场强度足够小,使得电离的正负离子能够重组。
在电离平衡状态下,正负离子的浓度与电场强度、气体种类和温度有关。
实验步骤:1. 将电离箱与电离室连接好,调节电压控制器使得电场强度达到一定数值。
2. 在电离室内外分别测量气体的温度、压强和电场强度,并记录下来。
3. 开启电流计和电压表,记录正负离子的产生速率和重组速率。
4. 调节电场强度,重复步骤2和3,记录数据。
实验结果及分析:通过实验数据的记录和分析,我们可以得出以下结论:1. 电场强度对电离平衡的影响,当电场强度增大时,正负离子的产生速率增加,但重组速率也会增加,最终达到一个平衡状态。
因此,电场强度对电离平衡的影响是双向的,需要在实际应用中进行合理调节。
2. 气体种类对电离平衡的影响,不同的气体种类对电离平衡的影响是不同的。
一般来说,离子化能较低的气体更容易发生电离,因此在实际应用中需要根据具体情况选择合适的气体。
3. 温度对电离平衡的影响,温度的增加会导致气体分子的热运动加剧,从而增加电离和重组的速率,影响电离平衡的建立。
因此,在一定范围内控制温度对于维持电离平衡状态非常重要。
实验结论,电离平衡是在电场作用下,正负离子的产生速率与它们的重组速率相等的状态。
电离平衡的建立需要满足一定的条件,包括电场强度、气体种类和温度等因素。
了解电离平衡的原理和影响因素对于实际应用具有重要意义,可以指导我们合理调节电场强度、选择合适的气体种类和控制温度,从而实现更好的应用效果。
通过本次实验,我们对电离平衡有了更深入的了解,同时也意识到了电离平衡在实际应用中的重要性。