(完整版)药物临床试验项目结题签认表.doc
- 格式:doc
- 大小:62.02 KB
- 文档页数:1
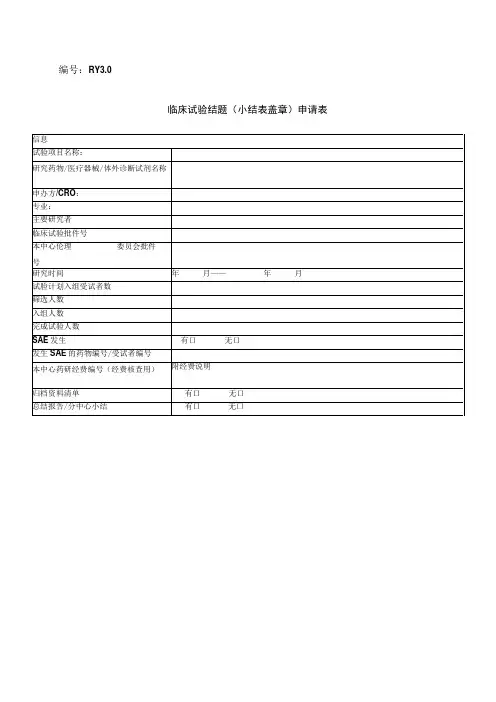
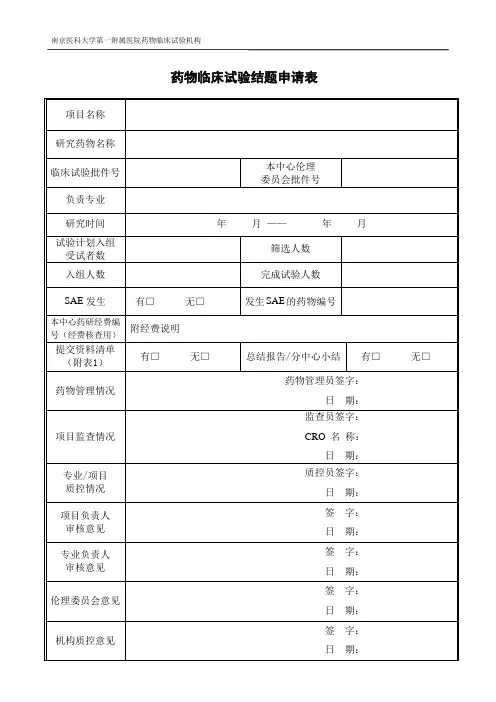
药物临床试验结题申请表项目名称研究药物名称临床试验批件号本中心伦理委员会批件号负责专业研究时间年月——年月试验计划入组受试者数筛选人数入组人数完成试验人数SAE发生有□无□发生SAE的药物编号本中心药研经费编号(经费核查用)附经费说明提交资料清单(附表1)有□无□总结报告/分中心小结有□无□药物管理情况药物管理员签字:日期:项目监查情况监查员签字:CRO 名称:日期:专业/项目质控情况质控员签字:日期:项目负责人审核意见签字:日期:专业负责人审核意见签字:日期:伦理委员会意见签字:日期:机构质控意见签字:日期:附表1 药物临床试验存档资料清单项目名称:申办单位: 负责科室:移交人签名: 接受部门:药研机构办公室 联系电话: 接收人签名: 移交日期: 接受日期:序号 移交文件有/无 序号 移交文件有/无 1 临床试验申请表 22监查报告2 临床试验备案表23研究者致申办者、药品监督管理局、3 国家食品药品监督管理局批件 伦理委员会的严重不良事件报告4 企业资质24 已签名的知情同意书 5 试验药物的药检证明 25 原始医疗文件6 药物标签 26 病例报告表(已填写、签名、注明日期)7 说明书样稿 27 试验药物登记表8 研究者手册28 试验药物回收表 9 试验方案及其修正案(已签名)29 试验药物销毁证明 10 病例报告表、研究病例、日记卡(样表) 30 生物样品留存记录 11 知情同意书(样稿) 31 揭盲记录(组长单位)12 伦理委员会批件 32 质控检查记录 13 协议书或合同书 33 统计报告 14 研究者履历及相关文件34 分中心小结15 临床试验有关的实验室检测正常值范围 35 总结报告(组长单位:签名、盖章) 16 医学或实验室操作的质控证明 36 17 各种文件更新版本37 18 启动培训记录3819 受试者筛选表与入选表39 20 受试者鉴认代码表40 21试验药物与试验相关物资的接收记录41临床试验经费明细项目名称负责专业药研经费编号应付经费病例观察费(元/例)完成病例:元/例×例 = 元未完成病例:(包括脱落和筛选失败)元/例×例 = 元组织管理费受试者补贴费CRC服务费检查费质量控制费药品管理费其他费用应付费用合计到账经费发票日期汇款单位名称金额(元)发票号到账经费合计有无退的化验单:监查员电话:PI或研究者邮箱:项目负责人(确认病例完成情况)签名:机构办(确认经费到账情况)盖章:。

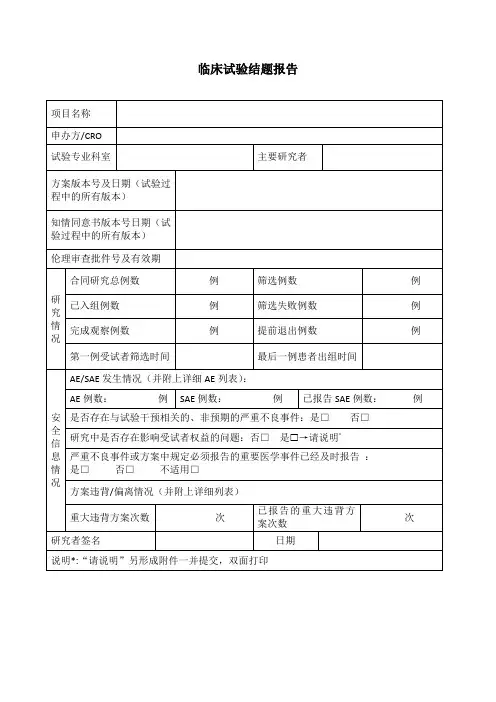
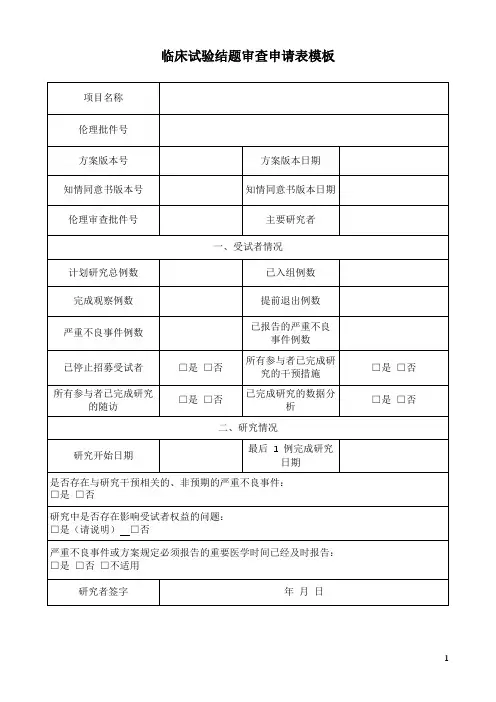
临床试验结题报告表
一、受试者信息
※合同研究总例数:
※已入组例数:
※完成观察例数:
※提前退出例数:
※严重不良事件例数:
※可疑且非预期严重不良反应例数:
※已报告的严重不良事件和可疑且非预期严重不良反应例数:
二、研究情况
※研究开始日期:
※最后1 例出组日期:
※是否存在与研究干预相关的、非预期的严重不良事件:□是,□否
※是否存在可疑且非预期严重不良反应:□是,□否
※研究中是否存在影响受试者权益的问题:□否,□是→请说明:
※严重不良事件、可疑且非预期严重不良反应或方案规定必须报告的重要医学事件已经及时报告:□不适用,□是,□否
研究者签字:
日期:
1。
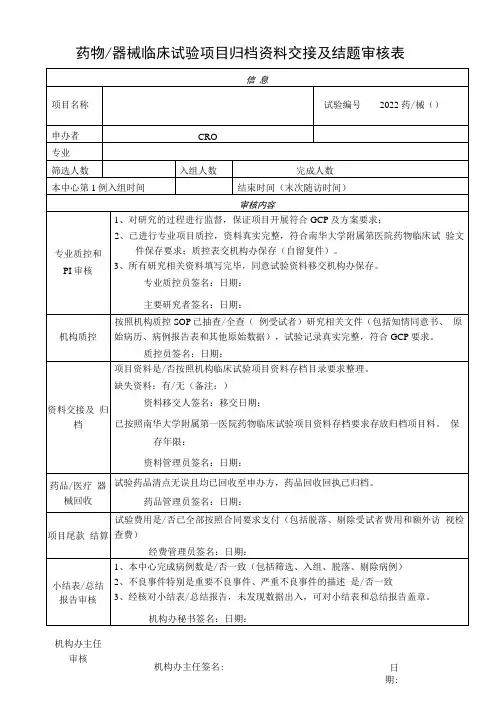
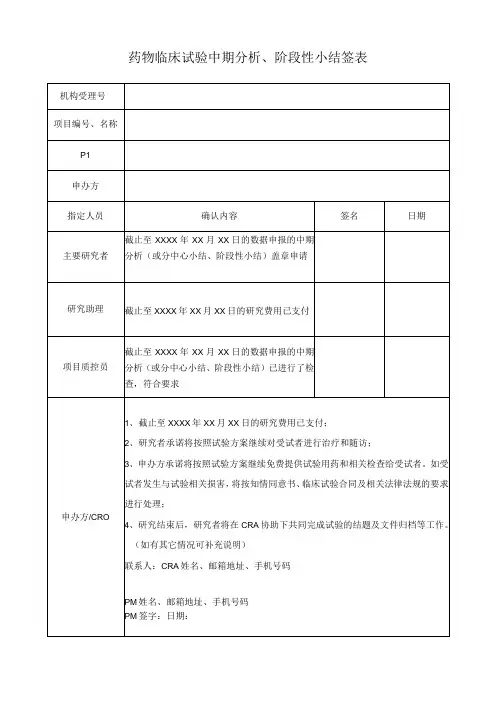
临床试验项目分中心小结/总结报告盖章信息确认表
试验项目名称:
申办者/CRO:
主要研究者:
试验用药品/医疗器械/体外诊断试剂已返还至申办者,相关文件记录已与项目组交接。
是☐否☐不适用☐
试验用药品/医疗器械/体外诊断试剂管理员签字/日期:
质控检查通过。
是☐否☐不适用☐机构质控员签字/日期:
本人承诺对本项临床试验数据的真实性、完整性负责并已仔细核对分中心小结/总结报告,确认内容准确无误。
主要研究者签字/日期:
分中心小结初审通过。
是☐否☐不适用☐机构质控员签字/日期:
分中心小结复核通过。
是☐否☐不适用☐机构办公室秘书签字/日期:
已完成费用结算,支付尾款。
是☐否☐不适用☐主要研究者签字/日期:
是☐否☐不适用☐机构办公室秘书签字/日期:
资料合格,已归档。
是☐否☐不适用☐档案管理员签字/日期:
同意分中心小结盖章。
是☐否☐不适用☐机构办公室主任签字/日期:
是☐否☐不适用☐机构副主任签字/日期:
临床试验总结报告审核通过。
是☐否☐不适用☐机构办公室主任签字/日期:
是☐否☐不适用☐机构副主任签字/日期:
同意临床试验总结报告盖。
是☐否☐不适用☐机构主任签字/日期:
注:选项选择请打“×”。
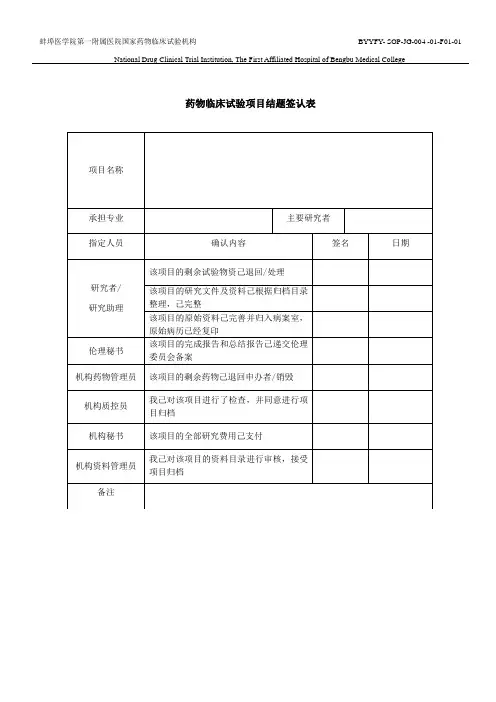
蚌埠医学院第一附属医院国家药物临床试验机构BYYFY- SOP-JG-004 -01-F01-01 National Drug Clinical Trial Institution, The First Affiliated Hospital of Bengbu Medical College
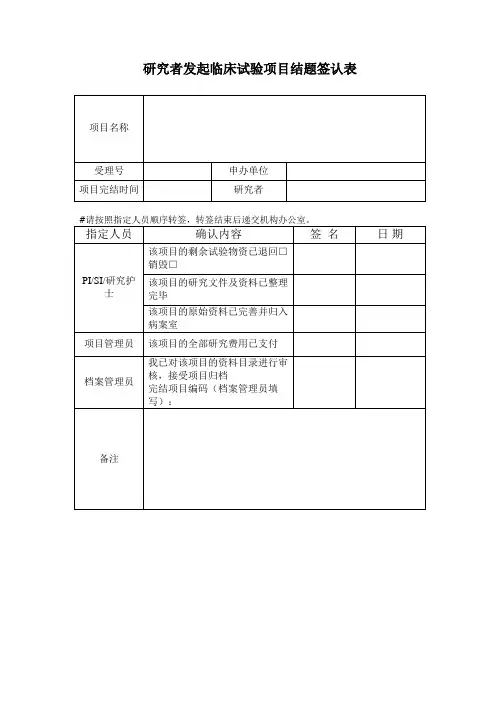
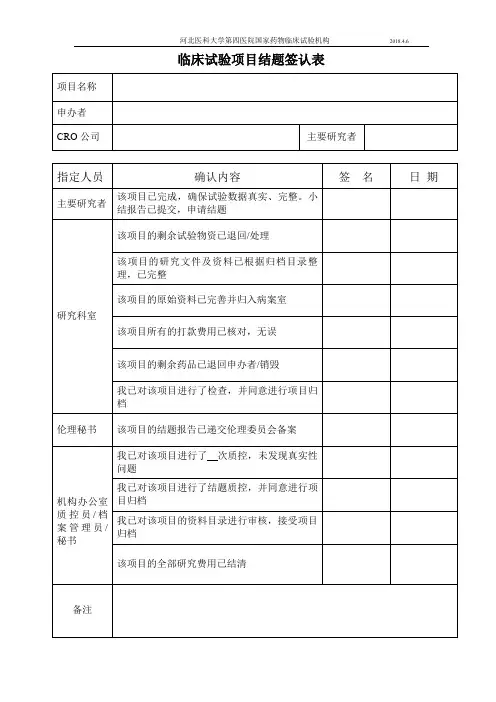
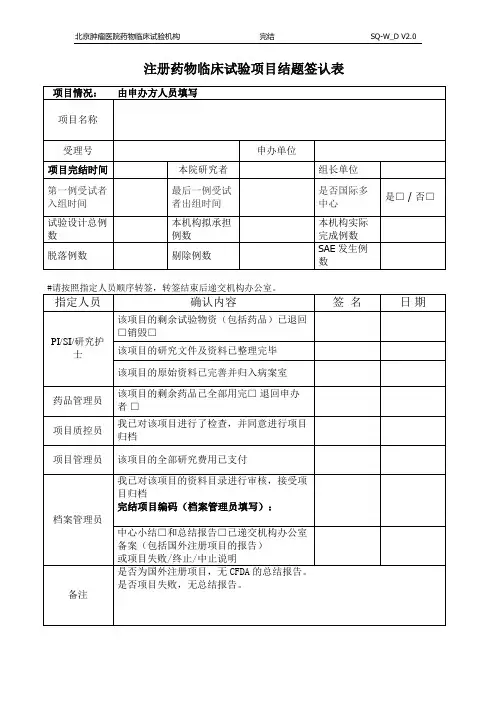
药物临床试验项目结题签认表
项目名称
承担专业
指定人员
研究者 /
研究助理
伦理秘书
机构药物管理员机构质控员
机构秘书
机构资料管理员
主要研究者
确认内容签名日期该项目的剩余试验物资己退回/ 处理
该项目的研究文件及资料己根据归档目录
整理,己完整
该项目的原始资料己完善并归入病案室,
原始病历已经复印
该项目的完成报告和总结报告己递交伦理
委员会备案
该项目的剩余药物己退回申办者/ 销毁
我己对该项目进行了检查,并同意进行项
目归档
该项目的全部研究费用己支付
我己对该项目的资料目录进行审核,接受
项目归档
备注。