上海交通大学物理化学习题课 熵
- 格式:doc
- 大小:625.00 KB
- 文档页数:25

第二章 热力学第二定律本章通过卡诺定理引入了熵的概念及克劳修不等式,定义了亥姆霍兹自由能和吉布斯自由能两个辅助热力学函数,导出了封闭系统中热力学基本公式,对应系数和麦克斯韦关系式以及克拉贝龙方程等一系列重要的热力学公式,简要介绍了熵的统计意义和热力学第三定律。
通过本章内容的学习,可以了解S 、A 、G 等热力学函数改变值在各种过程中的计算,以及如何运用它们判别自发变化的方向,学会运用热力学基本原理演绎平衡系统性质的方法,为学习多组分系统和相平衡系统等后续内容奠定良好的基础。
一、基本内容(一)热力学第二定律的经典表述 开尔文(Kelvin )说法:“不可能从单一热源取出热使之完全变为功,而不引起其他变化”。
此表述也可说成:“第二类永动机不可能造成”。
克劳修斯(Clausius )说法:“不可能把热从低温物体传到高温物体,而不引起其他变化。
” (二)卡诺(Carnot )定理工作在两个给定的热源之间的任何热机,其热机效率I η不可能超过卡诺热机的效率R η。
设从高温热源2T 吸热2Q ,对外做功为W ,向低温热源1T 放热1Q ,则1221I R 222Q Q T T W Q Q T ηη+-=-=≤= 由此式可以得到12120Q Q T T +≤ “=”表示可逆,“<”表示不可逆。
即在指定的低温热源和高温热源之间,一切可逆循环的热温商之和等于零,一切不可逆循环的热温商之和小于零。
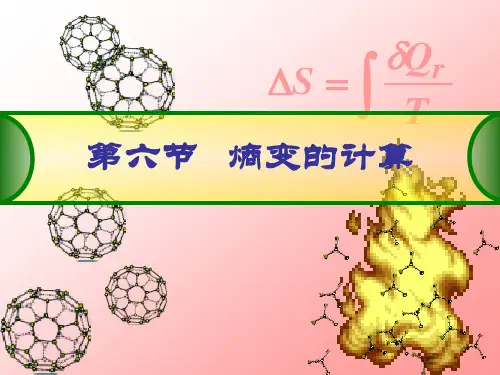
(三)熵的概念及其统计意义R δd Q S T =或RδQ S T∆=∑ 熵变是可逆过程中的热温商之和。
熵具有统计意义,它是系统微观状态数Ω(或混乱度)的量度,这一关系可由玻耳兹曼公式给出ln S k =Ω 式中k 为玻耳兹曼常量,2311.38110J K k --=⨯⋅。
(四)克劳修斯不等式BAδ0QS T∆-≥∑或δd 0Q S T -≥此式称为克劳修斯不等式,并作为热力学第二定律的数学表达式。
将此式应用于绝热系统(或隔离系统)时得到0S ∆≥或d 0S ≥此式称为熵增加原理。



作业题1-1. 10mol理想气体由25℃,1.00MPa 。
设过程为:(i)向真空膨胀;(ii)对抗外压0.100MPa膨胀。
分别计算以上各过程的体积功。
(i) Wv=0(ii) Wv=-P S△V=- P S nRT(1/R2-1/R1)=-nRT(P S/P2- P S/P1)P2= P S∴Wv=-PnRT(1- P S/P1)=-10mol×8.3145J·mol-1·k-1×298.15k×(1-0.100 MPa/1.00MPa)=-22.31kJ体会:(i)真空膨胀不做体积功(ii)膨胀功做负功,W=-P△V运用W=-∫V1V2Pdv=-P(V2-V1)计算体积功。
1-3.473K,0.2MPa,1dm3 的双原子分子理想气体,连续经过下列变化:(Ⅰ)定温膨胀到3dm3;(Ⅱ)定容升温使温度升到0.2MPa;(Ⅲ)保持0.2 MPa降温到初始温度473K。
(i)在p-V图上表示处该循环全过程;(ii)计算各步及整个循环过程的Wv、Q 、△U 和△H 。
一直双原子分子理想气体Cp,m=7/2R 。
解:解:(Ⅰ).W Ⅰ=-Q Ⅰ=-n RT ㏑v 2/v 1=-8.3145*473*㏑3/1*n n=p A v A /T A R=0.2*106*1*103/8.3145*473=0.0508molW Ⅰ=-219.5J Q Ⅰ=219.5△ u=△H=0(Ⅱ).△H =nCp.m(T C -T B )=0.0508*7/2*8.3145*(1419-473) =1398JH 定容 Wv=0Q Ⅱ=△u Ⅱ=nCv,m(T C -T B )=0.0508*5/2*8.3145*(1419-473)双原子分子理想气体 473K 0.2MPa1dm 3 双原子分子理想气体 473K 1/3×0.2MPa 3dm 3 双原子分子理想气体 1419K 0.2MPa 1dm 3=998.9J(Ⅲ).Wv=-p A(v A-v B)=-0.2*106*(1-3)*103=400JQⅢ=△HⅢ=nCp,m(T A-T C)=0.O508*7/2*8.3145*(473-1419)=-1398J△uⅢ=nCv,m(T A-T C)=0.0508*5/2*8.3145*(473-1419)=-998.9J循环过程:△u=0, △H=0,Wv=180.5J,Q=-179.6J体会:U和H为状态函数,循环过程△u=0, △H=0理想气体:p A v A =p B v B PV=n RT∆ U = n C V,m(T2- T1)∆ H = n C p,m (T2- T1)1-4.10mol理想气体从2×106 Pa、10-3 定容降温,使压力降到2×105 Pa,再定容膨胀到10-2 m3 。


《物理化学》习题课 (电化学、动力学部分)(中科院2009硕士入学考试)1. 某药物分解反应为一级反应,298K 时,反应速率常数k 为0.46h -1,若服用该药物0.16g ,则体内停留多长时间分解90%?A) 3h B) 5h C) 4.6h D) 6h2. 升高温度可以增加反应速率,主要原因是A) 增加分子总 B) 增加活化分子总数C) 降低反应的活化能 D) 使反应向吸热方向进行3. 浓度为0.001 mol/L 的硫酸钠溶液的电导率为0.026 S.cm 2,当该溶液饱和了硫酸钙以后,电导率上升为0.070 S.cm 2,求硫酸钙的活度积(已知Na +与1/2Ca 2+的摩尔电导率分别为5.0×10-3和6.0×10-3 S.m 2.mol -1)4. 某气相反应12()()()k k A g B g C g −−→+←−−,在298K 时,K 1=0.2s -1,K 2=5×10-6 pa ∙s -1,当温度升高到310K 时,K 1和K 2均增加1倍,求:(1)298K 的平衡常数; (2)正逆反应的表观活化能; (3)反应的r m H ∆; (4)在298K 时,A 的起始压力为101.325kpa ,总压力到151.99kpa 时,需时间多少?(中科院2007硕士入学考试)5. 某反应的速率常数与各基元反应的速率常数的关系为124()2k k k k =,则该反应的表观活化能E a 与各基元反应活化能的关系为: (A) 21412a E E E E =+- (B) 2141()2a E E E E =+- (C) 1/2214(2)a E E E E =+- (D) 214a E E E E =+-6. 在化学反应动力学中,反应级数是个宏观的概念,其值 。
(A )只能是正整数; (B )可正、可负、可为零,可以是整数,也可以是分数;(C )只能是0,1,2,3,· ; (D )无法确定。

《物理化学》课程中的熵变计算问题探讨随着物理化学的研究深入,熵的概念及熵变的计算越来越重要。
在《物理化学》课程中,熵变计算是一个重要的主题。
在本文中,我们将对熵变计算问题进行探讨。
一、熵和熵变的概念熵是描述系统无序程度的物理量。
一个系统越无序,其熵值就越大。
熵的单位是焦耳每开尔文。
熵变是指在化学反应或其他过程中,系统熵的变化量。
熵变可以为正或为负。
二、熵变的计算计算熵变首先要确定反应前后的状态,包括物质组成、物质量、温度、压强等。
然后便可以利用下列公式计算熵变:ΔS = ΣnSf - ΣmSi,其中ΔS是系统熵的变化量;Sf是反应产物的摩尔熵;Si是反应物的摩尔熵;n是反应产物的摩尔数;m是反应物的摩尔数。
三、熵变计算中的常见问题1. 理解反应的状态熵变计算的前提是要了解反应前后的状态,包括温度、压强、物质组成以及物质量等。
如果对反应状态了解不够深入,做出的计算结果就有可能出现偏差。
2. 计算反应物和产物的摩尔熵在计算熵变时,需要计算反应物和产物的摩尔熵。
这需要使用热力学数据手册中给出的数值。
但是手册中的数据是在标准状态下(298K和1 atm)给出的,而实际反应中的物质状态很可能与标准状态不同。
因此,在计算时要特别注意。
3. 考虑温度和压强对熵变的影响温度和压强对熵变的计算也有重要影响。
当温度和压强发生变化时,熵变的计算也需要相应调整。
这需要对熵的定义有深刻的理解和处理经验。
四、总结在物理化学中,熵变计算是一个重要的主题。
正确地计算熵变需要准确理解反应的状态,计算反应物和产物的摩尔熵,并考虑温度和压强对熵变的影响等。
这样才能得到准确的结果,并在化学反应的研究中发挥实际作用。


物理化学习题课答案(一)班级:_______________ 姓名:_______________ 学号:_______________一. 选择题1. 对于理想气体的内能有下述四种理解:(1) 状态一定,内能也一定(2) 对应于某一状态的内能是可以直接测定的(3) 对应于某一状态,内能只有一个数值,不可能有两个或两个以上的数值(4) 状态改变时,内能一定跟着改变其中正确的是:( D )(A)(1)(2)(B)(3)(4)(C)(2)(4)(D)(1)(3)2. 下列宏观过程:(1) p,273 K 下冰融化为水(2) 电流通过金属发热(3) 往车胎内打气(4) 水在 101 325 Pa, 373 K 下蒸发可看作可逆过程的是:( A )(A)(1)(4)(B)(2)(3)(C)(1)(3)(D)(2)(4)3. 一定量的理想气体从同一始态出发,分别经 (1) 等温压缩,(2) 绝热压缩到具有相同压力的终态,以H1,H2分别表示两个终态的焓值,则有: ( C )(A) H1> H2 (B) H1= H2(C) H1< H2 (D) 不能确定4. 对于下列的四种表述:(1) 因为ΔH = Qp,所以只有等压过程才有ΔH(2) 因为ΔH = Qp,所以Qp也具有状态函数的性质(3) 公式ΔH = Qp只适用于封闭体系(4) 对于封闭体系经历一个不作其它功的等压过程,其热量只决定于体系的始态和终态上述诸结论中正确的是:( B )(A)(1)(4)(B)(3)(4)(C)(2)(3)(D)(1)(2)5. ΔH = Qp适用于下列哪个过程? ( B )(A) 理想气体从1×107Pa反抗恒定的外压1×105Pa膨胀到1×105Pa(B) 0℃、101325Pa下冰融化成水(C) 101325Pa下电解CuSO4水溶液(D) 气体从298K,101325Pa可逆变化到373K、10132.5Pa6. 在体系温度恒定的变化中,体系与环境之间: ( CD )(A) 一定产生热交换 (B) 一定不产生热交换(C) 不一定产生热交换 (D) 温度恒定与热交换无关7. 在一个刚性的绝热容器中燃 ( B ) C6H6(l) + (15/2) O2(g)6CO2(g)+ 3H2O(g)(A) ΔU = 0 ,ΔH < 0 , Q = 0(B) ΔU = 0 ,ΔH > 0 , W = 0(C) ΔU = 0 ,ΔH = 0 , Q = 0(D) ΔU ≠ 0 ,ΔH ≠ 0 , Q = 08. 体系的压力p(体系)与环境的压力p(环境)有何关系? ( D )(A) 相等 (B) 无关系(C) p(体系)> p(环境) (D) 可逆变化途径中p(体系)=p(环境)9. 如图,在绝热盛水容器中,浸有电阻丝,通以电流一段时间,如以电阻丝为体系,则上述过程的Q、W和体系的ΔU值的符号为: ( B )(A) W = 0, Q < 0,ΔU <0(B) W > 0, Q < 0,ΔU >0(C) W = 0, Q > 0,ΔU > 0(D)W < 0, Q = 0,ΔU > 010. 理想气体卡诺循环的图为下列四种情况中的哪一种? ( BC )11. 测定有机物燃烧热Qp,一般使反应在氧弹中进行,实测得热效应为QV。

优秀学习资料 欢迎下载习题 55-1.容器的体积为 2V 0 ,绝热板 C 将其隔为体积相等的A 、B 两个部分, A 内储有 1mol 单原子理想气体, B 内储有 2mol 双原子理想气体, A 、B 两部分的压强均为 p 0。
( 1)求 A 、B 两部分气体各自的内能;( 2)现抽出绝热板 C ,求两种气体混合后达到平衡时的压强和温度。
解:( 1)由理想气体内能公式:EiRT23 3 3A 中气体为 1mol 单原子理想气体:E ART ART Ap 0V 0 ,222B 中气体为 2mol 双原子理想气体:E B 25RT B 5RT B5p 0V 0 ;3RT A2 2(2)混合前总内能: E 05RT B ,由于 RT Ap 0V 0 , 2RT B2p 0V 0 ,∴ 2T B T A ,则: E 04RT A 4 p 0V 0 ;混合后内能不变,设温度为T ,有: E3RT 5RT4 p V20 08 p 0V 0∴ T;13Rp nkT3N 0 kT 3RT3R 8 p 0V 0 12p 0 。
2V 2V13R 132V0 05-2.1mol 单原子理想气体从 300K 加热至 350K ,问在以下两个过程中各吸收了多少热量?增加了多少内能?对外做了多少功? (1)容积保持不变; ( 2)压强保持不变。
解:( 1)等容升温过程做功:A 0内能变化:EC V ,m(T2T 1 )3R(T 2 T 1 ) 13 8.31 50 623.25( J )2 2吸热: Q A E623.25(J)(2)等压升温过程()( ) 1 8.31 50 415 5(J)做功:A p V 2 V 1R T 2 -T 1 .内能变化:EC V ,m(T2T 1 )3R(T 2 T 1 ) 13 8.31 50 623.25(J)2 2吸热: Q A E415.5 623.251039(J)5-3. 1g 氦气中加进 1J 的热量,若氦气压强无变化,它的初始温度为200K ,求它的温度升高多少?解:等压过程QCp ,m(T2T 1 )7R(T 2 T 1 )2T 2 Q10.19(K)5 R158.3124 25-4.如图所示, AB 、 DC 是绝热过程, CEA 是等温过程, BED是任意过程,组成一个循环。
第一章 热力学定律思考题1. 设有一电炉丝浸入水槽中(见下图),接上电源,通以电流一段时间。
分别按下列几种情况作为体系,试问ΔU 、Q 、W 为正、为负,还是为零?①以水和电阻丝为体系; ②以水为体系; ③以电阻丝为体系; ④以电池为体系;⑤以电池、电阻丝为体系; ⑥以电池、电阻丝和水为体系。
答:该题答案列表如下。
2. 任一气体从同一始态出发分别经绝热可逆膨胀和绝热不可逆膨胀达到体积相同的终态,终态压力相同吗?答:不同。
膨胀到相同体积时,绝热可逆与绝热不可逆的终态温度和压力不同。
3. 熵是量度体系无序程度大小的物理量。
下列情况哪一种物质的摩尔熵值更大?(1)室温下纯铁与碳钢; (2)100℃的液态水与100℃的水蒸气; (3)同一温度下结晶完整的金属与有缺陷的金属;(4)1000℃的铁块与1600℃铁水。
答:温度相同的同一种物质,气、液、固态相比(例如水蒸气、液态水和冰相比),气态的微观状态数最大,固态的微观状态数最小,液态居中,因此,摩尔熵气态最大,液态次之,固态最小;同类物质,例如,氟、氯、溴、碘,分子量越大摩尔熵越大;分子结构越复杂熵越大;分子构象越丰富熵越大;同素异形体或同分异构体的摩尔熵也不相同。
(1)、(2)、(3)和(4)均是后者摩尔熵值大。
4. 小分子电解质的渗透压与非电解质的渗透压哪个大?为什么?电解质的稀溶液是否有依数性?其渗透压公式是怎样的?答:非电解质的渗透压大。
因为非电解质不能电离,通过半透膜的几率就小,这样就造成膜两侧的浓差增大,使渗透压增大。
小分子电解质的稀溶液有依数性,但不显著。
稀溶液以浓度代替活度,()RT RT 212c 1c 1c 2c +=∆=π,若c 1>>c 2,RT 1c 2=π;若c 2>>c 1,RT 1c =π,c 1、c 2分别为溶液一侧和溶剂一侧的浓度。
5. 下列物理量中,哪一组是广度性质的状态函数?(1). C p ,C v ,S ,H m (2). U m ,T ,P ,V m (3). V m ,H m ,μ,U (4). H ,V ,U ,G答:(4)组,即H ,V ,U ,G 是广度性质的状态函数。
熵增原理物理化学-回复熵增原理在物理化学中扮演着至关重要的角色。
它是热力学第二定律的本质体现,描述了一个孤立系统中熵的增加趋势。
熵增原理帮助我们理解自然界中发生的各种物理化学过程,从宏观角度理解微观粒子的行为,以及预测和控制系统的变化。
本文将一步一步回答与熵增原理相关的问题,探讨其在物理化学领域中的重要性。
首先,我们需要明确什么是熵。
熵是描述系统混乱程度或无序程度的物理量。
它可以通过统计方法定义为系统的微观状态数目的对数,通常用符号S表示。
对于一个给定的系统,其熵随着系统的无序程度增加而增加。
一个有序的晶体具有较低的熵,而一个无序的气体具有较高的熵。
熵增原理告诉我们在一个孤立系统中,系统的熵将随时间不断增加。
然后,我们来探讨为什么熵会增加。
根据热力学第二定律,自然界中的物理化学过程在满足宏观条件下(例如能量守恒、质量守恒)必须是不可逆的。
这意味着系统的熵不会自行减少,而只会增加或保持不变。
这是因为不可逆过程会导致能量的耗散以及微观粒子的无序运动,从而增加系统的无序程度和熵。
那么,我们如何定量描述熵的增加?这可以通过熵变(ΔS)来实现。
熵变定义为系统在经历一个过程时,系统熵的变化量。
对于一个孤立系统,熵变可以通过下式给出:ΔS = S(final) - S(initial)其中,ΔS是系统熵的变化量,S(final)是系统在过程结束时的熵值,S(initial)是系统在过程开始时的熵值。
根据熵增原理,ΔS大于零,表示系统的熵增加,而ΔS小于零,表示系统的熵减少。
接下来,我们来看一些具体的应用和例子。
例如,考虑一个热机(如内燃机)的工作过程。
在这个过程中,燃料燃烧产生的热能转化为机械能,同时也会有一部分能量以热方式散失到周围环境中。
根据熵增原理,系统的熵不会减少,因此热机的工作过程会带来熵的增加。
这也意味着,热机的效率受限于它所工作的温度差异。
此外,熵增原理也有助于我们理解化学反应的方向性。
根据熵增原理,化学反应发生的方向是为了增加系统的总熵。
热力学第一定律主要公式及使用条件1. 热力学第一定律的数学表示式W Q U +=∆或'amb δδδd δdU Q W Q p V W =+=-+规定系统吸热为正,放热为负。
系统得功为正,对环境作功为负。
式中 p amb 为环境的压力,W ’为非体积功。
上式适用于封闭体系的一切过程。
2. 焓的定义式pV U H +=3. 焓变(1))(pV U H ∆+∆=∆式中)(pV ∆为pV 乘积的增量,只有在恒压下)()(12V V p pV -=∆在数值上等于体积功。
(2)2,m 1d p H nC T ∆=⎰此式适用于理想气体单纯pVT 变化的一切过程,或真实气体的恒压变温过程,或纯的液体、固体物质压力变化不大的变温过程。
4. 热力学能变2,m 1d V U nC T∆=⎰此式适用于理想气体单纯pVT 变化的一切过程。
5. 恒容热和恒压热V Q U =∆ (d 0,'0)V W ==p Q H =∆ (d 0,'0)p W ==6. 热容的定义式 (1)定压热容和定容热容δ/d (/)p p p C Q T H T ==∂∂δ/d (/)V V V C Q T U T ==∂∂(2)摩尔定压热容和摩尔定容热容,m m /(/)p p p C C n H T ==∂∂,m m /(/)V V V C C n U T ==∂∂上式分别适用于无相变变化、无化学变化、非体积功为零的恒压和恒容过程。
(3),m ,m p V C C R -=此式只适用于理想气体。
(4)摩尔定压热容与温度的关系23,m p C a bT cT dT =+++式中a , b , c 及d 对指定气体皆为常数。
(5)平均摩尔定压热容21,m ,m 21d /()Tp p T C T T T C =-⎰7. 体积功 (1)定义式V p W d amb -=∂或 V p W d amb ∑-= (2))()(1221T T nR V V p W --=--=适用于理想气体恒压过程。
判断题:1.(✕)不可逆过程一定是自发的,而自发过程一定是不可逆的2.(✕)凡熵增加的过程都是自发过程3.(✕)不可逆过程的熵永不减少4.(✕)系统达到平衡时,熵值最大5.(✕)某系统从始态经过一个绝热不可逆过程到达终态,现在要在相同的始终态之间设计一条绝热可逆过程。
6.(✕)在一个绝热系统中,发生了一个不可逆过程,系统从状态1变到了状态2,不论用什么方法,系统再也回不到原来的状态了7.(✕)理想气体的等温膨胀过程,∆U=0,系统吸收的热全部变成了功,这与Kelvin的说法不符8.(✕)冷冻机可以从低温热源吸热放热给高温热源,这与Clausius的说法不符简答题:指出下列各过程的Q,W,∆U, ∆H, ∆S等热力学函数的变量哪些为零,哪些绝对值相等1.理想气体等温可逆膨胀∆U=∆H=0,Q和W绝对值相等2.实际气体绝热可逆膨胀Q=0,∆S=0,∆U=Q+W=W计算题:2mol 理想气体,从始态300K,20L,经过下列不同过程等温膨胀至50L,计算各过程的Q,W,∆U,∆H,∆S(1)可逆膨胀(2)真空膨胀(3)对抗恒外压100 KPa膨胀等温可逆过程:∆U=∆H=0,Q=-W0.5mol理想气体,压力为101.325KPa,温度为600K,分别经历下列过程(1)定温可逆膨胀过程(2)真空膨胀过程,变化到10.1325KPa,计算过程的熵变,并判断过程是否可逆1mol 液体水在100℃、101325Pa 下气化为水蒸气,再升温降压到200℃、50660Pa ,求整个过程的ΔS 。
已知在100℃、101325Pa 时水的气化热为406401J mol -•,设水蒸气为理想气体,且水蒸汽的Cp,m=34.911J K mol --••。
解:已知1mol 水所经历的过程如下:H 2O (l ) H 2O(g) H 2O(g)T 1=373.2K (1)−−→ T 2=T 1(2)−−→ T 3=473.2K P 1=101325Pa p 2=p 1 p 3=50660Pa由以上过程可知,过程(1)为可逆相变可用式H S T ∆∆=计算△S 1。
热力学第一定律主要公式及使用条件1. 热力学第一定律的数学表示式W Q U +=∆或 'amb δδδd δdU Q W Q p V W =+=-+规定系统吸热为正,放热为负。
系统得功为正,对环境作功为负。
式中 p amb 为环境的压力,W ’为非体积功。
上式适用于封闭体系的一切过程。
2. 焓的定义式pV U H +=3. 焓变(1) )(pV U H ∆+∆=∆式中)(pV ∆为pV 乘积的增量,只有在恒压下)()(12V V p pV -=∆在数值上等于体积功。
(2) 2,m 1d p H nC T ∆=⎰ 此式适用于理想气体单纯pVT 变化的一切过程,或真实气体的恒压变温过程,或纯的液体、固体物质压力变化不大的变温过程。
4. 热力学能变2,m 1d V U nC T ∆=⎰此式适用于理想气体单纯pVT 变化的一切过程。
5. 恒容热和恒压热V Q U =∆ (d 0,'0)V W ==p Q H =∆ (d 0,'0)p W ==6. 热容的定义式(1)定压热容和定容热容δ/d (/)p p p C Q T H T ==∂∂δ/d (/)V V V C Q T U T ==∂∂(2)摩尔定压热容和摩尔定容热容,m m /(/)p p p C C n H T ==∂∂,m m /(/)V V V C C n U T ==∂∂上式分别适用于无相变变化、无化学变化、非体积功为零的恒压和恒容过程。
(3) ,m ,m p V C C R -=此式只适用于理想气体。
(4)摩尔定压热容与温度的关系23,m p C a bT cT dT =+++式中a , b , c 及d 对指定气体皆为常数。
(5)平均摩尔定压热容21,m ,m 21d /()T p p T C T T T C =-⎰7. 体积功(1)定义式V p W d amb -=∂或 V p W d amb ∑-=(2) )()(1221T T nR V V p W --=--=适用于理想气体恒压过程。
(3) )(21amb V V p W --=适用于恒外压过程。
(4) )/ln()/ln(d 121221p p nRT V V nRT V p W V V =-=-=⎰适用于理想气体恒温可逆过程。
(5) ,m 21()V W U nC T T =∆=-适用于,m V C 为常数的理想气体绝热过程。
9. 理想气体可逆绝热过程方程,m 2121(/)(/)1V C R T T V V =,m2121(/)(/)1p C R T T p p -= 1)/)(/(1212=r V V p p上式中,,m ,m /p V C C γ=称为热容比(以前称为绝热指数),适用于,m V C 为常数,理想气体可逆绝热过程p ,V ,T 的计算。
10. 反应进度B B /νξn ∆=上式是用于反应开始时的反应进度为零的情况,B,0B B n n n -=∆,B,0n 为反应前B 的物质的量。
B ν为B 的反应计量系数,其量纲为一。
ξ的量纲为mol 。
11. 标准摩尔反应焓θθθr m B f m B c m (B,)(B,)H H H νβνβ∆=∆=-∆∑∑式中θf m (B,)H β∆及θc m (B,)H β∆分别为相态为β的物质B 的标准摩尔生成焓和标准摩尔燃烧焓。
上式适用于ξ=1 mol ,在标准状态下的反应。
12. θm r H ∆与温度的关系21θθr m 2r m 1r ,m ()()d T p T H T H T C T ∆=∆+∆⎰ 式中 r ,m ,m B(B)p p C C ν∆=∑,适用于恒压反应。
13. 节流膨胀系数的定义式J T (/)H T p μ-=∂∂ T J -μ又称为焦耳-汤姆逊系数。
热力学第二定律主要公式及使用条件1. 热机效率1211211/)(/)(/T T T Q Q Q Q W -=+=-=η式中1Q 和2Q 分别为工质在循环过程中从高温热源T 1吸收的热量和向低温热源T 2放出的热。
W 为在循环过程中热机中的工质对环境所作的功。
此式适用于在任意两个不同温度的热源之间一切可逆循环过程。
2. 卡诺定理的重要结论2211//T Q T Q +⎩⎨⎧=<可逆循环不可逆循环,,00任意可逆循环的热温商之和为零,不可逆循环的热温商之和必小于零。
3. 熵的定义4. 克劳修斯不等式d S {//Q T Q T =>δ, δ, 可逆不可逆5. 熵判据amb sy s iso S S S ∆+∆=∆{0, 0, >=不可逆可逆 式中iso, sys 和amb 分别代表隔离系统、系统和环境。
在隔离系统中,不可逆过程即自发过程。
可逆,即系统内部及系统与环境之间皆处于平衡态。
在隔离系统中,一切自动进行的过程,都是向熵增大的方向进行,这称之为熵增原理。
此式只适用于隔离系统。
6. 环境的熵变7. 熵变计算的主要公式r d δ/S Q T =amby s amb amb amb //S T Q T Q s -==∆222r 111δd d d d Q U p V H V p S T T T+-∆===⎰⎰⎰ 对于封闭系统,不做非体积功的可逆过程的S ∆计算式,皆可由上式导出(1),m 2121ln(/)ln(/)V S nC T T nR V V ∆=+,m 2112ln(/)ln(/)p S nC T T nR p p ∆=+,m 21,m 21ln(/)ln(/)V p S nC p p nC V V ∆=+上式只适用于封闭系统、理想气体、,m V C 为常数,只有pVT 变化的一切过程(2) T 2112ln(/)ln(/)S nR V V nR p p ∆==此式使用于n 一定、理想气体、恒温过程或始末态温度相等的过程。
(3) ,m 21ln(/)p S nC T T ∆=此式使用于n 一定、,m p C 为常数、任意物质的恒压过程或始末态压力相等的过程。
8. 相变过程的熵变此式使用于物质的量n 一定,在α和β两相平衡时衡T ,p 下的可逆相变化。
9. 热力学第三定律0)(lim m =*→完美晶体S T 0或 0)0K ,(m =*完美晶体S上式中符号*代表纯物质。
上述两式只适用于完美晶体。
10. 标准摩尔反应熵)B (B m B m r ∑=∆θθνS S2r m 2r m 1r ,m 1()()(/)d p S T S T C T T θθ∆=∆+∆⎰上式中r ,m p C ∆=B ,m B(B)p C ν∑,适用于在标准状态下,反应进度为1 mol 时,任一化学反应在任一温度下,标准摩尔反应熵的计算。
TH S /βαβα∆=∆11. 亥姆霍兹函数的定义TS U A -=r d δ'T A W =此式只适用n 一定的恒温恒容可逆过程。
12. 亥姆霍兹函数判据V T A ,∆⎩⎨⎧=<平衡自发,0,0 只有在恒温恒容,且不做非体积功的条件下,才可用A ∆作为过程的判据。
13. 吉布斯函数的定义TS H G -=,r d δ'T P G W =此式适用恒温恒压的可逆过程。
14. 吉布斯函数判据,T p G ∆⎩⎨⎧=<平衡自发,,00 只有在恒温恒压,且不做非体积功的条件下,才可用G ∆作为过程的判据。
15. 热力学基本方程式d d d d d d d d d d d d U T S p VH T S V p A S T p VG S T V p=-=+=--=-+ 热力学基本方程适用于封闭的热力学平衡系统所进行的一切可逆过程。
说的更详细些,它们不仅适用于一定量的单相纯物质,或组成恒定的多组分系统发生单纯p , V , T 变化的过程,也可适用于相平衡或化学平衡的系统,由一平衡状态变为另一平衡态的过程。
16. 麦克斯韦关系式(/)(/)(/)(/)(/)(/)(/)(/)S pS VV Tp TT p V S T V p S p T S V V T S p ∂∂=∂∂-∂∂=∂∂∂∂=∂∂-∂∂=∂∂适用条件同热力学基本方程。
例1-1 已知水在25℃的密度ρ=997.04 kg·m -3。
求1 mol 水(H 2O ,l )在25℃下:(1)压力从100 kPa 增加到200kPa 时的△H ;(2)压力从100 kPa 增加到1 MPa 时的△H 。
假设水的密度不随压力改变,在此压力范围内水的摩尔热力学能近似认为与压力无关。
解:)(pV U H ∆+∆=∆因假设水的密度不随压力改变,即V 恒定,又因在此压力范围内水的摩尔热力学能近似认为与压力无关,故0=∆U ,上式变成为)()(12122p p M p p V p V H OH -=-=∆=∆ρ(1)J p p M H O H 8.110)100200(04.9971018)(33122=⨯-⨯⨯=-=∆-ρ (2)J p p M H O H 2.1610)1001000(04.9971018)(33122=⨯-⨯⨯=-=∆-ρ例1-2 某理想气体, 1.5V m C R =。
今有该气体5 mol 在恒容下温度升高50℃,求过程的W ,Q ,△H 和△U 。
解:恒容:W=0;kJ J K nC T K T nC dT nC U m V m V KT T m V 118.33118503145.823550 )50(,,50,==⨯⨯⨯=⨯=-+==∆⎰+ kJ J KR C n T K T nC dT nC H m V m p KT T m p 196.55196503145.8255 50)()50(,,50,==⨯⨯⨯=⨯+==-+==∆⎰+根据热力学第一定律,:W=0,故有Q=△U=3.118kJ例1-3 4 mol 某理想气体,R C m P 25,=。
由始态100 kPa ,100 dm 3,先恒压加热使体积升增大到150 dm 3,再恒容加热使压力增大到150kPa 。
求过程的W ,Q ,△H 和△U 。
解:过程为330323115015041501004100100421dm kPaT moldm kPa T mol dm kPa T mol W W −−→−−→−= K nR V p T 70.3003145.84101001010033111=⨯⨯⨯⨯==-; K nR V p T 02.4513145.84101501010033222=⨯⨯⨯⨯==-K nR V p T 53.6763145.84101501015033333=⨯⨯⨯⨯==- kJ J V V p W 00.5500010)100150(10100)(331311-=-=⨯-⨯⨯-=-⨯-=-kJ W kJ W W 00.5W W ;00.5 ;02112-=+=-==)(23)(13,,3131T T R n dT R C n dT nC U T T m p T T m V -⨯⨯=-==∆⎰⎰ kJ J 75.1818749)70.30053.676(314.8234==-⨯⨯⨯= )(2513,31T T R n dT nC H T T m P -⨯⨯==∆⎰kJ J 25.3131248)70.30053.676(314.8254==-⨯⨯⨯= kJ kJ kJ W U Q 23.75)00.5(75.18=--=-∆=例1-4 已知CO 2(g )的C p ,m ={26.75+42.258×10-3(T/K )-14.25×10-6(T/K )2} J·mol -1·K -1 求:(1)300K 至800K 间CO 2(g )的m p C ,;(2)1kg 常压下的CO 2(g )从300K 恒压加热至800K 的Q 。