上海交通大学物理化学电化学习题.
- 格式:pdf
- 大小:891.98 KB
- 文档页数:13

B1. p 和 298 K 下,把 Pb 和 Cu(Ac)2 溶液发生的反应安排为电池, 当 获得可为91.84 k J 时,电池热213.6 k J ,因此该: ( ) (A) r U>0, r S>0 (B) r U<0, r S>0 (C) r U>0, r S<0 (D) r U<0, r S<0 2.在 应用 电势 , 通 常用 到 : ( ) (A) 标准电池 (B ) 电极 (C) 甘汞电极 (D) 活度为 1 的电解质溶液 3. 下列电池中液接电势不能被忽: ( ) (A) Pt, H 2(p 1) │H C l m ( 1) │H 2(p 2), Pt (B) Pt, H 2(p) │HCl(m 1)‖HCl( m 2) │H 2(p), Pt (C) Pt, H 2(p) │H C l m ( 1)┆ HCl( m 2) │H 2(p), Pt (D) Pt, H 2(p) │H C l m ( 1) │AgCl,Ag-Ag,AgCl │HCl(m 1) │H 2( p ), Pt 4. 某电池反应为 : Hg 2Cl 2(s)+H 2(p ) ─→2Hg(l)+2 H +( a =1)+2 Cl -(a=1) -4 V ·K -1,则r S m 为: () 已知:E =0.268 V, ( E/ T)p =-3.2 ×10 (A) -61.76 J K · -1·m ol -1 (B) -30.88 J K -1·m ol -1(C) 62.028 J K ·-1·mol-1 (D) -0.268 J K-1··mol-15. 电池中使用盐桥的作用是:()(A) 使电池变成无液体接界的可逆电池(B) 基本消除电池中的液体接界电势(C) 消除电池中存在的扩散现象(D) 使液体接界电势为零6. 用对消法测定电池电动势,若实验中发现检流计始终偏向一边,则可能原因是:()(A) 被测定电池温度不均匀(B) 被测定电池的两极接反了(C) 搅拌不充分使浓度不均匀(D) 检流计灵敏度差7. 将一铂丝两端分别浸入含0.1 mol d·m-3 Sn2+和0.01 mol d·m-3 Sn4+的溶液中,这时的电位差为:()4+|Sn2+)+0.059/2 (B) E (Sn4+|Sn2+)+0.059(A) E(Sn4+|Sn2+) - 0.059 (D) E (Sn4+|Sn2+) - 0.059/2(C) E(Sn8. 测定电池电动势时,标准电池的作用是:()(A) 提供标准电极电势(B) 提供标准电流(C) 提供标准电位差(D) 提供稳定的电压9. 当电池的电动势E=0 时,表示:()(A) 电池反应中,反应物的活度与产物活度相等(B) 电池中各物质都处于标准态(C) 正极与负极的电极电势相等(D) 电池反应的平衡常数K a=110. 下列电池中,电动势与氯离子活度无关的电池是:(A) Zn│ZnCl2(aq)‖KCl(aq) │AgCl│Ag(B) Pt│H2│HCl(aq) │C2│l Pt(C) Ag│AgCl(s) │KCl(aq) │2C│l P t(D) Hg│Hg2Cl2(s) │KCl(aq‖) AgNO3(aq) │Ag二、填空题11. 电池Hg│Hg2Cl2│HCl(a) │C2l(p ) │(Pt)在25℃, a = 0.1 时, E = 1.135 Va = 0.01 时, E = ______12. 将反应H2(g) + PbSO 4(s) →Pb(s) + H2SO4(aq)设计成电池的表示式为:______________________________________________________。

电化学A一、选择题1. 某燃料电池的反应为:O2(g)─→H2O(g)H2(g)+12在400 K 时的∆r H m和∆r S m分别为-251.6 kJ·mol-1和–50 J·K-1·mol-1,则该电池的电动势为:( )(A) 1.2 V (B) 2.4 V(C) 1.4 V (D) 2.8 V2. 已知下列两个电极反应的标准电极电位为:Cu2++ 2e-─→Cu(s) φ$= 0.337 V1Cu++ e-─→Cu(s) φ$= 0.521 V2由此可算得Cu2++ e-─→Cu+的φ∃值为:( )(A) 0.184 V (B) 0.352 V(C) -0.184 V (D) 0.153 V3. 有下面一组电池:(1) H2(p∃)│HCl(a=1)‖NaOH(a=1)│O2(p∃)(2) H2(p∃)│NaOH(a=1)│O2(p∃)(3) H2(p∃)│HCl(a=1)│O2(p∃)(4) H2(p∃)│KOH(a=1)│O2(p∃)(5) H2(p∃)│H2SO4(a=1)│O2(p∃)电动势值:( )(A) 除1 外都相同(B) 只有2,4 相同(C) 只有3,5 相同(D) 都不同4. 对应电池Ag(s)|AgCl(s)|KCl(aq)|Hg2Cl2(s)|Hg(l)的化学反应是:()(A) 2Ag(s)+Hg22+(aq) = 2Hg(l) +2Ag+(B) 2Hg+2Ag+ = 2Ag +Hg22+(C) 2AgCl+2Hg = 2Ag +Hg2Cl2(D) 2Ag+Hg2Cl2 = 2AgCl +2Hg5. 电动势测定应用中,下列电池不能用于测定H2O(l)的离子积的是:()(A) Pt,H2(p∃)|KOH(aq)||H+(aq)|H2(p∃),Pt(B) Pt,H2(p∃)|KOH(aq)||参比电极(C) Pt,H2(p∃)|KOH(aq)|HgO(s)|Hg(l)(D) Pt,H2(p∃)|HCl(aq)|Cl2(p∃),Pt6. 在电极与溶液的界面处形成双电层,其中扩散层厚度与溶液中离子浓度大小的关系是()(A) 两者无关(B) 两者成正比关系(C) 两者无确定关系(D) 两者成反比关系7. 某电池反应为Zn(s)+Mg2+(a=0.1)=Zn2+(a=1)+Mg(s) 用实验测得该电池的电动势E=0.2312 V, 则电池的E∃为:( )(A) 0.2903 V (B) -0.2312 V(C) 0.0231 V (D) -0.202 V8. 电极Tl3+,Tl+/Pt 的电势为φ$=1.250 V,电极Tl+/Tl 的电势φ2$1=-0.336 V,则电极Tl3+/Tl 的电势φ$为: ( )3(A) 0.305 V (B) 0.721 V(C) 0.914 V (D) 1.568 V9. 298 K 时,在下列电池的右边溶液中加入0.01 mol·kg-1的Na2S 溶液, 则电池的电动势将:( )Pt│H2(p∃)│H+(a=1)‖CuSO4(0.01 mol·kg-1)│Cu(s)(A) 升高(B) 下降(C) 不变(D) 无法判断10.298 K时,反应为Zn(s)+Fe2+(aq)=Zn2+(aq)+Fe(s) 的电池的E∃为0.323 V,则其平衡常数K∃为:( )(A) 2.89×105(B) 8.46×1010(C) 5.53×104(D) 2.35×102二、填空题11.将反应H2(g) + I2(s) →2HI(aq)设计成电池的表示式为:__________________________________。

电化学部分练习题--物理化学电化学部分练习题(Ⅰ)电解质溶液一、选择题1. 用同一电导池分别测定浓度为0.01 mol ·kg -1和0.1 mol ·kg -1的两个电解质溶液,其电阻分别为1000 Ω 和500 Ω,则它们依次的摩尔电导率之比为 ( )(A) 1 : 5 (B) 5 : 1 (C) 10 : 5 (D) 5 : 102. 298 K 时,0.005 mol ·kg -1 的 KCl 和0.005 mol ·kg -1 的NaAc 溶液的离子平均活度系数分别为γ ±,1和γ ±,2,则有 ( )(A) γ ±,1= γ ±,2 (B) γ ±,1>γ ±,2 (C) γ ±,1<γ ±,2 (D) γ ±,1≥ γ ±,23. 在HAc 解离常数测定的实验中,总是应用惠斯顿电桥。
作为电桥平衡点的指零仪器,结合本实验,不能选用的是:()(A) 耳机 (B) 电导率仪 (C) 阴极射线示波器 (D) 直流桥流计4. 1-1型电解质溶液的摩尔电导率可以看作是正负离子的摩尔电导率之和,这一规律只适用于:()(A) 强电解质 (B) 弱电解质 (C) 无限稀释电解质溶液 (D) 摩尔浓度为1的溶液二、填空题1. CaCl 2摩尔电导率与其离子的摩尔电导率的关系是:____)Cl(2)Ca ()CaCl (-m 2m 2m ∞+∞∞+=λλΛ_________________________。
2. 0.3 mol ·kg -1 Na 2HPO 4水溶液的离子强度是____0.9________ mol ·kg -1 。
3. 浓度为0.1 mol ·kg -1 的MgCl 2水溶液,其离子强度为__0.3_________________ mol ·kg -1 。

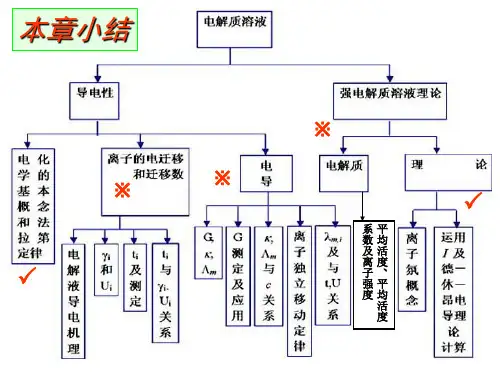
第八章、第九章和第十章 电化学【复习内容提纲】1、电解质溶液的导电机理是什么?(原电池和电解池装置是怎么有持续的电流的)2、什么是法拉第电解定律?公式?这定律在电化学中有何用处?3、离子迁移数的定义?计算离子迁移数的几个公式? 知道离子迁移数的测定方法?4、电导、电导率、摩尔电导率的定义、公式、物理意义和单位?P16页例题 P18页例题5、电导率和摩尔电导率与浓度的变化关系?(一定要理解为什么) 图8.11和 图8。
126、什么是离子独立运动定律? 会计算电解质溶液无限稀释摩尔电导率的两种方法? P22页7、电导测定的应用。
【计算题】会计算电离度和平衡常数P26页例题 P57页 习题19 ;P58页 习题21 ;会计算难溶盐的溶度积 P28页例题 P57页 习题158、离子的平均活度,平均质量摩尔浓度,平均活度系数的计算公式 P58页 习题25离子强度的计算公式 P58页 习题249、什么是可逆电池(可逆电池具备的条件)?10、可逆电极的种类(有哪三类),会写电极反应和电极符号11、电池表示式和电池反应的“互译" P109页 习题1 ;P109页 习题212、电动势E 及其温度系数与有关热力学量的关系 【计算题】类似于P110页 习题5 习题613、电池电动势产生的机理?(电池电动势是怎么产生的)14、标准氢电极和参比电极(甘汞电极)的构造?优缺点?15、电池的分类和各类电池电动势的两种计算方法? P82页 例题1 例题2 例题316、电极电势及电池电动势的应用。
【计算题】 类似于P84页 求±γ P85页 求W SP K K ;;;17、什么是电极的极化和过电势?电极极化的原因? 图10。
418、电解时电极反应。
知道阴极和阳极的放电顺序(析出顺序)的依据?例如:电解ZnCl 2水溶液,两极均用铂电极,电解反应如何? 若均改用锌电极,结果又如何?19、金属的腐蚀和防护(简单了解)【电化学 练习】一、填空题1、Pt|Cu 2+,Cu + 电极上的反应为Cu 2+ + e -→Cu +,当有1F 的电量通过电池时,发生反应的Cu 2+ 的物质的量为 。

物理化学第七章电化学习题及解答资料物理化学第七章电化学习题及解答资料第七章电化学练习与解决方案1.用铂电极电解cucl2溶液。
通过的电流为20a,经过15min后,问:(1)在阴极上能析出多少质量的cu;(2)在27℃,100kpa下,阳极析出多少cl2?解:电极反应为阴极:Cu2++2E-=Cu阳极:2Cl--2E-=Cl2电极反应的反应进度为ξ=q/(zf)=it/(zf)因此:mcu=mcuξ=mcuit/(zf)=63.546×20×15×60/(2×96485.309)=5.928gvcl2=ξrt/p=2.328dm32.用银电极电解agno3溶液。
通电一定时间后,测知在阴极上析出1.15g的ag,并知阴极区溶液中ag+的总量减少了0.605g。
求agno3溶液中的t(ag+)和t(no3-)。
解决方案:此类问题的解决方案主要基于电极区域的材料守恒(解决方案为电中性)。
显然,阴极区域溶液中Ag+总量的变化dmag等于从阴极沉淀的银的量MAG与从阳极迁移的银的量m’Ag之间的差值:dmag=mag-m’agm’ag=mag-dmagt(ag+)=q+/q=m'ag/mag=(mag-dmag)/mag=(1.15-0.605)/1.15=0.474t(no3-)=1-t(ag+)=1-0.474=0.5263.已知25℃时0.02mol/lkcl溶液的电导率为0.2768s/m。
一电导池中充以此溶液,在25℃时测得其电阻为453ω。
在同一电导池中装入同样体积的质量浓度为0.555g/l的cacl2溶液,测得电阻为1050ω。
计算(1)电导池系数;(2)cacl2溶液的电导率;(3)cacl2溶液的摩尔电导率。
解决方案:(1)电导池系数kcell为kcell=kr=0.2768×453=125.4m-1(2) cacl2溶液的电导率k=kcell/r=125.4/1050=0.1194s/m(3)cacl2溶液的摩尔电导率λm=k/c=110.983×0.1194/(0.555×1000)=0.02388sm2mol-在4.25℃下,将电导率为0.141s/m的KCl溶液放入电导池,测得其电阻为525Ω。

物理化学电化学练习题 -CAL-FENGHAI-(2020YEAR-YICAI)_JINGBIAN电化学练习题选择题1.离子独立运动定律适用于(A) 强电解质溶液 (B) 弱电解质溶液(C) 无限稀电解质溶液 (D) 理想稀溶液答案:C2. CaCl 2摩尔电导率与其离子的摩尔电导率的关系是(A))()()(22-∞+∞∞Λ+Λ=ΛCl CaCaCl m m m (B))(2)()(22-∞+∞∞Λ+Λ=ΛCl Ca CaCl m m m (C))()(21)(22-∞+∞∞Λ+Λ=ΛCl Ca CaCl m m m (D))}()({21)(22-∞+∞∞Λ+Λ=ΛCl Ca CaCl m m m 答案:B3.298K 时,当H 2SO 4溶液的浓度从0.01mol/kg 增加到0.1mol/kg 时,其电导率κ和摩尔电导率Λm 将(A) κ减小,Λm 增加 (B) κ增加,Λm 增加(C) κ减小,Λm 减小 (D) κ增加,Λm 减小答案:D4.下列电解质中,离子平均活度系数最大的是A. 0.01 mol/kg NaCl B. 0.01 mol/kg CaCl 2C .0.01 mol/kg LaCl 3 D. 0.01 mol/kg CuSO 4答案:A5.LiCl 的无限稀释摩尔电导率为1241003.115-⋅⋅⨯-mol m S ,在298K 时,测得LiCl稀溶液中Li+的迁移数为0.3364,则Cl-离子的摩尔电导率()-ΛCl m 为 (A) 1241033.76-⋅⋅⨯-molm S (B) 1241003.113-⋅⋅⨯-molm S (C) 1241070.38-⋅⋅⨯-mol m S(D) 1221033.76-⋅⋅⨯molm S答案:A 6.质量摩尔浓度为b 的Na 3PO 4溶液,平均活度系数为±γ,则电解质的活度为(A) ()()44/4±=γθb b a B(B) ()()4/4±=γθb b a B (C) ()()44/27±=γθb b a B (D) ()()4/27±=γθb b a B 答案:C7. 1mol/kg 的K 4Fe(CN)6的离子强度为(A) 10mol/kg(B) 7mol/kg(C) 4mol/kg(D) 15mol/kg答案:A8.下列电池电动势与氯离子活度无关的是(A) Zn│ZnCl 2(aq)‖KCl(aq) │AgCl│Ag(B) Pt│H 2│HCl(aq) │Cl 2│Pt(C) Ag│AgCl(s)│KCl(aq)│Cl 2│Pt(D) Hg│Hg 2Cl 2(s)│KCl(aq)‖AgNO 3(aq)│Ag答案:C9. 电解质水溶液的离子平均活度系数受多种因素的影响, 当温度一定时, 其主要的影响因素是(A) 离子的本性 (B) 电解质的强弱(C) 共存的它种离子的性质 (D) 离子浓度及离子电荷数答案:D10.若向摩尔电导率为1.4×10-2s m 2mol -1的CuSO 4溶液中,加入1m 3的纯水,这时CuSO 4摩尔电导率为:A. 降低;B. 增高;C. 不变;D. 不能确定答案:B 。

物理化学电化学习题及答案物理化学电化学习题及答案电化学是研究电与化学的相互关系的学科,是物理化学的重要分支之一。
在电化学中,我们经常会遇到一些习题,通过解答这些习题可以更好地理解电化学的原理和应用。
下面将给出一些典型的物理化学电化学习题及其详细解答。
习题一:在标准状态下,计算以下电池的标准电动势:(1)Zn | Zn2+(0.1 M) || Cu2+(0.01 M) | Cu(2)Al | Al3+(0.01 M) || Ag+(0.1 M) | Ag解答一:(1)根据标准电动势的定义,标准电动势等于阳极的标准电势减去阴极的标准电势。
在该电池中,Zn 是阳极,Cu 是阴极。
根据标准电极电势表,Zn2+/Zn 的标准电势为-0.76 V,Cu2+/Cu 的标准电势为0.34 V。
因此,该电池的标准电动势为0.34 V - (-0.76 V) = 1.10 V。
(2)在该电池中,Al 是阳极,Ag 是阴极。
根据标准电极电势表,Al3+/Al 的标准电势为-1.66 V,Ag+/Ag 的标准电势为0.80 V。
因此,该电池的标准电动势为0.80 V - (-1.66 V) = 2.46 V。
习题二:在电解质溶液中,电解质的浓度对电解过程有影响。
计算以下电池的电动势变化:(1)Zn | Zn2+(0.1 M) || Cu2+(0.01 M) | Cu(2)Al | Al3+(0.01 M) || Ag+(0.1 M) | Ag解答二:(1)根据液体电池的电动势公式,电动势等于标准电动势减去(0.059/n)log([Cu2+]/[Zn2+]),其中 n 为电子转移数,[Cu2+] 和 [Zn2+] 分别为 Cu2+ 和Zn2+ 的浓度。
在该电池中,n = 2,[Cu2+] = 0.01 M,[Zn2+] = 0.1 M。
代入公式计算得到电动势为 1.10 V - (0.059/2)log(0.01/0.1) ≈ 1.09 V。

物理化学-电化学部分习题答案4. 在18 o C 时,已知0.01 mol/dm 3 KCl 溶液的电导率为0.12205 S m -1,用同一电导池测出0.01 mol/dm 3 KCl 和0.001 mol/dm 3 K 2SO 4的电阻分别为145.00 Ω和712.2 Ω。
试求算(1)电导池常数;(2)0.001 mol/dm 3 K 2SO 4溶液的摩尔电导率。
解. (1)用标准KCl 溶液求电导池常数:170.1700.14512205.0-=⨯===m R GK cell κκ(2)K 2SO 4溶液的摩尔电导率:12302485.02.71210001.071.17-⋅⋅=⨯⨯====Λmol m S cR K c G K ccell cell m κ8. 在25 o C 时,一电导池充以0.01 mol/dm 3 KCl 和0.1 mol/dm 3 NH 3·H 2O 溶液,测出两溶液的电阻分别为525 Ω和2030 Ω,试计算此时NH 3·H 2O 溶液的解离度。
已知25 o C 时0.01 mol/dm 3 KCl 的电导率为0.1409 S m -1,()()121240198.0,00734.0--∞-+∞⋅⋅=⋅⋅=mol m S OH mol m S NH m m λλ 解. 用标准KCl 溶液求电导池常数:()()()()KCl R KCl KCl G KCl K cell κκ==0.1 mol/dm 3 NH 3·H 2O 溶液的电导率为:()()()()()123232303643.020305251409.0-⋅=⨯=⋅=⋅=⋅m S O H NH R KCl R KCl O H NH G K O H NH cell κκ0.1 mol/dm 3 NH 3·H 2O 溶液的摩尔电导率为:()()()124323232310643.3101.003643.0--⋅⋅⨯=⨯=⋅⋅=⋅Λmol m S O H NH c O H NH O H NH m κ ()()()1242302714.00198.000734.0--∞+∞∞⋅⋅=+=+=⋅Λmol m S OHNH O H NH m m m λλ NH 3·H 2O 溶液的解离度:()()0134.002714.010643.342323=⨯=⋅Λ⋅Λ=-∞O H NH O H NH m m α12. 在18 o C 时,测得CaF 2饱和水溶液及配制该溶液的纯水的电导率分别为3.83×10-3 和1.5×10-4 S m -1。

电化学A一、选择题1. 某燃料电池的反应为:O2(g)─→H2O(g)H2(g)+12在 400 K 时的r H m和r S m分别为 -251.6 kJ·mol-1和–50 J·K-1·mol-1,则该电池的电动势为: ( ) (A) 1.2 V (B) 2.4 V(C) 1.4 V (D) 2.8 V2. 已知下列两个电极反应的标准电极电位为:Cu2++ 2e-─→ Cu(s)$= 0.337 V1Cu++ e-─→ Cu(s)$= 0.521 V2由此可算得 Cu2++ e-─→ Cu+的值为: ( )(A) 0.184 V (B) 0.352 V(C) -0.184 V (D) 0.153 V3. 有下面一组电池:(1) H2(p)│HCl(a=1)‖NaOH(a=1)│O2(p)(2) H2(p)│NaOH(a=1)│O2(p)(3) H2(p)│HCl(a=1)│O2(p)(4) H2(p)│KOH(a=1)│O2(p)(5) H2(p)│H2SO4(a=1)│O2(p)电动势值: ( )(A) 除 1 外都相同 (B) 只有 2,4 相同(C) 只有 3,5 相同 (D) 都不同4. 对应电池Ag(s)|AgCl(s)|KCl(aq)|Hg2Cl2(s)|Hg(l)的化学反应是:()(A) 2Ag(s)+Hg22+(aq) = 2Hg(l) +2Ag+(B) 2Hg+2Ag+ = 2Ag +Hg22+(C) 2AgCl+2Hg = 2Ag +Hg2Cl2(D) 2Ag+Hg2Cl2 = 2AgCl +2Hg5. 电动势测定应用中,下列电池不能用于测定H2O(l)的离子积的是:()(A) Pt,H2(p)|KOH(aq)||H+(aq)|H2(p),Pt(B) Pt,H2(p)|KOH(aq)||参比电极(C) Pt,H2(p)|KOH(aq)|HgO(s)|Hg(l)(D) Pt,H2(p)|HCl(aq)|Cl2(p),Pt6. 在电极与溶液的界面处形成双电层,其中扩散层厚度与溶液中离子浓度大小的关系是()(A) 两者无关(B) 两者成正比关系(C) 两者无确定关系(D) 两者成反比关系7. 某电池反应为 Zn(s)+Mg2+(a=0.1)=Zn2+(a=1)+Mg(s) 用实验测得该电池的电动势E=0.2312 V, 则电池的E为:( )(A) 0.2903 V (B) -0.2312 V (C) 0.0231 V (D) -0.202 V 8. 电极 Tl 3+,Tl +/Pt 的电势为1$=1.250 V,电极 Tl +/Tl 的电势2$=-0.336 V ,则电极 Tl 3+/Tl 的电势 3$为: ( )(A) 0.305 V(B) 0.721 V (C) 0.914 V(D) 1.568 V9. 298 K 时,在下列电池的右边溶液中加入 0.01 mol ·kg -1的 Na 2S 溶液, 则电池的电动势将: ( )Pt │H 2(p )│H +(a =1)‖CuSO 4(0.01 mol ·kg -1)│Cu(s) (A) 升高 (B) 下降 (C) 不变(D) 无法判断10.298 K 时,反应为 Zn(s)+Fe 2+(aq)=Zn 2+(aq)+Fe(s) 的电池的E 为 0.323 V,则其平衡常数 K 为: ( )(A) 2.89×105 (B) 8.46×1010 (C) 5.53×104 (D) 2.35×102 二、填空题11.将反应H 2(g) + I 2(s) → 2HI(aq)设计成电池的表示式为:__________________________________。

物理化学电化学部分试卷班级 姓名 分数一、选择题 ( 共 8题 30分 )1. 在298 K 时,下述电池电动势为0.456V , Ag+AgI(s)|KI(0.02 mol ·kg -1 ,±=0.905)||KOH(0.05 mol ·kg -1,±= 0.820)|Ag 2O(s)|Ag(s)当电池反应进行至电子传输量为1mol 时,这时电池反应的平衡常数为: ( )(A) 5.16×107 (B) 1.9×10-8 (C) 1.17×108 (D) 1.22×1092. 在298 K 时,0.002 mol ·kg -1 的 CaCl 2溶液的平均活度系数±,1与0.002 mol ·kg -1 的CaSO 4溶液的平均活度系数±,2 相比较是: ( )(A) ±,1 > ±,2 (B) ±,1 < ±,2 (C) ±,1 = ±,2(D) 无法比较 3. 25℃,将含有Fe 2+和Fe 3+的水溶液与 Fe 粉一起振荡,使其达平衡,求出 K = [Fe 2+]3[Fe 3+]-2=8.98×1040,其φ (Fe 2+/Fe) = -0.4402 V ,则下列答案正确的是: ( )(A) φ (Fe 3+/Fe 2+) = 0.771 V , φ (Fe 2+/Fe) = 0.3308 V(B) φ (Fe 3+/Fe 2+) = 1.6514 V , φ (Fe 2+/Fe) = 0.8439 V(C) φ (Fe 3+/Fe 2+) = 0.771 V , φ (Fe 2+/Fe) = -0.0365 V(D) φ (Fe 3+/Fe 2+) = 1.6514 V , φ (Fe 2+/Fe) = -0.0365 V4. 18℃时,纯水的=∞O)H (2m Λ 4.89×10-2 -12mol m S ⋅⋅,此时水中m (H +)= m (OH -)=7.8×10-8 mol ·kg -1,则18℃时纯水的电导率为: ( )(A )3.81×10-6 S ·m -1 ((B )3.81×10-8 S ·m -1(C) 3.81×10-7 S ·m -1 (D) 3.81×10-5 S ·m -15. 在下列各电池中,其电池电动势与氯离子的活度a (Cl -)无关的是: ( )(A) Zn|ZnCl 2(aq)|Cl 2(p ),Pt (B) Zn|ZnCl 2(aq)|KCl(aq)|AgCl,Pt(C )Pt,H 2(p 1)|HCl(aq)|Cl 2(p 2),Pt (C) Ag,AgCl|KCl(aq)|Cl 2(p ),Pt6. Ostwald 稀释定律表示为:2m c m m m ()()c K c ∞∞Λ=ΛΛ-Λ,它适用于: ( )(A) 非电解质溶液 (B) 强电解质溶液(C) 解离度很小的弱电解质 (D) 无限稀释的电解质溶液7. 描述电极上通过的电量与已发生电极反应的物质的量之间的关系的是: ( )(A) 欧姆定律 (B )离子独立运动定律(C ) 法拉第定律 (D )能斯特定律8. 若算得电池反应的电池电动势为负值时,表示此电池反应是: ( )(A) 正向进行 (B) 逆向进行 (C) 不可能进行 (D) 反应方向不确定二、填空题 ( 共41题 100分 )9. 电化学中电极反应的速度以 ______ 表示,极化是 _________________________的现象,极化主要有 _________, _________。
物理化学电化学练习题电化学是物理化学的一个重要分支,研究电子和离子在电场作用下的行为,以及化学反应和电流之间的关系。
在学习电化学理论时,经常需要通过练习题来巩固知识并提升解题能力。
本文将提供一些物理化学电化学练习题,帮助读者理解该领域的基本概念和原理。
1. 在一个电解池中,将铜电极和铝电极浸泡在铜(II)硫酸溶液和铝硫酸溶液中。
根据下列化学方程式选择正确的反应:a) Cu2+ + 2e- → Cub) Al3+ + 3e- → Alc) Cu → Cu2+ + 2e-d) Al → Al3+ + 3e-2. 在一个银电极上,观察到有氯气生成。
根据观察所得,选择正确的化学方程式:a) 2Ag + 2Cl- → 2AgClb) AgCl2 + 2e- → 2Ag + 2Cl-c) Ag2+ + 2e- → 2Agd) 2AgCl → 2Ag + Cl23. 通过下列半反应方程式,选择正确的氧化剂和还原剂:a) Zn → Zn2+ + 2e-b) Sn4+ + 2e- → Sn2+c) 2OH- → O2 + 2e- + H2Od) Cu2+ + 2e- → Cu4. 在电化学中,阴极和阳极分别是电子的:a) 进入和离开的地方b) 离开和进入的地方c) 位于同一地方d) 不重要的地方5. 根据电池电势的定义,选择正确的描述:a) 电池电势是电池排放电子的能力b) 电池电势是电子在电解质中移动的能力c) 电池电势是电流通过电解质时产生的能力d) 电池电势是电池驱动电流流动的能力6. 下面哪个电化学概念与电解相关:a) 摩尔浓度b) 离子浓度c) 电解质浓度d) 电荷浓度7. 下列哪一种物质是理想电解质:a) CuCl2b) C6H12O6c) NaCld) H2SO48. 在一个铅蓄电池中,哪一种物质充当阴极活性材料:a) PbO2b) PbSO4c) H2SO4d) Pb9. 当一个金属在水中形成阳离子时,该反应被称为:a) 氧化b) 还原c) 电离d) 水解10. 在一个电解槽中,当电流通过溶液时,阴极上的电位为负或正?a) 正b) 负以上是一些物理化学电化学练习题,希望能帮助读者巩固学习成果,并深入理解电化学的基本概念和原理。
电化学 A一、选择题1. 某燃料电池的反应为: H 2(g)+12O 2(g)─→H 2O(g)在 400 K 时的 ∆r H m 和 ∆r S m 分别为 -251.6 kJ ·mol -1和 –50 J ·K -1·mol -1,则该电池的电动势为: ( ) (A) 1.2 V (B) 2.4 V (C) 1.4 V (D) 2.8 V 2. 已知下列两个电极反应的标准电极电位为: Cu 2++ 2e -─→ Cu(s) φ1$= 0.337 V Cu ++ e -─→ Cu(s) φ2$= 0.521 V 由此可算得 Cu 2++ e -─→ Cu +的 φ∃ 值为: ( ) (A) 0.184 V (B) 0.352 V (C) -0.184 V (D) 0.153 V 3. 有下面一组电池:(1) H 2(p ∃)│HCl(a =1)‖NaOH(a =1)│O 2(p ∃) (2) H 2(p ∃)│NaOH(a =1)│O 2(p ∃) (3) H 2(p ∃)│HCl(a =1)│O 2(p ∃) (4) H 2(p ∃)│KOH(a =1)│O 2(p ∃) (5) H 2(p ∃)│H 2SO 4(a =1)│O 2(p ∃) 电动势值: ( )(A) 除 1 外都相同 (B) 只有 2,4 相同(C) 只有 3,5 相同 (D) 都不同4. 对应电池Ag(s)|AgCl(s)|KCl(aq)|Hg 2Cl 2(s)|Hg(l)的化学反应是: ( )(A) 2Ag(s)+Hg 22+(aq) = 2Hg(l) +2Ag +(B) 2Hg+2Ag+ = 2Ag +Hg 22+(C) 2AgCl+2Hg = 2Ag +Hg 2Cl 2 (D) 2Ag+Hg 2Cl 2 = 2AgCl +2Hg5. 电动势测定应用中,下列电池不能用于测定H 2O(l)的离子积的是:( )(A) Pt,H 2(p ∃)|KOH(aq)||H +(aq)|H 2(p ∃),Pt (B) Pt,H 2(p ∃)|KOH(aq)||参比电极 (C) Pt,H 2(p ∃)|KOH(aq)|HgO(s)|Hg(l) (D) Pt,H 2(p∃)|HCl(aq)|Cl 2(p ∃),Pt6. 在电极与溶液的界面处形成双电层,其中扩散层厚度与溶液中离子浓度大小的关系是( )(A) 两者无关(B) 两者成正比关系 (C) 两者无确定关系 (D) 两者成反比关系7. 某电池反应为 Zn(s)+Mg 2+(a =0.1)=Zn 2+(a =1)+Mg(s) 用实验测得该电池的电动势 E =0.2312 V, 则电池的 E ∃为: ( )(A) 0.2903 V (B) -0.2312 V (C) 0.0231 V (D) -0.202 V8. 电极 Tl 3+,Tl +/Pt 的电势为φ1$=1.250 V,电极 Tl +/Tl 的电势 φ2$=-0.336 V ,则电极 Tl 3+/Tl 的电势 φ3$为: ( ) (A) 0.305 V(B) 0.721 V (C) 0.914 V(D) 1.568 V9. 298 K 时,在下列电池的右边溶液中加入 0.01 mol ·kg -1的 Na 2S 溶液, 则电池的电动势将: ( )Pt │H 2(p ∃)│H +(a =1)‖CuSO 4(0.01 mol ·kg -1)│Cu(s) (A) 升高 (B) 下降 (C) 不变(D) 无法判断10.298 K 时,反应为 Zn(s)+Fe 2+(aq)=Zn 2+(aq)+Fe(s) 的电池的 E ∃为 0.323 V,则其平衡常数 K ∃为: ( ) (A) 2.89×105 (B) 8.46×1010 (C) 5.53×104 (D) 2.35×102 二、填空题11.将反应H 2(g) + I 2(s) → 2HI(aq)设计成电池的表示式为:__________________________________。
资料范本本资料为word版本,可以直接编辑和打印,感谢您的下载物理化学第七章电化学习题及解答地点:__________________时间:__________________说明:本资料适用于约定双方经过谈判,协商而共同承认,共同遵守的责任与义务,仅供参考,文档可直接下载或修改,不需要的部分可直接删除,使用时请详细阅读内容第七章电化学习题及解答1. 用铂电极电解CuCl2溶液。
通过的电流为20 A,经过15 min后,问:(1)在阴极上能析出多少质量的Cu ; (2) 在27℃,100 kPa下,阳极析出多少Cl2?解:电极反应为阴极:Cu2+ + 2e- = Cu阳极: 2Cl- - 2e- = Cl2电极反应的反应进度为ξ = Q/(ZF) =It / (ZF)因此:mCu = MCu ξ = MCu It /( ZF) =63.546×20×15×60/(2×96485.309)=5.928gVCl2 = ξ RT / p =2.328 dm32. 用银电极电解AgNO3溶液。
通电一定时间后,测知在阴极上析出1.15g 的Ag,并知阴极区溶液中Ag+的总量减少了0.605g。
求AgNO3溶液中的t (Ag+)和t (NO3-)。
解:解该类问题主要依据电极区的物料守恒(溶液是电中性的)。
显然阴极区溶液中Ag+的总量的改变D mAg等于阴极析出银的量mAg与从阳极迁移来的银的量m’Ag之差:DmAg = mAg - m’Agm’Ag = mAg - DmAgt (Ag+) = Q+/Q = m’Ag / mAg = (mAg - DmAg)/ mAg = (1.15-0.605)/1.15 = 0.474t (NO3-) = 1- t (Ag+) = 1- 0.474 = 0.5263. 已知25 ℃时0.02 mol/L KCl溶液的电导率为0.2768 S/m。
1在电路中串联着两个电量计,一为氢电量计,另一为银电量计。
当电路中通电
1 h后,在氢电量计中收集到19 ?C、99.19 kPa的;在银电量计中沉积。
用两个电量计的数据计算电路中通过的电流为多少。
解:两个电量计的阴极反应分别为
电量计中电极反应的反应进度为
对银电量计
对氢电量计
2用银电极电解溶液。
通电一定时间后,测知在阴极上析出的,并知阴极区溶液中的总量减少了。
求溶液中的和。
解:该类问题主要依据电极区的物料守恒(溶液是电中性的)。
显然阴极区溶液中的总量的改变等于阴极析出银的量与从阳极迁移来的银的量之差:
3用银电极电解水溶液。
电解前每溶液中含。
阳极溶解下来
的银与溶液中的反应生成,其反应可表示
为
总反应为
通电一定时间后,测得银电量计中沉积了,并测知阳极区溶液重,其中含。
试计算溶液中的和。
解:先计算是方便的。
注意到电解前后阳极区中水的量不变,量的改变为
该量由两部分组成(1)与阳极溶解的生成,(2)从阴极迁移到阳极
4已知25 ?C时溶液的电导率为。
一电导池中充以此溶液,在25 ?C时测得其电阻为。
在同一电导池中装入同样体积的质量浓度为的溶液,测得电阻为。
计算(1)电导池系数;(2)
溶液的电导率;(3)溶液的摩尔电导率。
解:(1)电导池系数为
(2)溶液的电导率
(3)溶液的摩尔电导率
5已知25 ?C时溶液的电导率为。
计算的解离度及解离常熟。
所需离子摩尔电导率的数据查表。
解:的解离反应为
查表知
因此,
6已知25 ?C时水的离子积,、和的分别等于
,和。
求25 ?C时纯水的电导率。
解:水的无限稀释摩尔电导率为
纯水的电导率
7试计算下列各溶液的离子强度:(1);(2);(3)。
解:根据离子强度的定义
8电池在25 ?C时电动势为,电动势的温度系数为。
(1)写出电池反应;
(2)计算25 ?C时该反应的,以及电池恒温可逆放电时该反应过程的。
解:电池反应为
该反应的各热力学函数变化为
9电池的电池反应为
已知25 ?C时,此电池反应的,各物质的规定熵
分别为:;;;。
试计算25 ?C时电池的电动势及电动势的温度系数。
解:该电池反应的各热力学函数变化为
因此,
10氨可以作为燃料电池的燃料,其电极反应及电池反应分别为
试利用物质的标准摩尔生成Gibbs函数,计算该电池在25 ?C时的标准电动势。
解:查表知各物质的标准摩尔生成Gibbs函数为
电池反应的标准摩尔Gibbs函数为
11写出下列各电池的电池反应,查表计算25 ?C时各电池的电动势及各电池反应的摩尔Gibbs函数变,并指明各电池反应能否自发进行。
解:(1)
,反应可自发进行。
(2)
,反应可自发进行。
12写出电池的电池反应和电动势的计算式。
解:该电池为浓差电池,其电池反应为
因此,
13电池在25 ?C时电动势为,试计算HCl溶液中HCl 的平均离子活度因子。
解:该电池的电池反应为
根据Nernst方程
14为了确定亚汞离子在水溶液中是以Hg+还是以形式存在,涉及了如下电池
测得在18 o C 时的E = 29 mV,求亚汞离子的形式。
解:设硝酸亚汞的存在形式为,则电池反应为
电池电动势为
作为估算,可以取,。
所以硝酸亚汞的存在形式为。
15电池在25 o C,当某溶液为pH = 3.98的缓冲溶液时,测得电池的电动势;当某溶液换成待测 pH的溶液时,测得电池的电动势。
试计算待测溶液的 pH。
解:电池反应
根据Nernst方程,电池电动势为
设在两种情况下H2O的活度相同,则
16将下列反应设计成原电池,并查表计算25 o C时电池反应的解:(1)
(2)
(3)
17(1)查表计算反应在25 o C时的平衡常数。
(2)将适量的银粉加入到浓度为的溶液中,计算平衡时Ag+的浓度(假设各离子的活度因子均等于1)。
解:(1)设计电池
(2)设平衡时Fe2+的浓度为x,则
因此,,解此二次方程得到。
18已知25 o C时AgBr的溶度积,,。
试计算25 o C时
(1)银-溴化银电极的标准电极电势;
(2)的标准生成吉布斯函数。
解:(1)设计电池,电池反应为
根据Nernst方程
沉淀反应平衡时,所以
(2)设计电池,电池反应为
该反应为的生成反应,。