无菌模拟灌装工艺验证共44页文档
- 格式:ppt
- 大小:4.58 MB
- 文档页数:44

无菌灌装模拟试验方案验证分类:工艺验证验证部门:冻干粉针剂车间1.概述:为证明在确定的环境、工艺和操作下,生产过程能有效地防止微生物污染,使产品达到无菌要求,需进行培养基模拟灌装试验,来验证所提供产品的无菌可靠性达到可接受的标准。
这是GMP对非最终灭菌无菌冻干粉注射剂生产的基本要求,是无菌制剂工艺验证的重要组成部分。
但是此试验不能对常规生产造成不良影响。
无菌灌装模拟试验是指由掌握了无菌操作的人员在一个有控制的环境中,利用适宜的设备系统,将经灭菌(或经除菌过滤)的无菌培养基灌装于事先灭菌的容器中,制成无菌药物的过程。
该验证是在与无菌灌装生产过程有关的其他验证如:洁净厂房、公用系统(工业用水系统等)、设备(包括蒸汽灭菌柜、隧道式干燥灭菌器等)等验证合格后,且操作人员熟练掌握了岗位SOP后进行的。
采用培养基代替药品进行无菌灌装对无菌工艺进行验证,即用经过湿热灭菌(除菌过滤)的液体胰酪胨大豆肉汤培养基代替产品药液,进行无菌灌装、半加塞操作,灌装后的样品送入冻干箱内放置产品冻干程序所需时间,再进行压塞、轧盖,然后进行培养观察,以确认无菌灌装工艺的可靠性,以上整个操作过程应模拟正常的产品生产时的最差状态。
培养基灌装作为无菌灌装的模拟实验,可以直观、方便、准确地反映出无菌灌装过程的污染情况及问题。
2.目的:通过培养基无菌灌装模拟试验,来确认在冻干粉针剂灌装过程中所采用的各种方法和各种规程,防止微生物污染的水平达到可接受的合格标准的能力,或提供保证所生产产品的无菌性的可信限度达到可接受的合格标准的证据,为今后对粉针车间进行冻干粉针剂灌装作业管理确定依据,即通过对经过培养的灌装样品进行检查并对结果进行分析解读可以综合评估无菌工艺的可靠性,借以确定实际生产中产品被污染的概率,确保无菌产品的无菌性。
3.范围:此验证方案适用于粉针车间,非最终灭菌的无菌生产工艺模拟试验。
4.依据:药品生产质量管理规范》2010修订版附录1:无菌药品生产;《中国药典》2010年版二部附录无菌检查;GMP指南5.责任:质量部、生产部、质检科、粉针车间、设备部等部门负责本试验的执行、分析及报告。



培养基模拟灌装无菌生产工艺验证方案目录1 概述2 验证目的3 适用范围4 验证小组成员与职责5 文件资料及培训确认6 编制依据7 验证计划8风险评估分析9 验证内容10验证结果的分析与评价11验证周期验证立项申请表验证方案会签审批表1、概述1.1我公司小容量注射剂车间2号生产线,按GMP2010版及其附录要求进行设计,是专用于≥小容量注射剂非最终灭菌产品生产使用。
维生素C注射液(5ml:0.5g)因无法进行F0 8分钟湿热灭菌,以达到SAL≤10-6,但处方可以通过微生物滞留过滤器过滤,故采用除菌过滤和无菌工艺相结合的灭菌方法。
1.2培养基灌装验证是用和实际生产工艺相同的条件与操作方法(包括生产环境),向安瓿内灌装经除菌过滤的培养基,然后将此模拟制品在适当条件下培养,以确认工艺过程的可靠性。
对设备、环境以及人员操作的一种系统验证,是判断无菌保证水平的关键手段。
在正式生产前必须按维生素C注射液(5ml:0.5g)生产工艺进行培养基模拟灌装验证。
1.3验证次数按2010版GMP附录1要求,因该生产线为新建设施,本次为规格为5ml培养基模拟灌装试验首次验证,故需进行连续三个批次的验证活动。
2、验证目的2.1证明无菌生产区的设计及其设备布局,环境及卫生状态、人员无菌操作等各方面因素均能保证产品的无菌性。
2.2确定生产最差条件下仍能保证产品的无菌性。
2.3通过培养基模拟灌装试验确保生产符合现行GMP法规要求。
3、验证范围本验证方案适用于小容量注射剂车间无菌灌装生产线(二线)正式投入使用前培养基模拟灌装试验的验证。
4、验证小组成员与职责4.1验证小组成员验证小组:准备、检查和实施确认方案;设计、组织和协调验证试验;收集整理验证数据,偏差处理,编写确认报告;再验证周期的确定。
验证小组组长:组织编写验证方案,领导协调验证项目的实施,协调验证小组的工作,对验证过程的技术负责,审核批准验证方案、偏差及验证报告。
验证小组副组长:负责起草验证方案,编写验证报告,负责协调确认方案的实施,相关操作规程的修订,协助收集整理验证数据,对偏差提出纠正措施建议。

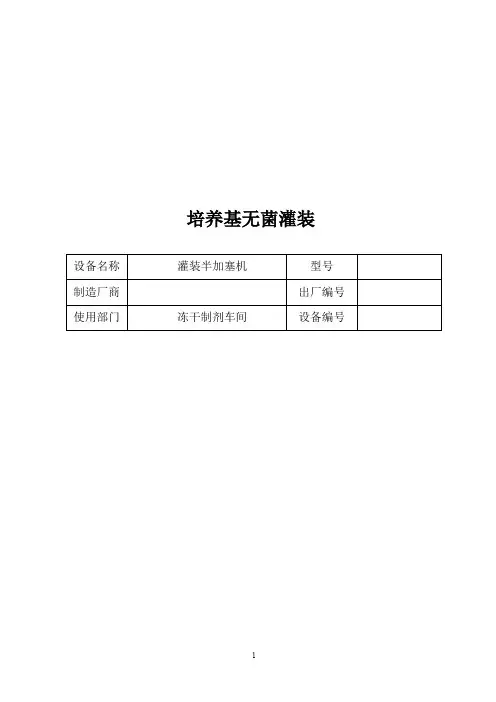
培养基无菌灌装目录验证方案一、验证目的二、设备概述三、验证小组组成四、验证程序五、验证进度六、验证内容与方法验证报告一、验证实施二、验证结果三、结果分析四、评价五、验证后期工作六、建议验证记录一、培养基灌装验证记录附:1.灭菌后西林瓶、胶塞无菌检测记录2.百级区表面微生物及操作人员手和衣物微生物动态监测记录培养基无菌灌装验证方案无菌灌装(培养基灌装)验证方案一、验证目的:通过培养基无菌灌装试验时已灌装培养基的西林瓶染菌率能否达到规定的合格标准,来确认冻干车间的洁净环境以及进行无菌灌装过程中所采用的各种防止微生物污染的方法和规程的可行性,从而为保证所生产产品的无菌性提供依据。
二、概述:无菌灌装是指由掌握了无菌操作的人员在一个有控制的环境中将经灭菌的无菌药液灌封于灭菌后的容器中,制成无菌药物的过程。
无菌灌装验证,是在与无菌灌装生产过程有关的其他验证,如:洁净厂房、公用系统、灭菌设备(包括蒸汽灭菌柜、隧道式灭菌干燥器、热循环烘箱等)验证合格后,且操作人员熟练掌握了岗位SOP后进行的。
培养基灌装作为无菌灌装的模拟实验,可以直观、方便、准确地反映出无菌灌装过程的污染情况及问题。
三、验证小组的成员:本设备的验证按文件SMP—YZ—0001—01规定组成验证小组,其成员及职责为:组长:全面负责本验证工作。
生产部:负责培养基的灌装操作。
质管部:负责样品的检测工作。
负责验证全过程的监控。
四、验证程序:本验证按文件SMP—XX—XXXX—XX规定的程序进行验证。
五、验证进度:年月日至年月日完成。
六、验证内容与方法:1.验证前须确认项目: 确认人员培训合格,公用系统、工艺用水系统和空调系统、车间设备处于正常运行状态,并提供相关的合格报告。
2.验证方法及过程监测项目:2.1 培养基的准备:培养基名称:胰蛋酶胨大豆肉汤培养基。
在临试验前,按规定配置好所需的液体培养基,并于121℃、20分钟进行灭菌。
2.2 灌装过程:按规程做好无菌灌装前的一切准备工作,开始无菌灌装,每支装量2毫升,每机灌装数量不得少于3000瓶,加塞为半加塞,灌装加塞同步完成后,每盘依次编号入冻干箱,模拟生产状态时压塞,压塞完毕传入轧盖间加铝盖轧盖后交QC培养。

无菌灌装验证方案无菌灌装模拟试验方案验证分类:工艺验证验证部门:冻干粉针剂车间甘肃大得利制药有限公司1.概述:为证明在确定的环境、工艺和操作下,生产过程能有效地防止微生物污染,使产品达到无菌要求,需进行培养基模拟灌装试验,来验证所提供产品的无菌可靠性达到可接受的标准。
这是GMP对非最终灭菌无菌冻干粉注射剂生产的基本要求,是无菌制剂工艺验证的重要组成部分。
但是此试验不能对常规生产造成不良影响。
无菌灌装模拟试验是指由掌握了无菌操作的人员在一个有控制的环境中,利用适宜的设备系统,将经灭菌(或经除菌过滤)的无菌培养基灌装于事先灭菌的容器中,制成无菌药物的过程。
该验证是在与无菌灌装生产过程有关的其他验证如:洁净厂房、公用系统(工业用水系统等)、设备(包括蒸汽灭菌柜、隧道式干燥灭菌器等)等验证合格后,且操作人员熟练掌握了岗位SOP后进行的。
采用培养基代替药品进行无菌灌装对无菌工艺进行验证,即用经过湿热灭菌(除菌过滤)的液体胰酪胨大豆肉汤培养基代替产品药液,进行无菌灌装、半加塞操作,灌装后的样品送入冻干箱内放Z产品冻干程序所需时间,再进行压塞、轧盖,然后进行培养观察,以确认无菌灌装工艺的可靠性,以上整个操作过程应模拟正常的产品生产时的最差状态。
培养基灌装作为无菌灌装的模拟实验,可以直观、方便、准确地反映出无菌灌装过程的污染情况及问题。
2.目的:通过培养基无菌灌装模拟试验,来确认在冻干粉针剂灌装过程中所采用的各种方法和各种规程,防止微生物污染的水平达到可接受的合格标准的能力,或提供保证所生产产品的无菌性的可信限度达到可接受的合格标准的证据,为今后对粉针车间进行冻干粉针剂灌装作业管理确定依据,即通过对经过培养的灌装样品进行检查并对结果进行分析解读可以综合评估无菌工艺的可靠性,借以确定实际生产中产品被污染的概率,确保无菌产品的无菌性。
3.范围:此验证方案适用于粉针车间,非最终灭菌的无菌生产工艺模拟试验。
4.依据:药品生产质量管理规范》2022年修订版附录1:无菌药品生产;《中国药典》2022年版二部附录无菌检查;GMP指南5.责任:质量部、生产部、质检科、粉针车间、设备部等部门负责本试验的执行、分析及报告。
![无菌模拟灌装工艺验证[指南]](https://uimg.taocdn.com/f74cc6ae6c85ec3a86c2c524.webp)
无菌工艺模拟验证-培养基灌装试验王新峰QA/QC 厂房设施人员灭菌工艺无菌保证培养基灌装HVAC,水操作规程日常监控EM&PM内容1.培养基灌装的目的2.法规要求3.不同制剂工艺的培养基灌装(液体、冻干产品,干粉分装产品)4.风险分析5.实验设计6.审计要点培养基灌装试验的定义定义:培养基灌装-采用培养基代替产品,按照正常生产的程序来进行无菌灌装工艺验证。
培养基灌装试验目的目的:–评估在既定无菌生产环境和过程控制条件下生产无菌产品的能力–证明指定的无菌工艺设计和变更是否可行–证明无菌工艺过程中的相关操作是否可行–评估无菌工艺人员的操作水平(资格确认组成部分)– QAR调查的手段–证明符合cCMP的要求–发现无菌工艺过程中潜在的微生物污染因素培养基灌装试验应用范围•无菌药品和生物制剂的生产•用无菌工艺进行医疗器械,人和动物保健品的生产法规要求2010GMP•第四十七条无菌生产工艺的验证应当包括培养基模拟灌装试验。
•应当根据产品的剂型、培养基的选择性、澄清度、浓度和灭菌的适用性选择培养基。
应当尽可能模拟常规的无菌生产工艺,包括所有对无菌结果有影响的关键操作,及生产中可能出现的各种干预和最差条件。
•培养基模拟灌装试验的首次验证,每班次应当连续进行3次合格试验。
空气净化系统、设备、生产工艺及人员重大变更后,应当重复进行培养基模拟灌装试验。
培养基模拟灌装试验通常应当按照生产工艺每班次半年进行1次,每次至少一批。
•培养基灌装容器的数量应当足以保证评价的有效性。
批量较小的产品,培养基灌装的数量应当至少等于产品的批量。
培养基模拟灌装试验的目标是零污染,应当遵循以下要求:•(一)灌装数量少于5000支时,不得检出污染品。
•(二)灌装数量在5000至10000支时:•1.有1支污染,需调查,可考虑重复试验;•2.有2支污染,需调查后,进行再验证。
•(三)灌装数量超过10000支时:•1.有1支污染,需调查;•2.有2支污染,需调查后,进行再验证。

培养基模拟灌装验证文件编码VPZ17001 颁发部门制定部门:____________ 制定人:_________ 日期:_________ _________ 日期:_____________ 审核部门:审核人:日期:日期:批准人:日期:生效日期:年月日验证小组人员名单培养基模拟灌装验证方案文件编码 颁发部门 制定部门: 制定人: 日期: 日期: 审核部门:审核人:日期:日期:批准人: ________________ 日期: _____________ 生效日期: ____________ 年 _____ 月 ____ 日 分发部门质量管理中心 [V]质量保证部 [] 质量控制部 [V] 设备工程部 [] 采 购 部[] 财务部[]研发 部 []销售 售部[]综合无菌 []制剂车间2验证目的 3适用范围培训部门:___________培训岗位: ___________________________________验证领导小组会签 项目负责人: 验证协调员:QC 负责人:质量部负责人: 生产部负责人: 工程部负责人: 变更历史 版本号修订原因与内容目录日期: ______________ 日期: ________________ 日期: _______________ 日期: _______________ 日期: ________________ 日期: _______________修订后版本号 生效日期4相关部门职责5验证条件6验证引用的文件-7严并甘7培养基8培养基模拟灌装试验条件9培养基模拟灌装试验的频率10培养基模拟灌装量和灌装数量的确定11培养基模拟灌装最差条件的设计12培养基配制和无菌灌装操作过程13取样计划14试验样品的培养15试验结果评价16环境监控和微生物限度控制17清场与清洁18培养基灌装过程监控记录19偏差调差20纠偏措施21异常情况处理程序22变更23拟定再验证周期24验证结果评定与结论附录附录1:人员培训附录2:系统验证及设备验证确认附录3:纯化水检验报告单附录4:注射用水检验报告单附录5:环境监测报告单附录6:胰酪胨大豆肉汤培养基适应性实验结果附录7:胰酪胨大豆肉汤培养基灵敏度检查结果附录8培养基及内包材确认附录9:最差条件确认附录10:内包材检验结果附录11:未参加培养灌装瓶原因说明附录12: 培养基的培养观察记录附录13: 培养基的培养阳性结果和培养基灌装失败情况说明附录14:培养基灌装过程中监控统计表附录15:灌装生产结束清洁记录附录16:质控过程监控产品基本信息:1概述培养基模拟灌装主要用的是胰酪胨大豆肉汤培养基,适用于黑龙江天龙药业江北新厂滴眼剂车间生产线。

