过氧化物酶活性测定
- 格式:doc
- 大小:27.00 KB
- 文档页数:2

一、实验目的了解过氧化物酶(POD)在植物生理学中的重要作用,掌握测定POD活性的方法,并分析不同因素对POD活性的影响。
二、实验原理过氧化物酶是一种广泛存在于植物组织中的酶,能够催化过氧化氢(H2O2)分解为水(H2O)和氧气(O2)。
在实验中,通过测定在一定时间内POD分解H2O2产生氧气的量,来评价POD的活性。
反应方程式如下:2H2O2 → 2H2O + O2本实验采用愈创木酚法测定POD活性。
愈创木酚在POD催化下被氧化,生成对苯醌,进而与氯化铁形成紫色络合物,通过测定紫色络合物的吸光度变化来反映POD的活性。
三、实验材料与仪器1. 实验材料:- 植物叶片(如马铃薯、菠菜等)- 过氧化氢(H2O2)- 愈创木酚- 氯化铁- 磷酸氢二钠(Na2HPO4)- 磷酸氢钠(NaH2PO4)- pH计- 离心机- 分光光度计- 研钵- 试管- 移液器- 电子天平2. 实验试剂:- 0.1 M磷酸盐缓冲液(pH 7.0)- 0.1 M H2O2溶液- 0.5 M愈创木酚溶液- 0.1 M氯化铁溶液四、实验步骤1. 酶液提取:将植物叶片洗净、剪碎,加入预冷的磷酸盐缓冲液,在研钵中研磨成匀浆。
将匀浆液转移至离心管中,4℃、12,000 rpm离心10分钟,取上清液即为酶液。
2. 测定酶活性:取5支试管,编号为1-5,分别加入以下试剂:- 空白组:0.1 M磷酸盐缓冲液1.0 mL、0.1 M H2O2溶液1.0 mL、0.5 M愈创木酚溶液1.0 mL- 实验组:0.1 M磷酸盐缓冲液1.0 mL、0.1 M H2O2溶液1.0 mL、0.5 M愈创木酚溶液1.0 mL、酶液0.1 mL将各试管混匀,置于37℃恒温水浴中保温5分钟。
取出试管,立即放入冰浴中终止反应。
使用分光光度计在波长560 nm处测定各试管吸光度。
3. 计算酶活性:以空白组吸光度为基准,计算各实验组吸光度变化值(ΔA)。
根据下列公式计算酶活性:酶活性(U/g·min)= ΔA × 0.05 × 10^3 / 酶液浓度五、结果与分析1. 不同植物叶片POD活性比较:实验结果显示,不同植物叶片的POD活性存在差异。
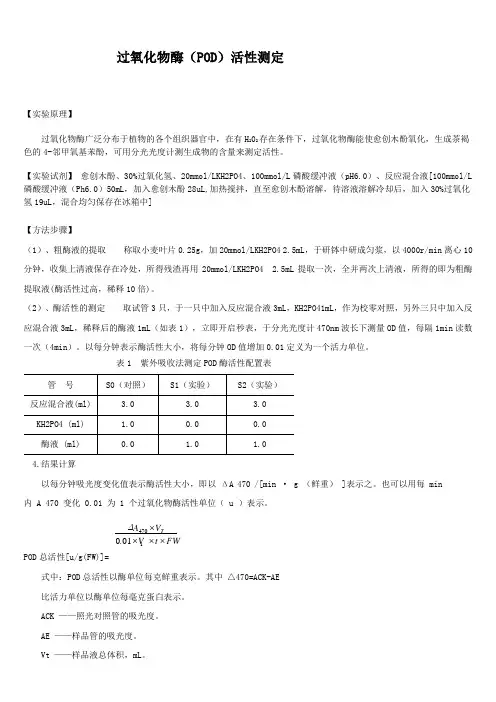
过氧化物酶(POD )活性测定【实验原理】过氧化物酶广泛分布于植物的各个组织器官中,在有H 202存在条件下,过氧化物酶能使愈创木酚氧化,生成茶褐色的4-邻甲氧基苯酚,可用分光光度计测生成物的含量来测定活性。
【实验试剂】 愈创木酚、30%过氧化氢、20mmol/LKH2PO4、100mmol/L 磷酸缓冲液(pH6.0)、反应混合液[100mmol/L 磷酸缓冲液(Ph6.0)50mL ,加入愈创木酚28uL,加热搅拌,直至愈创木酚溶解,待溶液溶解冷却后,加入30%过氧化氢19uL ,混合均匀保存在冰箱中]【方法步骤】(1)、粗酶液的提取 称取小麦叶片0.25g ,加20mmol/LKH2PO4 2.5mL ,于研钵中研成匀浆,以4000r/min 离心10分钟,收集上清液保存在冷处,所得残渣再用20mmol/LKH2PO4 2.5mL 提取一次,全并两次上清液,所得的即为粗酶提取液(酶活性过高,稀释10倍)。
(2)、酶活性的测定 取试管3只,于一只中加入反应混合液3mL ,KH2PO41mL ,作为校零对照,另外三只中加入反应混合液3mL ,稀释后的酶液1mL (如表1),立即开启秒表,于分光光度计470nm 波长下测量OD 值,每隔1min 读数一次(4min )。
以每分钟表示酶活性大小,将每分钟OD 值增加0.01定义为一个活力单位。
表1 紫外吸收法测定POD 酶活性配置表4.结果计算以每分钟吸光度变化值表示酶活性大小,即以 ΔA 470 /[min · g (鲜重) ]表示之。
也可以用每 min内 A 470 变化 0.01 为 1 个过氧化物酶活性单位( u )表示。
POD 总活性[u/g(FW)]=式中:POD 总活性以酶单位每克鲜重表示。
其中 △470=ACK-AE比活力单位以酶单位每毫克蛋白表示。
ACK ——照光对照管的吸光度。
AE ——样品管的吸光度。
Vt ——样品液总体积,mL 。

过氧化物酶活性的测定实验报告实验名称:过氧化物酶活性的测定实验实验目的:1. 了解过氧化物酶(CAT)的性质及其在生物体内的作用;2. 学习如何测定CAT活性。
实验原理:CAT是一种重要的氧化酶,在生物体内主要负责清除细胞内的过氧化氢(H2O2)。
CAT能够将H2O2分解为水和氧,从而减少H2O2引起的细胞损伤。
因此,CAT的活性是衡量生物体抵抗氧化损伤能力的重要指标。
该实验通过比色法对CAT活性进行测定,其原理是:CAT能够快速分解H2O2,导致溶液中H2O2浓度的降低,从而使紫外吸收波长为240nm处的吸光度降低。
实验步骤:1.制备1mg/ml的CAT标准溶液;2.制备一定浓度的H2O2溶液;3.将CAT标准溶液和H2O2溶液分别稀释为不同浓度;4.将待测样品(如动物组织、血清等)加入混合液中,使得CAT参与H2O2的分解反应;5.反应10min后,加入硫酸铨(K2Cr2O7)溶液并混匀,其中硫酸铨是一种催化剂,能够加速反应速度;6.反应后,在240nm处测定溶液的吸光度;7.根据不同CAT标准溶液的吸光度值,绘制标准曲线;8.根据待测样品的吸光度值,利用标准曲线计算出CAT的活性。
实验结果:利用如上实验步骤,我们测得样品A的吸光度为0.56,样品B的吸光度为0.36,样品C的吸光度为0.22。
依据标准曲线的测定结果,我们可分别计算出样品A、B、C的CAT活性分别为12.3、8.4、5.2 U/g。
实验结论:本实验采用比色法测定了不同样品中CAT的活性。
结果表明,样品A的CAT活性最高,样品C的CAT活性最低。
通过该实验,我们可以了解CAT的性质及其在生物体内的作用,同时也掌握CAT活性的测定方法。

过氧化物酶活性测定
过氧化物酶(peroxidase)是一类广泛存在于各种生物中的酶。
它们能够催化过氧化物与底物之间的氧化还原反应。
此类酶有多种生物功能,其中最重要的是用于废弃物的代谢和细胞保护。
在工业和农业领域中,过氧化物酶也常被用作催化剂。
因此,对于过氧化物酶的活性测定十分重要。
传统的过氧化物酶活性测定方法主要包括光谱分析法、吸光度法、滴定法、电化学法等。
今天我们主要介绍光谱分析法的原理和步骤。
过氧化物酶在酸性pH下的催化活性主要是由其含有的含铁金属离子(Fe3+)决定的。
Fe3+构成的氧桥结构能够与底物发生氧化还原反应,同时产生吸收峰。
因此,利用曲线拟合的方法可以测定样品中过氧化物酶的活性。
具体操作步骤如下:
1. 处理样品。
将待测样品加入一定比例的磷酸盐缓冲液(pH 5.0)。
若含有颜色物质需添加过滤效果的吸附剂。
2. 加入反应液。
向样品中加入过氧化氢,使其浓度为0.1%。
3. 反应后读取吸收度。
反应结束后,利用紫外-可见光谱仪读取其吸收值。
4. 分析数据。
根据吸收峰的强度和波长,利用标准曲线计算出过氧化物酶的活性。
总之,过氧化物酶活性的测定对于研究生物学和工业化学等领域都具有重要的意义。
随着科学技术的不断发展,相信在未来,这一领域的研究也将不断深入,为我们带来更多的新发现和应用。

实验六:过氧化物酶活性的测定左哥一、实验目的:过氧化物酶是植物体内重要的呼吸酶类,其活性高低与酶类物质代谢,植物抗性密切相关。
通过实验掌握提取POD和测定其活性方法和原理。
二、实验原理:过氧化物酶催化H2O2氧化酶类,生成醌类化合物,此化合物进一步缩合或与其它分子缩合,产生颜色较深产物。
本实验以愈创木酚为底物,过氧化物酶催化H2O2将愈创木酚氧化成茶褐色产物,次产物在470nm波长处有最大吸收峰,故可通过测定470nm波长下的吸收光度变化得知过氧化物酶的活性。
三、材料与试剂材料:马铃薯试剂:20m mol/L KH2PO4,反应混合液四、方法步骤:1、酶液制备:称取材料1.079g,加入20m mol/L KH2PO4 5ml,于研钵中研磨成匀浆,在3000r/min,下离心10min,上清液转入25ml,容量瓶,残渣再用5ml, KH2PO4,提取一次,定容,混匀,贮于冷凉处备用。
2、比色测定:光径1cm比色杯两只,1只先加1ml KH2PO4,再加3ml混合液作参比液;另一只加1ml,酶液,3ml混合液,立即计时并置于分光光度计中,在470nm下测定光密度,每隔1min读数一次,连续测8min,每次测定前重新对照校准。
五、实验结果酶活力(0.01 A470/L)=(A2-A1)/0.01(t2-t1)*(V2/V1)=328.2μ酶的比活力(μ/g)=酶活力/样品重=304.2μ/g实验七:种子生活力快速测定一、实验目的:种子生活力即种子发芽潜力,是鉴定种子力量研究种子储藏生理的重要指标,本实验运用TTC,红墨水发快速测定种子生活力。
二、实验原理:1、TTC法:有生活力的种子呼吸作用产生的NADH能还原TTC,生产的红色的TPE,将胚染成红色,无生活力的种子,无呼吸代谢活动,不能还原TTC,肧不着色。
2、红墨水法:植物活细胞的原生质膜有选择透性,某些染料分子不能透过。
如红墨水,因而不能将种肧染色,而死的种肧,其细胞膜结果破坏,选择透性丧失,因而染料分子能透过膜进入细胞将种肧染色。

实验五_过氧化物酶酶活性的测定一、实验原理1. 过氧化物酶(POD)在植物生长过程中发挥重要作用。
在压力、紫外线辐射、微生物侵入和病原体感染等外界刺激下,植物组织中的过氧化物酶活性会显著增加,以保护植物免遭伤害。
2. 过氧化物酶是一种氧化酶,催化产生氧气的反应(如下):ROOR′+ 酶———> R′OH + O23. 过氧化物酶活性的测定实验基于上述反应,利用巴尔的显色方法测定过氧化物酶催化下的氧化反应速率。
二、实验步骤1. 将100mL的3% H2O2(v/v)制成浓度为60mmol/L的过氧化氢溶液。
2. 按0.5mL、1mL、1.5mL、2mL、2.5mL 5个等份,取出浓度分别为6、12、18、24、30mmol/L的H2O2溶液,放入5个试管中。
4. 将1mL的20mg/mL酶溶液加入中等浓度(12mmol/L)的H2O2溶液中,混合均匀。
缓慢倾斜试管,使溶液彻底混合。
5. 取出一根手指,将其浸泡于硫酸铁铵溶液中。
将试管倾斜,瓶口与硫酸铁铵溶液接触,放入深100°C的水浴中加热2min。
将溶液混合均匀。
6. 将试管移出水浴,冷却到室温后,再加入1mL的硼酸缓冲液,混合均匀。
7. 测定吸收值(深紫色的铁化合物阴离子形成)。
利用光度计在546nm处测量。
8. 按照如上步骤分别测定不同浓度下的H2O2溶液。
三、结果分析1. 计算各试管中产生的氧气量,并绘制曲线(以5mmol/L,10mmol/L,15mmol/L,20mmol/L,25mmol/L的浓度为横坐标)。
2. 计算过氧化物酶活性(OD/min/mg)。
四、实验注意事项1. 检查瓶塞和试管,确保没有损坏。
2. 操作过程中,需严格按照试剂用量来添加试剂。
3. 热水浴器的温度应为100°C。
4. 硫酸铁铵溶液应略微加热一会儿,以充分溶解。
5. 实验过程中避免强光照射。

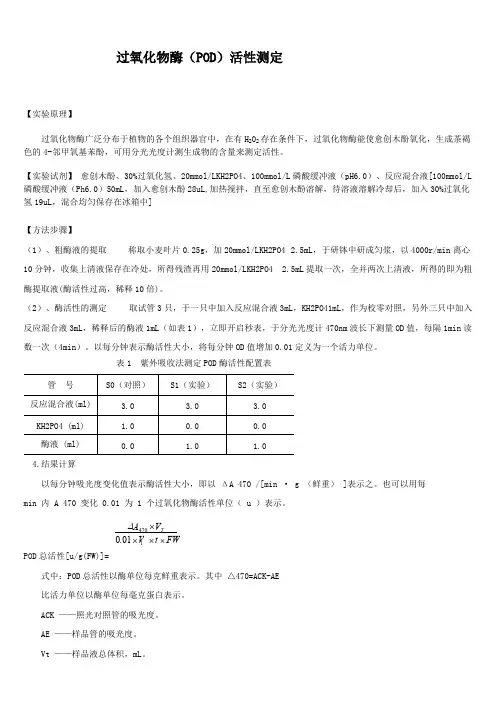
过氧化物酶(POD)活性测定【实验原理】过氧化物酶广泛分布于植物的各个组织器官中,在有H202存在条件下,过氧化物酶能使愈创木酚氧化,生成茶褐色的4-邻甲氧基苯酚,可用分光光度计测生成物的含量来测定活性。
【实验试剂】愈创木酚、30%过氧化氢、20mmol/LKH2PO4、100mmol/L磷酸缓冲液(pH6.0)、反应混合液[100mmol/L 磷酸缓冲液(Ph6.0)50mL,加入愈创木酚28uL,加热搅拌,直至愈创木酚溶解,待溶液溶解冷却后,加入30%过氧化氢19uL,混合均匀保存在冰箱中]【方法步骤】(1)、粗酶液的提取称取小麦叶片0.25g,加20mmol/LKH2PO4 2.5mL,于研钵中研成匀浆,以4000r/min离心10分钟,收集上清液保存在冷处,所得残渣再用20mmol/LKH2PO4 2.5mL提取一次,全并两次上清液,所得的即为粗酶提取液(酶活性过高,稀释10倍)。
(2)、酶活性的测定取试管3只,于一只中加入反应混合液3mL,KH2PO41mL,作为校零对照,另外三只中加入反应混合液3mL,稀释后的酶液1mL(如表1),立即开启秒表,于分光光度计470nm波长下测量OD值,每隔1min读数一次(4min)。
以每分钟表示酶活性大小,将每分钟OD值增加0.01定义为一个活力单位。
表1 紫外吸收法测定POD酶活性配置表管号S0(对照)S1(实验)S2(实验)反应混合液(ml) 3.0 3.0 3.0KH2PO4 (ml) 1.00.00.0酶液 (ml)0.0 1.0 1.04.结果计算以每分钟吸光度变化值表示酶活性大小,即以ΔA 470 /[min · g (鲜重) ]表示之。
也可以用每min 内 A 470 变化 0.01 为 1 个过氧化物酶活性单位( u )表示。
POD总活性[u/g(FW)]=FWtV.VA T⨯⨯⨯⨯147001∆式中:POD总活性以酶单位每克鲜重表示。
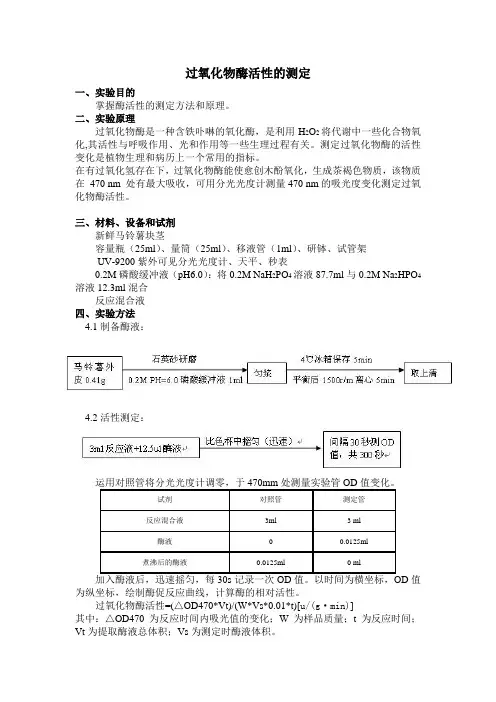
过氧化物酶活性的测定一、实验目的掌握酶活性的测定方法和原理。
二、实验原理过氧化物酶是一种含铁卟啉的氧化酶,是利用H2O2将代谢中一些化合物氧化,其活性与呼吸作用、光和作用等一些生理过程有关。
测定过氧化物酶的活性变化是植物生理和病历上一个常用的指标。
在有过氧化氢存在下,过氧化物酶能使愈创木酚氧化,生成茶褐色物质,该物质在470 nm 处有最大吸收,可用分光光度计测量470 nm的吸光度变化测定过氧化物酶活性。
三、材料、设备和试剂新鲜马铃薯块茎容量瓶(25ml)、量筒(25ml)、移液管(1ml)、研钵、试管架UV-9200紫外可见分光光度计、天平、秒表0.2M磷酸缓冲液(pH6.0):将0.2M NaH2PO4溶液87.7ml与0.2M Na2HPO4溶液12.3ml混合反应混合液四、实验方法4.1制备酶液:4.2活性测定:值为纵坐标,绘制酶促反应曲线,计算酶的相对活性。
过氧化物酶活性=(△OD470*Vt)/(W*Vs*0.01*t)[u/(g·min)]其中:△OD470为反应时间内吸光值的变化;W为样品质量;t为反应时间;Vt为提取酶液总体积;Vs为测定时酶液体积。
聚丙烯酰胺凝胶垂直板电泳分离种子蛋白质一、实验目的学习聚丙烯酰胺凝胶电泳的原理,掌握聚丙烯酰胺凝胶垂直板电泳的操作技术。
二、实验原理SDS-聚丙烯酰胺凝胶电泳,是在聚丙烯酰胺凝胶系统中引进SDS(十二烷基磺酸钠), SDS能断裂分子内和分子间氢键,破坏蛋白质的二级和三级结构,强还原剂能使半胱氨酸之间的二硫键断裂,蛋白质在一定浓度的含有强还原剂的SDS溶液中,与SDS分子按比例结合,形成带负电荷的SDS-蛋白质复合物,这种复合物由于结合大量的SDS,使蛋白质丧失了原有的电荷状态形成仅保持原有分子大小为特征的负离子团块,从而降低或消除了各种蛋白质分子之间天然的电荷差异,由于SDS与蛋白质的结合是按重量成比例的,因此在进行电泳时,蛋白质分子的迁移速度取决于分子大小.当分子量在15KD到200KD之间时,蛋白质的迁移率和分子量的对数呈线性关系,符合下式:logMW=K-bX,式中:MW为分子量,X为迁移率,k,b 均为常数,若将已知分子量的标准蛋白质的迁移率对分子量对数作图,可获得一条标准曲线,未知蛋白质在相同条件下进行电泳,根据它的电泳迁移率即可在标准曲线上求得分子量,从而根据分子量将混合蛋白质分离开。

实验29 过氧化氢酶活性测定(高锰酸钾滴定法)过氧化氢酶普遍存在于植物的所有组织中,其活性与植物的代谢强度及抗寒、抗病能力有一定关系,故常加以测定。
一、原理过氧化氢酶(catalase)属于血红蛋白酶,含有铁,它能催化过氧化氢分解为水和分子氧,在此过程中起传递电子的作用,过氧化氢则既是氧化剂又是还原剂。
可根据H2O2的消耗量或O2的生成量测定该酶活力大小。
在反应系统中加入一定量(反应过量)的过氧化氢溶液,经酶促反应后,用标准高锰酸钾溶液(在酸性条件下)滴定多余的过氧化氢。
即可求出消耗的H2O2的量。
二、材料、仪器设备及试剂(一)材料:小麦叶片(二)仪器设备:1. 研钵;2. 三角瓶;3. 酸式滴定管;4. 恒温水浴;5. 容量瓶。
(三)试剂:1. 10%H2SO4;2. 0.2 mol/L pH7.8磷酸缓冲液;3. 0.1mol/L 高锰酸钾标准液称:取KMnO4(A R)3.1605g,用新煮沸冷却蒸馏水配制成1000ml,再用0.1mol/L 草酸溶液标定;4. 0.1mol/L H2O2市售30%H2O2大约等于17.6mol/L,取30%H2O2溶液5.68ml,稀释至1000ml,用标准0.1mol/L KMnO4溶液(在酸性条件下)进行标定;5. 0.1mol/L 草酸:称取优级纯H2C2O4.2H2O 12.607g,用蒸馏水溶解后,定容至1000ml。
三、实验步骤(一)酶液提取:取小麦叶片2.5g加入pH7.8的磷酸缓冲溶液少量,研磨成匀浆,转移至25ml容量瓶中,用该缓冲液冲洗研钵,并将冲洗液转至容量瓶中,用同一缓冲液定容,4000rpm 离心15min,上清液即为过氧化氢酶的粗提液。
(二)取50ml三角瓶4个(两个测定,另两个为对照),测定瓶加入酶液2.5ml,对照加煮死酶液2.5ml,再加入2.5ml 0.1mol/L H2O2,同时计时,于30℃恒温水浴中保温10min,立即加入10%H2SO42.5ml。

过氧化物酶活性的测定POD一、原理: 过氧化物酶催化过氧化氢氧化酚类的反应,产物为醌类化合物,此化合物进一步缩合或与其他分子缩合,产生颜色较深的化合物。
本实验以邻甲氧基苯酚(即愈创木酚)为过氧化物酶的底物,在此酶存在下,H 2O 2可将邻甲氧基苯酚氧化成红棕色的4-邻甲氧基苯酚红棕色的物质可用分光光度计在470nm 处测定其消光值,即可求出该酶的活性。
,二、实验准备仪器:分光光度计、离心机、秒表、天平、研钵、磁力搅拌器试剂:愈创木酚、30%H 2O 2、0.2mol/L 磷酸缓冲液(7.8)、0.1mol/L 磷酸缓冲溶液(PH6.0,见附录) 反应混合液[100mmol/L 磷酸缓冲溶液(PH6.0)50ml ,加入愈创木酚28μl ,于磁力搅拌器上加热搅拌,直至愈创木酚溶解、待溶液冷却后,加入(待溶液冷却后再加入,否则引起分解)30%H 2O 2 19μl ,混合均匀,保存于冰箱中。
]三、步骤:1、粗酶液的提取:称取植物材料0.4-0.5g ,加磷酸缓冲液(7.8)5ml (分几次加入),于研钵中研磨成匀浆,以8000r/min 离心10min ,收集上清液于冷处(冰箱4度保存)。
2、酶活性的测定:一个试管入反应混合液3ml ,磷酸缓冲液(7.8) 1ml ,作为校零对照,另外加入反应混合液3ml ,上述酶液1ml (龙麦26酶液稀释10倍,克旱16酶液稀释15倍),立即开启秒表计时,于470nm 测OD 值,每隔15秒读1次值,读45秒,以为每15秒钟OD 变化值测酶活性的大小,以△OD/min.mg 蛋白质表示。
四、计算公式W t t ⋅⋅⋅∆=01.0V VA 活性POD 470 ΔA 470:反应时间内吸光值的变化W :样品重量V :提取液总体积,即5mlVt :测定时所用体积,即1mlt :反应时间注意:一般来说,都需要稀释,如果酶液稀释了,应在计算时乘上相应的倍数。
——张志良,瞿伟菁,P 123-124,2004高教版《植物生理学实验指导》——李玲主编,P 97-98,科学出版社,2009,《植物生理学模块实验指导》磷酸缓冲液配置A 0.2mol/l NaH2PO4 27.8g NaH2PO4•H2O 1000mlB 0.2mol/l Na2HPO4 71.7g Na2HPO4•12H2O 1000mlA(ml) B(ml)PH7.8 8.5 91.5200mlPH6.0 87.7 12.3。
过氧化物酶活性的测定实验报告过氧化物酶活性的测定实验报告引言:过氧化物酶(peroxidase)是一类广泛存在于生物体内的酶,具有氧化还原催化作用。
它能够催化过氧化物的分解,将有害的过氧化物转化为无害的物质,起到保护生物体的作用。
本实验旨在通过测定过氧化物酶活性的方法,了解该酶在不同条件下的活性变化。
材料与方法:1. 实验材料:- 过氧化氢(H2O2)溶液- 过氧化苯胺(TMB)溶液- 过氧化物酶提取液- 磷酸盐缓冲液(pH 6.0)- 96孔微孔板- 酶标仪2. 实验步骤:1) 在96孔微孔板中加入100μL过氧化物酶提取液;2) 加入100μL磷酸盐缓冲液和100μL过氧化苯胺溶液;3) 加入100μL过氧化氢溶液;4) 快速混匀,放置在酶标仪中;5) 设置酶标仪的波长为450nm,记录吸光度的变化;6) 每隔10秒记录一次吸光度值,持续测定3分钟。
结果与讨论:实验结果显示,随着时间的推移,吸光度值逐渐增加,说明过氧化物酶催化反应正在进行。
吸光度的变化趋势反映了过氧化物酶的活性。
进一步分析发现,在实验开始时,吸光度值的增加速度较快,随后逐渐减缓,最终趋于平稳。
这说明过氧化物酶的活性在反应初期较高,随着反应的进行,底物浓度逐渐降低,酶的反应速率也随之降低。
这种现象与酶的底物浓度和酶-底物复合物的形成有关。
此外,我们还进行了不同条件下过氧化物酶活性的比较。
将实验分为两组,分别在室温和低温条件下进行。
结果显示,在室温下,酶的活性较高,吸光度值增加的速度更快。
而在低温条件下,酶的活性明显降低,吸光度值的增加速度也较慢。
这表明过氧化物酶的活性受到温度的影响,适宜的温度有利于酶的催化活性。
结论:通过本实验的测定,我们成功地测定了过氧化物酶的活性,并观察到了其在不同条件下的活性变化。
实验结果表明,过氧化物酶的活性受到底物浓度和温度的影响。
在反应初期,酶的活性较高,随着反应进行,活性逐渐降低。
适宜的温度有利于酶的催化活性。
实验六过氧化物酶活性的测定(比色法)过氧化物酶(peroxidase)是广泛存在于植物、动物和微生物体内的一种酶类。
它可以光催化、热催化或金属离子诱导形式存在。
过氧化物酶具有良好的实用性,因为它可以用于许多领域的生物学研究,例如生物化学、分子生物学和环境科学等领域。
本实验采用比色法测定过氧化物酶的活性,其原理是利用二氧化氢和过氧化氢作为试剂,测量其光吸光度能力。
其中,一种常用的受体是酚类化合物,如4-氨基联苯酚,其产生的有色化合物可以通过反应过程的光谱特性来检测光学密度变化。
实验原理当过氧化物酶在存在过氧化氢的情况下催化苯酚型受体的氧化反应时,产生的产物可在可见光区域吸收电磁能,并产生有色化合物。
比色法即是利用这种能力来检测催化作用在反应中的过氧化氢的活性。
该实验中,使用4-氨基联苯酚作为受体,在pH为6.0的琼脂糖基质中,在340nm处测量反应混合物的吸光度变化。
反应的一侧为过氧化氢,另一侧为受体,过氧化氢在过氧化物酶的催化下,氧化受体,产生的有色产物吸收可见光,从而形成比色反应。
过氧化氢的亲电性较大,能够与生物的活性系数发生相互作用。
因此,过氧化物酶的测量能力可以作为生物活性系数的一个指标。
实验材料1. 4-氨基联苯酚2. 过氧化氢4. 磷酸盐缓冲液(pH6.0)5. 琼脂糖实验步骤1. 将500μL的催化过程反应液与250μL的4-氨基联苯酚、250μL的磷酸盐缓冲液和50μL的琼脂糖混合,制备琼脂糖基质。
2. 分别添加20μL、40μL、60μL、80μL和100μL的过氧化物酶,混合后立即测量其吸光度。
3. 测量样品的吸光度变化,记录5次实验结果。
实验结果分析计算出反应液的吸光度,并绘制反应液中过氧化物酶催化下4-氨基联苯酚氧化反应过程的浓度关系曲线。
因为过氧化物酶的催化效率与其浓度成正比,所以可以用这种曲线来确定反应液中的过氧化物酶浓度。
实验注意事项1. 实验中的4-氨基联苯酚是有毒的,应严格遵守安全操作规程。
园艺学院设施201402李密实验三(一)过氧化物酶活性的测定(愈创木酚法)一、实验目的通过实验掌握提取POD和测定其活性的方法和原理。
二、实验原理以愈创木酚为底物,在过氧化物酶(POD)催化下,H2O2将愈创木酚氧化成茶褐色产物。
此产物在470nm波长处有最大光吸收值,故可通过测470nm波长下的吸亮度变化测定过氧化物酶的活性。
三、材料、设备和原理1.材料马铃薯块茎2.设备光亮度计、离心机、天平、研钵、容量瓶、量筒、试管、吸管3.试剂已配置好的反应混合液、20mmol/LKH2PO4、100mmol/L磷酸缓冲液四、操作方法1.酶液制备2.比色测定计算:酶活力(0.01A 470/min )=A2−A1(t2−t1)×0.01×D=0.875−0.385(7−2)×0.01×25 =245.0酶的比活力(μ/g )=酶活力(μ)样品重(g )或样品中蛋白质的含量(mg )=245.00.9956=246.08 六、讨论1、由于仪器较少,等待测POD 值的时间较长,且没有放在低温下保持。
导致酶活性的测定结果出现一定的偏差。
2、理论上POD 值与时间的关系曲线应为抛物线,但实际测出来的曲线大体为线性关系。
可能原因有①把酶液加入到3ml 反应混合液时,反应太快,待到1min 读取POD 值时,反应已经过了指数增长期,处于缓慢增长状态。
②离心出来的酶液在室温下放置时间过长。
(二)可溶性蛋白质含量的测定(考马斯蓝G -250法)一、实验目的掌握测量可溶性蛋白的方法及其原理。
二、实验原理可溶性蛋白质与考马斯蓝G -250反应生成青色产物,在595nm 波长有最大吸收峰,其颜色深浅与可溶性蛋白含量成正相关,可用分光亮度法测定可溶性蛋白的含量。
三、材料、设备和原理 1.材料马铃薯提取液2.设备分光亮度计、10ml 刻度试管、移液管3.试剂考马斯蓝G -250、100μg/ml 标准蛋白液 四、操作方法 1. 标准曲线制作2. 样品液测定试剂 0号 1号 2号 3号 4号 5号 标准蛋白体积/ml 0.00 0.20 0.40 0.60 0.80 1.00 蒸馏水体积/ml 1.00 0.80 0.60 0.40 0.20 0.00 考马斯蓝G -250/ml 5 5 5 5 5 5 蛋白质含量/ g20406080100取10ml 刻度试管6只以100μg 标准蛋白液为母液配制成0、20、40、60、80、100的系列浓度蛋白液 即:在6支试管中分别加蛋白液0、0.2、0.4、0.6、0.8、1.0ml,并加蒸馏水 在各试管中加考马斯蓝G -250,摇匀 在595nm 下,测定各管吸亮度 以蛋白含量为横轴,A595为纵轴,绘制标准曲线595计算:实验测得马铃薯提取液的吸亮度值为0.106由Y=0.0059x得x=0.106/0.0059 =17.97μg/ml蛋白含量=m w ▪1000×V 总V1=17.970.9956×1000×250.5=0.902 六、讨论1、如果要求严格,最好在试剂加入后的5~20min 内测定光吸收,因为这段时间内颜色是最稳定的。
过氧化物酶(POD)活性测定
一、原理:
过氧化物酶含铁,广泛存在于植物组织中,可催化过氧化氢氧化酚类,产物为醌类化合物,此化合物进一步缩合或与其他分子缩合,产生颜色较深的化合物。
本实验以邻甲氧基苯酚(即愈创木酚)为过氧化物酶的底物,当有H2O2 存在时,过氧化物酶可将邻甲氧基苯酚氧化成红棕色的4-邻甲氧基苯酚,其在470nm处有最大吸收峰,故可用分光光度计在470nm处测定其吸光值,即可求出该酶的活性。
二、实验准备:
仪器:分光光度计、离心机、秒表、研钵、磁力搅拌器、移液管、电子天平、冰箱、100ml 容量瓶、试管、胶头滴管、试管架、烧杯、吸水纸、比色皿、剪子
试剂:
0.05 mol/L愈创木酚;2%H2O2; pH 6.0的磷酸缓冲液;75%酒精;蒸馏水
试剂配制:
○1pH 6.0的磷酸缓冲液:0.2mol/l NaH2PO4 (27.6g NaH2PO4•H2O 用蒸馏水配成1000ml)取87.7ml和0.2mol/l Na2HPO4 (71.7g Na2HPO4•12H2O 或53.65g Na2HPO4•7H2O 用蒸馏水配成1000ml)取12.3ml后混合,用蒸馏水稀释至200ml即可。
○22%H2O2:取6.7ml 30%H2O2于烧杯中,再加入93.3mL蒸馏水(或加蒸馏水稀释至100mL),搅拌均匀。
○30.05 mol/L愈创木酚:准确称取6.2g愈创木酚,再用95%的乙醇配制定容至100ml即可。
三、步骤:
○1粗酶液的提取:称取一定质量的植物材料放入研钵中,加入提取液1 mL(pH 6.0的磷酸缓冲液),研磨,再加入9 mL提取液,将匀浆全部转入离心管中,于4 000 r/min 4 ℃离心10 min,上清液即为酶的粗提取液,收集上清液于冷处(冰箱4℃保存)。
○2酶活性的测定:将4 mL反应混合液( pH 6.0的磷酸缓冲液2 mL,酶液1 mL,0.05 mol/L 愈创木酚1 mL)和1 mL 2% H202加入试管中立即摇匀并迅速倒入比色皿中,于470 nm波长下用U 2800型紫外可见分光光度计比色,立刻记录吸光度值,以后每15 s记录1次,记录
2 min ,另外以缓冲液代替酶液作为较零对照组。
注意:反应混合液要在磁力搅拌器上加热搅拌,直至愈创木酚溶解、待溶液冷却后,加入H 2O 2 (待溶液冷却后再加入,否则引起分解),混合均匀后,保存于冰箱中。
四、计算公式
W t t ⋅⋅⋅
∆=01.0V V
A 活性POD 470 ΔA 470:反应时间内吸光值的变化
W :植物样品鲜重(g )
V :提取酶液总体积(ml )
Vt :测定时所用酶液体积(ml )
t :反应时间(min )
【0.01为以吸光度值(ΔA 470)变化0.01为1个酶活性单位(u)】
注意:一般来说,都需要稀释,如果酶液稀释了,应在计算时乘上相应的稀释倍数。