
植物叶绿素荧光成像技术在国内的应用(第四期)
植物叶绿素荧光成像技术作为最早实用化的叶绿素荧光成像技术,是目前世界上最权威、使用范围最广、种类最全面、发表论文最多的叶绿素荧光成像技术。涵盖了从叶绿体、单个细胞、微藻到叶片、果实、花朵,乃至整株植物和植物灌层,几乎可以测量所有的植物样品,甚至包括含有叶绿素的微生物和动物。
叶绿素荧光成像技术最早在21世纪初引进到国内,但一直到2010年后国内的科学家才在国际交流中逐渐发现这项技术的巨大价值,在短短数年中也利用这一技术发表了几十篇高水平SCI 文献。本期主要介绍目前叶绿素荧光成像技术在国内的应用情况。
一、 植物光合生理研究
叶绿素荧光可以直接反应植物光系统的生理状况,因此从叶绿素荧光技术发明之初,就被用于各种植物光合生理研究。
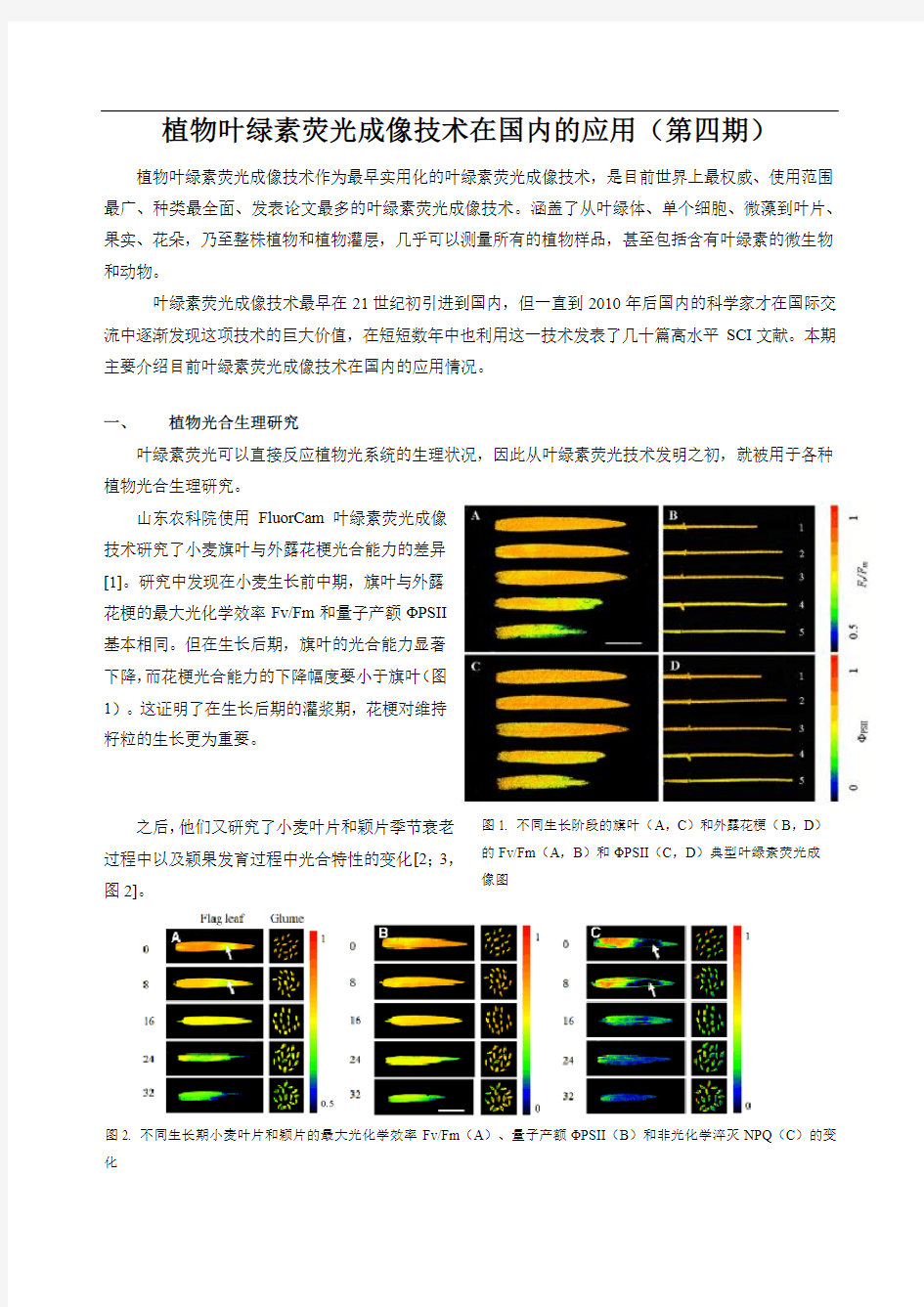
山东农科院使用FluorCam 叶绿素荧光成像技术研究了小麦旗叶与外露花梗光合能力的差异[1]。研究中发现在小麦生长前中期,旗叶与外露花梗的最大光化学效率Fv/Fm 和量子产额ΦPSII 基本相同。但在生长后期,旗叶的光合能力显著下降,而花梗光合能力的下降幅度要小于旗叶(图1)。这证明了在生长后期的灌浆期,花梗对维持籽粒的生长更为重要。
之后,他们又研究了小麦叶片和颖片季节衰老过程中以及颖果发育过程中光合特性的变化[2;3,图2]。
图2. 不同生长期小麦叶片和颖片的最大光化学效率Fv/Fm (A )、量子产额ΦPSII (B )和非光化学淬灭NPQ (C )的变
化
图1. 不同生长阶段的旗叶(A ,C )和外露花梗(B ,D )的Fv/Fm (A ,B )和ΦPSII (C ,D )典型叶绿素荧光成像图
二、植物生物/非生物逆境胁迫与抗逆性研究
由于几乎所有种类的生物/非生物逆境胁迫都会影响到植物光合系统的正常生理功能,而叶绿素荧光技术是公认的植物逆境光合功能研究最灵敏的无损探针。因此通过叶绿素荧光成像技术不但能反映植物受胁迫程度和抗逆能力的差异,而且能指明胁迫影响光合系统的具体机理过程。
1.养分亏缺
山东农业大学使用研究了两种玉米在不同施氮条件下光合特性的变化[4]。研究发现,施加氮肥使两个品种的最大光化学效率Fv/Fm和量子产额ΦPSII都有所升高,而ΦPSII的升高幅度要高于Fv/Fm,表明氮肥对PSII的实际功能活性更有作用。同时玉米品种HZ4荧光参数的升高幅度也要高于Q319,这应该是由于HZ4是一种低N效率的非持绿玉米(图3)。
图3. 氮对两种玉米品种造成影响的叶绿素荧光成像图
2.盐碱胁迫
山东农业大学使用研究发现S-adenosyl-L-methionine (SAM)基因过表达会显著增加在碱胁迫下的番茄的光合能力[5](图4)。
图4. 野生型和转基因番茄叶片在碱胁迫下的Fv/Fm荧光成像图
3.水分胁迫
山东农科院研究了不同灌溉方式对小麦光合特性的影响[6]。研究发现比起传统的漫灌,沟灌条件下的小麦叶片有更高的最大光化学效率Fv/Fm、量子产额ΦPSII、光化学淬灭qP和更低的非光化学淬灭NPQ(图5)。这说明沟灌给小麦提供了更好的土壤水分条件,从而使小麦叶片拥有了更强的光化学活性。
图5. 传统漫灌和沟灌条件下小麦的Fv/Fm、ΦPSII、qP和NPQ荧光成像图
国内还有其他院校使用开展了热胁迫、病害、重金属毒害、光质影响等多种胁迫研究[7;8;9;10]。
三、植物光合基因组学与分子生物学研究
植物光合作用可以说是植物对人类乃至整个生物圈最重要的功能,一方面为其他生物直接或间接地提供能量和食物,另一方面也在地球碳氧循环中发挥关键性作用。因此,对植物光合作用功能基因的研究,一直是植物基因组学与分子生物学研究的重中之重。而叶绿素荧光能直接反映相关功能基因的表型变化,所以几乎所有与光合基因相关的研究都要用叶绿素荧光技术来进行表型筛选、基因功能验证等方面的工作。
1. 从光合表型到基因功能
中国科学院植物研究所张立新研究员是最早将FluorCam 叶绿素荧光成像技术引入国内的科学家。中科院植物所光生物学重点实验室是国内植物光合基因相关研究最前沿的科研单位。FluorCam 叶绿素荧光成像技术引入后就立刻用于了光合相关基因功能与表型研究。
2006年,张立新研究团队就使用FluorCam 叶绿素荧光成像技术研究了拟南芥ppt1突变体光系统II 光化学能力的变化,进而证明了磷酸盐转运蛋白对维持叶片生长后期正常光合作用的重要性[11](图6)。
之后,植物所张立新团队和彭连伟团队都使用FluorCam 发表了多篇植物光合基因相关文献[12;13]。
彭连伟在研究NADH 脱氢酶复合体稳定性时[14],发现在50μmol photons /m2.s 的光强下,lhca5 lhca6 pgr5、lhca6 pgr5和crr4-2 pgr5拟南
芥突变体都产生了生长阻滞,并表现出了高叶绿素荧光(图7A ,B )。这表明了这些突变体的光合电子传递活性和NDH 活性都受到了抑制。进一步分析不同光强下的ΦPSII ,野生型、lhca5和lhca6突变体的ΦPSII 水平是相近的,这表明Lhca5和Lhca6在光合电子传递中都不是必需的(图7C )。而lhca6 pgr5和lhca5 lhca6 pgr5的ΦPSII 水平则显著降低,通过其他结果比对发现这是由于在低光照条件下,这些突变体的PSI 就受到了光抑制并出现了氧化应激反应。
在后续的研究中,彭连伟团队还使用FluorCam 发现了NdhV 亚基对NADH 脱氢酶复合体稳定性的重要作用[15]。其团队的张琳博士利用 封闭式荧光成像系统,从 T-DNA 插入或EMS 诱变的拟南芥突变体库中筛选光合电子传递调控的突变体,并重点研究了bfa3的功能,相关结果于 2016 年 4 月发表在国际学术期刊 Plant Physiology[16]。
图6. ppt1突变体和野生型的表型和叶绿素荧光成像图
图7. lhca5 lhca6 pgr5三突变体叶绿素荧光分析,A.可见表型;B.叶绿素荧光表型;C. ΦPSII测量
国内另一个应用FluorCam技术进行光合基因研究较为出色的单位是西北农林科技大学。他们引进仪器技术虽然较晚,但在购置开放式叶绿素荧光成像系统后很快就发表了2篇高水平文章,研究了多个关于拟南芥叶绿体发育和叶片颜色相关的基因功能[17;18](图8)。
图8. 拟南芥野生型与GTPase家族基因突变株的叶绿素荧光成像图
上海生命科学研究院青年研究组长、博士生导师Chanhong Kim 在苏黎世联邦理工学院、康奈尔大学博伊斯汤普森研究所工作期间就已经使用叶绿素荧光成像系统进行了大量的研究工作并在PNAS 、Plant Cell 发表多篇相关文献。2014年,Chanhong Kim 到上海生命科学研究院工作后立刻购置了一台封闭式叶绿素荧光/GFP 成像系统。他用这一系统一方面进行GFP 表达植株的快速筛选(图9),另一方面进行单线态氧和EXECUTER1介导信号在基粒中发生过程的研究,这一最新研究成果发表同样在2016年PNAS 上[19]。
沈阳农业大学也使用FluorCam 技术开展
了大白菜生长缓慢、类囊体减少的突变体光和特性的研究[20]。
2. 从基因功能到光合表型
在有的研究中,光合基因功能是通过其他方法基本上确定的。但这个基因表达出的表型是否符合预期,还是必须通过叶绿素荧光成像技术进行光合表型方面的验证。
中国农业大学与EcoLab 生态实验室合作,从黄瓜中克隆了紫黄质脱环氧化酶基因(CsVDE ),再将这一基因的反义片段转基因到拟南芥中[21]。发现在高光胁迫条件下,转基因拟南芥的叶绿素荧光参数非光化学淬灭(NPQ )比野生型显著降低,这证明了CsVDE 在叶黄素循环和PSII 光抑制敏感性上的重要作用(图10)。
图10. 野生型与转基因拟南芥在高光条件下的NPQ 成像图
四、 国际合作
由于叶绿素荧光成像技术引进到国内的时间较晚,国内科学家对这一技术的运用程度还低于欧美同
行。因此,很多国内的科学家目前是与国际上的知名科研院所开展合作,使用叶绿素荧光技术进行研究
图9. 使用FluorCam 获得的GFP 成像图,图中发出明亮颜色的拟南芥植株即为表达了GFP 的植株,其颜色越偏向红色,则表明其表达的GFP 更多,暗蓝色的植株即为没有表达GFP 的植株
工作并发表文章。比如浙江大学与德国康斯坦茨大学合作发表的使用FKM多光谱荧光动态显微成像系统(此系统应用了叶绿素荧光显微成像技术,康斯坦茨大学Kupper教授和PSI公司合作完善了这一技术,是国际上对这一技术应用最前沿的学者)研究了铜对海州香薷Elsholtzia splendens光合系统的毒害作用[22];华中农业大学、江西农业大学与德国洪堡大学等单位合作研究了病毒介导的豌豆基因沉默对四吡咯生物合成、叶绿体发育等造成的影响[23];内蒙古农业大学与捷克科学院等单位合作研究的芽单胞菌门含有叶绿体的稀有细菌的光合特性和相关基因研究[24;25];江苏农科院与英国诺丁汉大学合作研究的两种病原菌对不同小麦品系的侵害性[26]等。
参考文献:
1.Kong LA, et al. 2010. The structural and photosynthetic characteristics of the exposed peduncle of wheat
(Triticum aestivum L.): an important photosynthate source for grain–filling. BMC plant biology 10, 141
2.Kong LA, et al. 2015. Photochemical and antioxidative responses of the glume and flag leaf to seasonal
senescence in wheat. Frontiers in Plant Science, 6:358. doi: 10.3389/fpls.2015.00358
3.Kong LA, et al. 2016. Comparison of the photosynthetic characteristics in the pericarp and flag leaves during
wheat (Triticum aestivum L.) caryopsis development. Photosynthetica 54(1), 40-46
4.Li, G. et al. 2012. Effects of nitrogen on photosynthetic characteristics of leaves from two different stay-
green corn (Zea mays L.) varieties at the grain-?lling stage. Can. J. Plant Sci. 92, 671-680
5.Gong, B. et al. 2014. Overexpression of S-adenosyl-L-methionine synthetase increased tomato tolerance to
alkali stress through polyamine metabolism. Plant Biotechnology Journal, 12, 694–708
6.Kong LA, et al.2010. A root–zone soil regime of wheat: physiological and growth responses to furrow
irrigation in raised bed planting in Northern China. Agronomy Journal 102, 154 – 162
7.Feng B. et al. 2014. Effect of Heat Stress on the Photosynthetic Characteristics in Flag Leaves at the Grain‐
Filling Stage of Different Heat‐Resistant Winter Wheat Varieties. Journal of Agronomy and Crop Science 200(2), 143 – 155
8.周锦业,丁国昌,何荆洲,曹光球,李秀玲,卜朝阳. 2015. 不同光质对金线莲组培苗叶绿素含量及
叶绿素荧光参数的影响. 农学学报5(5),67-72
9.简敏菲,汪斯琛,余厚平,李玲玉,简美锋,余冠军.2016. Cd2+?Cu2+胁迫对黑藻(Hydrilla verticillata)
的生长及光合荧光特性的影响. 生态学报36(6)
10.郑国华, 潘东明, 牛先前& 方树民. 2010. 冰核细菌对低温胁迫下枇杷光合参数和叶绿素荧光参数
的影响. 中国生态农业学报18(6),1251 – 1255
11.Ma JF, Guo JK, Peng LW, Chen CY & Zhang LX, 2006. Decrease of photosystem ii photochemistry in
Arabidopsis ppt1 mutant is dependent on leaf age. Journal of integrative plant biology 48, 1409 – 1414 12.Sun X W, Wang L Y & Zhang LX, 2007. Involvement of DEG5 and DEG8 proteases in the turnover of the
photosystem II reaction center D1 protein under heat stress in Arabidopsis thaliana. Chinese Science Bulletin 52, 1742 – 1745
13.Chi W, et al.2008. The pentratricopeptide repeat protein DELAYED GREENING1 is involved in the
regulation of early chloroplast development and chloroplast gene expression in Arabidopsis. Plant physiology
147, 573 – 584
14.Peng L, & Shikanai, T. 2011. Supercomplex formation with photosystem I is required for the stabilization of
the chloroplast NADH dehydrogenase–like complex in Arabidopsis. Plant physiology 155, 1629 – 1639 15.Fan X, et al. 2015. The NdhV subunit is required to stabilize the chloroplast NADH dehydrogenase-like
complex in Arabidopsis. The Plant Journal , 82, 221–231
16.Zhang L, et al. 2016. Biogenesis Factor Required For ATP Synthase 3 Facilitates Assembly of the Chloroplast
ATP Synthase Complex. Plant Physiology 171, 1291-1306
17.Qi Y, et al. 2016. A Putative Chloroplast Thylakoid Metalloprotease VIRESCENT3 Regulates Chloroplast
Development in Arabidopsis thaliana. The Journal of Biological Chemistry 291, 3319-3332
18.Qi Y, et al. 2016. Mutations in circularly permuted GTPase family genes AtNOA1/RIF1/SVR10 and BPG2
suppress var2-mediated leaf variegation in Arabidopsis thaliana. Photosynthesis Research 127(3), 355-367 19.Wang LS, et al. 2016. Singlet oxygen- and EXECUTER1-mediated signaling is initiated in grana margins
and depends on the protease FtsH2. PNAS, DOI: 10.1073/pnas.1603562113
20.Zhang L, et al. 2016. Biogenesis Factor Required For ATP Synthase 3 Facilitates Assembly of the Chloroplast
ATP Synthase Complex. Plant Physiology 171, 1291-1306
21.Li X, et al.2013. Molecular Cloning and Characterization of Violaxanthin De–Epoxidase (CsVDE) in
Cucumber. PLoS ONE 8(5): 1-11
22.Peng H, et al. 2012. Differences in copper accumulation and copper stress between eight populations of
Haumaniastrum katangense, Environmental and Experimental Botany, 79: 58- 65
23.Luo T. et al. 2013. Virus-induced gene silencing of pea CHLI and CHLD affects tetrapyrrole biosynthesis,
chloroplast development and the primary metabolic network. Plant Physiology and Biochemistry 65, 17 – 26 24.Zeng Y,et al. 2014. Functional type 2 photosynthetic reaction centers found in the rare bacterial phylum
Gemmatimonadetes. PNAS, 111(21), 7795–7800
25.Zeng Y, et al. 2015. Characterization of the microaerophilic, bacteriochlorophyll a-containing bacterium
Gemmatimonas phototrophica sp. nov., and emended descriptions of the genus Gemmatimonas and Gemmatimonas aurantiaca. International Journal of Systematic and Evolutionary Microbiology, DOI:
10.1099/ijs.0.000272
26.Ren R, et al. 2015. Comparative aggressiveness of Microdochium nivale and M. majus and evaluation of
screening methods for Fusarium seedling blight resistance in wheat cultivars. Eur J Plant Pathol , 141, 281–294
第一节 叶绿素荧光参数及其意义 韩志国,吕中贤(泽泉开放实验室,上海泽泉科技有限公司,上海,200333) 叶绿素荧光技术作为光合作用的经典测量方法,已经成为藻类生理生态研究领域功能最强大、使用最 广泛的技术之一。由于常温常压下叶绿素荧光主要来源于光系统II 的叶绿素a ,而光系统II 处于整个光合 作用过程的最上游,因此包括光反应和暗反应在内的多数光合过程的变化都会反馈给光系统II ,进而引起 叶绿素a 荧光的变化,也就是说几乎所有光合作用过程的变化都可通过叶绿素荧光反映出来。与其它测量 方法相比,叶绿素荧光技术还具有不需破碎细胞、简便、快捷、可靠等特性,因此在国际上得到了广泛的 应用。 1 叶绿素荧光的来源 藻细胞内的叶绿素分子既可以直接捕获光能,也可以间接获取其它捕光色素(如类胡萝卜素)传递来 的能量。叶绿素分子得到能量后,会从基态(低能态)跃迁到激发态(高能态)。根据吸收的能量多少, 叶绿素分子可以跃迁到不同能级的激发态。若叶绿素分子吸收蓝光,则跃迁到较高激发态;若叶绿素分析 吸收红光,则跃迁到最低激发态。处于较高激发态的叶绿素分子很不稳定,会在几百飞秒(fs ,1 fs=10-15 s )内通过振动弛豫向周围环境辐射热量,回到最低激发态(图1)。而最低激发态的叶绿素分子可以稳定 存在几纳秒(ns ,1 ns=10-9 s )。 波长吸收荧光红 B 蓝 荧光 热耗散 最低激发态较高激发态基态吸收蓝光吸收红光能量A 图1 叶绿素吸收光能后能级变化(A )和对应的吸收光谱(B )(引自韩博平 et al., 2003) 处于最低激发态的叶绿素分子可以通过几种途径(图2)释放能量回到基态(韩博平 et al., 2003; Schreiber, 2004):1)将能量在一系列叶绿素分子之间传递,最后传递给反应中心叶绿素a ,用于进行光化 学反应;2)以热的形式将能量耗散掉,即非辐射能量耗散(热耗散);3)放出荧光。这三个途径相互竞 争、此消彼长,往往是具有最大速率的途径处于支配地位。一般而言,叶绿素荧光发生在纳秒级,而光化 学反应发射在皮秒级(ps ,1 ps=10-12 s ),因此在正常生理状态下(室温下),捕光色素吸收的能量主要用 于进行光化学反应,荧光只占约3%~5%(Krause and Weis, 1991; 林世青 et al., 1992)。 在活体细胞内,由于激发能从叶绿素b 到叶绿素a 的传递几乎达到100%的效率,因此基本检测不到 叶绿素b 荧光。在常温常压下,光系统I 的叶绿素a 发出的荧光很弱,基本可以忽略不计,对光系统I 叶 绿素a 荧光的研究要在77 K 的低温下进行。因此,当我们谈到活体叶绿素荧光时,其实指的是来自光系 统II 的叶绿素a 发出的荧光。
植物生理学实验 叶绿体色素的提取分离及其理化性质 姓名 学号 系别 班级 实验日期 同组姓名
摘要:为探究植物叶绿素理化性质,根据不同的叶绿体色素分子结构不同,在有机溶剂中的溶解性和吸附剂上的吸附性差异,本实验在提取菠菜叶片叶绿体色素(叶绿素和类胡萝卜素)后,利用纸层析法将不同的色素分离的方法,对植物叶绿素的理化性质进行观察与检验。 一、实验原理及实验目的 实验原理: 1、提取: 叶绿体中含有叶绿素(叶绿素a与b)和类胡萝卜素(胡萝卜素和叶黄素),这两类色素均不溶于水,而溶于有机溶剂,故常用乙醇、丙酮等有机溶剂提取。 2、分离: 当溶剂沿支持物不断向前推进时,由于叶绿体中不同色素分子结构不同,在两相(流动相与固定相)间具有不同的分配系数,因此它们移动速率不同。对叶绿体色素进行层析可将不同色素分离。 3、理化性质的观察: 叶绿素是一种二羧酸酯,在碱作用下,发生皂化反应;在弱酸作用下,叶绿素中镁可被氢原子取代而成为褐色的去镁叶绿素,后者遇铜则成为绿色的铜代叶绿素,叶绿素具有荧光,故从与入射光相垂直的方向观察叶绿素溶液呈血红色。叶绿素的化学性质不稳定,易受强光氧化,特别是当叶绿素与蛋白质分离后,破坏更快。 分子吸收光能后,从基态转变到激发态。叶绿素分子有两种单线激发态,对应两个主要的光吸收区。 分子在激发态停留的时间不超过数纳秒(10-9秒) 由激发态回到基态的过程称为衰变(Decay)。 叶绿素a:C 55H 72 O 5 N 4 Mg,MW=893.4891 叶绿素b:C 55H 70 O 6 N 4 Mg,MW=907.4727 胡萝卜素:C 40H 56 , MW= 536.8726 叶黄素:C 40H 56 O 2 , MW=568.8714 实验目的: 以植物叶片组织为材料,提取叶绿体色素;以纸层析法分离其成分;鉴定叶绿体色素的理化性质. 二、实验材料和方法 1、实验材料:菠菜 2、实验用具:天平、研钵、三角漏斗、滤纸、层析缸、毛细管、分光镜、量筒、烧杯、试 管等 3、实验试剂:丙酮、碳酸钙、层析液(石油醚:丙酮=25:3),20%KOH-甲醇、乙醚、1%HCl、 醋酸铜 三、实验步骤 1、叶绿体色素的提取 (1)取新鲜菠菜叶片2克,擦干,去中脉,剪碎放入研钵; (2)加入少许石英砂和CaCO 3 ,再加入无水丙酮10ml,研磨成匀浆,再加丙酮15ml; (3)用漏斗滤去残渣,得叶绿体色素提取液(置于暗处). 2、纸层析分离叶绿体色素 (1)层析样纸制备,将优质滤纸剪成3cm×9cm的长条,将一端剪成中央留约1cm×0.5cm的
FluorCam多光谱荧光成像技术(Multi-color FluorCam) 自上世纪90s年代PSI公司首席科学家Nedbal教授与公司总裁Trtilek博士等首次将PAM脉冲调制叶绿素荧光技术与CCD技术结合在一起,成功研制生产FluorCam叶绿素荧光成像系统(Nedbal等,2000)以来,FluorCam叶绿素荧光成像技术得到长足发展和广泛应用,先后有封闭式、开放式(包括标准版和大型版)、便携式叶绿素荧光成像系统,及显微叶绿素荧光成像系统、大型叶绿素荧光成像平台(包括移动式、样带式、XYZ三维扫描式等)等,近些年还进一步发展了PlantScreen植物表型成像分析平台(Phenotyping)(有传送带版、XYZ三维扫描版及野外版等)及多光谱荧光成像技术。 Multi-color FluorCam多光谱荧光成像技术包括多激发光-多光谱荧光成像技术和UV 紫外光激发多光谱荧光成像技术: 1.多激发光-多光谱荧光成像技术:通过光学滤波器技术,仅使特定波长的光(激发光) 到达样品以激发荧光,同时仅使特定波长的激发荧光到达检测器。不同的荧光发色团(如叶绿素或GFP绿色荧光蛋白等)对不同波长的激发光“敏感”并吸收后激发出不同波长的荧光,根据此原理可以选配2个或2个以上的激发光源、绿波轮及相应滤波器,对不同波长荧光(多光谱荧光)进行成像分析。如FluorCam便携式GFP/Chl.荧光成像仪及FluorCam封闭式GFP/Chl.荧光成像系统具备红光和兰光及相应滤波器,可以对GFP和叶绿素荧光成像分析;FluorCam开放式多光谱荧光成像系统可以进一步选配不同颜色的激发光,如除红光、蓝光外,还可选配绿色光源及相应滤波器,以对YFP进行荧光成像分析等; 2.UV紫外光激发多光谱荧光成像技术:长波段UV紫外光(320nm-400nm)对植物叶片 激发,可以产生具有4个特征 性波峰的荧光光谱,4个波峰 的波长为兰光440nm(F440)、 绿光520nm(F520)、红光690nm (F690)和远红外740nm (F740),其中F440和F520 统称为BGF,由表皮及叶肉细 胞壁和叶脉发出,F690和F740 为叶绿素荧光Chl-F。紫外光 激发多光谱荧光(UV-MCF)可 以用来灵敏、特异性地评估植 物生理状态包括受胁迫状态, 包括干旱、病虫害、环境污染、 氮胁迫等 本文就FluorCam多光谱荧光成像技术产品及最新应用案例做一简单介绍,其中FluorCam便携式GFP/Chl荧光成像仪(Handy GFPCam)和FluorCam封闭式GFP/Chl荧光成像系统(Closed GFPCam)已有较为详细的资料介绍,在此不再专门介绍。
叶绿素荧光研究背景知识介绍 前言 近些年来,叶绿素荧光技术已经逐渐成为植物生理生态研究的热门方向。荧光数据是植物光合性能方面的必要研究内容。目前这种趋势由于叶绿素荧光检测仪的改进而得到发展。然而荧光理论和数据解释仍然比较复杂。就我们所了解的情况来看,目前许多研究者对荧光理论不是很清楚,仪器应用仅仅限于简单的数据说明的基础上,本文在此基础上,目的在于简单明晰地介绍相关理论和研究要点,以求简单明确地使用叶绿素荧光检测设备,充分分析实验数据,重点在于植物生理生态学技术的应用和限制。 荧光测量基础 植物叶片所吸收的光的能量有三个走向:光合驱动、热能、叶绿素荧光。三个过程之间存在竞争,其中任何一个效率的增加都将造成另外两个产量的下降。因此,测量叶绿素荧光产量,我们可以获得光化学过程与热耗散的效率的变化信息。尽管叶绿素荧光的总量很小(一般仅占叶片吸收光能总量的1-2%),测量却非常简单。荧光光谱不同于吸收光谱,其波长更长,因此荧光测量可以通过把叶片经过给定波长的光线的照射,同时测量发射光中波长较长的部分光线的量来实现。有一点需要注意的是,这种测量永远是相对的,因为光线不可避免会有损失。因此,所有分析必须把数据进行标准化处理,包括其进一步计算的许多参数也是如此。 调制荧光仪的出现是荧光研究技术的革命性的创新。在这类仪器中,测量光源是调制(高频率开关)的,其检测器也被调谐来仅仅检测被测量光激发的荧光。因此,相对的荧光产量可以在背景光线(主要是指野外全光照的条件下)存在的条件下进行测量。目前绝大多数的荧光仪采用了调制系统,同时也强烈建议选择调制荧光仪(Kate Maxwell,2000)。 为什么荧光产量会发生改变?Kautsky效应和Beyond 叶绿素荧光产量的变化最早在1960年被Kautsky和其合作者发现。他们发现,当把植物叶片从黑暗中转入光下,荧光产量瞬间上升(大约在1秒左右)这种上升可以解释为光合途径中电子受体的还原(可接受电子的受体的减少)。一旦PSII吸收光能,初级电子受体Q A(质体醌)接受了电子,它将不能再接受电子,直到它把电子传递给下一级电子载体Q B。此期间,反应中心是关闭的,反应中心关闭的比
叶绿素含量的测定 一、原理 根据叶绿体色素提取液对可见光谱的吸收,利用分光光度计在某一特定波长测定其吸光度,即可用公式计算出提取液中各色素的含量。根据朗伯—比尔定律,某有色溶液的吸光度A与其中溶质浓度C和液层厚度L成正比,即A=αCL式中:α比例常数。当溶液浓度以百分浓度为单位,液层厚度为1cm时,α为该物质的吸光系数。各种有色物质溶液在不同波长下的吸光系数可通过测定已知浓度的纯物质在不同波长下的吸光度而求得。如果溶液中有数种吸光物质,则此混合液在某一波长下的总吸光度等于各组分在相应波长下吸光度的总和。这就是吸光度的加和性。今欲测定叶绿体色素混合提取液中叶绿素a、b和类胡萝卜素的含量,只需测定该提取液在三个特定波长下的吸光度A,并根据叶绿素a、b 及类胡萝卜素在该波长下的吸光系数即可求出其浓度。在测定叶绿素a、b时为了排除类胡萝卜素的干扰,所用单色光的波长选择叶绿素在红光区的最大吸收峰。 二、材料、仪器设备及试剂 (一)材料:新鲜(或烘干)的植物叶片。 (二)仪器设备:1)分光光度计;2)电子顶载天平(感量0.01g);3)研钵;4)棕色容量瓶; 5)小漏斗;6)定量滤纸;7)吸水纸; 8)擦境纸;9)滴管。 (三)试剂:1)95%乙醇(或80%丙酮)(v丙酮:v乙醇=2:1的95%水溶液);2)石英砂;3)碳酸钙粉。暗中2h,0.5g,25ml 三、实验步骤 1)取新鲜植物叶片(或其它绿色组织)或干材料,擦净组织表面污物,剪碎(去掉中脉),混匀。 2)称取剪碎的新鲜样品 0.2g ,共3份,分别放入研钵中,加少量石英砂和碳酸钙粉及2~3ml 95%乙醇,研成均浆,再加乙醇10ml,继续研磨至组织变白。静置3~5m 3)取滤纸1张,置漏斗中,用乙醇湿润,沿玻棒把提取液倒入漏斗中,过滤到25ml棕色容量瓶中,用少量乙醇冲洗研钵、研棒及残渣数次,最后连同残渣一起倒入漏斗中。 4)用滴管吸取乙醇,将滤纸上的叶绿体色素全部洗入容量瓶中。直至滤纸和残渣中无绿色为止。最后用乙醇定容至25ml,摇匀。 5)把叶绿体色素提取液倒入光径1cm的比色杯内,以95%乙醇为空白,在波长663nm 和645nm下测定吸光度。在波长663nm、645nm下或652nm测定吸光度。 四、实验结果计算 叶绿素a的含量 = 12.7 ? OD 663 – 2.69 ? OD 645 叶绿素a的含量 = 22.9 ? OD 645 – 4.86 ? OD 663 叶绿素a、b的总含量 = 8.02 ? OD 663 + 20.20 ? OD 645
叶绿素的药理功能及特性 ■叶绿素的药理功能 叶绿素是植物中含的绿色色素,植物细胞内的叶绿体吸收太阳光能源,从水和空气中CO2合成糖等有机物。叶绿素结构类似动物血液中的红色素,为维持生命不可缺的重要物质。 叶绿素存在许多类似体,高等绿色植物和绿藻等含叶绿素a和b,褐藻、硅藻等含叶绿素a。为提高稳定性,食品和医药品中用叶绿素诱导体为多。 叶绿素有多种药理效果引起食品界的注目。铜叶绿素、铜叶绿素钠、铁叶绿素钠早在上世纪60年代初就被作为食品添加剂,用于口香糖、蔬菜等加工品的着色。日本研究表明,叶绿素的诱导体可作胃肠药、口臭防止药、洗口液等成分。 具体说,叶绿素有下列重要药理功能: 创伤治愈作用 叶绿素能促进切伤、火伤、溃疡等伤口的肉芽新生、加快治愈作用。对创伤、溃疡局部涂布能使创伤面干燥,加快肉芽及上皮细胞的产生,明显促进创伤治愈。 脱臭作用。叶绿素能除去饮食、香烟及新陈代谢产生的口臭、脚臭、腋下恶臭、饮酒后酒气臭。铜叶绿酸钠有显著抑制口臭的挥发性硫化物的效果。 抗过敏作用。铜叶绿酸钠对治疗顽固性慢性荨麻疹、顽固性慢性湿疹、支气管哮喘及冻疮均有明显效果。叶绿素的抗过敏作用强。 抗溃疡作用。据国外对鼠试验,对幽门结扎溃疡的鼠同时投服叶绿酸作制酸剂和抗胆碱药有明显抗溃疡效果。 肠蠕动功能亢进作用。叶绿素能使肠道蠕动轻度亢进,解消便秘。 抗变异原性。叶绿酸、叶绿素能和发癌物质Trp-p-2的活性体形成复合体,使其不活化,还能抑制黄曲霉素、苯并芘等变异原物质。 制癌作用。叶绿酸钠能使肝癌细胞的增殖消失。叶绿素提取物有抗肿瘤功能及大大提高肿瘤的光导疗法效果。 降血清胆固醇作用。叶绿素的分解物脱镁叶绿素及叶绿酸均有降低胆固醇效果。 叶绿素来自天然植物,安全性高,作为绿色的叶绿素的应用将更加广泛,在食品中作健康与功能食品添加剂。 ■叶绿素的制造及性质 叶绿素制造,以小球藻等为原料,用丙酮等有机溶剂提取,得到叶绿素a、b的混合物。但这种天然的叶绿素受光线(特别是紫外线)和热分解、易褪色。对酸非常不稳定,其中金属镁容易脱离生成脱镁叶绿素,呈褐色。 将叶绿素中的镁用铜、铁等置换,能使稳定化。以酯结合的叶绿醇用碱加水分解得到叶绿酸,叶绿酸的钠或钾盐溶于水。市售的叶绿素,是将叶绿素的镁置换为铜的铜叶绿素,铜叶绿素被钠、铁置换成水溶性的铁叶绿酸钠。 叶绿素为黑绿~浓绿色的油或膏状,易溶于醚、丙酮等有机溶剂和油脂类,微溶于乙醇,不溶于水,因此因乳化剂呈分散性制剂。铜叶绿素外观、溶解性和叶绿素相同,色调呈强绿色。 铜叶绿素酸钠及铁叶绿酸钠是青黑色~暗绿色的粉末。易溶于水或稀酒精溶液中,不溶于油脂类中,但在酸性溶液中钠游离而使不溶于水,在钙镁离子等存在下,生成不溶性的盐,因此用水须非常注意。
对于叶绿素荧光全方面的研究 叶绿素荧光现象的发现 将暗适应的绿色植物突然暴露在可见光下后,植物绿色组织发出一种暗红色,强度不断变化的荧光。荧光随时间变化的曲线称为叶绿素荧光诱导动力学曲线。最直观的表现是,叶绿素溶液在透射光下呈绿色,在反射光下呈红色的现象。其本质是,叶绿素吸收光后,激发了捕光色素蛋白复合体,LHC将其能量传递到光系统2或光系统1,期间所吸收的光能有所损失,大约3%-9%的所吸收的光能被重新发射出来,其波长较长,即叶绿素荧光。 叶绿素荧光动力学研究的特点 1、叶绿素荧光动力学特性包含着光合作用过程的丰富信息 光能的吸收和转换 能量的传递与分配 反应中心的状态 过剩光能及其耗散 光合作用光抑制与光破坏 2、可以对光合器官进行“无损伤探查” 3、操作步骤简单快捷 光合作用的光抑制 光抑制是过剩光能造成光合功能下降的过程。过剩光能指植物所吸收的光能超出光化学反应所能利用的部分。过去人们把光抑制与光破坏等同起来,认为发生了光抑制就意味着光和机构遭到破坏。甚至把光抑制、光破坏、光氧化等,沦为一体。 光抑制的基本特征表现为: 光合效率下降说明叶片吸收的光能不能有效地转化为化学能。光破坏:PSII 是光破坏的主要场所,破坏也可能发生在反应中心也可能发生在与次级电子受体结合的蛋白上。发生光破坏后的结果:电子传递受阻、光合效率下降。当过剩的光能,不能及时有效地排散时,会对光合机构造成不可逆的伤害,如光氧化、光漂白等等。一切影响二氧化碳同化的外界因素,如低温、高温、水分亏缺、矿质元素亏缺等都会减少对光能的利用,导致过剩光能增加,进而加重光破坏。 植物防御破坏的措施 1、减少对光能的吸收 增加叶片的绒毛、蜡质 减少叶片与主茎夹角 2、增强代谢能力 碳同化 光呼吸 氮代谢 3、增加热耗散 依赖叶黄素循环的热耗散 状态转换 作用中心可逆失活 光合作用
一、实验课题名称:不同环境条件下植物叶绿素a、b含量的比较 二、选题背景或文献综述: 《植物生理学实验指导》(第四版)、《植物生理学》(第六版)、上网查阅相关资料 阴生植物也称“阴性植物”,是在较弱的光照条件下生长良好的植物,但并不是阴生植物对光照强度的要求越弱越好,而是必须达到阴生植物的补偿点,植物才能正常生长。 阳生植物也称“阳性植物”,光照强度对植物的生长发育及形态结构的形成有重要作用,在强光环境中生长发育健壮,在阴蔽和弱光条件下生长发育不良的植物称阳性植物,这类植物要求全日照,并且在水分、温度等条件适合的情况下,不存在光照过强的问题。 阳生植物和阴生植物的区别:关于光的饱和点和补偿点光是光合作用的能量来源,光照强度直接影响光合速率,在其它条件都适宜的情况下,在一定范围内,光合速率随光照强度提高而加快,当光照强度高到一定数值后,光照强度再提高而光合速率不再加快,这种现象叫光饱和现象。开始达到光饱和现象的光照强度称为光饱和点,在光饱和点以下,随着光照强度减弱,光合速率减慢,当减弱到一定光照强度时,光合作用吸收二氧化碳量与呼吸释放二氧化碳的量处于动态平衡,这时的光照强度称为光补偿点。此时植物制造有机物量和消耗有机物量相等,不同类型植物的光饱和点和
补偿点是不同的,阳性植物的光饱和点和补偿点一般都高于阴性植物。 结构和特性的区别:阴生植物的叶片的疏导组织比阳生植物稀疏,以叶绿体来说,阳生植物有较大的基粒,基粒片层数目多的多,叶绿素含量也高,阴生植物在较低的光照条件下充分的吸收光线,叶绿素a/叶绿素b的比值小,能够强烈的利用蓝紫光,阳性植物叶片小而厚,表面具蜡质或绒毛,叶脉密,单位面积内气孔多,叶绿素含量高,体内含盐分多,渗透压高,可以抗高温干旱,阳生植物的气孔一般在叶片下表皮分布的数量多于上表皮,这样可以避免阳光直晒而减少水分散失,阳生植物的呼吸速率高于阴生植物。 区分阳生植物与阴生植物,主要是根据植物对光照强度需要的不同,阳生植物要求充分直射日光才能生长或生长良好,阴生植物适宜于生长在荫蔽环境中,它们在完全日照下反而生长不良或不能生长,阳生植物和阴生植物之所以能适应不同光照,是与它们的生理特征和形态特征不同有关,以光饱和点来说,阳生植物的光饱合点是全光照(即全部太阳光照)的100%,而阴生植物是全光照的10%~50%。因为阴生植物叶片的输导组织比阳生植物的稀疏,当光照强度增大时,水分对叶片的供给不足,阴生植物便不再增加光合速率,以叶绿体来说,阴生植物与阳生植物相比,前者有较大的基粒,基粒片层数目多,叶绿素含量较高,能在较低光照强度下充分地吸收光线。此外,由于叶绿素b含量相对较多,易于吸收遮阴处的光(如
植物表型组学研究技术(一) ——FluorCam叶绿素荧光成像技术
FluorCam叶绿素荧光成像技术 Rousseau等(High throughput quantitative phenotyping of plant resistance using chlorophyll fluorescence image analysis.Plant Methods, 2013, 9:17),利用FluorCam开放式叶绿素荧光成像系统作为高通量表型分析平台,采用图像阈值分割等分析方法,对植物病原体感染进行了定量分析检测,根据Fv/Fm将感染分为不同阶段/等级,特别是可以将用其它方法难以分辨出来的感染前期加以分辨,并对5个品种的菜豆对普通细菌性疫病的抗性进行了定量分析评价。 PSI公司首席科学家Nedbal教授与公司总裁Trtilek博士等首次将PAM叶绿素荧光技术(Pulse Amplitude Modulated technique—— 脉冲调制技术)与CCD技术结合在一起,于1996 年在世界上成功研制生产出FluorCam叶绿素荧 光成像系统(Heck等,1999;Nedbal等,2000; Govindjee and Nedbal, 2000)。FluorCam叶 绿素荧光成像技术成为上世纪90年代叶绿素荧 光技术的重要突破,使科学家对光合作用与叶 绿素荧光的研究一下子进入二维世界和显微世 界,广泛应用于植物生理生态、植物胁迫与抗 性监测、作物育种、植物表型分析等。不同于 其它成像分析技术,FluorCam叶绿素荧光成像 只对叶绿素荧光波段敏感,可以有效避免环境 光的干扰,特异性、高灵敏度反映植物生理生 态状况。 主要功能特点如下: 1)高灵敏度CCD,时间分辨率可达50帧/秒,有效抓取叶绿素荧光瞬变;可选配高分 辨率CCD,分辨率1392x1040像素,用于气孔功能成像分析、稳态荧光如GFP荧光测量等
实验一植物叶绿素含量的测定 一、实验原理 根据叶绿体色素提取液对可见光谱的吸收,利用分光光度计在某一特定波长测定其吸光度,即可用公式计算出提取液中各色素的含量。根据朗伯—比尔定律,某有色溶液的吸光度A与其中溶质浓度C和液层厚度L成正比,即A=αCL式中:α比例常数。当溶液浓度以百分浓度为单位,液层厚度为1cm时,α为该物质的吸光系数。各种有色物质溶液在不同波长下的吸光系数可通过测定已知浓度的纯物质在不同波长下的吸光度而求得。如果溶液中有数种吸光物质,则此混合液在某一波长下的总吸光度等于各组分在相应波长下吸光度的总和。这就是吸光度的加和性。今欲测定叶绿体色素混合提取液中叶绿素a、b和类胡萝卜素的含量,只需测定该提取液在三个特定波长下的吸光度A,并根据叶绿素a、b 及类胡萝卜素在该波长下的吸光系数即可求出其浓度。在测定叶绿素a、b时为了排除类胡萝卜素的干扰,所用单色光的波长选择叶绿素在红光区的最大吸收峰。 二、材料、仪器设备及试剂 (一)材料:新鲜(或烘干)的植物叶片。 (二)仪器设备:1)分光光度计;2)电子天平;3)研钵;4)棕色容量瓶;5)小漏斗;6)定量滤纸;7)吸水纸;8)滴管。 (三)试剂:1)95%乙醇(或80%丙酮)(v丙酮:v乙醇=2:1的95%水溶液);2)石英砂;3)碳酸钙粉。 三、实验步骤 1)取新鲜植物叶片(或其它绿色组织)或干材料,擦净组织表面污物,剪碎(去掉中脉),混匀。 2)称取剪碎的新鲜样品0.2g ,共3份,分别放入研钵中,加少量石英砂和碳酸钙粉及2~3ml 95%乙醇,研成均浆,再加乙醇10ml,继续研磨至组织变白。静置3~5min。
藻类研究监测快讯 藻类是水体生态系统中的生产者,在生态系统中起着不可或缺的作用。随着能源与环境方面研究的深入,藻类已经越来越多的被利用到实验当中。叶绿素荧光是藻细胞中的叶绿素吸收光能后受激发而释放出的能量,通过检测荧光的强弱, 可初步判断藻类的光合作用强度及生理状况。该项技术使藻 类的生理生化研究变得更加简单、方便、精确。 重要参数如下: Ft瞬时荧光,与藻细胞浓度、叶绿素浓度有 关。在暗适应状态下测得的Ft值即为Fo最小荧 光值,在给予饱和光照时,即为Fm最大荧光值; QY反映藻类的光合效率,对胁迫非常敏感;暗适应条件下测得的QY值为最大光合效率值即(Fm-Fo)/Fm,反映藻类的潜在光合效率,光照下测得的QY值为有效光量子产量即(Fm’-Ft)/Fm’,反映藻类的实际光合效率。 OJIP曲线快速荧光诱导曲线,可测定藻类在由暗适应转到光照下的瞬间荧光变化,其中 FixArea与藻类叶绿素浓度 呈正相关,可作为藻类浓度 指标;PI为功能指数,对 胁迫非常敏感。有些胁迫不 会影响PSⅡ,也不会导致 QY降低,但可通过PI体 现出来,PI可以反映三个方面:反应中心密度、用于电荷分离过程的光子吸收率、电子传递效率。 NPQ 非光化学荧光淬灭,多余辐射能的散失,反映的藻类的光保护能力。 1、AquaPen探头式藻类荧光仪 AquaPen探头式藻类荧光仪用于水体微藻类的荧光测量,其高灵敏度和便携性可以对水 体较低浓度的浮游植物进行快速测量。检测极限可达0.5 μg Chl/L,测量计算参数:Fo, Ft, Fm, Fm‘, QY, OJIP, NPQ等。 光化学光和饱和光的强度在0 - 3,000 μmol·m-2·s-1可调,光 化光的持续时间可调,界面简单,易于操作,内存可达4Mb, 4节AAA电池供电,数据可通过USB数据线传至计算机或 掌上电脑。检测器前带有暗适应罩子,适合野外测量。
Fluorcam荧光成像技术及其在光合作用研究 中的应用 Eco‐lab生态实验室 北京易科泰生态技术有限公司 info@eco‐https://www.doczj.com/doc/cc14082166.html,
目录 1、叶绿素荧光成像技术发展过程 2、荧光参数及其生理意义 3、PSI介绍(荧光成像的发明者) 4、PSI产品介绍 5、应用案例
叶绿素荧光技术发展历程 ?Kautsky effect: Kautsky and Hirsch(1931)首次用肉眼发现叶绿素荧光现象并发表论文“CO2同化新实验”,后被称作“Kautsky effect” ?PAM(Pulse Amplitude Modulated Fluorometer): Schreiber(1986)等发明了PAM脉冲调制技术测量叶绿素荧光。?FluorCam:KineKc imaging of chlorophyll fluorescence: Ladislav Nedbal(2000)等于上世纪90年代末期发明了与 PAM技术相结合的叶绿素荧光成像技术
成像测量局部放大
荧光参数及其意义 ?Fo、Fm与QY,此外还有PAR_Abs及ETR ?Kautsky诱导效应:Fo,Fp,Fv,Ft_Lss,QY,Rfd ?荧光淬灭分析:Fo,Fm,Fp,Fs,Fv,QY,NPQ,Qp,Rfd 等50多个参数 ?OJIP曲线:快速荧光诱导曲线。Fo,Fj,Fi,P或Fm,Mo(OJIP曲线初始斜率)、FixArea固定面积、Sm(对关闭所有光反应中心所需能量的量度)、QY、PI等 ?LC光响应曲线:Fo,Fm,QY,QY_Ln
叶绿素荧光仪著名厂商 ?PSI:捷克布尔诺Brno(孟德尔在此发现著名的孟德尔遗传定律),Ladislav Nedbal为首席科学家和主要股东(另一股东为David Kramer,美国密执根州立大学教授),1997年为美国华盛顿大学H.Pakrasi教授研制成了第一台FluorCam荧光成像系统。主要产品有: –FluorCam叶绿素荧光成像系列产品 –FL3500/FL5000双调制荧光仪系列产品 –FluorPen及AquaPen等手持式荧光仪产品 –光养生物反应器等藻类培养与在线监测产品 –光源与植物培养室 ?Optics:美国,主要产品为OS5p‐PAM叶绿素荧光仪等?Walz:德国,主要产品为PAM2500叶绿素荧光仪等
植物叶绿素含量测定----丙酮提取法 高等植物光合作用过程中利用的光能是通过叶绿体色素(光合色素)吸收的。叶绿体色素由叶绿素a、叶绿素b、胡萝卜素和叶黄素组成。叶绿体色素的提取、分离和测定是研究它们的特性以及在光合中作用的第一步。叶片叶绿素含量与光合作用密切相关,是反眏叶片生理状态的重要指标。在植物光合生理、发育生理和抗性生理研究中经常需要测定叶绿素含量。叶绿素含量也是指导作物栽培生产和选育作物品种的重要指标。 [原理] 叶绿素不溶于水,溶于有机溶剂,可用多种有机溶剂,如丙酮、乙醇或二甲基亚砜等研磨提取或浸泡提取。叶绿色素在特定提取溶液中对特定波长的光有最大吸收,用分光光度计测定在该波长下叶绿素溶液的吸光度(也称为光密度),再根据叶绿素在该波长下的吸收系数即可计算叶绿素含量。 利用分光光计测定叶绿素含量的依据是Lambert-Beer定律,即当一束单色光通过溶液时,溶液的吸光度与溶液的浓度和液层厚度的乘积成正比。其数学表达式为: A=Kbc 式中: A为吸光度;K为吸光系数;b为溶液的厚度;c为溶液浓度。 叶绿素a、b的丙酮溶液在可见光范围内的最大吸收峰分别位于663、645nm处。叶绿素a 和b在663nm处的吸光系数(当溶液厚度为1cm,叶绿素浓度为g·L-1时的吸光度)分别为82.04和9.27;在645nm处的吸光系数分别为16.75和45.60。根据Lambert-Beer定律,叶绿素溶液在663nm和645nm处的吸光度(A663和A645)与溶液中叶绿素a、b和总浓度(a+b)(Ca、Cb 、Ca十b,单位为g·L-1),的关系可分别用下列方程式表示: A663=82.04Ca+9.27Cb (1) A645=16.76Ca+45.60Cb (2) 解方程(1)和(2)得: Ca=12.7 A663—2.59 A645 (3) Cb=22.9 A645—4.67 A663 (4) Ca十b=20.3 A645—8.04 A663 (5) 从公式(3)、(4)、(5)可以看出,只要测得叶绿素溶液在663nm和645nm处的吸光度,就可计算出提取液中的叶绿素a、b浓度和叶绿素总浓度(a+b)。 [材料、仪器、药品]
园艺学报,():– 2014411122152224 http: // www. ahs. ac. cn Acta Horticulturae Sinica E-mail: yuanyixuebao@https://www.doczj.com/doc/cc14082166.html, 收稿日期:2014–08–22;修回日期:2014–10–24 基金项目:河北省海外高层次人才百人计划项目(E2013100011);河北省杰出青年科学基金项目(C2013204118);‘十二五’农村领域国家科技计划课题(2012AA100202-5);农业部农业科研杰出人才培养计划项目(2130106);高等学校博士学科点专项基金项目(20121302110006) 大白菜叶色突变体的HRM 鉴定及其叶绿素荧光参数分析 刘梦洋,卢 银,赵建军,王彦华,申书兴* (河北农业大学园艺学院,河北省蔬菜种质创新与利用重点实验室,河北保定 071000) 摘 要:将大白菜经甲基磺酸乙酯(EMS )诱变种子获得的42株叶色突变体按照生殖时期叶片颜色和叶绿素含量分为9种类型:深绿色、灰绿色、绿色、浅绿色、白绿色、白浅绿色、黄绿色、黄浅绿色、黄色;利用高分辨率熔解曲线(high resolution melting ,HRM )技术对叶绿素荧光基因HCF164突变进行了筛选并结合叶绿素荧光参数测定,获得了1株黄绿色高光合效率突变体A29,1株黄绿色光合结构损伤突变体A35和1株浅绿色光合电子传递受阻突变体A21;对另外7个叶色相关基因的突变进行了HRM 鉴定,表明叶绿素相关基因ATRCCR 、CLH2、PORA 突变可能是造成18个突变体叶色变化的主要原因,黄叶特异基因家族YLS 突变与叶色变化也有关系。 关键词:大白菜;诱变;突变体叶色;HRM ;叶绿素荧光 中图分类号:S 634.1 文献标志码:A 文章编号:0513-353X (2014)11-2215-10 HRM Identification and Chlorophyll Fluorescence Characteristics on Leaf Color Mutants in Chinese Cabbage LIU Meng-yang ,LU Yin ,ZHAO Jian-jun ,WANG Yan-hua ,and SHEN Shu-xing * (College of Horticulture ,Agricultural University of Hebei ,Key Laboratory for Vegetable Germplasm Enhancement and Utilization of Hebei ,Baoding ,Heibei 071001,China ) Abstract :Forty-two leaf color mutants of Chinese cabbage obtained through EMS seeds mutagenesis were used as materials in this study. According to leaf color and leaf chlorophyll content at generative growth mutations were suggested to be divided into 9 types :Dark green ,gray-green ,green ,light green ,white-green ,light white-green ,yellow-green ,light yellow-green and yellow. By detecting the nucleotide variation of the gene HCF164 related to chlorophyll fluorescence using HRM technology and by measuring chlorophyll fluorescence characteristics ,we identified one yellow-green leaf color mutant A29 with high photosynthesis efficiency ,one yellow-green leaf color mutant A35 with photosynthetic structure damages ,one light green mutant A21 with photosynthetic electron transport obstruction. Through identifying other 7 leaf-color-related genes by HRM ,mutation of chlorophyll-related genes ATRCCR ,CLH2 and PORA could be the main reason resulted in 18 leaf color mutants ,mutation of yellow-leaf- specific genes was also affected the variation of leaf color. * 通信作者 Author for correspondence (E-mail :shensx@https://www.doczj.com/doc/cc14082166.html, )
二、植物叶绿素含量测定----丙酮提取法 高等植物光合作用过程中利用的光能是通过叶绿体色素(光合色素)吸收的。叶绿体色素由叶绿素a、叶绿素b、胡萝卜素和叶黄素组成。叶绿体色素的提取、分离和测定是研究它们的特性以及在光合中作用的第一步。叶片叶绿素含量与光合作用密切相关,是反眏叶片生理状态的重要指标。在植物光合生理、发育生理和抗性生理研究中经常需要测定叶绿素含量。叶绿素含量也是指导作物栽培生产和选育作物品种的重要指标。 [原理] 叶绿素不溶于水,溶于有机溶剂,可用多种有机溶剂,如丙酮、乙醇或二甲基亚砜等研磨提取或浸泡提取。叶绿色素在特定提取溶液中对特定波长的光有最大吸收,用分光光度计测定在该波长下叶绿素溶液的吸光度(也称为光密度),再根据叶绿素在该波长下的吸收系数即可计算叶绿素含量。 利用分光光计测定叶绿素含量的依据是Lambert-Beer定律,即当一束单色光通过溶液时,溶液的吸光度与溶液的浓度和液层厚度的乘积成正比。其数学表达式为: A=Kbc 式中:A为吸光度;K为吸光系数;b为溶液的厚度;c为溶液浓度。 叶绿素a、b的丙酮溶液在可见光范围内的最大吸收峰分别位于663、645nm处。叶绿素a和b 在663nm处的吸光系数(当溶液厚度为1cm,叶绿素浓度为g·L-1时的吸光度)分别为82.04 和9.27;在645nm处的吸光系数分别为16.75和45.60。根据Lambert-Beer定律,叶绿素溶液在663nm和645nm处的吸光度(A663和A645)与溶液中叶绿素a、b和总浓度(a+b)(C a、C 、C a十b,单位为g·L-1),的关系可分别用下列方程式表示: b A663=82.04C a+9.27C b (1) A645=16.76C a+45.60C b(2) 解方程(1)和(2)得: C a=12.7 A663—2.59 A645 (3) C b=22.9 A645—4.67 A663(4) C a十b=20.3 A645—8.04 A663(5) 从公式(3)、(4)、(5)可以看出,只要测得叶绿素溶液在663nm和645nm处的吸光度,就可计算出提取液中的叶绿素a、b浓度和叶绿素总浓度(a+b)。
植物叶绿素含量测定----无水乙醇提取法 摘要:本文是主要是用无水乙醇提取法提取叶绿素以及用比色法测定叶绿素的含量实验的综述。 关键词:叶绿素的提取、含量测定、无水乙醇、比色法 前言:高等植物光合作用过程中利用的光能是通过叶绿体色素(光合色素)吸收的。叶绿体色素由叶绿素a、叶绿素b、胡萝卜素和叶黄素组成。叶绿体色素的提取、分离和测定是研究它们的特性以及在光合中作用的第一步。叶片叶绿素含量与光合作用密切相关,是反眏叶片生理状态的重要指标。在植物光合生理、发育生理和抗性生理研究中经常需要测定叶绿素含量。叶绿素含量也是指导作物栽培生产和选育作物品种的重要指标。 正文: 一、原理 叶绿素不溶于水,溶于有机溶剂,可用多种有机溶剂,如丙酮、乙醇或二甲基亚砜等研磨提取或浸泡提取。叶绿色素在特定提取溶液中对特定波长的光有最大吸收,用分光光度计测定在该波长下叶绿素溶液的吸光度(也称为光密度),再根据叶绿素在该波长下的吸收系数即可计算叶绿素含量。 利用分光光计测定叶绿素含量的依据是Lambert-Beer定律,即当一束单色光通过溶液时,溶液的吸光度与溶液的浓度和液层厚度的
乘积成正比。其数学表达式为:A=K*b*c(式中: A为吸光度;K为吸光系数;b为溶液的厚度;c为溶液浓度);叶绿素a、b的丙酮溶液在可见光范围内的最大吸收峰分别位于663、645nm处。叶绿素a 和b在663nm处的吸光系数(当溶液厚度为1cm,叶绿素浓度为g?L-1时的吸光度)分别为82.04和9.27;在645nm处的吸光系数分别为16.75和45.60。根据Lambert-Beer定律,叶绿素溶液在663nm和645nm处的吸光度(A663和A645)与溶液中叶绿素a、b和总浓度(a+b)(Ca、Cb 、Ca十b,单位为g?L-1),的关系可分别用下列方程式表示: A663=82.04Ca+9.27Cb (1) A645=16.76Ca+45.60Cb (2) 解方程(1)和(2)得: Ca=12.7 A663—2.59 A645 (3) Cb=22.9 A645—4.67 A663 (4) Ca十b=20.3 A645—8.04 A663 (5) 二、实验的材料、仪器、药品 1.材料:植物绿色叶片。 2.仪器:分光光度计、比色皿、天平、研钵、滤纸、漏斗、滴管、剪刀、50ml容量瓶。 三、实验步骤 1.叶绿素的提取:用洗衣粉先将叶片表面的油迹和灰尘清洗干净,晾干后,用电子天平准确称取1.0g九里香叶子(0.5g紫背草叶子),
Sensors2011, 11, 3765-3779; doi:10.3390/s110403765 OPEN ACCESS sensors ISSN 1424-8220 https://www.doczj.com/doc/cc14082166.html,/journal/sensors Article Hyperspectral and Chlorophyll Fluorescence Imaging to Analyse the Impact of Fusarium culmorum on the Photosynthetic Integrity of Infected Wheat Ears Elke Bauriegel 1,*, Antje Giebel 1 and Werner B. Herppich 2 1Department of Engineering for Crop Production, Leibniz-Institute for Agricultural Engineering Potsdam-Bornim, D-14469 Potsdam, Germany; E-Mail: agiebel@atb-potsdam.de 2Department of Horticultural Engineering, Leibniz-Institute for Agricultural Engineering Potsdam-Bornim, D-14469 Potsdam, Germany; E-Mail: wherppich@atb-potsdam.de * Author to whom correspondence should be addressed; E-Mail: ebauriegel@atb-potsdam.de; Tel.: +49-331-5699-414; Fax: +49-331-5699-849. Received: 24 January 2011; in revised form: 23 March 2011 / Accepted: 25 March 2011 / Published: 28 March 2011 Abstract: Head blight on wheat, caused by Fusarium spp., is a serious problem for both farmers and food production due to the concomitant production of highly toxic mycotoxins in infected cereals. For selective mycotoxin analyses, information about the on-field status of infestation would be helpful. Early symptom detection directly on ears, together with the corresponding geographic position, would be important for selective harvesting. Hence, the capabilities of various digital imaging methods to detect head blight disease on winter wheat were tested. Time series of images of healthy and artificially Fusarium-infected ears were recorded with a laboratory hyperspectral imaging system (wavelength range: 400 nm to 1,000 nm). Disease-specific spectral signatures were evaluated with an imaging software. Applying the ?Spectral Angle Mapper‘ me thod, healthy and infected ear tissue could be clearly classified. Simultaneously, chlorophyll fluorescence imaging of healthy and infected ears, and visual rating of the severity of disease was performed. Between six and eleven days after artificial inoculation, photosynthetic efficiency of infected compared to healthy ears decreased. The severity of disease highly correlated with photosynthetic efficiency. Above an infection limit of 5% severity of disease, chlorophyll fluorescence imaging reliably recognised infected ears. With this technique, differentiation of the severity of disease was successful in steps of 10%. Depending on the quality of chosen regions of interests, hyperspectral imaging readily detects head blight 7 d after inoculation