
第九章可逆电池练习题 一、判断题: 1.电池(a) Ag,AgCl|KCl(aq)|Hg2Cl2,Hg与电池(b) Hg,Hg2Cl2|KCl(aq)|AgNO3(aq)|Ag 的电池反应可逆。 2.恒温、恒压下,ΔG > 0的反应不能自发进行。 3.电池Zn|ZnCl2(aq)|AgCl(s)|Ag在25℃、pф下可逆放电2F时放热23.12 kJ,则该电池反应: Zn + 2AgCl(s)→ZnCl2 + 2Ag 的Δr H mф(298K) = -23.12 kJ·mol-1。 4.Zn2+ + 2e →Zn ,E1ф,Δr G mф(1);?Zn2++e →?Zn,E2ф,Δr G mф(2)。因E1ф= E2ф,所以有Δr G mф(1) =Δr G mф(2)。 5.Fe2++ 2e → Fe,E1ф,Δr G mф(1) ;Fe3++ e→Fe2+,E2ф,Δr G mф(2);(1) + (2),得: Fe3++ 3e→Fe,E3ф,Δr G mф(3)。则:Δr G mф(3) =Δr G mф(1) +Δr G mф(2),E3ф=E1ф+ E2ф。6.2H++ 2e →H2,E1ф与2H2O + 2e→H2 + 2OH-,E2ф,因它们都是氢电极反应,所以φ1ф=φ2ф。 7.对于电极Pt |Cl2(p)|Cl- 其还原电极电势为: φ(Cl-/Cl2)=φф(Cl-/Cl2)-(RT/2F)ln{[p(Cl2)/[pфa2(Cl-)]} 。 8.对于电池Pt|H2|H2SO4(aq)|O2|Pt ,其电池反应可表示为: H2(g)+ ?O2(g)→H2O(l),E1ф,Δr G mф(1) 或2H2(g)+O2(g)→2H2O(l),E2ф,Δr G mф(2)。因2Δr G mф(1) =Δr G mф(2),所以2E1ф= E2ф。 9.电池(1) Ag|AgBr(s)|KBr(aq)|Br2|Pt ,电池(2) Ag|AgNO3(aq)|| KBr(aq)|AgBr(s)|Ag的电池电动势E1、E2都与Br-浓度无关。 10.在有液体接界电势的浓差电池中,当电池放电时,在液体接界处,离子总是从高浓度向低浓度扩散。 11.对于电池Zn|ZnSO4(aq)||AgNO3(aq)|Ag,其中的盐桥可以用饱和KCl溶液。 二、单选题: 1.丹聂尔电池(铜- 锌电池)在放电和充电时锌电极分别称为:() (A)负极和阴极; B)正极和阳极;(C)阳极和负极; (D)阴极和正极。 2.韦斯登标准电池放电时正极上发生的反应为:() (A) Cd2++2e→Cd ;(B) PbSO4(s)+2e→Pb + SO42-; (C)Hg2SO4(s)+2e→2Hg(l)+SO42-;(D)Hg2Cl2(s)+2e→2Hg(l) + 2Cl-。 3.下列说法不属于可逆电池特性的是:() (A)电池放电与充电过程电流无限小;(B)电池的工作过程肯定为热力学可逆过程;
(二) 电化学热力学与可逆电池电动势 将锌板浸入硫酸锌溶液,将铜板浸入硫酸铜溶液,中 间用多孔陶瓷隔开,就构成了丹尼尔(Daniell)电池。该 电池中发生的反应Zn + Cu2+?→ Zn2+ + Cu是一个典型的 氧化还原反应(redox reaction),当其在电池中发生时,则 可在正负极间形成约1.5 V的电势差,并对外输出电能。 化学反应与电化学反应两者为什么不同?如何将一 个反应设计成电池而使之对外输出电功?电极间的电势 差是如何形成的?输出的电功与体系化学能变化之间有 何关系?这些问题都要由电化学来回答。所谓电化学 (electrochemistry)就是研究化学现象与电现象之间的关系, 以及电能与化学能之间相互转化规律的科学。 电化学反应需在电化学装置中才能发生。将化学能转 化为电能的装置称为原电池(galvanic cell),将电能转化成电能的装置称为电解池(electrolytic cell)。无论原电池还是电解池通常的均由2个电极和对应的电解质溶液构成。电极的命名有2种,即正负极和阴阳极。其中,电势高的一极称为正极,电势低的为负极;发生氧化反应的一极是阳极,而发生还原反应的是负极。例如,图7.15中,Zn电极电势低,为负极,发生氧化反应Zn ?→ Zn2+ +2e-,是阳极;而Cu电极电势高,是正极,发生还原反应Cu2+ +2e-?→ Cu,所以是阴极。对于原电池和电解池,电极名称的对应关系如表7.7 所示。 表7.7 原电池和电解池的电极名称对应关系 原电池电解池 电势高低高低 正极负极正极负极 反应还原氧化氧化还原 阴极阳极阳极阴极 §7.6 可逆电池的设计 1.原电池设计的原理 通常的氧化还原反应在电池中发生时,会拆成单纯的氧化反应(oxidation reaction)和还原反应(reduction reaction)在两个电极上分别发生,如上例: 负极:Zn ?→ Zn2+ + e2- 正极:Cu2+ + e2-?→ Cu 总反应:Zn + Cu2+?→ Zn2+ + Cu 在电极上发生的反应称为电极反应(electrode reaction),也称半反应(half reaction),因为它们仅是完整氧化还原反应的一半。上述反应发生时,在负极Zn变成Zn2+进入溶液并将电子留在极板上,导致极板电子过剩,电势变负;在正极,溶液中的Cu2+到电极上夺取电子,导致铜板带正电,电势变正。可见,电极间电势差的形成是电极上分别发生氧化、还原反应的必然结果。因此,只要将一个反应拆成氧化和还原两个半反应,让它们在两个电极上 solution 4 partition 图7.15 丹尼尔电池示意图
第9章可逆原电池 1.写出下列原电池中各电极反应、电池反应及E的计算公式。 ① (101325Pa)|KOH(a)|O2(101325Pa),Pt ② Pt,H 2 ③ ④ 解:(1) 负极 Pb(s)+(a) → PbSO 4(s)+2e 正极 Cu2+() + 2e →Cu(s) (a) + Cu2+ (a Cu2+) ==== PbSO4(s)+Cu(s) 电池反应 Pb(s)+SO 4 ( pΘ ) -2e → 2H+ (a H+) (2) 负极 H 2 ( pΘ ) + H2O +2e → 2OH -(a OH -) 正极O 2 (pΘ) + 电池反应 H 2 (pΘ) → H2O(l) O 2 (3) 负极 3H (p H2) - 6e → 6H+(aq) 2
正极 Sb 2O 3 (s) + 6e + 6H+(aq) → 2Sb(s) +3H 2 O(l) 电池反应 Sb 2 O 3 +3H 2 (p H2) → 2Sb(s) + 3H2O(l) (4) 负极 Ag(s) + I -(a I -) → AgI(s) + e 正极 AgCl(s) + e → Ag(s) + Cl - (a Cl-) 电池反应 Agl(s) + I-(a I -) → Ag(s) + Cl - (a Cl-) 2.试将下列化学反应设计成原电池 (1)Zn(s) + H 2SO 4 (a1) === ZnSO4(a2) + H2(p H2); (2)Ni(s) + H 2O ==== NiO(s) + H 2 (p H2) (3)H 2 (p H2) + O2(p O2) ==== H2O(l); (4)H 2 (p H2) + HgO(s) ==== Hg(l) + H2O(l) 解:(1)负极 Zn(s) -2e → Zn2+(a2) 正极 2H+(a1) + 2e → H2(P H2) 电池反应 Zn(s) +2H+(a1) ==== Zn2+(a2)+ H2(p H2) 电池符号 Zn(s) | ZnSO 4 (a2) || H2SO4(a1) | H2(p H2),Pt
题目部分,(卷面共有25题,47.0分,各大题标有题量和总分) 一、选择(25小题,共47.0分) 1.(2分)电极 Tl 3+,Tl +/Pt 的电势为φ1$ =1.250 V,电极 Tl +/Tl 的电势 φ2$=-0.336 V 则电极 Tl 3+/Tl 的电势 φ3$为: ( ) A 、 0.305 V B 、 0.721 V C 、 0.914 V D 、 1.568 V 2.(2分)以下关于玻璃电极的说法正确的是: ( ) A 、 玻璃电极是一种不可逆电极 B 、 玻璃电极的工作原理是根据膜内外溶液中被测离子的交换 C 、 玻璃电极易受溶液中存在的氧化剂、还原剂的干扰 D 、 玻璃电极是离子选择性电极的一种 3.(2分)反应 Cu 2+(a 1)─→Cu 2+(a 2), 已知 a 1>a 2, 可构成两种电池 (1) Cu(s)│Cu 2+(a 2)‖Cu 2+(a 1)│Cu(s) (2) Pt │Cu 2+(a 2),Cu +(a ')‖Cu 2+(a 1),Cu +(a ')│Pt 这两个电池电动势 E 1与E 2的关系为: ( ) A 、 E 1=E 2 B 、 E 1=2 E 2 C 、 E 1= 1 2 E 2 D 、 无法比较 4.(2分)298 K 时,在下列电池的右边溶液中加入 0.01 mol ·kg -1的 Na 2S 溶液, 则电池的电动势将: ( ) Pt │H 2(p ?)│H +(a =1)‖CuSO 4(0.01 mol ·kg -1)│Cu(s) A 、 升高 B 、 下降 C 、 不变 D 、 无法判断 5.(1分)已知 φ? (Zn 2+,Zn)=-0.763 V, 则下列电池反应的电动势为:Zn(s)+2 H +(a =1)=Zn 2+(a =1)+H 2(p ?) ( ) A 、 -0.763 V B 、 0.763 V C 、 0 V D 、 无法确定 6.(2分)已知 φ? (Cl 2/Cl -)=1.36 V, φ? (Br 2/Br -)=1.07 V, φ? (I 2/I -)=0.54 V, φ? (Fe 3+/Fe 2+)=0.77 V 。请判断在相同温度和标准态下说法正确的是: ( ) A 、 只有 I - 能被 Fe 3+ 所氧化 B 、 Br - 和Cl - 都能被 Fe 3+ 所氧化 C 、 卤离子都能被 Fe 3+ 所氧化 D 、 卤离子都不能被 Fe 3+ 所氧化 7.(2分)298 K 时,已知 φ? (Fe 3+,Fe 2+)=0.77 V, φ? (Sn 4+,Sn 2+)=0.15 V, 当这两个电极组成自发电池时, E ?为: ( ) A 、 1.39 V B 、 0.62 V C 、 0.92 V D 、 1.07 V 8.(2分)在 298 K 时,浓度为 0.1 mol ·kg -1和 0.01 mol ·kg -1 HCl 溶液的液接电势为E J (1),浓度为 0.1 mol ·kg -1和 0.01 mol ·kg -1 KCl 溶液的液接电势 E J (2) 则: ( ) A 、 E J (1) = E J (2) B 、 E J (1) > E J (2)
目录(试卷均已上传至“百度文库”,请自己搜索)第一章热力学第一定律及其应用物化试卷(一)第一章热力学第一定律及其应用物化试卷(二)第二章热力学第二定律物化试卷(一) 第二章热力学第二定律物化试卷(二) 第三章统计热力学基础 第四章溶液物化试卷(一) 第四章溶液物化试卷(二) 第五章相平衡物化试卷(一) 第五章相平衡物化试卷(二) 第六章化学平衡物化试卷(一) 第六章化学平衡物化试卷(二) 第七章电解质溶液物化试卷(一) 第七章电解质溶液物化试卷(二) 第八章可逆电池的电动势及其应用物化试卷(一)第八章可逆电池的电动势及其应用物化试卷(二)第九章电解与极化作用 第十章化学动力学基础(一)物化试卷(一) 第十章化学动力学基础(一)物化试卷(二) 第十一章化学动力学基础(二) 物化试卷(一) 第十一章化学动力学基础(二) 物化试卷(二) 第十二章界面现象物化试卷(一) 第十二章界面现象物化试卷(二) 第十三章胶体与大分子溶液物化试卷(一) 第十三章胶体与大分子溶液物化试卷(二) 参考答案
1. 某一反应,当反应物和产物的活度都等于1 时,要使该反应能在电池内自发进行,则: ( ) (A) E 为负(B) Eθ为负(C) E 为零(D) 上述都不是 2. 298 K 时,φθ(Au+/Au) = 1.68 V,φθ(Au3+/Au) = 1.50 V,φθ(Fe3+/Fe2+) = 0.77 V 则反应2Fe2++Au3+=2Fe3++Au+的平衡常数Kθ值为:( ) (A) 4.33×1021(B) 2.29×10-22 (C) 6.61×1010(D) 7.65×10-23 3. 25℃时,电池反应 Ag +1/2Hg2Cl2= AgCl + Hg 的电池电动势为0.0193V,反应时所对应的Δr S m为32.9 J/(K·mol),则电池电动势的温度系数(αE/αT) 为:( ) (A) 1.70×10-4 V/K (B) 1.10×10-6 V/K (C) 0.101 V/K (D) 3.40×10-4 V/K 4. 已知298.15 K 及101325 Pa 压力下,反应 A(s) + 2BD(aq) = AD2(aq) + B2(g) 在电池中可逆地进行,完成一个单位的反应时,系统做电功150 kJ ,放热80 kJ,该反应的摩尔等压反应热为: ( ) (A) -80 kJ/mol (B) -230 kJ/mol (C) -232.5 kJ/mol (D) -277.5 kJ/mol 5. 某电池在298 K、pθ下可逆放电时,放出 100 J 的热量,则该电池反应的焓变值Δ H m为:( ) r (A) 100J (B) >100J (C) <-100J (D) -100J 6. 298 K时,反应为Zn(s)+Fe2+(aq)=Zn2+(aq)+Fe(s) 的电池的Eθ为0.323 V,则其平衡常数 Kθ为:( )
第九章可逆电池 本章用化学热力学得观点讨论电极反应得可逆行为.原电池就是将化学能转变为电能得装置,两个电极与电解质溶液就是电池最重要得组成部分。电极电势就是本章主要概念之一,它就是相对于标准氢电极而言得电势,就是一种相对值,即把一个电极与标准氢电极组成一个已消除了液接电势得原电池,其电动势就就是给定电极得标准电极电势.对于一个可逆化学电池,电极两极间得电势差称电池得电动势,可用电池反应得能斯特方程计算.因为电池电动势与热力学量之间密切相关,所以本章内容就是围绕电动势而展开。 一、基本内容 (一) =-zFE 式中为电池反应得摩尔吉布斯自由能变;z就是电池反应得电子得物质得量;E 为电池得电动势。此式运用于等温等压得可逆过程,所以E为可逆电池得电动势。此式表明,在可逆电池中,化学反应得化学能()全部转变成了电能zFE。该式将化学反应得性质与电池得性质联系起来,就是电化学得基本公式之一。若参与电池反应得所有物质均处于各自得标准态,则上式成为 =-zFE$ 其中E$称为电池得标准电动势,对于指定得电池,E$只就是温度得函数. (二)电池反应得能斯特公式 若电池反应为aA+bB=gG+hH E=E$—㏑ 此式表明,电池得电动势取决于参加反应得各物质得状态,它对如何改变电池电动势具有指导得意义,计算时首先要正确写出电池反应式。 (三)电极反应得能斯特公式 若电极反应为aA+bB+ze-=gG+hH E=E —㏑ 式中E与E 分别为该电极得电极电势与标准电极电势。此式表明,一个电极得电势取决于参与电极还原得各物质得状态。计算得关键就是要正确写出电极上得还
原反应. (四)E=,E = 式中E与E$分别为可逆电池得电动势与标准电动势;()与()分别为正极与负极得电极电势(标准电极电势). (五)标准电动势E$与标准平衡常数K$得关系 (六)电池反应得熵变就是与电池电动势得温度系数关系 (七)电池反应得焓变与电池电动势E与电池电动势得温度系数得关系 (八)可逆电池得反应热效应QR与电池电动势得温度系数得关系 (九) 液接电势E1得计算公式 E1=㏑[(a±)负/(a±)正] 式中z+,z-代表正、负离子得价数,t+与t—分别代表在液-液界面处正、负离子得迁移数,一般认为就是两溶液中迁移数得平均值,即 t+=1/2(t+,负+ t+,正) t -=1/2(t -,负 +t-,正) (十)膜电势E m计算公式 式中E m就是离子B得膜电势;zB就是离子B得价数;aB,左与a B,右分别为膜左右 两侧离子B得活度。此式表明,E m 取决于透过性离子在两侧溶液中得活度差异,活度差异越大,︱E m︱越大。 二、重点与难点 1、电化学主要研究电能与化学能之间得相互转化及转化过程中得有关规律。必须将电池表示式与电池反应“互译”,即将化学反应与电池反应相关联,尤其就是将已知化学反应,设计成电池表示式,读者往往难以入手,这里除了熟悉几类典型得电极反应外,还需善于分析反应中有关元素在反应前后氧化态有无变化。
第九章可逆电池的电动势及其应用习题一、选择题 1.某电池的电池反应可写成: (1)H 2 (g)+ 2 1 O 2 (g)→ H 2 O(l) (2)2H 2 (g)+ O 2 (g)→ 2H 2 O(l) 相应的电动势和化学反应平衡常数分别用E 1,E 2 和K 1 ,K 2 表示,则 (A)E 1=E 2 K 1 =K 2 (B)E 1 ≠E 2 K 1 =K 2 (C)E 1=E 2 K 1 ≠K 2 (D)E 1 ≠E 2 K 1 ≠K 2 2.通过电动势的测定,可以求难溶盐的活度积。欲测AgCl(s)的活度积K SP ,应设计的电池是: (A)Ag|AgCl(s)|HCl(aq)|Cl 2 (g,pθ)|Pt (B)Pt| Cl 2 (g,pθ)| HCl(aq)||AgNO 3 (aq)|Ag (C)Ag |AgNO 3 (aq)| HCl(aq)|AgCl(s)|Ag (D)Ag|AgCl(s)| HCl(aq)||AgNO 3 (aq)|Ag 3.下列电池中,电动势E与Cl-的浓度无关的是 (A)Ag|AgCl(s)|KCl(aq)| Cl 2 (g,100kPa)| Pt (B)Ag|Ag+(aq)|| Cl- (aq)| Cl 2 (g,100kPa)| Pt (C)Ag|Ag+(aq)|| Cl- (aq)| AgCl(s) |Ag (D)Ag|AgCl(s) |KCl(aq)|Hg 2Cl 2 (s)|Hg 4.在电池Pt| H2 (g,pθ)| HCl (1mol·kg-1)||CuSO4(0.01 mol·kg-1)|Cu 的阴极中加入下面四种溶液,使电池电动势增大的是 (A)0.1 mol·kg-1CuSO 4 (B)0.1 mol·kg-1Na 2 SO 4 (C)0.1 mol·kg-1Na 2 S (D)0.1 mol·kg-1氨水 5.298K时,电池Zn|ZnCl2(m=0.5mol·kg-1)|AgCl(s)-Ag的电动势E=1.015V,其温度系数为-4.92×10-3V·K-1,若电池以可逆方式输出2法拉第的电量, 则电池反应的Δ r H m (单位:kJ·mol-1)应为 (A)–196 (B)–95 (C)224 (D)–224 6.在298K时,为了测定待测液的pH值而组成电池: Pt,H 2 (p?)|pH(x)溶液|甘汞电极
第九章 可逆电池练习题 一、判断题: 1.电池(a) Ag,AgCl|KCl(aq)|Hg 2Cl 2,Hg 与电池(b) Hg,Hg 2Cl 2|KCl(aq)|AgNO 3(aq)|Ag 的电 池反应可逆。 2.恒温、恒压下,ΔG > 0的反应不能进行。 3.电池Zn|ZnCl 2(aq)|AgCl(s)|Ag 在25℃、p 下可逆放电2F 时放热 kJ ,则该电池 反应:Zn + 2AgCl(s) ZnCl 2 + 2Ag 的m r H ?(298K) = kJ·mol -1。 4.Zn 2+ + 2e Zn ,E 1,m r G ?(1);?Zn 2++e ?Zn ,E 2 ,m r G ?(2)。因 E 1= E 2,所以有:m r G ?(1) = m r G ?(2)。 5.Fe 2+ + 2e Fe ,E 1,m r G ?(1) ;Fe 3+ + e Fe 2+ ,E 2 ,m r G ?(2); (1) + (2),得:Fe 3+ + 3e Fe ,E 3,m r G ?(3)。 则:m r G ?(3) = m r G ?(1) + m r G ?(2),E 3=E 1 + E 2。 6.2H + + 2e H 2,E 1与2H 2O + 2e H 2 + 2OH -,E 2,因它们都是氢电极反应, 所以φ1 = φ2。 7.对于电极Pt |Cl 2(p )|Cl - 其还原电极电势为: φ(Cl -/Cl 2) = φ(Cl -/Cl 2) - (RT /2F )ln{[p (Cl 2)/[p a 2(Cl -)]] 。 8.对于电池Pt|H 2|H 2SO 4(aq)|O 2|Pt , 其电池反应可表示为:H 2(g) + ?O 2(g) H 2O(l),E 1,m r G ?(1) 或2H 2(g) + O 2(g) 2H 2O(l),E 2,m r G ?(2)。 因2m r G ?(1) = m r G ?(2),所以2E 1= E 2。 9.电池(1) Ag|AgBr(s)|KBr(aq)|Br 2|Pt ,电池(2) Ag|AgNO 3(aq)||KBr(aq)|AgBr(s)|Ag 的电 池电动势E 1、E 2都与Br - 浓度无关。 10.在有液体接界电势的浓差电池中,当电池放电时,在液体接界处,离子总是从高浓 度向低浓度扩散。 11.对于电池Zn|ZnSO 4(aq)||AgNO 3(aq)|Ag ,其中的盐桥可以用饱和KCl 溶液。 12. 电池Ag | Ag +(aq)||Cl -(aq)|Cl 2(g),Pt 与Ag(s),AgCl(s)|Cl -(aq)|Cl 2(g),Pt 对应 一个电池反应. 二、单选题: 1.丹聂尔电池(铜 - 锌电池)在放电和充电时锌电极分别称为: (A) 负极和阴极 ; (B) 正极和阳极 ; (C) 阳极和负极 ; (D) 阴极和正极 。 2.韦斯登标准电池放电时正极上发生的反应为: (A) Cd 2+ + 2e Cd ; (B) PbSO 4(s) + 2e Pb + SO 42- ; (C) Hg 2SO 4(s) + 2e 2Hg(l) + SO 42- ;(D) Hg 2Cl 2(s) + 2e 2Hg(l) + 2Cl - 。 3.下列说法不属于可逆电池特性的是: (A) 电池放电与充电过程电流无限小; (B) 电池的工作过程肯定为热力学可逆过程; (C) 电池内的化学反应在正逆方向彼此相反; (D) 电池所对应的化学反应Δr G m = 0 。 4.电池在下列三种情况:(1)I→0;(2)有一定电流;(3)短路。忽略电池内电阻,下列说 法正确的: (A) 电池电动势改变 ; (B) 电池输出电压不变 ; (C) 对外输出电能相同 ; (D) 对外输出电功率相等 。
可逆电池电动势及其应用 一、简答题 1.标准电极电势等于电极与周围活度为1的电解质之间的电势差,这种说法对吗?为什么? 2.为什么要提出标准氢电极?标准氢电极θ?实际上是否为零?当H +的活度不等 于1时,2,H H ?+是否仍为零? 3.在公式m r H ?=-zEF +zFT (E T ??)p 中,当(E T ??)p <0时,测定m r H ?<-zEF ,则m r H ?一部分转变为电功,一部分以热的形式放出。所以在相同的始终态下,化学反应的m r H ?比安排成电池的m r H ?大,这种说法对不对?为什么? 4.将下列化学反应设计成电池: (1)AgBr(s)→Ag ++Br -; (2) Fe 3++Ag→Fe 2++Ag +; (3) 2Br -+Cl 2(g)→Br 2(l)+2Cl -。 5.将下列反应物设计成电池: (1) Ti ++Sn 4+→Ti 3++Sn 2+; (2) 2Br -+Cl 2→Br 2+2Cl -; (3) AgCl+I -→AgI+Cl -。 6.为什么不能用普通电压表直接测量可逆电池的电动势? 7.Zn 和Ag 插在HCl 溶液中所构成的原电池是否是可逆电池?为什么? 8.下列两个反应设计成电池,此两个电池的E θ、电池反应的ΔG θ及K θ是否相同?为什么?(1)H 2(g)+1/2O 2(g)→H 2O(l) (2)2H 2(g)+ O 2(g)→2H 2O(l) 9.已知电池Ag-AgCl(s)|HCl (m=0.01 mol·kg -1)| Cl 2 (g, p )| Pt 在25℃时,E=1.135V ,如果以m=0.10 mol·kg -1代替m=0.01 mol·kg -1的HCl ,电池电动势将改变多少? 10.同一反应,如Cu 2+ + Zn = Cu + Zn 2+,化学反应的热效应和电池反应的热效应是否相同?为什么? 二、计算题
题目部分,(卷面共有25题,分,各大题标有题量和总分) 一、选择(25小题,共分) 1.(2分)电极 Tl 3+,Tl +/Pt 的电势为 1$= V,电极 Tl +/Tl 的电势 2$= V 则电极 Tl 3+/Tl 的电势 3$ 为: ( ) A 、 V B 、 V C 、 V D 、 V 2.(2分)以下关于玻璃电极的说法正确的是: ( ) A 、 玻璃电极是一种不可逆电极 B 、 玻璃电极的工作原理是根据膜内外溶液中被测离子的交换 C 、 玻璃电极易受溶液中存在的氧化剂、还原剂的干扰 D 、 玻璃电极是离子选择性电极的一种 3.(2分)反应 Cu 2+(a 1)─→Cu 2+(a 2), 已知 a 1>a 2, 可构成两种电池 (1) Cu(s)│Cu 2+(a 2)‖Cu 2+(a 1)│Cu(s) (2) Pt │Cu 2+(a 2),Cu +(a ')‖Cu 2+(a 1),Cu +(a ')│Pt 这两个电池电动势 E 1与E 2的关系为: ( ) A 、 E 1=E 2 B 、 E 1=2 E 2 C 、 E 1=12E 2 D 、 无法比较 4.(2分)298 K 时,在下列电池的右边溶液中加入 mol ·kg -1的 Na 2S 溶液, 则电池的电动 势将: ( ) Pt │H 2(p )│H +(a =1)‖CuSO 4 mol ·kg -1)│Cu(s) A 、 升高 B 、 下降 C 、 不变 D 、 无法判断 5.(1分)已知 (Zn 2+,Zn)=- V, 则下列电池反应的电动势为:Zn(s)+2 H +(a =1)= Zn 2+(a =1)+H 2(p ) ( ) A 、 V B 、 V C 、 0 V D 、 无法确定 6.(2分)已知 (Cl 2/Cl -)= V, (Br 2/Br -)= V, (I 2/I -)= V, (Fe 3+/Fe 2+) = V 。请判断在相同温度和标准态下说法正确的是: ( ) A 、 只有 I - 能被 Fe 3+ 所氧化 B 、 Br - 和Cl - 都能被 Fe 3+ 所氧化 C 、 卤离子都能被 Fe 3+ 所氧化 D 、 卤离子都不能被 Fe 3+ 所氧化 7.(2分)298 K 时,已知 (Fe 3+,Fe 2+)= V, (Sn 4+,Sn 2+)= V, 当这两个电极组成 自发电池时, E 为: ( ) A 、 V B 、 V C 、 V D 、 V 8.(2分)在 298 K 时,浓度为 mol ·kg -1和 mol ·kg -1 HCl 溶液的液接电势为E J (1), 浓度为 mol ·kg -1和 mol ·kg -1 KCl 溶液的液接电势 E J (2) 则: ( ) A 、 E J (1) = E J (2) B 、 E J (1) > E J (2)
第九章 可逆电池 本章用化学热力学的观点讨论电极反应的可逆行为。原电池是将化学能转变为电能的装置,两个电极和电解质溶液是电池最重要的组成部分。电极电势是本章主要概念之一,它是相对于标准氢电极而言的电势,是一种相对值,即把一个电极与标准氢电极组成一个已消除了液接电势的原电池,其电动势就是给定电极的标准电极电势。对于一个可逆化学电池,电极两极间的电势差称电池的电动势,可用电池反应的能斯特方程计算。因为电池电动势与热力学量之间密切相关,所以本章内容是围绕电动势而展开。 一、基本内容 (一) m r G ?=-zFE 式中m r G ?为电池反应的摩尔吉布斯自由能变;z 是电池反应的电子的物质的量;E 为电池的电动势。此式运用于等温等压的可逆过程,所以E 为可逆电池的电动势。此式表明,在可逆电池中,化学反应的化学能(m r G ?)全部转变成了电能z FE 。该式将化学反应的性质与电池的性质联系起来,是电化学的基本公式之一。若参与电池反应的所有物质均处于各自的标准态,则上式成为 θ m r G ?=-zFE $ 其中E $称为电池的标准电动势,对于指定的电池,E $只是温度的函数。 (二) 电池反应的能斯特公式 若电池反应为 aA+bB =gG+hH E=E $ -zF RT ㏑b B a A h H g G a a a a ?? 此式表明,电池的电动势取决于参加反应的各物质的状态,它对如何改变电池电动势具有指导的意义,计算时首先要正确写出电池反应式。 (三) 电极反应的能斯特公式 若电极反应为 aA+bB+ze -=gG+hH E=E $ -zF RT ㏑b B a A h H g G a a a a ??
第九章可逆电池的电动势及其应用 (12学时) 物理化学教研室
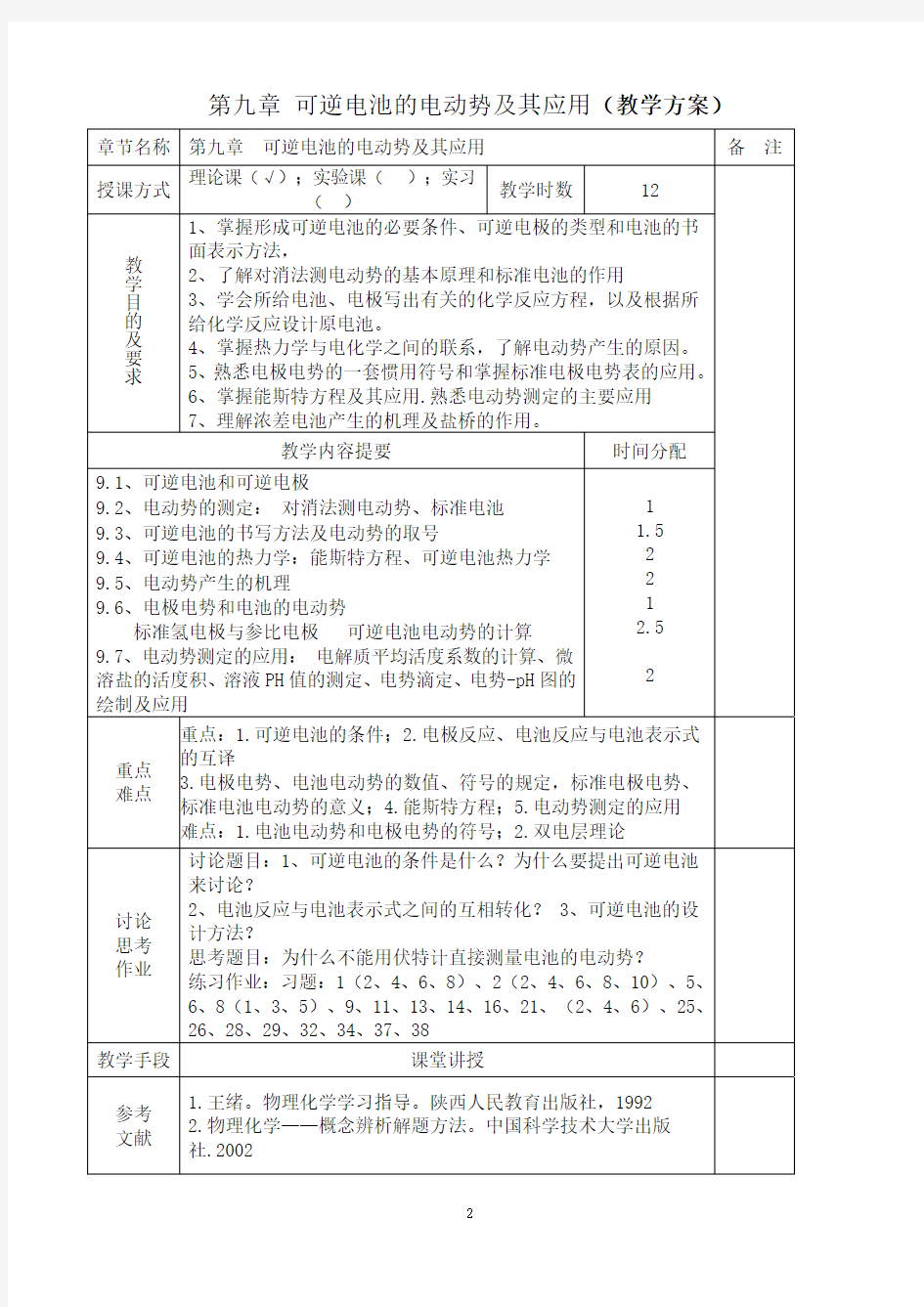
第九章 可逆电池的电动势及其应用(教学方案) 章节名称 第九章 可逆电池的电动势及其应用 备 注 授课方式 理论课(√);实验课( );实习 ( ) 教学时数12 教学目的及要求1、掌握形成可逆电池的必要条件、可逆电极的类型和电池的书面表示方法, 2、了解对消法测电动势的基本原理和标准电池的作用 3、学会所给电池、电极写出有关的化学反应方程,以及根据所给化学反应设计原电池。 4、掌握热力学与电化学之间的联系,了解电动势产生的原因。 5、熟悉电极电势的一套惯用符号和掌握标准电极电势表的应用。 6、掌握能斯特方程及其应用.熟悉电动势测定的主要应用 7、理解浓差电池产生的机理及盐桥的作用。 教学内容提要 时间分配 9.1、可逆电池和可逆电极 9.2、电动势的测定: 对消法测电动势、标准电池 9.3、可逆电池的书写方法及电动势的取号 9.4、可逆电池的热力学:能斯特方程、可逆电池热力学 9.5、电动势产生的机理 9.6、电极电势和电池的电动势 标准氢电极与参比电极 可逆电池电动势的计算 9.7、电动势测定的应用: 电解质平均活度系数的计算、微溶盐的活度积、溶液PH值的测定、电势滴定、电势-pH图的绘制及应用 1 1.5 2 2 1 2.5 2 重点 难点 重点:1.可逆电池的条件;2.电极反应、电池反应与电池表示式的互译 3.电极电势、电池电动势的数值、符号的规定,标准电极电势、标准电池电动势的意义; 4.能斯特方程; 5.电动势测定的应用 难点:1.电池电动势和电极电势的符号;2.双电层理论 讨论 思考 作业 讨论题目:1、可逆电池的条件是什么?为什么要提出可逆电池来讨论? 2、电池反应与电池表示式之间的互相转化? 3、可逆电池的设计方法? 思考题目:为什么不能用伏特计直接测量电池的电动势? 练习作业:习题:1(2、4、6、8)、2(2、4、6、8、10)、5、6、8(1、3、5)、9、11、13、14、16、21、(2、4、6)、25、26、28、29、32、34、37、38 教学手段 课堂讲授 参考 文献 1.王绪。物理化学学习指导。陕西人民教育出版社,1992 2.物理化学——概念辨析解题方法。中国科学技术大学出版社.2002
实验报告 一、数据记录和处理 1. 室温时各电池的电池电动势测定 T室温= 289.15K 表1 室温时各电池的电池电动势 2. 数据处理 (1)写出a、b、c、d各被测电池的表达式、电极反应和电池反应。 a. 电池的表达式:Hg│Hg2Cl2 (s)│KCl(饱和)‖AgNO3(0.0100 mol/L)│Ag 电极反应: Hg + Cl-(饱和) + Ag + = 1/2 Hg2Cl2 + Ag 负极:Hg + Cl-(饱和)= 1/2 Hg2Cl2 + e- 正极:Ag ++ e-= Ag b. 电池的表达式:Hg│Hg2Cl2 (s)│KCl(饱和)‖Q,QH2,H+│Pt 电极反应: C6H4O2(醌)+ 2H+ + 2e- = C6H4(OH)2(氢醌) 负极:2Hg+ 2Cl- - 2e- → Hg2Cl2 正极:Q + 2H+ + 2e- → QH2
c. 电池的表达式:Hg │Hg 2Cl 2(s)│KCl(饱和)‖AgNO 3(0.100 mol/L)│Ag 电极反应: Hg + Cl -(饱和) + Ag + = 1/2 Hg 2Cl 2 + Ag 负极:Hg + Cl -(饱和)= 1/2 Hg 2Cl 2 + e - 正极:Ag + + e - = Ag d. 电池的表达式:Ag │AgCl (s)│HCl (0.1 mol/L)‖AgNO 3(0.100 mol/L)│Ag 电极反应: Ag + + Cl - = Ag 负极:Ag + Cl - - e - → AgCl 正极:Ag + + e - → Ag (2)由电池(a )的电动势计算银电极电势。根据能斯特公式计算银电极的标准电极电势。与文献值比较,求相对误差(已知0.01001 -?kg mol AgNO 3溶液的离子平均活度系数±γ=0.90) 。饱和甘汞电极电势和银电极的标准电极电势文献值见附表9-17。 查附表9-17计算饱和甘汞电极的电极电势和银电极的标准电极电势: =饱和甘汞?0.24735 V θ?Ag Ag + =0.80773 V 由饱和甘汞??-=+Ag Ag E 得: =+ Ag Ag ?0.70267 V 再由能斯特方程+ ++ -=Ag Ag Ag Ag Ag F RT α??θ1ln 得θ ?Ag Ag + θ ?Ag Ag + =0.70267 + 8.314*289.15/96500*ln(1/0.01) =0.81739 V 并计算银电极标准电极电势的相对误差:
第十章 可逆电池练习题 一、判断题: 1.电池(a) Ag,AgCl|KCl(aq)|Hg 2Cl 2,Hg 与电池(b) Hg,Hg 2Cl 2|KCl(aq)|AgNO 3(aq)|Ag 的电 池反应可逆。 2.恒温、恒压下,ΔG > 0的反应不能进行。 3.电池Zn|ZnCl 2(aq)|AgCl(s)|Ag 在25℃、p 下可逆放电2F 时放热23.12 kJ ,则该电池 反应:Zn + 2AgCl(s) ZnCl 2 + 2Ag 的m r H ?(298K) = -23.12 kJ ·mol -1。 4.Zn 2+ + 2e Zn ,E 1,m r G ?(1);?Zn 2++e ?Zn ,E 2 ,m r G ?(2)。因 E 1= E 2,所以有:m r G ?(1) = m r G ?(2)。 5.Fe 2+ + 2e Fe ,E 1,m r G ?(1) ;Fe 3+ + e Fe 2+ ,E 2 ,m r G ?(2); (1) + (2),得:Fe 3+ + 3e Fe ,E 3,m r G ?(3)。 则:m r G ?(3) = m r G ?(1) + m r G ?(2),E 3=E 1 + E 2。 6.2H + + 2e H 2,E 1与2H 2O + 2e H 2 + 2OH -,E 2,因它们都是氢电极反应, 所以φ1 = φ2。 7.对于电极Pt |Cl 2(p )|Cl - 其还原电极电势为: φ(Cl -/Cl 2) = φ(Cl -/Cl 2) - (RT /2F )ln{[p (Cl 2)/[p a 2(Cl -)]] 。 8.对于电池Pt|H 2|H 2SO 4(aq)|O 2|Pt , 其电池反应可表示为:H 2(g) + ?O 2(g) H 2O(l),E 1,m r G ?(1) 或2H 2(g) + O 2(g) 2H 2O(l),E 2,m r G ?(2)。 因2m r G ?(1) = m r G ?(2),所以2E 1= E 2。 9.电池(1) Ag|AgBr(s)|KBr(aq)|Br 2|Pt ,电池(2) Ag|AgNO 3(aq)||KBr(aq)|AgBr(s)|Ag 的电 池电动势E 1、E 2都与Br - 浓度无关。 10.在有液体接界电势的浓差电池中,当电池放电时,在液体接界处,离子总是从高浓 度向低浓度扩散。 11.对于电池Zn|ZnSO 4(aq)||AgNO 3(aq)|Ag ,其中的盐桥可以用饱和KCl 溶液。 12. 电池Ag | Ag +(aq)||Cl -(aq)|Cl 2(g),Pt 与Ag(s),AgCl(s)|Cl -(aq)|Cl 2(g),Pt 对应 一个电池反应. 二、单选题: 1.丹聂尔电池(铜 - 锌电池)在放电和充电时锌电极分别称为: (A) 负极和阴极 ; (B) 正极和阳极 ; (C) 阳极和负极 ; (D) 阴极和正极 。 2.韦斯登标准电池放电时正极上发生的反应为: (A) Cd 2+ + 2e Cd ; (B) PbSO 4(s) + 2e Pb + SO 42- ; (C) Hg 2SO 4(s) + 2e 2Hg(l) + SO 42- ;(D) Hg 2Cl 2(s) + 2e 2Hg(l) + 2Cl - 。 3.下列说法不属于可逆电池特性的是: (A) 电池放电与充电过程电流无限小; (B) 电池的工作过程肯定为热力学可逆过程; (C) 电池内的化学反应在正逆方向彼此相反; (D) 电池所对应的化学反应Δr G m = 0 。 4.电池在下列三种情况:(1)I →0;(2)有一定电流;(3)短路。忽略电池内电阻,下列说
第八章可逆电池的电动势及其应用练习题 一、是非题 1.电池的正极即阳极,负极即阴极。 2.在电池工作时,电解质溶液中的阳离子向正极迁移,阴离子向负极迁移。 3.一电池若在可逆条件下工作,必有E-V外=δE。 4. 电极Pt|Cl2(P)|Cl-(a)属于第二类电极。 5.Weston标准工作时,阴极反应为Hg2SO4(s)+2e- 2Hg(l)+SO42-。 6.液接电势与接触电势产生的基本原因相同。 7.国际上规定标准氢电极的电势值为零,且与温度无关。 8.CuSO4浓度不同的两个同电极组成自发性浓差电池时,CuSO4浓度大的 电极为正极。 9.电池中的液接电势不能完全消除。 10.根据H2O的电势-pH图可知,在氧线以上为H2O不稳定区。 二、填空题 1.Pt|O2(P)|OH-属第————类电极。 2.自发性电池的电动势E————。 3.自发性可逆电池的等压热效应与过程热之差Δr H m - Q R————0。
4.有两个电极:① Pt|Cl (P )|Cl -(a 1)②Cu (s )|Cu 2+(a 2) 组成一自发性电池时, 正极应是 ————。(填①或②) 5.一电池电动势的温度系数小雨零,则电池反应的过程热Q R ——0。 6.电极Zn|Zn 2+(a 1)和Ag(s)|Ag(a 2) 组成一自发性电池时,应选用的盐桥电解质是————。 7.当任意给定电极与标准氢电极组成原电池:标准氢电极||给定电极 若给定电极发生的是氧化反应, 则 x ?———— 0。 8.电池K(Hg)(a 1)|KCl(m )|K(Hg)(a 2) 若为非自发电池,则必然是a 1————a 2。 9.自发性电池的反应为Ag ++Cl - ?AgCl(s),达到平衡态时电动势E ———0。 10. Weston 标准电池在298.15K 时,电动势E =———V 。(小数点后第五位4舍5入)。 三、单选题(选一个最佳答案): 1.实际的电池工作时 (A) 物质变化和能量转换都是可逆的。 (B) 只有物质变化是可逆的 (C) 能量转换肯定不可逆,物质变化可能可逆。 (D) 只有能量转换是可逆的。 2.下例电极中属第二类的是 (A ) K (Ag )|KCl (m ) (B ) Pt|- r B Br 2(l )|Br -- r B (a ) (C ) Ag|AgCl (s )|KCl (m ) (D ) Pt|Fe 3+ , Fe 2+ 3.下面的说法中正确的是 (A ) 原电池的阴极就是正极 (B ) 原电池的负极就是阴极 (C ) 电解池的正极就是阴极
第九章 可逆电池与电动势 一. 重点内容 * 可逆电池条件:1. 充、放电时的反应完全可逆 2. 流经电池的电流无限小。因而测量电动势用对消法。 * 规定 发生氧化反应的是阳极。发生还原反应的是阴极 电势高的为正极;电势低的为负极 电池:阳极(负极) 阴极(正极) 电解池:阳极(正极) 阴极(负极) 电池式的左边是负极,右边是正极 能熟练地由电池式写出电极反应和电池反应 掌握如何设计电池 可逆电池热力学 O O O m r K RT zFE G ln -=-=? zFE G m r -=? p m r T E zF S ? ?? ????=? p m r R T E zFT S T Q ? ?? ????=?= p R m r m r m r m r T E zFT zFE Q G S T G H ? ?? ????+-=+?=?+?=? 注意:在封闭体系仅作膨胀功时有p Q H =? ;作电功时 p Q H ≠? 例如:对错题 在恒定压力下电解水制氢 ) g (O 2 1)g (H )(O H 2 2 2 + ??→?电解 l ,则 p Q H =? 答:错 当缺乏E 与T 的关系式时,温度系数也可近似计算,1 212T T E E T E p --≈ ??? ???? 已知 T 1 时的电动势 E 1 ,则可由温度系数计算T 2 时的电动势 E 2 * 能斯特方程 电池反应为 hH gG dD cC +?→? + 时
d D c C h H g G O a a a a zF RT E E ??- =ln 对电极电势 (氧化态)还原态)a a zF RT O (ln - =?? 例如: ) (2)(22s Cu e a Cu Cu ?→?+- + + )(+ + + - =2221ln 2)/()/(Cu a F RT Cu Cu Cu Cu O ?? 又: ) (22)(2=- - ?→?+Cl O a Cl e p Cl - - =- -Cl O a F RT Cl Cl Cl Cl ln )/()/(22?? 计算电动势E 。和标准电动势以及平均活度系数等均需要利用此类方程 活度积的计算 例如: 溶解反应:- + +?→←Cl Ag s AgCl )( 设计电池:氧化电极:- + +?→←e Ag s Ag )( 还原电极:- - +?→?+Cl s Ag e s AgCl )()( 电池反应:- + +?→?Cl Ag s AgCl )( )/()/(Ag Ag Cl Ag AgCl E O O O + - + -+=?? ??? ? ??=?=- + RT zFE a a K O Cl Ag ap exp 二 ,例题 例1. 电池 Cu │Cu +‖Cu +,Cu 2+│Pt 和Cu │Cu 2+‖Cu +,Cu 2+│Pt 的反应均可简写作 Cu +Cu 2+=2Cu +, 此两电池的: (A)O m r G ?、O E 相同 (B) O m r G ?相同,O E 不相同 (C) O m r G ?不相同,O E 相同 (D) O m r G ?、O E 均不相同 答 (B) 例2. 应用能斯特方程计算出电池E <0,这表示电池的反应: (A) 不可能进行 (B) 反应已达平衡 (C) 反应能进行,但和电池的书面表示式刚好相反 (D) 反应方向不能确定