
实验六循环伏安法测定电极反应参数
一、实验目的
1. 学习循环伏安法测定电极反应参数的基本原理。
2. 熟悉伏安法测量的实验技术。
二、方法原理
循环伏安法(CV)是最重要的电分析化学研究方法之一。在电化学、无机化学、有机化学、生物化学的研究领域广泛应用。由于它仪器简单、操作方便、图谱解析直观,常常是首先进行实验的方法。CV方法是将循环变化的电压施加于工作电极和参比电极之间,记录工作电极上得到的电流与施加电压的关系曲线。这种方法也常称为三角波线性电位扫描方法。
图6—1 循环伏安法的典型激发信号图6—2
图6—1中表明了施加电压的变化方式:起扫电位为0.8V,反向起扫电位为-0.2V,终点又回扫到0.8V,扫描速度可从斜率反映出来,其值为
50mV/s。图6-1循环伏安法的典型激发信号三角波电位,转换电位为0.8V和-0.2V(vs.SCE〉虚线表示的是第二次循环。一台现代的电化学分析仪具有多种功能,可方便地进行一次或多次循环,任意变换扫描电压范围和扫描速度。当工作电极被施加的扫描电压激发时;其上将产生响应电流。以该电流(纵坐标)对电位(横坐标)作图,称为循环伏安图。
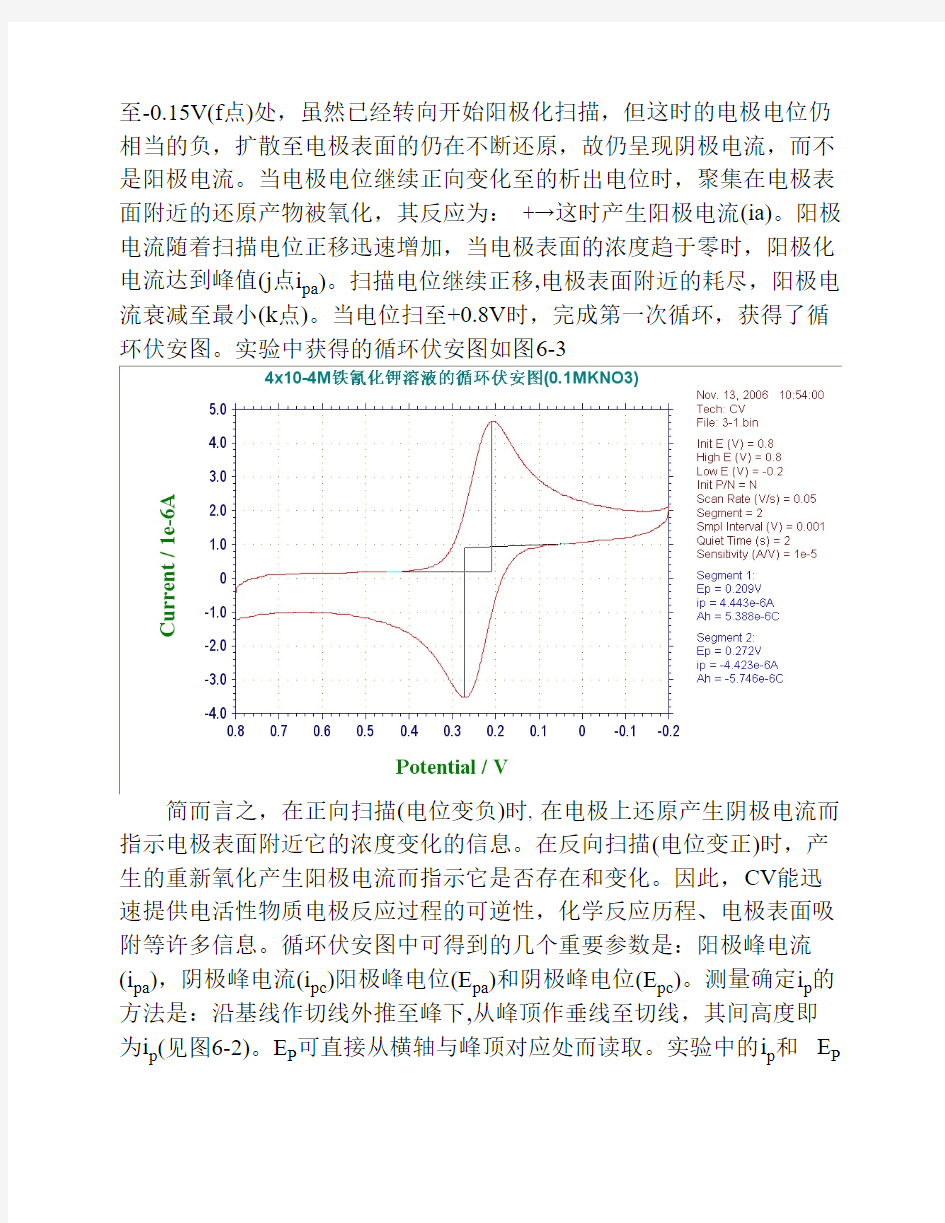
典型的循环伏安图如图6-2所示。该图是在1.0mol/L KNO3电解质溶液中,6×10-3mol/LK3Fe(CN)6在Pt工作电极上的反应所得到的结果。从图可见,起始电位Ei为+0.8V(a点),电位比较正的目的是为了避免电极接通后发生电解。然后沿负的电位扫描,如箭头所指方向,当电位至可还原时,即析出电位,将产生阴极电流(b点)。其电极反应为:,随着电位的变负,阴极电流迅速增加(b→d),直至电极表面的浓度趋近零,电流在d点达到最高峰。然后电流迅速衰减(d→g),这是因为电极表面附近溶液中的几乎全部电解转变为而耗尽,即所谓的贫乏效应。当电压扫
至-0.15V(f点)处,虽然已经转向开始阳极化扫描,但这时的电极电位仍相当的负,扩散至电极表面的仍在不断还原,故仍呈现阴极电流,而不是阳极电流。当电极电位继续正向变化至的析出电位时,聚集在电极表面附近的还原产物被氧化,其反应为: +→这时产生阳极电流(ia)。阳极电流随着扫描电位正移迅速增加,当电极表面的浓度趋于零时,阳极化电流达到峰值(j点i pa)。扫描电位继续正移,电极表面附近的耗尽,阳极电流衰减至最小(k点)。当电位扫至+0.8V时,完成第一次循环,获得了循环伏安图。实验中获得的循环伏安图如图6-3
简而言之,在正向扫描(电位变负)时, 在电极上还原产生阴极电流而指示电极表面附近它的浓度变化的信息。在反向扫描(电位变正)时,产生的重新氧化产生阳极电流而指示它是否存在和变化。因此,CV能迅速提供电活性物质电极反应过程的可逆性,化学反应历程、电极表面吸附等许多信息。循环伏安图中可得到的几个重要参数是:阳极峰电流(i pa),阴极峰电流(i pc)阳极峰电位(E pa)和阴极峰电位(E pc)。测量确定i p的方法是:沿基线作切线外推至峰下,从峰顶作垂线至切线,其间高度即为i p(见图6-2)。E P可直接从横轴与峰顶对应处而读取。实验中的i p和E P
均可直接由仪器上读取(见图6-3)。对可逆氧化还原电对的条件电位,与E pa和E pc的关系可表示为:
(6-1)
而两峰之间的电位差值为:
(6-2)
对铁氰化钾电对,其反应为单电子过程, 是多少?从实验求出来与理论值比较。
对可逆体系的正向峰电流,由Randles-savcik方程可表示为:
(6-3)
为峰电流(A),n为电子转移数,A为电极面积(cm2),D为扩散系数(cm2/s),为扫描速度(V/s),c为浓度(mol/L)。根据(11-13)式, 与1/2和c都是直线关系,对研究电极反应过程具有重要意义。在可逆电极反应过程中,
(6-4)
对一个简单的电极反应过程,式(11-12)和式(11—14)是判别电极反应是否可逆体系的重要依据。
三、仪器和试剂
1. CHI830 、CHI620 、CHI660电化学分析仪。
2. 圆盘型工作电极、铂丝辅助电极和饱和甘汞参比电极组成电极系统。
3. 铁氰化钾溶液:2.0×10-2mo1/L.
4. 硝酸钾溶液:1.0 mo1/L.
四、实验步骤
1. Pt(玻碳电极)工作电极预处理。将Pt(玻碳电极)工作电极在放有氧化铝粉沫的抛光布上轻轻研磨一分钟,二次蒸馏水拎洗干净后,用超声波清洗1min,用滤纸吸干表面水分即可进行测定。
2. 配制试液。
在5个50mL容量瓶中,分别加入2.0×10-zmol/L的铁氰化钾溶液0,0.5mL,1.0mL,2.0.00mL,5.0mL,再各加人1mol/L的硝酸钾溶液
5.0mL。用二次蒸馏水稀释至刻度,摇匀。
3. 循环伏安法测量。将配制的系列铁氰化钾溶液逐一转移至电解池中,插入干净的电极系统。起始电位+0.8V,转向电位-0.1V,以50mV/s 的扫描速度测量,当测量2×10-3mol/L的溶液时,逐一变化扫描速度:20mV/s,50mV/s,100mV/s,125mV/s,150mV/s,175mV/s,200mV/s 进行测量。在完成每一个扫速的测定后,要重新处理电极。
五、结果处理
1. 列表总结铁氰化钾溶液的测量结果(Epa,Epc,△Epa,ipa ,ipc)。
2. 绘制铁氰化钾溶液的的ipa与ipc相应浓度c的关系曲线;绘制ipa与ipc与相应的v1/2关系曲线。
3. 求算铁氧化饵电极反应的n和E·'。
六、问题讨论
1. 铁氰化钾的Epa对其相应的v是什么关系?由此可表明什么?
2. 由铁氰化钾的循环伏安图解释它在电极上的可能反应机理。
8.1 一般规定 8.1.1 水文地质参数的计算,必须在分析勘察区水文地质条件的基础上,合理地选用公式(选用的公式应注明出处)。 8.1.2 本章所列潜水孔的计算公式,当采用观测孔资料时,其使用范围应限制在抽水孔水位下降漏斗坡度小于1/4处。 8.2 渗透系数 8.2.1 单孔稳定流抽水试验,当利用抽水孔的水位下降资料计算渗透系数时,可采用下列公式: 1 当Q~s(或Δh2)关系曲线呈直线时, 1)承压水完整孔: (8.2.1-1) 2)承压水非完整孔: 当M>150r,l/M>0.1时: (8.2.1-2) 或当过滤器位于含水层的顶部或底部时: (8.2.1-3)
3)潜水完整孔: (8.2.1-4) 4)潜水非完整孔: 当>150r,l>0.1时: (8.2.1-5) 或当过滤器位于含水层的顶部或底部时: (8.2.1-6)式中K——渗透系数(m/d); Q——出水量(m3/d); s——水位下降值(m); M——承压水含水层的厚度(m); H——自然情况下潜水含水层的厚度(m); h——潜水含水层在自然情况下和抽水试验时的厚度的平均值(m); h——潜水含水层在抽水试验时的厚度(m); l——过滤器的长度(m); r——抽水孔过滤器的半径(m);
R——影响半径(m)。 2 当Q~s(或Δh2)关系曲线呈曲线时,可采用插值法得出Q~s 代数多项式,即: s=a1Q+a2Q2+……a n Qn (8.2.1-7) 式中a1、a2……a n——待定系数。 注:a1宜按均差表求得后,可相应地将公式(8.2.1-1)、(8.2.1-2)、(8.2.1-3)中的 Q/s和公式(8.2.1-4)、(8.2.1-5)、(8.2.1-6)中的以1/a1代换,分别进行计算。 3 当s/Q (或Δh2/Q)~Q关系曲线呈直线时,可采用作图截距法求出a1后,按本条第二款代换,并计算。 8.2.2 单孔稳定流抽水试验,当利用观测孔中的水位下降资料计算渗透系数时,若观测孔中的值s(或Δh2)在s(或Δh2)~lgr关系曲线上能连成直线,可采用下列公式: 1 承压水完整孔: (8.2.2-1) 2 潜水完整孔: (8.2.2-2) 式中s1、s2——在s~lgr关系曲线的直线段上任意两点的纵坐标值(m); ——在Δh2~lgr关系曲线的直线段上任意两点的纵坐标值(m2); r1、r2———在s(或Δh2)~lgr关系曲线上纵坐标为s1、s2(或)的两点至抽水孔的距离(m)。
华南师范大学实验报告 学生姓名学号2014 专业新能源材料与器件年级、班级2014 课程名称电化学实验实验项目循环伏安法测定电极反应参数实验类型□√验证□设计□综合实验时间2016年4月25日 实验指导老师吕东生实验评分
一、实验目的 1.了解循环伏安法的基本原理及应用 2. 掌握循环伏安法的实验技术和有关参数的测定方法。 二、实验原理 循环伏安法(Cyclic Voltammetry)是一种常用的电化学研究方法。该法控制电极电势以不同的速率,随时间以三角波形一次或多次反复扫描,电势范围是使电极上能交替发生不同的还原和氧化反应,并记录电流-电势曲线。根据曲线形状可以判断电极反应的可逆程度,中间体、相界吸附或新相形成的可能性,以及偶联化学反应的性质等。常用来测量电极反应参数,判断其控制步骤和反应机理,并观察整个电势扫描范围内可发生哪些反应,及其性质如何。对于一个新的电化学体系,首选的研究方法往往就是循环伏安法。该方法使用的仪器简单,操作方便,图谱解析直观,在电化学、无机化学、有机化学、生物化学等许多研究领域被广泛使用。循环伏安法通常采用三电极系统,一支工作电极(被研究物质起反应的电极),,一支参比电极,一支对电极。外加电压在工作电极和辅助电极之间,反应电流通过工作电极与辅助电极。 图1 循环伏安法测得的氧化还原曲线 正向扫描的峰电流i p 与v^0.5和C都成线性关系,对研究电极过程具有重要意义。标准 电极电势为:EΘ=(E pa +E pc )/2。所以对可逆过程,循环伏安法是一个方便的测量标准电极 电位的方法。 三、实验器材 CHI电化学工作站;玻碳电极;铂电极;Hg/Hg2SO4电极;0.1 mol/L VO2+ + 0.1 mol/L VO2+ +3 mol/L H2SO4溶液 四、实验步骤 1. 预处理电极
双代号网络图计算方法是每年建造师考试中的必考题,小到选择题、大到案例分析题,笔者在此总结2种计算方法,并附实例,供大家参考学习,互相交流,考出好成绩。 双代号网络图计算方法一 一、要点: 任何一个工作总时差≥自由时差 自由时差等于各时间间隔的最小值(这点对六时参数的计算非常用用) 关键线路上相邻工作的时间间隔为零,且自由时差=总时差 最迟开始时间—最早开始时间(最小) 关键工作:总时差最小的工作 最迟完成时间—最早完成时间(最小) 在网络计划中,计算工期是根据终点节点的最早完成时间的最大值 二、双代号网络图六时参数我总结的计算步骤(比书上简单得多) ①② t过程 做题次序: 1 4 5 ES LS TF 2 3 6 FS LF FF
步骤一: 1、A 上再做A 下 2 3、起点的A 上=0,下一个的A 上 A 上 4、A 下=A 上+t 过程(时间) 步骤二: 1、 B 下再做B 上 2、 做的方向从结束点往开始点 3、 结束点B 下=T (需要的总时间=结束工作节点中最大的A 下) 结束点B 上=T-t 过程(时间) 4、B 下=前一个的B 上(这里的前一个是从终点起算的) 遇到多指出去的时,取数值小的B 上 B 上=B 下—t 过程(时间) 步骤三: 总时差=B 上—A 上=B 下—A 下 如果不相等,你就是算错了 步骤四: 自由时差=紧后工作A 上(取最小的)—本工作A 下 =紧后工作的最早开始时间—本工作的最迟开始时间 (有多个紧后工作的取最小值) 例:
双代号网络图计算方法二 一、双代号网络图6个时间参数的计算方法(图上计算法) 从左向右累加,多个紧前取大,计算最早开始结束; 从右到左累减,多个紧后取小,计算最迟结束开始。 紧后左上-自己右下=自由时差。 上方之差或下方之差是总时差。 计算某工作总时差的简单方法:①找出关键线路,计算总工期; ②找出经过该工作的所有线路,求出最长的时间 ③该工作总时差=总工期-② 二、双代号时标网络图 双代号时标网络计划是以时间坐标为尺度编制的网络计划,以实
实验四循环结构设计实现 一、实验目的 1. 掌握while,do-while循环语句的使用与区别; 2. 掌握循环条件、循环体、循环终止等循环要素, 3. 理解循环的执行过程。 二、实验内容 1、上机验证课堂实例:求1+2+3+…+100的和。要求分别用while和do-while和for语句实现。 2、打印出所有的“水仙花数”。 算法提示: 1)水仙花数是一个3位数,被判断的范围是[100,999]。 2)如何分离出百、十、个位数。可参考教材P115例5.16。 3、验证课堂例题:打印“九九乘法表”。 4、公元钱五世纪,我国古代数学家张丘建在《算经》一书中提出了“百鸡问题”:鸡翁一值钱五,鸡母一值钱三,鸡雏三值钱一。百钱买百鸡,问鸡翁、鸡母、鸡雏各几何? 数学模型:设i代表母鸡数,j代表公鸡数,k代表小鸡数。用凑数法解决问题。 i+j+k=100 (1) 5*i+3*j+k\3=100 (2) 算法提示: S1. i从1到20依次一一取值; S2.对每一个固定的i值,j都要从1到33依次一一取一遍值; S3.对每一个固定的i值及每一个固定的j值,按公式k=100-i-j取得k值; S4.做下列验证工作:S3中所取的一组i,j,k是否满足条件(2) 5*i+3*j+1/3*k=100? 若满足,则输出这组解i,j,k,然后转2;否则直接转2。 当i已取到20,j也取到33时整个任务就结束。 三、仪器、设备、材料 微机 四、实验准备 1.理论知识预习及要求 ①表达式的书写规范; ②while语句和do-while语句的格式、功能、执行过程; ③while语句和do-while语句间的区别; ④循环结构程序设计的简单算法。 2.实验指导书预习及要求 对程序执行流程不清楚时,请先画出程序的流程图. 上机前先思考编出程序,并分析结果,上机时调试,并写出实验结果。 3.其他准备
参数计算(第一版) 1.线路参数计算内容 1.1已知量: 线路型号(导线材料、截面积mm 2 )、长度(km)、排列方式、线间距离(m)、外径(mm)、分裂数、分裂距(m)、电压等级(kV)、基准电压U B (kV, 母线电压作为基准电压)、基准容量S B (100MVA)。 1.2待计算量: 电阻R(Ω/km)、线电抗X(Ω/km)、零序电阻R0(Ω/km)、零序电抗X0(Ω/km)、对地电纳B(S/km)、对地零序电纳B0(S/km)。 1.3计算公式: 1.3.1线路电阻 R=ρ/S (Ω/km) R*=R 2B B U S 式中 ρ——导线材料的电阻率(Ω·mm 2 /km); S ——线路导线的额定面积(mm 2)。 1.3.2线路的电抗 X=0.1445lg eq m r D +n 0157 .0(Ω/km) X*=X 2B B U S 式中 m D ——几何均距,m D =ac bc ab D D D (mm 或cm,其单位应与eq r 的单位相同); eq r ——等值半径, eq r =n n m rD 1 (mm,其中r 为导线半径); n ——每个导线的分裂数。 1.3.3零序电阻 R0=R+3R g (Ω/km)
R0*=R0 2B B U S 式中 R g ——大地电阻, R g =π2×10-4×f =9.869×10-4 ×f (Ω/km)。在f =50Hz 时, R g =0.05Ω/km 。 1.3.4零序电抗 X0=0.4335lg s g D D (Ω/km) X0*=X0 2B B U S 式中 g D ——等值深度, g D = γ f 660,其中γ为土壤的电导率,S/m 。当土壤电导率不 明确时,在一般计算中可取g D =1000m 。 s D ——几何平均半径, s D =32 m D r '其中r '为导线的等值半径。若r 为单根导 线的实际半径,则对非铁磁材料的圆形实心线,r '=0.779r ;对铜或铝的绞线,r '与绞线股数有关,一般r '=0.724~0.771r ;纲芯铝线取 r '=0.95r ;若为分裂导线,r '应为导线的相应等值半径。m D 为几何均 距。 1.3.5对地电钠 B= 610lg 58 .7-?eq m r D (S/km) B*=B B B S U 2 式中 m D ——几何均距,m D =ac bc ab D D D (mm 或cm,其单位应与eq r 的单位相同); eq r ——等值半径, eq r =n n m rD 1 -(其中r 为导线半径);
实验6 循环结构程序设计 一.实验目的 1.掌握在设计条件型循环结构时,如何正确地设定循环条件。 2.掌握如何正确地控制计数型循环结构的循环次数。 3.练习并掌握选择结构与循环结构的嵌套、多重循环的应用。 4.掌握在程序设计中用循环的方法实现一些常用算法,加强调试程序的能力。二.实验要求 1.复习while、do-while、for语句和continue、break语句。 2.能够用流程图表示实验题目的算法。 3.能够独立调试运行实验题目。 4.本实验要求4学时完成。 三.实验内容和步骤 题目1:分别用while循环和for循环计算:1+2+3+…+100=? 要求:写出程序并上机查看运行结果。 题目2:输入一行字符,分别统计出其中大小写英文字母、空格、数字和其他字母的个数。要求:程序填空并写出2组运行结果。 01#include
循环伏安法实验 【实验目的】 学习和掌握循环伏安法的原理和实验技术。 了解可逆波的循环伏安图的特性以及测算玻碳电极的有效面积的方法。 【实验原理】 循环伏安法是在固定面积的工作电极和参比电极之间加上对称的三角波扫 描电压(如图1),记录工作电极上得到的电流与施加电位的关系曲线(如图2),即循环伏安图。从伏安图的波形、氧化还原峰电流的数值及其比值、峰电位等可以判断电极反应机理。 与汞电极相比,物质在固体电极上伏安行为的重现性差,其原因与固体电极的表面状态直接有关,因而了解固体电极表面处理的方法和衡量电极表面被净化的程度,以及测算电极有效表面积的方法,是十分重要的。一般对这类问题要根据固体电极材料不同而采取适当的方法。 对于碳电极,一般以Fe(CN) 63-/4- 的氧化还原行为作电化学探针。首先,固体 电极表面的第一步处理是进行机械研磨、抛光至镜面程度。通常用于抛光电极的 材料有金钢砂、CeO 2、ZrO 2 、MgO和α-Al 2 O 3 粉及其抛光液。抛光时总是按抛 光剂粒度降低的顺序依次进行研磨,如对新的电极表面先经金钢砂纸粗研和细磨 后,再用一定粒度的α-Al 2O 3 粉在抛光布上进行抛光。抛光后先洗去表面污物, 再移入超声水浴中清洗,每次2~3分钟,重复三次,直至清洗干净。最后用乙 醇、稀酸和水彻底洗涤,得到一个平滑光洁的、新鲜的电极表面。将处理好的碳 图2:循环伏安曲线(i—E曲线)
电极放入含一定浓度的K 3Fe(CN)6和支持电解质的水溶液中,观察其伏安曲线。如得到如图2所示的曲线,其阴、阳极峰对称,两峰的电流值相等(i pc / i pa =1),峰峰电位差ΔE p 约为70 mV (理论值约59/n mV ),即说明电极表面已处理好,否则需重新抛光,直到达到要求。 有关电极有效表面积的计算,可根据Randles-Sevcik 公式: 在25°C 时,i p =(2.69×105 )n 3/2 AD o 1/2ν1/2 C o 其中A 为电极的有效面积(cm 2 ),D o 为反应物的扩散系数(cm 2 /s),n 为电极反应的电子转移数,ν为扫速(V/s ),C o 为反应物的浓度(mol/cm 3 ),i p 为峰电流(A )。 【仪器和试剂】 1. CHI 660D 电化学系统,玻碳电极(d = 4mm ) 为工作电极,银/氯化银电极为参比电极,铂片电极为辅助电极; 2. 固体铁氰化钾、H 2SO 4 溶液、高纯水; 3. 100 mL 容量瓶、50 mL 烧杯、玻棒。 【实验内容】 1. 配制5 mM K 3Fe(CN)6 溶液(含0.5 M H 2SO 4),倒适量溶液至电解杯中; 2. 将玻碳电极在麂皮上用抛光粉抛光后,再用蒸馏水清洗干净; 3. 依次接上工作电极(绿)、参比电极(白)和辅助电极(红); 4. 开启电化学系统及计算机电源开关,启动电化学程序,在菜单中依次选择Setup 、Technique 、CV 、Parameter ,输入以下参数: 5. 点击Run 开始扫描,将实验图存盘后,记录氧化还原峰电位E pc 、E pa 及峰电流I pc 、I pa ; 6. 改变扫速为0.05、0.1 和0.2 V/s ,分别作循环伏安图; 7. 将4个循环伏安图叠加比较; Init E (V) 0.8 V Segment 2 High E (V) 0.8 V Smpl Interval (V) 0.001 Low E (V) ?0.2 V Quiet Time (s) 2 Scan Rate (V/s) 0.02 V Sensitivity (A/V) 5e?5
嘉应学院计算机学院 实验报告 课程名称程序设计基础实验名称实验地点 指导老师实验时间提交时间 班级姓名座号 一、实验目的和要求 (1)熟悉掌握用while语句、do…while语句和for语句实现循环的方法。 (2)掌握在程序设计中用循环的方法实现一些常用算法(如穷举、迭代、递推等)。 (3)进一步学习调试程序。 二、实验环境和方法 实验方法: (一)综合运用课本所学的知识,用不同的算法实现在不同的程序功能。 (二)结合指导老师的指导,解决程序中的问题,正确解决实际中存在的异常情况,逐步改善功能。 (三)根据实验内容,编译程序。 实验环境:Windows xp Visual C++6.0 三、实验内容及过程描述 实验步骤: ①进入Visual C++ 6.0集成环境。 ②输入自己编好的程序。 ③检查一遍已输入的程序是否有错(包括输入时输错的和编程中的错误),如发现有错, 及时改正。 ④进行编译和连接。如果在编译和连接过程中发现错误,频幕上会出现“报错信息”, 根据提示找到出错位置和原因,加以改正。再进行编译,如此反复直到不出错为止。 ⑤运行程序并分析运行结果是否合理。在运行是要注意当输入不同的数据时所得结果 是否正确,应运行多次,分别检查在不同情况下结果是否正确。 实验内容:编译以下题目的程序并调试运行。 (1)输入一行字符,分别统计出其中的英文字母、空格、数字和其它字符的个数。 编写程序如下: #include
循环伏安法测定亚铁氰化钾 实验目的 (1) 学习固体电极表面的处理方法; (2) 掌握循环伏安仪的使用技术; (3) 了解扫描速率和浓度对循环伏安图的影响 实验原理 铁氰化钾离子[Fe(CN)6]3--亚铁氰化钾离子[Fe(CN)6]4-氧化还原电对的标准电极电位为 [Fe(CN)6]3- + e -= [Fe(CN)6]4- φθ= 0.36V(vs.NHE) 电极电位与电极表面活度的Nernst 方程式为 φ=φθ+ RT/Fln(C Ox /C Red ) -0.2 0.00.20.4 0.60.8 -0.0005 -0.0004-0.0003-0.0002-0.00010.0000 0.00010.00020.0003i pa i pc I /m A E /V vs.Hg 2Cl 2/Hg,Cl - 起始电位:(-0.20V) 终止电位:(0.80 V) 溶液中的溶解氧具有电活性,用通入惰性气体除去。 仪器与试剂 MEC-16多功能电化学分析仪(配有电脑机打印机);金电极;铂丝电极;饱和甘汞电极; 容量瓶:250 mL 、100mL 各2个,25 mL 7个。 移液管:2、5、10mL 、20mL 各一支。 NaCl 溶液、K 4[Fe(CN)6]、、Al 2O 3粉末(粒径0.05 μm ) 实验步骤
1、指示电极的预处理 金电极用金相砂纸细心打磨,超声波超声清洗,蒸馏水冲洗备用。 2、溶液的配制 配制0.20 mol/L NaCl溶液250mL,再用此溶液配制0.10 mol/L的K4[Fe(CN)6]溶液100mL备用。 3、支持电解质的循环伏安图 在电解池中,放入25mL 0.2 mol·L-1 NaCl溶液,插入电极,以新处理的铂电极为工作电极,铂丝电极为辅助电极,饱和甘汞电极为参比电极,进行循环伏安仪设定,扫描速率为0.1V/s;起始电位为-0.20V,终止电位为0.80V。开始循环伏安扫描. 4、K4 [Fe(CN)6]溶液的循环伏安图 在-0.20至0.80V电位范围内,以0.1V/s的扫描速度分别作0.01 mol·L-1、0.02 mol·L-1、0.04 mol·L-1、0.06 mol·L-1、0.08 mol·L-1的K4 [Fe(CN)6]溶液(均含支持电解质NaCl浓度为0.20mol·L-1)循环伏安图 5、不同扫描速率K4 [Fe(CN)6]溶液的循环伏安图 在0.08 mol·L-1 K4 [Fe(CN)6]溶液中,以0.1V/s、0.15 V/s、0.2V/s、0.25 V/s、0.3V/s、0.35V/s,在-0.20至0.80V电位范围内扫描,做循环伏安图 数据处理 1、从K4[Fe(CN)6]溶液的循环伏安图,测量i pa、i pc值。 -1;起始电位为-0.20V,终止电位为0.80V) 2、分别以i pa和i pc对K4[Fe(CN)6]溶液浓度c作图,说明峰电流与浓度的关系。
实验报告 班级:电信13-1班学号:130******** 姓名:谢朗星成绩: 实验四循环结构 一、实验目的 1.掌握循环结构C程序的编写和调试方法。 2.掌握循环结构C程序中使用while语句和do while语句。 二、实验内容和步骤 1.调试下面三个程序,分析执行的结果。 1. #include
} 在该程序中,先判断i是否<=100,如果是,在循环体先执行了sum=sum+i,接着再执行i++,然后输出当次运行的结果,然后再返回判断i是否<=100,接着再重复上步骤,直到i>100,结束该程序。 3.#include
实验六循环伏安法测定电极反应参数 一、实验目的 1. 学习循环伏安法测定电极反应参数的基本原理。 2. 熟悉伏安法测量的实验技术。 二、方法原理 循环伏安法(CV)是最重要的电分析化学研究方法之一。在电化学、无机化学、有机化学、生物化学的研究领域广泛应用。由于它仪器简单、操作方便、图谱解析直观,常常是首先进行实验的方法。CV方法是将循环变化的电压施加于工作电极和参比电极之间,记录工作电极上得到的电流与施加电压的关系曲线。这种方法也常称为三角波线性电位扫描方法。 图6—1 循环伏安法的典型激发信号图6—2 图6—1中表明了施加电压的变化方式:起扫电位为0.8V,反向起扫电位为-0.2V,终点又回扫到0.8V,扫描速度可从斜率反映出来,其值为 50mV/s。图6-1循环伏安法的典型激发信号三角波电位,转换电位为0.8V和-0.2V(vs.SCE〉虚线表示的是第二次循环。一台现代的电化学分析仪具有多种功能,可方便地进行一次或多次循环,任意变换扫描电压范围和扫描速度。当工作电极被施加的扫描电压激发时;其上将产生响应电流。以该电流(纵坐标)对电位(横坐标)作图,称为循环伏安图。 典型的循环伏安图如图6-2所示。该图是在1.0mol/L KNO3电解质溶液中,6×10-3mol/LK3Fe(CN)6在Pt工作电极上的反应所得到的结果。从图可见,起始电位Ei为+0.8V(a点),电位比较正的目的是为了避免电极接通后发生电解。然后沿负的电位扫描,如箭头所指方向,当电位至可还原时,即析出电位,将产生阴极电流(b点)。其电极反应为:,随着电位的变负,阴极电流迅速增加(b→d),直至电极表面的浓度趋近零,电流在d点达到最高峰。然后电流迅速衰减(d→g),这是因为电极表面附近溶液中的几乎全部电解转变为而耗尽,即所谓的贫乏效应。当电压扫
关于计算双代号网络图的题目 用图上计算法计算如图所示双代号网络图的各项时间参数(六时标注)确定关键路线、关键工作和总工期。
注:其中工作F的最迟完成时间为计算工期17 其自由时差为17-12=5(计算工期-F的最早完成时间,因F后没有紧后工作了;H后也没有紧后工作了) 双代号网络图是应用较为普遍的一种网络计划形式。它是以箭线及其两端节点的编号表示工作的网络图。 双代号网络图中的计算主要有六个时间参数: ES:最早开始时间,指各项工作紧前工作全部完成后,本工作最有可能开始的时刻; EF:最早完成时间,指各项紧前工作全部完成后,本工作有可能完成的最早时刻 LF:最迟完成时间,不影响整个网络计划工期完成的前提下,本工作的最迟完成时间; LS:最迟开始时间,指不影响整个网络计划工期完成的前提下,本工作最迟开始时间; TF:总时差,指不影响计划工期的前提下,本工作可以利用的机动时间;
FF:自由时差,不影响紧后工作最早开始的前提下,本工作可以利用的机动时间。 双代号网络图时间参数的计算一般采用图上计算法。下面用例题进行讲解。 例题:试计算下面双代号网络图中,求工作C的总时差? 早时间计算:ES,如果该工作与开始节点相连,最早开始时间为0,即A的最早开始时间ES=0; EF,最早结束时间等于该工作的最早开始+持续时间,即A的最早结束EF为0+5=5; 如果工作有紧前工作的时候,最早开始等于紧前工作的最早结束取大值,即B的最早开始FS=5,同理最早结束EF为5+6=11,而E 工作的最早开始ES为B、C工作最早结束(11、8)取大值为11。 迟时间计算:LF,如果该工作与结束节点相连,最迟结束时间为计算工期23,即F的最迟结束时间LF=23; LS,最迟开始时间等于最迟结束时间减去持续时间,即LS=LF-D; 如果工作有紧后工作,最迟结束时间等于紧后工作最迟开始时间取小值。 时差计算: FF,自由时差=(紧后工作的ES-本工作的EF);
实验三循环结构 一.实验目的 1.熟悉用while语句,do-while语句和for语句实现循环的方法。 2.掌握循环嵌套的用法。 3.掌握在程序设计中用循环的方法实现各种算法(如迭代,递推,穷举等)。4.掌握break和continue语句的用法。 二.实验要点 在C语言中主要用以下方法实现循环: 1.while语句格式:while (表达式)语句 2.do- while语句格式:do 语句 while (表达式); 3.for语句 for语句的一般格式: for (表达式1;表达式2;表达式3)语句 for (初值表达式;条件表达式;增值表达式) 语句 三.实验要求 1.上机前编写好以下程序。 2.上机输入和调试自己所编的程序并存在自己的U盘上。 3.检查实验结果是否正确。 4.上机结束后,整理实验报告,以“学号—姓名-第3次实验”命名的文件上传到作业服务器。 四.实验内容 上机调试运行以下程序。 1.下面的程序段是从键盘输入的字符中统计数字字符的个数,用换行符结束循环.请填空. #include”stdio.h” void main(){ int n=0; char c; c=getchar(); while (【】) { if ( 【】) n++; c=getchar(); } printf(“n=%d”,n);}
键盘输入:abcdef12345k
实验十循环伏安法分析 一、实验目的 1.仔细阅读理解本讲义和相关资料,掌握循环伏安法的基本原理。 2.熟练使用循环伏安法分析的实验技术。 二、实验原理 循环伏安法(Cyclic Voltammetry, 简称CV)往往是首选的电化学分析测试技术,非常重要,已被广泛地应用于化学、生命科学、能源科学、材料科学和环境科学等领域中相关体系的测试表征。 现代电化学仪器均使用计算机控制仪器和处理数据。CV测试比较简便,所获信息量大。采用三电极系统的常规CV实验中,工作电极(The Working Electrode, 简称WE)相对于参比电极(the Reference Electrode,简称RE)的电位在设定的电位区间内随时间进行循环的线
表1. 图1的实验条件和一些重要解释
零,所以RE的电位在CV实验中几乎不变,因此RE是实验中WE电位测控过程中的稳定参比。若忽略流过RE上的微弱电流,则实验体系的电解电流全部流过由WE和对电极(The Counter Electrode,简称CE)组成的串联回路。WE和CE间的电位差可能很大,以保证能成功地施加上所设定的WE电位(相对于RE)。CE也常称为辅助电极(The Auxiliary Electrode, 简称AE)。 分析CV实验所得到的电流-电位曲线(伏安曲线)可以获得溶液中或固定在电极表面的组分的氧化和还原信息,电极|溶液界面上电子转移(电极反应)的热力学和动力学信息,和电极反应所伴随的溶液中或电极表面组分的化学反应的热力学和动力学信息。与只进行电位单向扫描(电位正扫或负扫)的线性扫描伏安法(Linear Scan Voltammetry,简称LSV)相比,循环伏安法是一种控制电位的电位反向扫描技术,所以,只需要做1个循环伏安实验,就可既对溶液中或电极表面组分电对的氧化反应进行测试和研究,又可测试和研究其还原反应。 循环伏安法也可以进行多达100圈以上的反复多圈电位扫描。多圈电位扫描的循环伏安实验常可用于电化学合成导电高分子。 图1为3 mmol L-1 K4Fe(CN)6 + 0.5 mol L-1 Na2SO4水溶液中金电极上的CV实验结果。实验条件和一些重要的解释列于表1中。 三、仪器和试剂 仪器:CHI400电化学工作站 磁力搅拌器 铂片工作电极 铅笔芯对电极 KCl饱和甘汞电极 试剂:K3Fe(CN)6(分析纯或优级纯) KNO3(分析纯或优级纯) 溶液及其浓度:1.0 mol L-1 KNO3水溶液。实验中每组学员使用30.0 mL。 0.100 mol L-1 K3Fe(CN)6水溶液储备液。实验中每组学员使用100 L微量注射 器依次注射适量体积的0.100 mol L-1 K3Fe(CN)6水溶液到30 mL的1.0 mol L-1 KNO3水溶液中,详见如下4.3.节。
115.5°E 中星6B号 接收参数频道名称状态加密方式VPID A PID 语言频道商/地 区 更新日 期 3600 V 27500 fec:7/8 波束:C 读书频道 加 密 Mediaguard30103011汉语 鼎视传媒 中国 111102考试在线 加 密 Mediaguard30203021汉语111102车迷频道 加 密 Mediaguard30303031汉语111102亲亲宝贝 加 密 Mediaguard30403041汉语111102环球旅游 加 密 Mediaguard30503051汉语111102新娱乐 加 密 Mediaguard30603061汉语111102收藏天下 加 密 Mediaguard30703071汉语111102时代美食 加 密 Mediaguard30803081汉语111102央广健康 加 密 Mediaguard30903091汉语120801时代风尚 加 密 Mediaguard31003101汉语111102百姓健康 加 密 Mediaguard33303331汉语111102 3640 V 27500 fec:7/8 波束:C 时代家居 加 密 Mediaguard31103111汉语 鼎视传媒 中国 111102时代出行 加 密 Mediaguard31203121汉语111102四海钓鱼 加 密 Mediaguard31303131汉语111102快乐宠物 加 密 Mediaguard31403141汉语111102家家购物 加 密 Mediaguard31503151汉语111102电子体育 加 密 Mediaguard31603161汉语111102碟市 加 密 Mediaguard31703171汉语111102职业指南 加 密 Mediaguard31803181汉语111102快乐购物 加 密 Mediaguard31903191汉语120110家庭理财加Mediaguard32003201汉语111102
实验五循环结构程序设计 【目的与要求】 熟练掌握while、do—while和for三种循环语句的应用。 【上机内容】 【示例】只要求运行前4个例题,并在/* */中说明该语句的作用或使用的方法等;典型例题仅供参考,不作要求。 【例1】求5! main() { int n,t; n=1; t=1; while(t<=5) { n=n*t; t=t+1;/**/ } printf(“%d”,n); } 【例2】求和s=1!+2!+3! main() { int n,s=0,t=1; for(n=1;n<=3;n++) { t=t*n;/*计算阶乘*/ s=s+t;/* */ } printf(“%d”,s); } 【例3】求和s= 3+33+333 main() { int s=0,t=3,i; for(i=1;i<=3;i++) { s=s+t; t=10*t+3;/*生成3,33,333等数据*/ } printf(“%d”,s); } 【例4】打印500以内的“水仙花数”。“水仙花数”是一个三位数,其各位数立方和等于该数本身。main()
int i,j,k,n; for(n=100;n<=500;n++) { i=n/100;/* */ j=n/10-i*10; /* */ k=n%10; /* */ if(n= =i*i*i+j*j*j+k*k*k) /* */ printf(“ %d”,n); } } 【典型示例】 【例1】计算两个数的最大公约数;分析:首先,随机输入两个数m,n(默认m>n);其次,算法:使k为m除以n的余数,如果m能被n整除,则k值为0,n为这两个数的最大公约数,否则,使k代替n,n代替m,重复以上过程,直到k值为0。 #include"stdio.h" main() { int m,n,k,result; printf("Enter two numbers:"); scanf("%d,%d",&m,&n); if(m>0&&n>0) /*限定两个正整数*/ { do { k= m % n; if(k= =0) result=n; else { m = n; n=k; } }while(k>0); /*循环取余求出最大公因子*/ printf("The greatest common divistor is:%d\n",result); } else printf("Nonpositive values not allowed\n"); } 【例2】打印下列图案 * *** ***** ******* main()
线路参数计算(公式)
参数计算(第一版) 1.线路参数计算内容 1.1已知量: 线路型号(导线材料、截面积mm 2)、长度(km)、排列方式、线间距离(m)、外径(mm)、分裂数、分裂距(m)、电压等级(kV)、基准电压U B (kV, 母线电压作为基准电压)、基准容量S B (100MVA)。 1.2待计算量: 电阻R(Ω/km)、线电抗X(Ω/km)、零序电阻R0(Ω/km)、零序电抗X0(Ω/km)、对地电纳B(S/km)、对地零序电纳B0(S/km)。 1.3计算公式: 1.3.1线路电阻 R=ρ/S (Ω/km) R*=R 2B B U S 式中 ρ——导线材料的电阻率(Ω·mm 2/km); S ——线路导线的额定面积(mm 2)。 1.3.2线路的电抗 X=0.1445lg eq m r D +n 0157.0(Ω/km) X*=X 2B B U S 式中
m D ——几何均距,m D =ac bc ab D D D (mm 或cm,其单位应与eq r 的单位 相同); eq r ——等值半径, eq r =n n m rD 1-(mm,其中r 为导线半径); n ——每个导线的分裂数。 1.3.3零序电阻 R0=R+3R g (Ω/km) R0*=R0 2B B U S 式中 R g ——大地电阻, R g =π2×10-4×f =9.869×10-4×f (Ω/km)。在f =50Hz 时,R g =0.05Ω/km 。 1.3.4零序电抗 X0=0.4335lg s g D D (Ω/km) X0*=X0 2B B U S 式中 g D ——等值深度, g D =γf 660 ,其中γ为土壤的电导率,S/m 。当土壤电 导率不明确时,在一般计算中可取g D =1000m 。 s D ——几何平均半径, s D =32m D r '其中r '为导线的等值半径。若r 为单根导线的实际半径,则对非铁磁材料的圆形实心线,r '=0.779r ;对铜或铝的绞线,r '与绞线股数有关,一般
实验一循环伏安法判断电极过程 一.实验目的 1.学习和掌握循环伏安法的原理和实验技术。 2.了解可逆波的循环伏安图的特性以及测算玻碳电极的有效面积的方法。 3.学会使用电化学工作站 二.实验原理 循环伏安法是在固定面积的工作电极和参比电极之间加上对称的三角波扫描电压,记录工作电极上得到的电流与施加电位的关系曲线,即循环伏安图。从伏安图的波形、氧化还原峰电流的数值及其比值、峰电位等可以判断电极反应机理。 与汞电极相比,物质在固体电极上伏安行为的重现性差,其原因与固体电极的表面状态直接有关,因而了解固体电极表面处理的方法和衡量电极表面被净化的程度,以及测算电极有效表面积的方法,是十分重要的。一般对这类问题要根据固体电极材料不同而采取适当的方法。 对于碳电极,一般以Fe(CN)63-/4-的氧化还原行为作电化学探针。首先,固体电极表面的第一步处理是进行机械研磨、抛光至镜面程度。通常用于抛光电极的材料有金钢砂、CeO2、ZrO2、MgO和α-Al2O3粉及其抛光液。抛光时总是按抛光剂粒度降低的顺序依次进行研磨,如对新的电极表面先经金钢砂纸粗研和细磨后,再用一定粒度的α-Al2O3粉在抛光布上进行抛光。抛光后先洗去表面污物,再移入超声水浴中清洗,每次2~3分钟,重复三次,直至清洗干净。最后用乙醇、稀酸和水彻底洗涤,得到一个平滑光洁的、新鲜的电极表面。将处理好的碳电极放入含一定浓度的K3Fe(CN)6和支持电解质的水溶液中,观察其伏安曲线。如得到如图所示的曲线,其阴、阳极峰对称,两峰的电流值相等(i pc/i pa=1),峰峰电位差ΔE p约为70mV(理论值约60 mV),即说明电极表面已处理好,否则需要重新抛光,直到达到要求。 有关电极有效表面积的计算,可根据Randles-Sevcik公式: 在25℃时,i p=(2.69×105)n3/2AD o1/2v1/2C o 其中A为电极的有效面积(cm2),D o为反应物的扩散系数(cm2/s),n为电极反
寄语:不管一建、二建,双代号是必考点,再复杂的网络图也能简单化, 本工作室整理了 三页纸供大家快速掌握,希望大家多学多练,掌握该知识 点,至少十分收入囊中。 双代号网络图六个参数计算的简易方法 一、非常有用的要点: 任何一个工作总时差≥自由时差 自由时差等于各时间间隔的最小值(这点对六时参数的计算非常用用) 关键线路上相邻工作的时间间隔为零,且自由时差=总时差 最迟开始时间—最早开始时间(最小) 关键工作:总时差最小的工作 最迟完成时间—最早完成时间(最小) 在网络计划中,计算工期是根据终点节点的最早完成时间的最大值 二、双代号网络图六时参数我总结的计算步骤(比书上简单得多) ① ② t 过程 做题次序: 1 4 5 ES LS TF 2 3 6 FS LF FF 步骤一: 1、A 上再做 A 下 2、 做的方向从起始工作往结束工作方向; 3、 起点的 A 上=0,下一个的 A 上=前一个的 A 下当遇到多指向时,要取数值大的 A 下
A 上 4、 A 下=A 上+t 过程(时间) 步骤二: 1、 B 下再做 B 上 2、 做的方向从结束点往开始点 3、 结束点 B 下=T (需要的总时间结束点 B 上=T-t 过程(时间) 4、 B 下=前一个的 B 上(这里的前一个是从终点起算的) 遇到多指出去的时,取数值小的 B 上 B 上=B 下—t 过程(时间) 步骤三: 总时差=B 上—A 上=B 下—A 下 如果不相等,你就是算错了 步骤四: 自由时差=紧后工作 A 上(取最小的)—本工作 A 下 =紧后工作的最早开始时间—本工作的最迟开始时间 (有多个紧后工作的取最小值) 例: