
循环伏安法实验报告
在电化学研究中,循环伏安法是一种简单而又强大的研究方法。通过循环伏安法,
可以对电极可逆性进行判断:反应是可逆的,则曲线上下对称,若反应不可逆,则曲线上下不对称;判断电极反应机理的判断:如电极吸附现象、电化学反应过程中产物等;更重要的是,循环伏安法能够用于实验中的定量分析。接下来,运用实验数据来答疑解惑。通常我们选择铁氰化钾体系(Fe(CN)63-/4-)对电化学行为中的可逆过程进行研究,它的氧化与还原峰对称,两峰的电流值相等,两峰电位差理论值为0.059V 0 通常电极表面的处理对该理论值有很大的影响,一般选择玻碳电极为工作电极、铂电极为对电极、饱和甘汞电极为参比电极。选择AI2O3抛光粉将电极表面磨
光,然后在抛光机上抛成镜面,最后分别在1:1乙醇、1:1HNO3和蒸馏水中超
声波清洗15秒。另外,溶液是否除氧,这个也是必须考虑的,我们选择通高纯
N2除O2 o在电解池中放入 5.00 x l0-4mol/LK3(内含0.20mol/L KNO3 ,作为支持电解质。支持电解质的浓度实际上也对实验有影响,此处暂不考虑)。插入工作电极、铂丝辅助电极和饱和甘汞电极。设置电化学工作站中的参数,参数的设定需要不断的尝试,根据电化学工作站窗口显示的图形调节出合适的参数
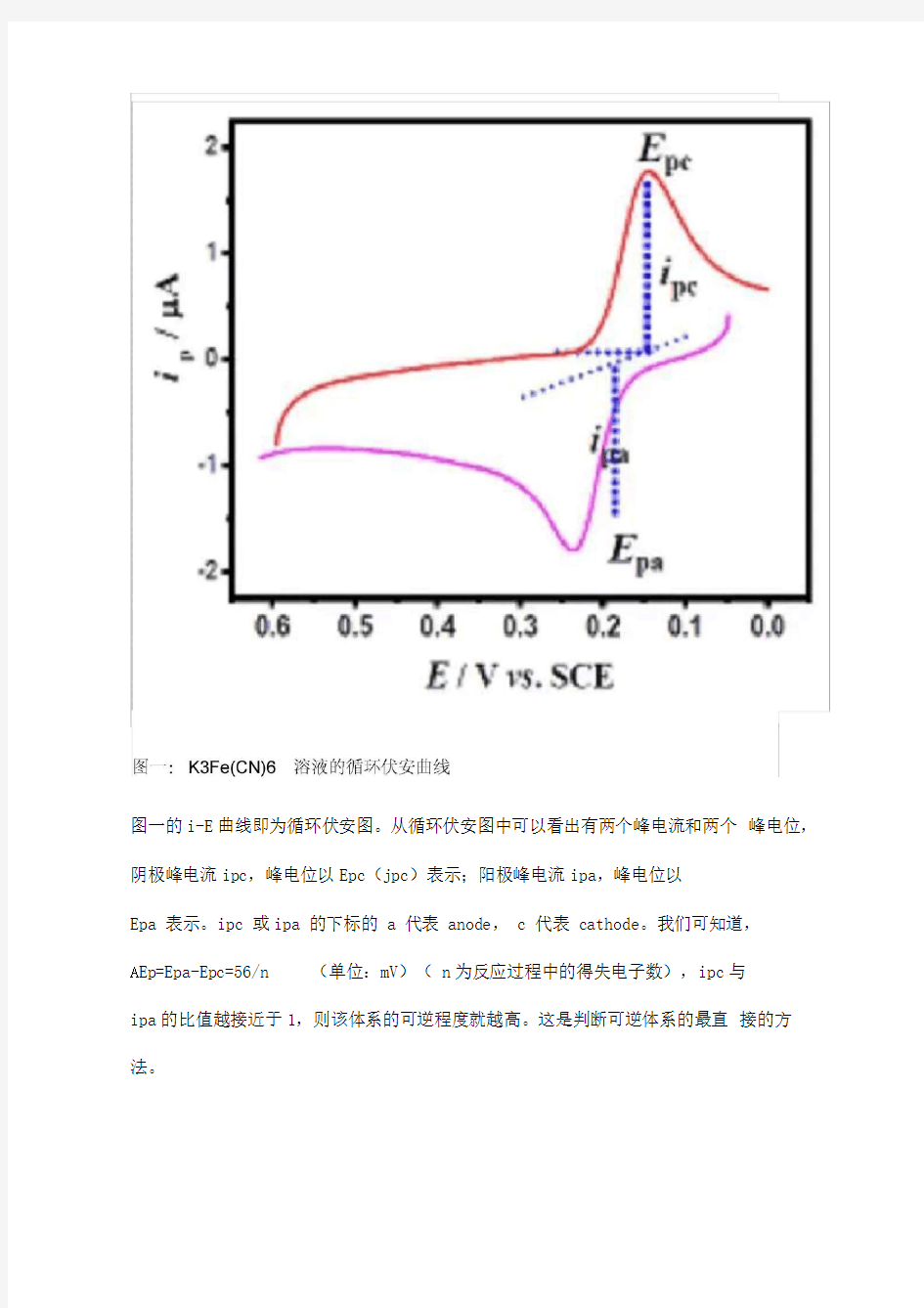
图一的i-E曲线即为循环伏安图。从循环伏安图中可以看出有两个峰电流和两个峰电位,阴极峰电流ipc,峰电位以Epc(jpc)表示;阳极峰电流ipa,峰电位以
Epa 表示。ipc 或ipa 的下标的 a 代表 anode, c 代表 cathode。我们可知道,
A Ep=Epa-Epc=56/n (单位:mV)( n为反应过程中的得失电子数),ipc与
ipa的比值越接近于1,则该体系的可逆程度就越高。这是判断可逆体系的最直接的方法。
OOOOOOOOODOOAUOOOO 987<05
从321 12 3 4-^5-7- 从电化学工作站的工作界面,可以得出氧化峰电位为 Epa=227mV,峰电流为
ipa=-1.91 '10-6A ;还原峰电位是 Epc=170mV ,峰电流是 ipc=1.9 '10-6A 。氧 化峰与还原峰电位差为57mV (直接比较横坐标数值即可),峰电流的比值为: ipa/ipc=1.005 "1。由此可知,pH=7时,铁氰化钾体系(Fe (CN )63-/4-)的
电化学反应是一个可逆过程。(通常都是借助该体系与其它体系进行比较,鉴别 电极的优劣以及反应可逆程度)。
接下来,我们来研究扫速与峰电流及峰电位的关系。 本实验室通常选择铁氰化钾 作为实验对象。不同扫描速率 100、200、300、400mV/s ,分别记录从-200?
+600mV 扫描的循环伏安图。记录循环伏安曲线,观察峰电位和峰电流,判断
电极活性。
O
-
图二:不同扫描速率下铁氰化钾溶液的循环伏安曲线
将不同扫描速率100、200、300、400mV/s 的循环伏安曲线进行叠加,如上图 所示。由图可知,随着扫描速度的增加,峰电流也增加。且分别测量他们的峰数 据可以得到峰电流与扫描速度的关系。 根据电化学理论,对于扩散控制的电极过
程,峰电流ip 与扫描速度的二分之一次方呈正比关系,即ip ?n1/2为一直线。 对于表面吸附控制的电极反应过程,峰电流 ip 与扫描速度呈正比关系,即ip ? n 为一直线。
v A
l/2ipa 关系曲线图
OCOOCDOS
Q.QOQaOOB
0 DOCX) 007
0 0000066
aaoacDos
0 DOM DM
0DCM0DO3
0 0000002
0 DGOOOOl
0 0.005 0.01 0015 D.D25 Q ?潞 O-Q35 0.04 0.045y = 0.00OQ2X 十 CLCKJEUI =0.98399 —
v A
l/2一一巾匚关系曲线图
0 0000005 0 0000007
O.DGM006
0 0000 DOS
ocwe-XM
0,0300 003
0 OOM 002
0 DOODOOl
G.0C5 0.01 0015 0.02 D.Q25 0.M 住 03 5 004
0. 妇折遽度y 七[rrwQ 1/2
图三:扫描速率与峰电流的关系曲线
以上详细介绍了循环伏安法在电化学应用中的定量分析, 如有不足,欢迎批评指 正。最后,我针对微信留言区的问题来做解答。
一、 计算扩散系数时,n 是否取值?
答:物质的扩散系数表示它的扩散能力, 结合物理化学中谈到的菲克定律,扩散 系数是沿扩散方向,在单位时间每单位浓度梯度的条件下, 垂直通过单位面积所 扩散某物质的质量或摩尔数。质量扩散系数D 和动量扩散系数v 及热量扩散系数 a 具有相同的单位(mT/s )或(cm A 2/s ),扩散系数的大小主要取决于扩散 物质和扩散介质的种类及其温度和压力。
二、 测试时,搅拌溶液对 CV 曲线有什么影响,峰电流与峰电位怎么变化?¥ = 0,00002x + 0.00001 心 0-9S505
华南师范大学实验报告 学生姓名学号2014 专业新能源材料与器件年级、班级2014 课程名称电化学实验实验项目循环伏安法测定电极反应参数实验类型□√验证□设计□综合实验时间2016年4月25日 实验指导老师吕东生实验评分
一、实验目的 1.了解循环伏安法的基本原理及应用 2. 掌握循环伏安法的实验技术和有关参数的测定方法。 二、实验原理 循环伏安法(Cyclic Voltammetry)是一种常用的电化学研究方法。该法控制电极电势以不同的速率,随时间以三角波形一次或多次反复扫描,电势范围是使电极上能交替发生不同的还原和氧化反应,并记录电流-电势曲线。根据曲线形状可以判断电极反应的可逆程度,中间体、相界吸附或新相形成的可能性,以及偶联化学反应的性质等。常用来测量电极反应参数,判断其控制步骤和反应机理,并观察整个电势扫描范围内可发生哪些反应,及其性质如何。对于一个新的电化学体系,首选的研究方法往往就是循环伏安法。该方法使用的仪器简单,操作方便,图谱解析直观,在电化学、无机化学、有机化学、生物化学等许多研究领域被广泛使用。循环伏安法通常采用三电极系统,一支工作电极(被研究物质起反应的电极),,一支参比电极,一支对电极。外加电压在工作电极和辅助电极之间,反应电流通过工作电极与辅助电极。 图1 循环伏安法测得的氧化还原曲线 正向扫描的峰电流i p 与v^0.5和C都成线性关系,对研究电极过程具有重要意义。标准 电极电势为:EΘ=(E pa +E pc )/2。所以对可逆过程,循环伏安法是一个方便的测量标准电极 电位的方法。 三、实验器材 CHI电化学工作站;玻碳电极;铂电极;Hg/Hg2SO4电极;0.1 mol/L VO2+ + 0.1 mol/L VO2+ +3 mol/L H2SO4溶液 四、实验步骤 1. 预处理电极
实验二堆栈和队列 实验目的: 1.熟悉栈这种特殊线性结构的特性; 2.熟练并掌握栈在顺序存储结构和链表存储结构下的基本运算; 3.熟悉队列这种特殊线性结构的特性; 3.熟练掌握队列在链表存储结构下的基本运算。 实验原理: 堆栈顺序存储结构下的基本算法; 堆栈链式存储结构下的基本算法; 队列顺序存储结构下的基本算法; 队列链式存储结构下的基本算法; 实验内容: 第一题链式堆栈设计。要求 (1)用链式堆栈设计实现堆栈,堆栈的操作集合要求包括:初始化StackInitiate(S),非空否StackNotEmpty(S),入栈StackiPush(S,x),出栈StackPop(S,d),取栈顶数据元素StackTop(S,d); (2)设计一个主函数对链式堆栈进行测试。测试方法为:依次把数据元素1,2,3,4,5入栈,然后出栈并在屏幕上显示出栈的数据元素; (3)定义数据元素的数据类型为如下形式的结构体, Typedef struct { char taskName[10]; int taskNo; }DataType; 首先设计一个包含5个数据元素的测试数据,然后设计一个主函数对链式堆栈进行测试,测试方法为:依次吧5个数据元素入栈,然后出栈并在屏幕上显示出栈的数据元素。 第二题对顺序循环队列,常规的设计方法是使用対尾指针和对头指针,对尾指针用于指示当前的対尾位置下标,对头指针用于指示当前的対头位置下标。现要求: (1)设计一个使用对头指针和计数器的顺序循环队列抽象数据类型,其中操作包括:初始化,入队列,出队列,取对头元素和判断队列是否为空; (2)编写主函数进行测试。 程序代码: 第一题: (1)源程序"LinStack.h"如下: #define NULL 0 typedef struct snode { DataType data; struct snode *next; } LSNode; /*(1)初始化StackInitiate(LSNode ** head) */ void StackInitiate(LSNode ** head) /*初始化带头结点链式堆栈*/
电化学分析实验报告 院系:化学化工学院专业班级:学号:姓名: 同组者: 实验日期: 指导老师: 实验一:铁氰化钾在玻碳电极上的氧化还原 一、实验目的 1.掌握循环伏安扫描法。 2.学习测量峰电流和峰电位的方法。 二、实验原理 循环伏安法也是在电极上快速施加线性扫描电压,起始电压从ei开始,沿某一方向变化, 当达到某设定的终止电压em后,再反向回扫至某设定的起始电压,形成一个三角波,电压扫 描速率可以从每秒数毫伏到1v。 当溶液中存在氧化态物质ox时,它在电极上可逆地还原生成还原态物质,即 ox + ne → red;反向回扫时,在电极表面生成的还原态red则可逆地氧化成ox,即 red → ox + ne.由 此可得循环伏安法极化曲线。 在一定的溶液组成和实验条件下,峰电流与被测物质的浓度成正比。从循环伏安法图中 可以确定氧化峰峰电流ipa、还原峰峰电流ipc、氧化峰峰电位φ pa 和还原峰峰电位φpc。 对于可逆体系,氧化峰峰电流与还原峰峰电流比为:ipa/ipc =1 25℃时,氧化峰峰电位 与还原峰峰电位差为:△φ条件电位为:φ=(φpa+ φpc)/2 由这些数值可判断一个电极过程的可逆性。 =φ pa - φpc≈56/z (mv) 三、仪器与试剂 仪器::电化学分析仪va2020, 玻碳电极、甘汞电极、铂电极。试剂:铁氰化钾标准溶 液,0.5mol/l氯化钾溶液,蒸馏水。 四、实验步骤 1、溶液的配制 移取铁氰化钾标准溶液(10mol/l)5ml于50ml的塑料杯中,加入0.5mol/l氯化钾溶液, 使溶液达到30ml 。 2、调试 (1)打开仪器、电脑,准备好玻璃电极、甘汞电极和铂电极并清洗干净。(2)双击桌 面上的valab图标。 3、选择实验方法:循环伏安法 设置参数:低电位:-100mv;高电位600mv;初始电位-100mv; 扫描速度:50mv/s;取样间隔:2mv;静止时间:1s;扫描次数:1;量程: 200μa。 4. 开始扫描:点击绿色的“三角形”。 5. 将上述体系改变扫描速度分别为10mv/s、50mv/s、100mv/s、160mv/s、200mv/s,其 他条件不变,作不同速度下的铁氰化钾溶液的循环伏安曲线,其峰值电流与扫描速度的平方 根成正比关系。 -3 五、实验数据及处理 1. 找到循环伏安曲线上对应的氧化与还原峰,然后手动做切线。
一.实验项目名称 循环队列和链式队列的创建 二、实验目的 1、掌握队列的特点 (先进先出 FIFO) 及基本操作 ,如入队、出队等, 2、队列顺序存储结构、链式存储结构和循环队列的实现,以便在 实际问题背景下灵活应用。 三、实验内容 1.链式队列的实现和运算 2.循环队列的实现和运算 四、主要仪器设备及耗材 VC++6.0 运行环境实现其操作 五.程序算法 (1)循环队列操作的算法 1>进队列 Void enqueue (seqqueue &q, elemtype x) { if ((q.rear+1)%maxsize = = q.front) cout<< ” overflow”; else { q.rear=(q.rear+1)%maxsize; // 编号加 1 或循环回第一个单元 q.queue[q.rear]=x; } } 2>出队列 Void dlqueue(seqqueue &q ) { if (q.rear= =q.front)cout<< ” underflow”; else q.front =(q.front+1)%maxsize; } 3>取对头元素
elemtype gethead(seqqueue q ) { if(q.rear= =q.front) { cout<<” underflow;” return NULL;} else return q.queue[(q.front+1)%maxsize]; //front 指向队头前一个位置 } 4>判队列空否 int empty(seqqueue q ) { if (q.rear= =q.front) else return 0; reurn 1; } (2).链队列操作的算法 1>.链队列上的初始化 void INIQUEUE( linkqueue&s) {link *p; p=new link; p->next=NULL;//p 是结构体指针类型,用 s.front=p;//s 是结构体变量,用. s.rear=p;//头尾指针都指向头结点 -> } 2>.入队列 void push(linkqueue &s, elemtype x) { link*p;//p 是结构体指针类型,用-> p=new link; p->data=x; p->next=s.rear->next;//s 是结构体变量,用s.rear->next=p; s.rear=p;//插入最后 . } 3>判队空 int empty( linkqueue s ) {if (s.front= =s.rear) return 1; else return 0; } 4>.取队头元素 elemtype gethead( linkqueue s ) { if (s.front= =s.rear) else retuen return NULL; s.front->next->data; }
循环伏安法实验 【实验目的】 学习和掌握循环伏安法的原理和实验技术。 了解可逆波的循环伏安图的特性以及测算玻碳电极的有效面积的方法。 【实验原理】 循环伏安法是在固定面积的工作电极和参比电极之间加上对称的三角波扫 描电压(如图1),记录工作电极上得到的电流与施加电位的关系曲线(如图2),即循环伏安图。从伏安图的波形、氧化还原峰电流的数值及其比值、峰电位等可以判断电极反应机理。 与汞电极相比,物质在固体电极上伏安行为的重现性差,其原因与固体电极的表面状态直接有关,因而了解固体电极表面处理的方法和衡量电极表面被净化的程度,以及测算电极有效表面积的方法,是十分重要的。一般对这类问题要根据固体电极材料不同而采取适当的方法。 对于碳电极,一般以Fe(CN) 63-/4- 的氧化还原行为作电化学探针。首先,固体 电极表面的第一步处理是进行机械研磨、抛光至镜面程度。通常用于抛光电极的 材料有金钢砂、CeO 2、ZrO 2 、MgO和α-Al 2 O 3 粉及其抛光液。抛光时总是按抛 光剂粒度降低的顺序依次进行研磨,如对新的电极表面先经金钢砂纸粗研和细磨 后,再用一定粒度的α-Al 2O 3 粉在抛光布上进行抛光。抛光后先洗去表面污物, 再移入超声水浴中清洗,每次2~3分钟,重复三次,直至清洗干净。最后用乙 醇、稀酸和水彻底洗涤,得到一个平滑光洁的、新鲜的电极表面。将处理好的碳 图2:循环伏安曲线(i—E曲线)
电极放入含一定浓度的K 3Fe(CN)6和支持电解质的水溶液中,观察其伏安曲线。如得到如图2所示的曲线,其阴、阳极峰对称,两峰的电流值相等(i pc / i pa =1),峰峰电位差ΔE p 约为70 mV (理论值约59/n mV ),即说明电极表面已处理好,否则需重新抛光,直到达到要求。 有关电极有效表面积的计算,可根据Randles-Sevcik 公式: 在25°C 时,i p =(2.69×105 )n 3/2 AD o 1/2ν1/2 C o 其中A 为电极的有效面积(cm 2 ),D o 为反应物的扩散系数(cm 2 /s),n 为电极反应的电子转移数,ν为扫速(V/s ),C o 为反应物的浓度(mol/cm 3 ),i p 为峰电流(A )。 【仪器和试剂】 1. CHI 660D 电化学系统,玻碳电极(d = 4mm ) 为工作电极,银/氯化银电极为参比电极,铂片电极为辅助电极; 2. 固体铁氰化钾、H 2SO 4 溶液、高纯水; 3. 100 mL 容量瓶、50 mL 烧杯、玻棒。 【实验内容】 1. 配制5 mM K 3Fe(CN)6 溶液(含0.5 M H 2SO 4),倒适量溶液至电解杯中; 2. 将玻碳电极在麂皮上用抛光粉抛光后,再用蒸馏水清洗干净; 3. 依次接上工作电极(绿)、参比电极(白)和辅助电极(红); 4. 开启电化学系统及计算机电源开关,启动电化学程序,在菜单中依次选择Setup 、Technique 、CV 、Parameter ,输入以下参数: 5. 点击Run 开始扫描,将实验图存盘后,记录氧化还原峰电位E pc 、E pa 及峰电流I pc 、I pa ; 6. 改变扫速为0.05、0.1 和0.2 V/s ,分别作循环伏安图; 7. 将4个循环伏安图叠加比较; Init E (V) 0.8 V Segment 2 High E (V) 0.8 V Smpl Interval (V) 0.001 Low E (V) ?0.2 V Quiet Time (s) 2 Scan Rate (V/s) 0.02 V Sensitivity (A/V) 5e?5
《数据结构》课程实验报告 一、实验目的和要求 (1)熟悉C语言的上机环境,进一步掌握C语言的结构特点。 (2)掌握队列的顺序表示和实现。 二、实验环境 Windows7 ,VC 三、实验内容及实施 实验三:队列 【实验要求】 构建一个循环队列, 实现下列操作 1、初始化队列(清空); 2、入队; 3、出队; 4、求队列长度; 5、判断队列是否为空; 【源程序】 #include
Q.base=new int[MAXSIZE]; Q.front=Q.rear=0; return OK; }//队列的初始化 int EnQueue(SqQueue &Q,int e) { if((Q.rear+1)%MAXSIZE==Q.front) return ERROR; Q.base[Q.rear]=e; Q.rear=(Q.rear+1)%MAXSIZE; return OK; }//队列的入队 int DeQueue(SqQueue &Q,int &e) { if(Q.front==Q.rear) return ERROR; e=Q.base[Q.front]; Q.front=(Q.front+1)%MAXSIZE; return OK; }//队列的出队 int QueueLength(SqQueue &Q) { int i; i=(Q.rear-Q.front+MAXSIZE)%MAXSIZE; return i; }//求队列长度 void JuQueue(SqQueue &Q) { if(Q.rear==Q.front) printf("队列为空"); else printf("队列不为空"); }//判断队列是否为空 void QueueTraverse(SqQueue &Q)
实验报告 题目C,MnO2的电化学电容特性实验姓名许树茂 学号20104016005 所在学院化学与环境学院 年级专业新能源材料与器件创新班 指导教师舒东老师 完成时间2012 年 4 月
1.【实验目的】 1. 了解超级电容器的原理; 2. 了解超级电容器的比电容的测试原理及方法; 3. 了解超级电容器双电层储能机理的特点; 4. 掌握超级电容器电极材料的制备方法; 5. 掌握利用循环伏安法及恒流充放电的测定材料比电容的测试方法。 2. 【实验原理】 超级电容器的原理 超级电容器是由两个电极插入电解质中构成。超级电容与电解电容相比,具有非常高的功率密度和实质的能量密度。尽管超级电容器储存电荷的能力比普通电容器高,但是超级电容与电解电容或者电池的结构非常相似。 图1 超级电容器的结构图 从图中可看出,超级电容器与电解电容或者电池的结构非常相似,主要差别是用到的电极材料不一样。在超级电容器里,电极基于碳材料技术,可提供非常大的表面面积。表面面积大且电荷间隔很小,使超级电容器具有很高的能量密度。大多数超级电容器的容量用法拉(F)标定,通常在1F到5,000F之间。 (1) 双电层超级电容器的工作原理 双电层电容是在电极/溶液界面通过电子或离子的定向排列造成电荷的对峙所产生的。对一个电极/溶液体系,会在电子导电的电极和离子导电的电解质溶液界面上形成双电层。当在两个电极上施加电场后,溶液中的阴、阳离子分别向正、负电极迁移,在电极表面形成双电层;撤消电场后,电极上的正负电荷与溶液中的相反电荷离子相吸引而使双电层稳定,在正负极间产生相对稳定的电位差。这时对某一电极而言,会在一定距离内(分散层)产生与电极上的
HUNAN UNIVERSITY 姓名:扫描电镜实验报告 姓名:高子琪 学号: 2
一.实验目的 1.了解扫描电镜的基本结构与原理; 2.掌握扫描电镜样品的准备与制备方法; 3.掌握扫描电镜的基本操作并上机操作拍摄二次电子像; 4.了解扫描电镜图片的分析与描述方法。 二.实验设备及样品 1.实验仪器:D5000-X衍射仪 基本组成:1)电子光学系统:电子枪、聚光镜、物镜光阑、样品室等 2)偏转系统:扫描信号发生器、扫描放大控制器、扫描偏转线圈 3)信号探测放大系统 4)图象显示和记录系统 5)真空系统 2.样品:块状铝合金 三.实验原理 1.扫描电镜成像原理 从电子枪阴极发出的电子束,经聚光镜及物镜会聚成极细的电子束(0.00025微米-25微米),在扫描线圈的作用下,电子束在样品表面作扫描,激发出二次电子和背散射电子等信号,被二次电子检测器或背散射电子检测器接收处理后在显象管上形成衬度图象。二次电子像和背反射电子反映样品表面微观形貌特征。而利用特征X射线则可以分析样品微区化学成分。 扫描电镜成像原理与闭路电视非常相似,显像管上图像的形成是靠信息的传送完成的。电子束在样品表面逐点逐行扫描,依次记录每个点的二次电子、背散射电子或X射线等信号强度,经放大后调制显像管上对应位置的光点亮度,扫描发生器所产生的同一信号又被用于驱动显像管电子束实现同步扫描,样品表面与显像管上图像保持逐点逐行一一对应的几何关系。因此,扫描电子图像所包含的信息能很好地反映样品的表面形貌。 2.X射线能谱分析原理 X射线能谱定性分析的理论基础是Moseley定律,即各元素的特征X射线频率ν的平方根与原子序数Z成线性关系。同种元素,不论其所处的物理状态或化学状态如何,所发射的特征X射线均应具有相同的能量。
实验一 线性极化法测定金属Fe 在稀H 2SO 4中的腐蚀速度 一、基本要求 1. 掌握动电位扫描法测定电极极化曲线的原理和实验技术。通过测定Fe 在 0.1M 硫酸溶液中的极化曲线,求算Fe 的自腐蚀电位,自腐蚀电流。 2. 讨论极化曲线在金属腐蚀与防护中的应用。 二、实验原理 当金属浸于腐蚀介质时,如果金属的平衡电极电位低于介质中去极化剂(如H +或氧分子)的平衡电极电位,则金属和介质构成一个腐蚀体系,称为共轭体系。此时,金属发生阳极溶解,去极化剂发生还原。以金属铁在盐酸体系中为例: 阳极反应: Fe-2e=Fe 2+ 阴极反应: H ++2e=H 2 阳极反应的电流密度以 i a 表示, 阴极反应的速度以 i k 表示, 当体系达到稳定时,即金属处于自腐蚀状态时,i a =i k =i corr (i corr 为腐蚀电流),体系不会有净的电流积累,体系处于一稳定电位c ?。根据法拉第定律,体系通过的电流和电极上发生反应的物质的量存在严格的一一对应关系,故可阴阳极反应的电流密度代表阴阳极反应的腐蚀速度。金属自腐蚀状态的腐蚀电流密度即代表了金属的腐蚀速度。因此求得金属腐蚀电流即代表了金属的腐蚀速度。 金属处于自腐蚀状态时,外测电流为零。 极化电位与极化电流或极化电流密度之间的关系曲线称为极化曲线。极化曲线在金属腐蚀研究中有重要的意义。测量腐蚀体系的阴阳极极化曲线可以揭示腐蚀的控制因素及缓蚀剂的作用机理。在腐蚀点位附近积弱极化区的举行集会测量可以可以快速求得腐蚀速度。还可以通过极化曲线的测量获得阴极保护和阳极保护的主要参数。 在活化极化控制下,金属腐蚀速度的一般方程式为: 其中 I 为外测电流密度,i a 为金属阳极溶解的速度,i k 为去极化剂还原的速度,βa 、βk 分别为金属阳极溶解的自然对数塔菲尔斜率和去极化剂还原的自然对数 )]ex p()[ex p( k c a c corr k a i i i I β? ?β??---=-=
数据结构实验报告 ----试验三循环队列的基本操作及应用 一、问题描述: 熟悉并掌握循环队列的相关操作,自己设计程序,实现循环队列的构造、清空、销毁及队列元素的插入和删除等相关操作。 二、数据结构设计: #define MAXQSIZE 10 //最大队列长度 struct SqQueue { QElemType *base; //初始化动态分配存储空间 Int front; // 头指针,若队列不空,只想对列头元素 int rear; //尾指针,若队列不空,指向队列尾元素的 //下一个位置 }; 三、功能设计: 程序中所涉及到的函数如下: Status InitQueue(SqQueue &Q) //构造一个空队列Q Status DestroyQueue(SqQueue &Q) //销毁队列Q,Q不再存在 Status ClearQueue(SqQueue &Q) //将Q清为空队列 Status QueueEmpty(SqQueue Q) //若队列Q为空队列,则 //返回TRUE,否则返回FALSE int QueueLength(SqQueue Q) //返回Q的元素个数,即队列长度Status GetHead(SqQueue Q,QElemType &e)//若队列不空,则用e返回Q的对 //头元素,并返回OK,否则返回ERROR Status EnQueue(SqQueue &Q,QElemType e)//插入元素e为Q的新的队尾元素Status DeQueue(SqQueue &Q,QElemType &e)//若队列不空,则删除Q的队头 //元素,用e返回其值,并返回 //OK,否则返回ERROR Status QueueTraverse(SqQueue Q,void(*vi)(QElemType))//从队头到队尾依次 //对队列Q中每个元素调用函数 //vi()。一旦vi失败,则操作失败四、源程序: // c1.h (程序名) #include
循环伏安法测定亚铁氰化钾 实验目的 (1) 学习固体电极表面的处理方法; (2) 掌握循环伏安仪的使用技术; (3) 了解扫描速率和浓度对循环伏安图的影响 实验原理 铁氰化钾离子[Fe(CN)6]3--亚铁氰化钾离子[Fe(CN)6]4-氧化还原电对的标准电极电位为 [Fe(CN)6]3- + e -= [Fe(CN)6]4- φθ= 0.36V(vs.NHE) 电极电位与电极表面活度的Nernst 方程式为 φ=φθ+ RT/Fln(C Ox /C Red ) -0.2 0.00.20.4 0.60.8 -0.0005 -0.0004-0.0003-0.0002-0.00010.0000 0.00010.00020.0003i pa i pc I /m A E /V vs.Hg 2Cl 2/Hg,Cl - 起始电位:(-0.20V) 终止电位:(0.80 V) 溶液中的溶解氧具有电活性,用通入惰性气体除去。 仪器与试剂 MEC-16多功能电化学分析仪(配有电脑机打印机);金电极;铂丝电极;饱和甘汞电极; 容量瓶:250 mL 、100mL 各2个,25 mL 7个。 移液管:2、5、10mL 、20mL 各一支。 NaCl 溶液、K 4[Fe(CN)6]、、Al 2O 3粉末(粒径0.05 μm ) 实验步骤
1、指示电极的预处理 金电极用金相砂纸细心打磨,超声波超声清洗,蒸馏水冲洗备用。 2、溶液的配制 配制0.20 mol/L NaCl溶液250mL,再用此溶液配制0.10 mol/L的K4[Fe(CN)6]溶液100mL备用。 3、支持电解质的循环伏安图 在电解池中,放入25mL 0.2 mol·L-1 NaCl溶液,插入电极,以新处理的铂电极为工作电极,铂丝电极为辅助电极,饱和甘汞电极为参比电极,进行循环伏安仪设定,扫描速率为0.1V/s;起始电位为-0.20V,终止电位为0.80V。开始循环伏安扫描. 4、K4 [Fe(CN)6]溶液的循环伏安图 在-0.20至0.80V电位范围内,以0.1V/s的扫描速度分别作0.01 mol·L-1、0.02 mol·L-1、0.04 mol·L-1、0.06 mol·L-1、0.08 mol·L-1的K4 [Fe(CN)6]溶液(均含支持电解质NaCl浓度为0.20mol·L-1)循环伏安图 5、不同扫描速率K4 [Fe(CN)6]溶液的循环伏安图 在0.08 mol·L-1 K4 [Fe(CN)6]溶液中,以0.1V/s、0.15 V/s、0.2V/s、0.25 V/s、0.3V/s、0.35V/s,在-0.20至0.80V电位范围内扫描,做循环伏安图 数据处理 1、从K4[Fe(CN)6]溶液的循环伏安图,测量i pa、i pc值。 -1;起始电位为-0.20V,终止电位为0.80V) 2、分别以i pa和i pc对K4[Fe(CN)6]溶液浓度c作图,说明峰电流与浓度的关系。
电化学分析实验报告院系:化学化工学院 专业班级: 学号: 姓名: 同组者: 实验日期: 指导老师:
实验一:铁氰化钾在玻碳电极上的氧化还原 一、实验目的 1.掌握循环伏安扫描法。 2.学习测量峰电流和峰电位的方法。 二、实验原理 循环伏安法也是在电极上快速施加线性扫描电压,起始电压从E i开始,沿某一方向变化,当达到某设定的终止电压E m后,再反向回扫至某设定的起始电压,形成一个三角波,电压扫描速率可以从每秒数毫伏到1V。 当溶液中存在氧化态物质Ox时,它在电极上可逆地还原生成还原态物质,即 Ox + ne → Red;反向回扫时,在电极表面生成的还原态Red则可逆地氧化成Ox,即 Red → Ox + ne.由此可得循环伏安法极化曲线。 在一定的溶液组成和实验条件下,峰电流与被测物质的浓度成正比。 从循环伏安法图中可以确定氧化峰峰电流I pa、还原峰峰电流I pc、氧化峰峰电位φpa和还原峰峰电位φpc。 对于可逆体系,氧化峰峰电流与还原峰峰电流比为:I pa/I pc =1 25℃时,氧化峰峰电位与还原峰峰电位差为:△φ=φpa- φpc≈56/z (mV) 条件电位为:φ=(φpa+ φpc)/2 由这些数值可判断一个电极过程的可逆性。 三、仪器与试剂 仪器::电化学分析仪VA2020, 玻碳电极、甘汞电极、铂电极。 试剂:铁氰化钾标准溶液,0.5mol/l氯化钾溶液,蒸馏水。 四、实验步骤 1、溶液的配制
移取铁氰化钾标准溶液(10-3mol/L)5ml于50mL的塑料杯中,加入0.5mol/l 氯化钾溶液,使溶液达到30mL 。 2、调试 (1)打开仪器、电脑,准备好玻璃电极、甘汞电极和铂电极并清洗干净。(2)双击桌面上的VaLab图标。 3、选择实验方法:循环伏安法 设置参数:低电位:-100mv;高电位600mv;初始电位-100mv; 扫描速度:50mv/s;取样间隔:2mv;静止时间:1s; 扫描次数:1;量程: 200μA。 4. 开始扫描:点击绿色的“三角形”。 5. 将上述体系改变扫描速度分别为10mv/s、50mv/s、100mv/s、160mv/s、 200mv/s,其他条件不变,作不同速度下的铁氰化钾溶液的循环伏安曲线,其峰值电流与扫描速度的平方根成正比关系。 五、实验数据及处理 1. 找到循环伏安曲线上对应的氧化与还原峰,然后手动做切线。 200mv/s
栈的顺序表示和实现 一、实验目的 1. 了解栈和队列的特性。 2. 掌握栈的顺序表示和实现。 3. 掌握栈的链式表示和实现。 4. 掌握队列的顺序表示和实现。 5. 掌握队列的链式表示和实现。 6. 掌握栈和队列在实际问题中的应用。 二、实验要求 1.认真阅读和掌握本实验的程序。 2. 上机运行本程序。 3. 保存和打印出程序的运行结果,并结合程序进行分析。 4. 按照对顺序表和单链表的操作需要,重新改写主程序并运行,打印出文件清单和运行结果。 三、实验内容 编写一个程序实现顺序栈的各种基本运算,并在此基础上设计一个主程序完成如下功能: (1)初始化顺序栈。 (2)插入元素。 (3)删除栈顶元素。 (4)取栈顶元素。 (5)遍历顺序栈。 (6)置空顺序栈。 四,解题思路 五、程序清单 #include
{ if(p->top
**大学本科实验报告专用纸 课程名称 仪器分析实验 成绩评定 实验项目名称 线性扫描伏安法与循环伏安法实验 指导教师 实验项目编号 实验项目类型 实验地点 学生姓名 学号 学院 系 化学系 专业 实验时间2015年11月13日下午~11月13日下午 温度 ℃湿度 一.实验目的 1.掌握线性扫描伏安法及循环伏安法的原理; 2.掌握微机电化学分析系统的使用及维护。 3.掌握利用线性扫描伏安法进行定量分析及利用循环伏安法判断电极反应过程。 二.实验原理 1. 线性扫描伏安法: 线性扫描伏安法是在电极上施加一个线性变化的电压,记录工作电极上的电解电流的方法。记录的电流随电极电位变化的曲线称为线性扫描伏安图。 ⑴可逆电极反应的峰电流如下: c v AD n i p 121351069.2?= 式中,n 为电子交换数;A 为电极有效面积;D 为反应物的扩散系数;v 为电位扫描速度;c 为反应物(氧化态)的本体浓度。当电极的有效面积A 不变时,上式可简化为:c Kv i p 21= 即峰电流与电位扫描速度v 的1/2次方成正比,与反应物的本体浓度成正比。这就是线性扫描伏安法定量分析的依据。 ⑵可逆电极反应,峰电位与扫描速度无关,nF RT E E p /1.121±= 电极反应为不可逆时,峰电位p E 随扫描速度v 增大而负(或正)移。 2. 循环伏安法: 循环伏安法的原理与线性扫描伏安法相同,只是比线性扫描伏安法多了一个回扫,所以称为循环伏安法。循环伏安法是电化学方法中最常用的实验技术,也是电化学表征的主要方法。循环伏安法有两个重要的实验参数,一是峰电流之比,二是峰电位之差。对于可逆电极反应,峰电流之比pa pc i i /(阴极峰电流pc i 与阳极峰电流pa i 之比)的绝对值约等于1。峰电位之差p E ?(阴极峰电位pc E 与阳极峰电位pa E 之差)约为60mV(25℃),即 nF RT E p /22.2=?。
循环伏安法测定电极反应 一、实验目的 1、学习循环伏安法测定电极反应的基本原理和方法。 2、熟悉电化学工作站的使用并根据所测数据验证并判断电极反应是否是可逆反应。 二、实验原理 伏安分析法是在一定电位下测量体系的电流,得到伏安特性曲线。根据伏安特性曲线进行定性定量分析。循环伏安法是将对称的三角波扫描电压(如图一)施加于电解池的电极上,记录工作电极上的电流随电压变化的曲线。在三角波的前半部分,电极上若发生还原反应(阴极过程),得到一个峰形的阴极波;而在三角波的后半部分,则得到一个峰形的阳极波。一次三角波电压扫描,电极上完成一个氧化还原循环。当工作电极被施加的扫描电压激发时,其上将产生响应电流。以该电流(纵坐标)对电位(横坐标)做图,就得到了循环伏安图(如图二所示)。 图一
图二 E pc、E pa分别为阴极峰值电位与阳极峰值电位。i pc、i pa分别为阴极峰值电流与阳极峰值电流。这里p代表峰值,a代表阳极,c代表阴极。 [Fe(CN)6]3--[Fe(CN)6]4-体系氧化还原电对的标准电极电位为: [Fe(CN)6]3- + e- = [Fe(CN)6]4-φθ= 0.36V 电极电位与电极表面活度的Nernst方程式为:φ=φθ+ nRT/Fln(C Ox/C Red) 用循环伏安法正扫时(由正向负的扫描)为阴极扫描,产生还原电流: Fe(CN)63- + e- = Fe(CN)64- 反扫时(由负向正的扫描)为阳极扫描,产生氧化电流: Fe(CN)64- - e- = Fe(CN)63- 两峰之间的电位差值为: (1) 对扩散控制的体系,循环伏安的峰电流,由Randles–Savcik方程可表示为: i p= 2.69×105n3/2AD1/2υ1/2c (2) 其中: i p为峰电流(A),n为电子转移数, A为电极面积(cm2), D为扩散系数(cm2/s),υ为扫描速度(V / s), c为浓度(mol/L)。 根据上式,i p与υ1/2和c都是直线关系,对研究电极反应过程具有重要意义。 在可逆电极反应过程中,
陕西师范大学仪器分析实验 姓名:颜琦 实验日期:2014.11.12 学号:41207081 室温:17℃ 专业:化学二班 实验名称:循环伏安法测定亚铁氰化钾 1.实验目的 1.1学习固体电极表面的处理方法。 1.2掌握循环伏安法的使用技术。 1.3了解扫描速率和浓度对循环伏安图的影响。 2.实验原理 2.1 [Fe(CN)6]3-+e -[Fe(CN)6]4- 2.2 电极电位与电极表面活度的Nernst 方程为 )(Re d Ox c c In F RT +=θ ?? 2.3峰电流与电极表面活度的Ctroll 方程为 c v AD n i p 21 21235 1069.2?= s cm D /1061.626-?=(扩散系数) n=1(电子转移数) A (电极表面积) v(电压扫描速度) c (被测物质浓度) 2.4在一定扫描速率下: 从起始电位(-0.20V )正向扫描到转折电位(+0.80V )期间,溶液中[Fe(CN)6]4- V 36.0=θ?
被氧化生成[Fe(CN)6]3-,产生氧化电流。 当负向扫描,从转折电位(+0.80V)扫描到起始电位(-0.20V),溶液[Fe(CN)6]3-被还原[Fe(CN)6]4-,产生还原电流。 2.5循环伏安法电流-电位曲线为: 3.实验仪器与试剂 循环伏安仪 指示电极:铂电极 辅助电极:铂丝电极 参比电极:饱和甘汞电极 0.5mol/LK4[Fe(CN)6]溶液 1.0mol/LNaCl溶液 4.实验过程 4.1打开电脑和循环伏安仪,预热10min。 4.2指示电极的预处理 铂电极用Al2O3粉末将电极表面抛光,蒸馏水冲洗。 4.3支持电解质的循环伏安图 在电解池中放入0.10mol/LNaCl溶液,分别插入参比、辅助、指示电极,连接循环伏安仪,设定扫描速率为0.1V/s,起始电位为-0.2V,终止点位为0.8V,开始循环伏安扫描。 4.4不同浓度的K4[Fe(CN)6]溶液的循环伏安图
《算法与数据结构》课程
一、实验目的 掌握队列的存储结构及进队/出队等操作的实现。 二、实验内容及要求 1.实现队列的一种存储结构。 2.实现队列的相关操作。 3.利用队列的操作特点,借助进队与出队操作完成打印二项式系数的任务。 三、系统分析 (1)数据方面:该队列数据元素类型采用整型,在此基础上进行队列的一些基本操作,应用体现在打印二项式系数即打印杨辉三角形。 (2)功能方面: 1.进队操作:若队列不满,则将元素x进入队列。 2.出队操作:若队列不空,则退出队头元素x并由函数返回true,否则返 回false。 3.获取队头元素:若队列不为空,则函数返回true及队头元素的值,否则 返回false。 4.判断队列是否为空、判断队列是否满。 5.计算队列中元素个数:直接返回队列中元素个数。 6.清空队列内容:队头指针和队尾指针置0。 7.打印杨辉三角形前n行数字。 四、系统设计 (1)设计的主要思路 队列得基于数组得存储表示亦称为顺序队列,是利用一个一维数组作为队列元素的存储结构,并且设置两个指针front和rear,分别指示队列的队头和队尾位置。每当添加一个新元素时,先将新元素添加到rear所指位置,再让队尾指针
rear进1。每当退出队头元素,应当先把front所指位置元素记录下来,再让队头指针进1,指示下一队头元素位置,最后把记录下来的元素值返回。 但当队头指针front==rear,队列为空;而当rear==maxSize时,队列满,如果再加入新元素,就会产生“溢出”。但这种“溢出”可能时假溢出,因为在数组的前端可能还有空位置。为了能够充分地使用数组中的存储空间,把数组的前端和后端连接起来,形成一个环形表,即把存储队列元素的表从逻辑上看成一个环,成为循环队列。循环队列的首尾相接,当队头指针front和队尾指针rear进到maxSize-1后,再前进一个位置就自动到0.这可以利用除法取余的运算实现。(2)数据结构的设计 队列的定义是一种限定存取位置的线性表。它只允许在表的一端插入,在另一端删除。允许插入的一端叫做队尾,允许删除的一端叫做队头。最先进入队列的元素最先退出队列,队列这种特性叫做先进先出。 空队列 A进队 对头指针进1:front=(front+1)%maxSize; 队尾指针进1:rear=(rear+1)%maxSize; 队列初始化:front=rear=0; 循环队列的队头指针和队尾指针初始化时都设置为0:front=rear=0.在队尾插入新元素和删除队头元素时,两个指针都按顺时针方向进1.当它们进到maxSize-1时,并不表示表的终结,只要有需要,利用%运算可以前进到数组的0号位置。 五、编程环境与实验步骤 (1)编程环境 操作系统:Windows操作系统;编程工具软件:Visual Studio 2017 (2)实验步骤 无文件操作。 (3)编译参数
附录A 实验报告 课程:数据结构(c语言)实验名称:栈和队列 系别:数字媒体技术实验日期: 11月15号 专业班级:组别: 姓名:学号: 实验报告内容 验证性实验 一、预习准备: 实验目的: 1. 掌握栈的顺序表示、链表表示以及相应操作的实现。特别注意栈空和栈满 的条件; 2. 掌握队列的顺序表示、链表表示以及相应操作的实现。特别是循环队列中 队头与队尾指针的变化情况; 实验环境:Widows操作系统、VC6.0 实验原理: 1.定义: 栈:只允许在一端插入和删除的线性表,允许插入和删除的一端称为 栈顶(top),另一端称为栈底(bottom)。 队列: 是只允许在一端删除,在另一端插入的顺序表,允许删除的一端叫做队 头(front),允许插入的一端叫做队尾(rear)。 2.特点: 栈:后进先出(LIFO) 队列:先进先出(FIFO, First In First Out) 9
3. 表示: 栈:(1)栈的数组表示—顺序栈 (2)栈的链接表示—链式栈 队列:(1)队列的顺序存储结构表示——循环队列 (2)队列的链式表示—链队列 实验内容和要求: 分别使用顺序循环队列和堆栈以及链式队列和堆栈编写程序:判断一个字符序列是否是回文。回文是指一个字符序列以中间字符为基准,两边字符完全相同。如:“ABCDEDCBA”。字符串长度小于等于80,用于判断回文的字符串不包括字符串的结束标记符。 基本要求: (1)字符序列可由用户从键盘随意输入; (2)可以连续测试多个字符序列,由用户决定退出测试程序; 算法思想: 判断回文的算法思想是:把字符串中的字符逐个分别存入队列和堆栈中,然后逐个出队列和退栈并比较出队列的数据元素和退栈的数据元素是否相等,若全部相等则该字符序列为回文,否则就不是回文。 基本操作: 回文判断操作主要包括入栈和入队列、退栈和出队列操作。在对堆栈以及队列进行操作之前,必须对队列以及堆栈进行初始化。若使用链式堆栈和链式队列,操作结束后必须销毁链表。 二、实验过程: 程序流程图:
循环伏安法测定电极反应参数 一目的要求 1掌握用循环伏安法判断电极过程的可逆性。 2学会使用循环伏安仪。 3测量峰电流和峰电位。 二原理 循环伏安法与单扫描极谱法相似。在电极上施加线形扫描电压,当到达某设定的终止电压后,再反向回扫至某设定的起始电压,若溶液中存在氧化态O,电极上将发生还原反应: O+Ze == R 反向回扫时,电极上生成的还原态R将发生氧化反应: R == O+Ze 峰电流可表示为: i p =KZ3/2D1/2m2/3t2/3v1/2c 其峰电流与被测物质浓度C、扫描速率v等因素有关。 从循环伏安图可确定氧化峰峰电流i pa 和还原峰峰电流i pc ,氧化峰峰电位φ pa 和还原峰峰电位φ pc 值。 对于可逆体系,氧化峰峰电流与还原峰峰电流比:1 = pc pa i i 氧化峰峰电位与还原峰峰电位差:) ( 058 .0 V z pc pa = - = ?? ? ? 条件电位φo’: 2 pc pa O ? ? ? + = ' 由此可判断电极过程的可逆性。 三仪器与试剂 仪器 CHI660C 电化学工作站;x-y函数记录仪器;金属盘电极、铂圆盘电 极或玻璃碳电极,铂丝电极和饱和甘汞电极。
试剂 1.00×10-2mol/L K 3Fe(CN) 6 ;1.0mol/L KNO 3 。 四实验步骤 1金属圆盘电极(或铂圆盘电极、玻璃碳电极)的预处理。 用Al2O3粉(或牙膏)将电极表面抛光(或用抛光机处理),然后用蒸馏水清洗,待用。也可用超声波处理。 2 K 3Fe(CN) 6 溶液的循环伏安图 在电解池中放入含0.1mol/LKNO 3 的铁氰化钾标准溶液,插入玻碳圆盘电极 (或金圆盘)工作电极、铂丝辅助电极和饱和甘汞电极,通N 2除O 2 。 打开CHI660C伏安仪和计算机的电源。屏幕显示清楚后,再打开测量窗口;测量铁氰化钾试液:置电极系统于10ml小烧杯的铁氰化钾试液里;打开ESTUP 的下拉菜单,在Technique项中选择Cyclic voltammetry方法,在Parameters 项内选择参数。点击“▲”进行测量。完成后,命名存储。 以扫描速率100mV/s,从+0.6~-0.2V扫描,分别记录1.00×10-5、1.00× 10-4、1.00×10-3和1.00×10-2 mol/L K 3Fe(CN) 6 +0.1mol/L KNO 3 溶液的循环伏安 图。 取1.00×10-3mol/L K 3Fe(CN) 6 +0.1mol/L KNO 3 溶液,改变扫描速率从100mV/s 到20mV/s。