
全国药物安全性评价专题负责人第二期高级培训班
中国毒理学会药物毒理与安全性评价专业委员会 中国药学会药物安全性评价专业委员会 中国药理学会药物毒理专业委员会
毒代动力学及 其研究方法
李川
(021-********;chli@https://www.doczj.com/doc/244148016.html,) 中国科学院上海药物研究所 上海药物代谢研究中心
2009年11月·成都
演讲内容
一 新药安评与体内药物暴露 二 影响体内药物暴露的因素 三 毒代动力学的概念 四 毒代动力学的研究方法与实施 五 小结
一 新药安评与体内药物暴露
过去20多年在新药研发领域发生的变化
45% 30%
ADME/PK
15%
0%
Financial
CaImndpirdoavteed
Formulation
Commercial Human AEs
ToAxnicimityal
EfCficliancicyal
Other
Br. J. Clin. Pharmacol. 25: 387 (1988)
Nature Rev./Drug discovery 3: 711 (2004)
化合物资源
新药上市前必须对其 安全性进行仔细评估
药物发现
1 药物先导化合物的发现 2 药物先导化合物的结构优化
药药物物候候选选化化合合物物
非临床安评研究
由于开展临床试验的伦理限制,必须先在
新药开发
1 临床前研究 2 临床试验
动物上进行全面的新药安评,以揭示新药 对动物器官组织的毒副作用,研究其剂量
药药安
质
新
依赖性、体内暴露相关性和可恢复性等, 帮助确定临床试验的初始安全剂量和应观
效代评
量
药
察的潜在毒副作用。
临床试验中的新药安全性考察
新药安全有效评价体系
安全性始终是临床试验关注的重点,影响临床试
验的推进。先从低剂量、小范围人群开展临床试
验,在安全性得以保证后,再增加给药剂量、扩
大人群已验证药物的有效性。
为什么在药物安评中要考虑体内药物暴露?
(确定药物的两个要素:功能和物质)
剂量-暴露
体内药物暴露
(化学形式/浓度)
机体对药物的作用
反映药物“物质” 的一种形式 相对准确
浓度-效应
给药剂量
反映药物“物质” 的一种形式
好用,但不准确
药物对机体的作用
毒副作用
1
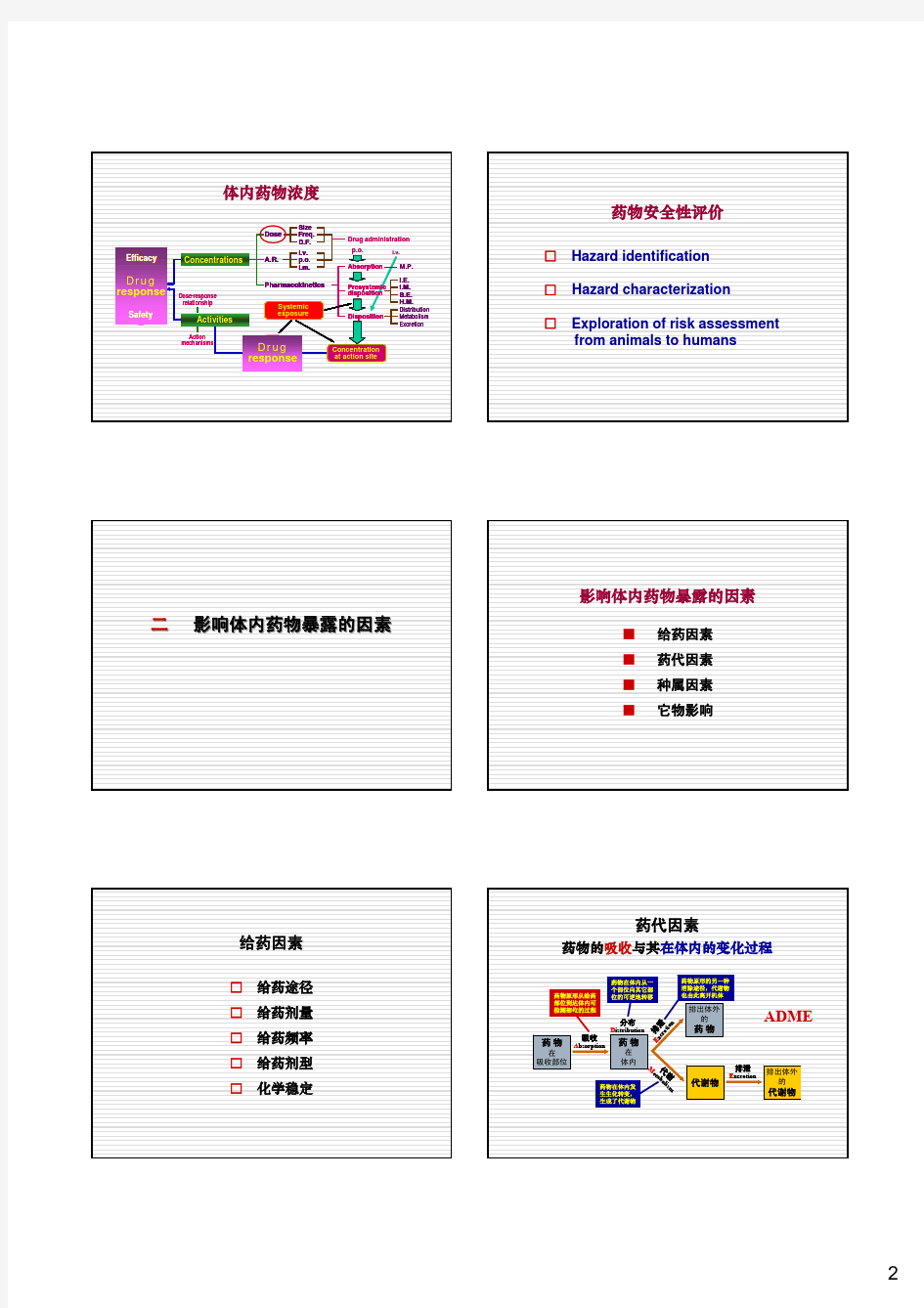
体内药物浓度
Efficacy
Drug response
Safety
Concentrations
Dose A.R.
Size Freq. D.F.
i.v. p.o. i.m.
Drug administration
p.o.
i.v.
Absorption
M.P.
Dose-response relationship
Activities
Pharmacokinetics
Systemic exposure
Presystemic disposition
Disposition
I.E. I.M. B.E. H.M.
Distribution Metabolism Excretion
Action mechanisms
Drug response
Concentration at action site
药物安全性评价
□ Hazard identification □ Hazard characterization □ Exploration of risk assessment
from animals to humans
二 影响体内药物暴露的因素
影响体内药物暴露的因素
■ 给药因素 ■ 药代因素 ■ 种属因素 ■ 它物影响
给药因素
□ 给药途径 □ 给药剂量 □ 给药频率 □ 给药剂型 □ 化学稳定
药代因素
药物的吸收与其在体内的变化过程
药物原形从给药 部位到达体内可 检测部位的过程
药物在体内从一 个部位向其它部 位的可逆地转移
药物 在
吸收部位
分布
Distribution
吸收 Absorption
药物
在
体内
药物在体内发 生生化转变, 生成了代谢物
Metab代oli谢sm
Excreti排on泄
药物原形的另一种 消除途径,代谢物 也由此离开机体
排出体外 的
药物
ADME
代谢物
排泄 Excretion
排出体外 的
代谢物
2
吸收
肠肝屏障
吸收是指药物原形从给药部位到达体循环的过程。药 物吸收的延迟和吸收过程中药物的损失均会影响药效,甚 至造成药物治疗的失败。
■ 肠上皮细胞紧密连接(膜通透性) ■ 肠上皮细胞肠腔测外排(P-gp等) ■ 肠上皮细胞内酶代谢(CYP3A、UGT等) ■ 肝细胞内酶代谢(CYP、UGT等) ■ 肝细胞胆小管测外排(OATP/OCT//P-gp/MRP2)
A drug given as a solid
口服给药的吸收过程
Gut Lumen
Gut Wall
Portal Vein
Liver
To Site of
Measurement
(Blood in an arm vein)
Metabolism
Metabolism
First-pass Effect
To Feces
首过效应
Clin. Pharmacol. Ther. 2005
分布
通过测量动物各组织中的药物浓度可获取药物分布信息, 人的药物分布信息通常利用血药浓度数据进行初略估计。
Plasma
Bound Unbound
Tissue
Bound Unbound
■ 药物与血浆蛋白和组织蛋白结合的差异 ■ 器官组织的血液流速 ■ 药物的脂溶性
药物通过血脑屏障(BBB)
■ 足够的脂溶性 ■ 极性适中 ■ 不是P-gp的底物
Clin. Pharmacol. Ther. 2005
代谢
肝脏是最主要的药物代谢器官,其它有肠、肾和肺; 药物在细胞中的代谢主要在内质网和胞液中进行。
Absorption
Distribution
Drug (Xenobiotics)
Lipophilic
药物代谢酶
Enzyme(s)
Metabolism
Excretion
Hydrophilic
Metabolism provides a mechanism for ridding the body
of undesirable foreign compounds and drugs.
药物代谢反应可分为“一相代谢反应”和“二相代谢反应”
一相代谢反应(Phase I reactions/Functionalization reactions) 在原药分子中引入或使其暴露功能团
二相代谢反应(Phase II reactions/Conjugation reactions) 让内源性的葡萄糖醛酸、硫酸、谷胱甘肽或氨基酸等与原药分子 或一相代谢物分子上的功能团产生共价结合
排泄
胆汁排泄
大分子药物和代谢物,MW > 500(人)、MW > 300(大鼠)
种属差异较大,小鼠、大鼠及犬的排泄较强,兔、豚鼠、猴、人的较弱
肾排泄
极性、水溶性、小分子(MW < 500)及代谢慢的药物
涉及肾小球过滤、肾小管重吸收及肾小管主动分泌
肾功能 尿的pH值(4.5~8.5)(血:7.3~7.5)
肺呼吸排泄
挥发性药物
肠肝屏障
SPD肠道 吸收良好
SPD
PAPS PAP
血脑屏障
SPD
SPD 易于通过 血脑屏障
Clin. Pharmacol. Ther. 2005
(大鼠) (大鼠/人)
l-SPD (人)
UDPGA
UDP
SPD-O-sulfate (M4)
SPD-O-glucuronide (M2)
l-Stepholidine口服生 物利用度低的原因:
II相代谢后随胆汁排泄
胆汁排泄 Br. J. Pharmacol. 2009
种属因素
(Drug-induced toxicity is often species-dependent, which can be explained by PK and PD effects of drugs. )
药物的吸收 与其在体内 的变化过程
Biotranslocation
转移
机体对药物的暴露
膜通透 转运体 核
受 血浆蛋白 体
转化
Biotransformation
药物代谢酶
(Parent compounds/metabolites/reactive intermediates)
CYP、UGT、羧酸酯酶等药物代谢酶均表现出种属差异。这些 种属差异表现在底物特异性、代谢速率、代谢物谱(代谢途径、手 性代谢)、酶受抑制剂、诱导剂、激素等的影响、性别差异等上。
药物胆汁排泄有显著的种属差异。
它物影响
□ 饲料影响 □ 饮水影响 □ 麻醉剂影响 □ DDI、HDI
3
有关体内药物暴露的信息
■ 药物原形的系统暴露及其与剂量的关系 ■ 药物的代谢途径及主要暴露形式
(主要代谢物的活性) ■ 系统暴露与组织暴露的同步性 ■ 尿排泄与系统暴露的相关性 ■ 尿排泄与系统暴露的相关性 ■ 系统暴露的体内关键调控环节 ■ 系统暴露的个体间、雌雄间、种属间差异
体内药物暴露信息的获取
检测部位(样品) 检测对象(化合物)
药物在作用靶位的浓度 药物的体内浓度 药物的血中浓度
(血浆、血清、全血)
药物的组织浓度
(组织匀浆、细胞间液)
药物在排泄物中的浓度
(尿、胆汁、粪便)
实测目标浓度 替代标识浓度
药物代谢物谱比较 药物原型的浓度
(总浓度、游离浓度)
药物的代谢物浓度
(活性代谢物、主要代谢物、 多个代谢物、手性化合物)
药物及其代谢物浓度
(水解后的汇总浓度)
PD和toxicity反映暴露 实测目标浓度 替代标识浓度
三 毒代动力学的概念
毒代动力学(Toxicokinetics)的概念
Toxicokinetics is defined as the generation of pharmacokinetic data, either as an integral component in the conduct of non-clinical toxicity studies or in specially designed supportive studies, in order to assess systemic exposure. These data may be used in the interpretation of toxicology findings and their relevance to clinical safety issue.
ICH Topic S3A Toxicokinetics: A Guidance for Assessing Systemic
Exposure in Toxicology Studies Date for Coming into Operation: June1, 1995
https://www.doczj.com/doc/244148016.html,/emea.html
毒代动力学研究是做好药物安评工作 的一个工具,不应机械地将其看成一项规 定必做的内容。
解释毒副反应 帮助试验设计
“毒代动力学”的基本研究目标
■ 揭示安评中新药在试验动物体内的系统暴露水平、及其与给药 剂量的相关性和随时间变化的过程。
“毒代动力学”的其它研究目标
■ 将安评中新药的体内暴露情况与其出现的毒副反应相关联,并 将此用于预测在下一步临床试验中可能出现的毒理学反应; ■ 为非临床毒性试验确定合适的动物种属和给药方案提供帮助; ■ 与安评中出现的毒副反应相结合,为设计拟开展的非临床安评 试验提供信息支持。
毒代动力学服务于药物安全性评价研究
■ Single-dose toxicity studies ■ Repeated-dose toxicity studies ■ Genotoxicity studies ■ Carcinogenicity studies ■ Reproductive toxicity studies
4
SFDA指导原则中的毒代动力学
■ 化学药物非临床药代动力学研究技术指 导原则(2005)
■ 化学药物长期毒性实验技术指导原则 (2005)
■ 中药、天然药物长期毒性研究技术指导 原则(2005)
■ 细胞毒类抗肿瘤药物非临床研究技术指 导原则(2006)
■ 药物遗传毒性研究技术指导原则(2007)
中国科学院上海药物研究所李川课题组 近五年由完成药代研究后获SFDA临床试验批件的新药
No.
药品名
1 (5R)-5-羟基雷公藤内酯醇 片
2 注射用熊果酸纳米脂质体
3 羟尼酮胶囊
4 甲磺酸阿帕替尼片
5 注射用马来酸氨柔比星
6 吡美拉唑肠溶片
7 吗啉硝唑注射液
8 酒石酸长春氟宁注射液
9 槐果碱注射液
批件号 2009L03464
2009L00634 2007L04739 2007L00837 2007L02825 2006L04064 2005L02858 2005L01720 2005L01577
注册分类 化药1.1类
化药1.2类 化药1.1类 化药1.1类 化药4类 化药1.1类 化药1.1类 化药1.1类 中药1类
申请人 中国科学院上海药物研究所/ 上海医药(集团)有限公司 武汉利元亨药物技术 上海睿星基因 江苏恒瑞医药/上海恒瑞医药 江苏豪森药业 江苏豪森药业 江苏豪森药业 江苏豪森药业 上海仁济医院
毒代动力学 √
√ √ √ — √ √ — √
四 毒代动力学的研究方法与实施
怎样做好毒代动力学研究工作?
以药代动力学研究为基础,借助其 方法和手段,努力为药物安全性评价工 作提供帮助,按GLP规范研究行为。
从药代动力学研究中获取体内药物暴露 特征的有用信息,支持药物安评研究
药代动力学研究 生物样品分析方法的建立,Non-GLP 大鼠血浆药动学研究 大鼠组织分布研究 大鼠排泄研究
大鼠代谢研究
犬血浆药动学研究 体外酶代谢研究 药物代谢酶影响研究 血浆蛋白结合率测试 多次给药药动学研究
毒代动力学研究/安评研究 引进方法,GLP 引进信息,帮助毒代实验设计 引进信息,帮助解释安评数据 引进信息,尿中药物也可能用做反 映体内暴露的Marker 引进信息,安评关注代谢物可能的 毒性 引进信息,帮助毒代实验设计 引进信息,帮助解释毒代数据 引进信息,帮助解释毒代数据 引进信息,增进对体内暴露的理解 大鼠及/或犬毒代研究
基本药代动力学参数(Primary PK Parameters) 从属药代动力学参数(Secondary PK Parameters)
一种药物在体 内被溶解的表 观体积计算值。
反映药物从体内被清除的 速率,即单位时间里药物 被清除的血浆体积大小。
分布体积
清除率
吸收
给药后,药 物吸收的程 度和快慢。
药物浓度下 降一般所需 要的时间。
半衰期 给药频率
口服生物 利用度
给药剂量
药物口服剂量 中到达循环系 统的比例。
体内药物暴露
毒副反应
5
毒代动力学的试验设计
■ 反映体内药物暴露的分析对象、 样品及方法
■ 动物实验的安排 ■ 数据处理及报告 ■ 需考虑的其它影响因素
反映体内药物暴露的 分析对象、样品及方法
□ 体内药物暴露
(反映安评试验剂量下的暴露情况,反映种属、剂量及性别等差异)
□ 分析对象
(药物原形; 代谢物:前药、活性代谢物、代谢物是主要暴露形 式且比药物原形易测;手性化合物)
□ 分析样品
(血浆、尿、组织等;采样引起最小的损伤,但反映暴露)
□ 分析方法
(满足安评研究需求,可靠-Cross-validation,与临床试验的一致)
动物实验的安排
□ 动物实验的类型
(针对某个具体安评试验还是真个安评研究;单独试验;相伴试验: 测安评试验大动物的暴露、设小动物卫星组测暴露;雌雄兼用)
□ 给药途径
(特殊情况:对难以反复多次给药的途径,根据药代信息采用替代 给药途径;新药研发中原来的给药途径发生了改变)
□ 给药剂量
(低剂量:无毒副作用剂量,动物暴露等于或略超过人的最大暴 露;中剂量:根据安评试验的需求是低剂量暴露的几倍;高剂量: 根据安评研究的考虑而设。当暴露主要受制于吸收时的Top剂量)
□ 采样安排
(原则:在满足反映暴露水平的情况下,尽可能减少采样点和量)
数据处理及报告
□ 反映暴露的毒代数据
(Cmax、AUC;代谢物谱/代谢途径)
□ 数据的精密度
(由于动物个体间差异、个体内的试验前后差异、每组动物数少等 原因,难以过高要求毒代数据的精密度。有时,动物个体的数据比 统计后的平均数据更重要)
□ 报告内容
(阐明毒代动力学研究的定位和目的,系统说明分析方法及其可靠 性,全面分析毒代数据的含义及其对新药毒副反应的解释)
需考虑的其它影响因素
□ 种属差异
(除了暴露水平外,种属差异还可能涉及蛋白结合、组织摄取、受 体性质、代谢途径的方面)
□ 系统暴露水平低
(有些药物虽然系统暴露水平相对较低,但该药或其代谢物在某些 特殊组织中的浓度水平可能很高)
毒代动力学研究的实施
■ 研究团队(SD、顾问、操作人员、 技术支持、对外联络)
■ 实验条件(分析仪器、样品储存设备 等;仪器校验与监控)
■ 学科知识、实验技术及培训制度
■ GLP制度建设
6
中国科学院上海药物研究所李川课题组
开展毒代研究的SOPs
类别
数量
组织、人员和综合管理(ADM)
11
试验实施(STU)
5
动物试验操作(ANI)
20
毒代用仪器使用和维护规程(TKT)
11
毒代生物样品分析
15
设施管理(FCI)
6
合计
68
研究实例介绍 (?)-Sophocarpine的比格犬毒代动力学研究
(–)-Sophocarpine (SC) 是一种抗病毒性心肌炎的 在研新药。在本项研究中,我们建立了一种基于液-质 联用技术的分析方法检测血浆样品中SC浓度的灵敏、 快速、可靠的方法,并请其应用于与SC三个月长毒试 验相伴的毒代动力学研究中。前期动物药代动力学研究 表明,血中SC浓度可用于反映i.v.给药后,机体对SC的 暴露。
O H
N H
H N
H
(–)-Sophocarpine
分析方法简介
样品前处理:MTBE-液液提取法; LC:C18柱,3-min等梯度洗脱法; MS/MS:ESI(+),SRM; 内标法:(?)-stepholidine。
MS/MS spectra of [M+H]+ at m/z 247 for SC and 328 for IS
LC/MS/MS chromatograms of a mixture of standards SC and IS (1), a typical blank beagle plasma sample (2), the same blank plasma sample spiked with SC and IS (3), and an IS-spiked plasma sample obtained from a beagle 4 h
after receiving a i.v. dose of SC at 7.5 mg /kg/day (4)
分析方法的优化
样品前处理的优化基于:不同有机溶剂 对SC和IS提取效率的高低 和带来的基质效应大小
分析方法的可靠性验证(一)
首先检验SC及IS是否在整个分析过程保持稳定。
Stability of SC and IS
Comparison of extraction efficiencies for plasma SC and IS when different organic solvents were used.
Comparison of matrix effects on the ionization of SC and IS in five different lots of blank dog plasma samples spiked after extraction with MTBE or EtOAc
7
分析方法的可靠性验证(二)
考察使用MTBE作为提取溶剂时, 从犬血浆样品提取SC及IS的回收率 及基质效应干扰情况 。
Absolute recoveries of SC and IS from plasma using MTBE as the extraction solvent
Matrix effect data for SC and IS in plasma extracts from five individual beagle dogs
分析方法的可靠性验证(三)
考察分析方法的准确性和精密度, 以及稀释样品对它们的影响 。
Accuracy and precision of the assay of over-curve* samples by dilution in water
Within-run and between-run accuracy and precision for assay of SC in dog plasma
SC犬毒代动力学数据
Semi-logarithmic plot of mean plasma concentration of SC against the time of blood sampling during a repeated-dose toxicity study in beagle dogs
以AUC0→23 h为观察指标,雌雄犬对SC的暴露水平未见显著的性别差异;在三个约 连续的试验周期里,未见SC在犬体内出现明显蓄积现象;以AUC0→23 h为观察指标, SC的暴露水平与给药剂量呈良好的正相关,且在给药周期中保持。
Toxicokinetic parameters for assessing systemic exposure to SC in repeated-dose toxicity study in beagle dogs
五 小结
■ 针对药物暴露的活性/主要形式 ■ 以药代研究为基础,根据安评需求设计试验 ■ 安评动物实验、生物样品质量 ■ 相伴毒代研究及单独毒代研究 ■ 毒代:GLP研究;药代:非GLP研究
8
附件 儿科人群药代动力学研究技术指导原则 一、概述 临床药代动力学(pharmacokinetic,PK)研究旨在阐明药物在人体内的吸收(Absorption,A)、分布(Distribution,D)、代谢(Metabolism,M)和排泄(Excretion,E)的动态变化规律。药效动力学(pharmacodynamics,PD)研究药物对机体的作用、作用原理及作用规律。人体对药物的处置过程(ADME)和药物在体内作用规律的共同研究,有助于全面认识人体与药物间的相互作用,为临床制定合理的用药方案提供依据。本指导原则重点探讨药代动力学研究的相关问题,也提及部分药效动力学的相关内容。 儿科人群药代动力学研究无论是研究设计还是方法学,都遵循与成年人群的药代动力学研究一致的科学原则,但由于儿科人群在不同的发育阶段各有其特殊性,与成人的药代动力学研究又存在诸多不同之处,需要从伦理和科学性方面给予更多关注。因此,本指导原则在系统地阐述儿科人群药代动力学特点的基础上,以研究设计和方法学为重点,就如何安全、有效并且符合医学伦理地在儿科人群中进行药代动力学研究的关键技术要点进行分析和说明。其重点阐明儿科人群研究的特殊性,为计划在儿科人群中开展药代动力学研究的注册申请人和科研机构提供指导性建议,鼓励和推动针对
我国儿科人群的药物研发。 本指导原则主要适用于小分子化学药物,其他药物如生物制品可以参照其中的适用内容。本原则鼓励注册申请人针对儿科人群药代动力学研究中的技术问题与药品注册监管部门进行沟通交流。 二、儿科人群药代动力学特点 (一)总体考虑 在儿科人群开展药代动力学研究的目的在于通过给予不同年龄阶段儿科人群相应剂量的药物后,了解其体内过程,重点明确全身暴露的水平,从而尽可能地依据现有的研究数据,推导出拟用于该目标人群的用药剂量。 通常情况下,在开展儿科人群药代动力学研究之前,会有一定的成人药代动力学研究数据。因此,在设计儿科人群的药代动力学研究方案时,应充分借鉴成人研究数据,保证在儿科人群开展的研究设计的科学性和合理性。 当药物在儿科人群中拟用于已在成人经过充分研究并获得批准的适应症,其疾病进程在儿科患者与成人相似,且药物全身暴露水平与预期治疗结果具有较好的相关性时,可通过儿科人群药代动力学与成人数据的相似性来外推在儿科人群的预期有效性。因此,在儿科人群进行的PK和安全性研究可为推荐儿科人群拟用剂量提供依据。通过以上外推难以确认儿科人群体内的药物浓度-效应关系与成人的相似性时,尽管儿科患者疾病过程与成人基本一致,仍应该进行儿科患者体内的药代动力学/药效动力学(PK/PD)的相关研究。
附件6 药物毒代动力学研究技术指导原则 一、概述 毒代动力学研究目的是获知受试物在毒性试验中不同剂量水平下的全身暴露程度和持续时间,预测受试物在人体暴露时的潜在风险(注释1)。毒代动力学是非临床毒性试验的重要研究内容之一,其研究重点是解释毒性试验结果和预测人体安全性,而不是简单描述受试物的基本动力学参数特征。 毒代动力学研究在安全性评价中的主要价值体现在: (一)阐述毒性试验中受试物和/或其代谢物的全身暴露及其与毒性反应的剂量和时间关系;评价受试物和/或其代谢物在不同动物种属、性别、年龄、机体状态(如妊娠状态)的毒性反应;评价非临床毒性研究的动物种属选择和用药方案的合理性。 (二)提高动物毒性试验结果对临床安全性评价的预测价值。依据暴露量来评价受试物蓄积引起的靶部位毒性(如肝脏或肾脏毒性),有助于为后续安全性评价提供量化的安全性信息。 (三)综合药效及其暴露量和毒性及其暴露信息来指导人体试验设计,如起始剂量、安全范围评价等,并根据暴露程度来指导临床安全监测。 本指导原则适用于中药、天然药物和化学药物。生物制品的毒代动力学研究可参考本指导原则(注释2)。
二、基本原则 毒代动力学研究需执行《药物非临床研究质量管理规范》(GLP)(注释3)。 毒代动力学试验通常伴随毒性试验进行,常被称为伴随毒代动力学试验。开展研究时可在所有动物或有代表性的亚组或卫星组动物中进行,以获得相应的毒代动力学数据(注释4)。 三、基本内容 (一)暴露量评估 毒代动力学试验的基本目的是评估受试物和/或其代谢物的全身暴露量,常通过适当数量的动物和剂量组来开展研究。伴随毒代动力学研究所用动物数量应保证能获得足够的毒代动力学数据。由于毒性试验中通常采用两种性别动物,暴露测定也应包括两种性别的动物。选择单性别动物时应说明理由(注释5)。 暴露评估应考虑以下因素(注释6):血浆蛋白质结合、组织摄取、受体性质和代谢特征的种属差异、代谢物的药理活性、免疫原性和毒理学作用。在血浆药物浓度相对较低时,特殊的组织或器官也可能会有较高水平的受试物和/或其代谢物。对于血浆蛋白结合率高的化合物,用游离(未结合)浓度来表示暴露更为合适。 暴露评估中需关注血浆或体液中代谢物浓度的情况有:1)受试物为“前体化合物”且其转化生成的代谢物为主要活性成分;2)受试物可被代谢为一种或多种具有药理或毒理活性代谢物,且代谢物可导致明显的组
【H】G C L 1-2 指导原则编号: 化学药物临床药代动力学研究 技术指导原则 二○○五年三月
目 录 一、概述 (1) 二、药代动力学研究生物样品分析方法的建立和确证 (2) (一)常用分析方法 (2) (二)方法学确证 (2) 1、特异性 (3) 2、标准曲线和定量范围 (3) 3、定量下限 (4) 4、精密度与准确度 (4) 5、样品稳定性 (5) 6、提取回收率 (5) 7、微生物学和免疫学分析 (5) 8、方法学质控 (6) (三)分析数据的记录与保存 (6) 1、方法建立与确认的数据 (7) 2、样品分析的数据 (7) 3、其他相关信息 (7) 三、药代动力学研究的具体内容 (7) (一)健康志愿者药代动力学研究 (8) 1、单次给药药代动力学研究 (8) 2、多次给药药代动力学研究 (11) 3、进食对口服药物制剂药代动力学影响的研究 (13) 4、药物代谢产物的药代动力学研究 (14) 5、药物-药物的药代动力学相互作用研究 (14) (二)目标适应症患者的药代动力学研究 (15)
(三)特殊人群药代动力学研究 (15) 1、肝功能损害患者的药代动力学研究 (15) 2、肾功能损害患者的药代动力学研究 (16) 3、老年人药代动力学研究 (17) 4、儿科人群药代动力学研究 (17) 四、结语 (18) 五、参考文献 (19) 六、著者 (20)
化学药物临床药代动力学研究技术指导原则 一、概述 新药的临床药代动力学研究旨在阐明药物在人体内的吸收、分布、代谢和排泄的动态变化规律。对药物上述处置过程的研究,是全面认识人体与药物间相互作用不可或缺的重要组成部分,也是临床制定合理用药方案的依据。 在药物临床试验阶段,新药的临床药代动力学研究主要涉及如下内容: 1、健康志愿者药代动力学研究 包括单次给药的药代动力学研究、多次给药的药代动力学研究、进食对口服药物药代动力学影响的研究、药物代谢产物的药代动力学研究以及药物-药物的药代动力学相互作用研究。 2、目标适应症患者的药代动力学研究 3、特殊人群药代动力学研究 包括肝功能损害患者的药代动力学研究、肾功能损害患者的药代动力学研究、老年患者的药代动力学研究和儿童患者的药代动力学研究。 上述研究内容反映了新药临床药代动力学研究的基本要求。在新药研发实践中,可结合新药临床试验分期分阶段逐步实施,以期阐明临床实践所关注的该药药代动力学的基本特征,为临床合理用药奠定基础。 鉴于不同类型药物的临床药代动力学特征各不相同,故应根据所研究品种的实际情况进行综合分析,确定不同阶段所拟研究的具体内容,合理设计试验方案,采用科学可行的试验技术,实施相关研究,并作出综合性
全国药物安全性评价专题负责人第二期高级培训班
中国毒理学会药物毒理与安全性评价专业委员会 中国药学会药物安全性评价专业委员会 中国药理学会药物毒理专业委员会
毒代动力学及 其研究方法
李川
(021-********;chli@https://www.doczj.com/doc/244148016.html,) 中国科学院上海药物研究所 上海药物代谢研究中心
2009年11月·成都
演讲内容
一 新药安评与体内药物暴露 二 影响体内药物暴露的因素 三 毒代动力学的概念 四 毒代动力学的研究方法与实施 五 小结
一 新药安评与体内药物暴露
过去20多年在新药研发领域发生的变化
45% 30%
ADME/PK
15%
0%
Financial
CaImndpirdoavteed
Formulation
Commercial Human AEs
ToAxnicimityal
EfCficliancicyal
Other
Br. J. Clin. Pharmacol. 25: 387 (1988)
Nature Rev./Drug discovery 3: 711 (2004)
化合物资源
新药上市前必须对其 安全性进行仔细评估
药物发现
1 药物先导化合物的发现 2 药物先导化合物的结构优化
药药物物候候选选化化合合物物
非临床安评研究
由于开展临床试验的伦理限制,必须先在
新药开发
1 临床前研究 2 临床试验
动物上进行全面的新药安评,以揭示新药 对动物器官组织的毒副作用,研究其剂量
药药安
质
新
依赖性、体内暴露相关性和可恢复性等, 帮助确定临床试验的初始安全剂量和应观
效代评
量
药
察的潜在毒副作用。
临床试验中的新药安全性考察
新药安全有效评价体系
安全性始终是临床试验关注的重点,影响临床试
验的推进。先从低剂量、小范围人群开展临床试
验,在安全性得以保证后,再增加给药剂量、扩
大人群已验证药物的有效性。
为什么在药物安评中要考虑体内药物暴露?
(确定药物的两个要素:功能和物质)
剂量-暴露
体内药物暴露
(化学形式/浓度)
机体对药物的作用
反映药物“物质” 的一种形式 相对准确
浓度-效应
给药剂量
反映药物“物质” 的一种形式
好用,但不准确
药物对机体的作用
毒副作用
1
化药药物评价-ICH毒代动力学指导原则:毒性研究中全身暴露量的评价 审评五部王海学彭健20051101 该指导原则为ICH(人用药品注册技术要求的国际协调会议)三方(欧盟、日本和美国)协调的指导原则。根据ICH程序,该指导原则由ICH专家工作组(安全性)起草,并提交管理部门讨论协商。1994年10月27日,在ICH程序的第4阶段会议上,该指导原则被 ICH筹备委员会推荐给欧盟、日本和美国的行政管理部门采纳。1995年3月,该指导原则发布在美国FDA的Federal Register上(60 FR 11264),适用于化学药物和生物制品。 1 前言 本指导原则所涉及的毒物代谢动力学(毒代动力学)仅与拟开发作为人用的药品有关。 毒代动力学是药代动力学在全身暴露评价中的延伸,为非临床毒性研究的一个组成部分,或为某一特殊设计的支持研究。研究结果可用于阐明毒理学发现及其与临床安全性的关系(文中其它术语的定义见注释1)。 制定该指导原则是为了使人们理解毒代动力学的意义和应用,指导毒代动力学的试验设计。本指导原则强调毒性试验需与毒代动力学相结合,这将有助于解释毒理学发现和制定合理的试验设计。 毒代动力学测定通常是结合于毒性研究中,故又被称为“伴随毒代动力学”。毒性试验的试验程序有助于获得受试动物多剂量的毒代动力学数据。如果在毒性试验中测定了合适的指标或参数,毒代动力学研究可避免重复的毒性试验。有时,模拟毒性试验的支持研究也可获得相应的毒代动力学数据。获取数据的优化设计可以减少试验动物数。 非临床药代动力学和代谢过程的研究,对解释毒理学的发现可能有价值,但毒代动力学数据侧重于新药毒性研究中的动力学。 因此,毒代动力学是非临床试验设计的组成部分,在理解毒性试验结果和临床人体用药风险性、安全性时可提高毒理学资料的价值。毒代动力学已成为毒性试验的组成部分,成为非临床和临床试验间的桥梁,其研究重点是解释毒性试验结果,而不是为描述受试物的基本药代动力学参数特征。 由于药品开发是在非临床和临床间反馈的动态过程,因此毒代动力学研究无严格的、详细的试验程序,也无必要在全部研究中获取毒代动力学数据,应该科学地判断什么情况下需要进行。在考虑某个毒性试验是否需要获取毒代动力学数据和评估暴露量时,应灵活地、逐步地和逐例地作出判断,以获得足够资料来评价药物的危险性和安全性。 2 毒代动力学的目的和测定参数 毒代动力学的主要目的是: ●描述化合物在动物造成的全身暴露和其与毒性研究剂量和时间关系。 次要目的是: ●了解毒性研究中造成的暴露量与毒理学结果之间的关系,以评价这些结果与临床安全性之间的关系。 ●支持非临床毒性研究的动物种属选择和给药方案。 ●结合毒性研究结果,提供有助于后续非临床毒性研究的信息。 要达到这些目的,可在某一项研究过程中通过选择合适的时间点进行采样测定而获得一个或多个毒代动力学参数2。这些测定通常包括血浆(全血或血清)的原型化合物和/或代谢物的浓度,应根据情况选择。血浆(或全血或血清)AUC,Cmax和C(time)是毒代
中药药代动力学研究进展 摘要:近年来,为了全面阐述中药吸收、分布、代谢、排泄的体内过程,推动中药现代化,研究者们在生物效应法和药物浓度法等经典药代动力学研究方法的基础上提出了一些新方法、新思路,大大推进了中药药代动力学研究的发展。在查阅通过近年来中药药代动力学相关研究的文献,并对其中新方法新思路进行总结,综述了中药药代动力学近年来的研究现况和前沿进展。 关键词:药代动力学,药代标记物,指征药代动力学,方法学 前言:药代动力学是应用动力学原理与数学处理方法,定量地描述药物通过各种途径 (如静脉注射液、静脉滴注、口服给药等)进入体内的吸收、分布、代谢、排泄过程的“量时”变化或“血药浓度经时”变化动态规律的一门科学,已经在生物药剂学、临床药剂学、药物治疗学、分析化学、药理学等学科领域中得到了广泛应用。在中药学研究中,药代动力学被广泛的应用于揭示中药作用机制及设计优化的研究,并衍生出了中药药代动力学这门新兴学科。中药药代动力学基于动力学原理研究中草药活性成分、组分、中药单方和复方体内吸收、分布、代谢和排泄(ADME)的动态变化规律及其体内时量-时效关系,并用数学函数对其加以定量描述。 1.中药药代动力学研究方法 1.1生物效应法 药效的变化取决于体内药量的变化,可以通过测定药效的经时过程来反映体内药量动态变化。生物效应法从整体观点出发研究中药的药代动力学特征,更符合中医药理论。该法包括药理效应法、药物累计法,微生物指标法。 1.1.1药理效应法 药理效应法是一种以药理效应为指标研究药代动力学的方法。该法己越来越广泛地用于中药及其复方,特别是有效成分不明的中草药及其复方的药代动力学研究。肇丽梅[1]采用小鼠热板致痛模型,以镇痛效应为指标,测定黄芩苷及清热合剂的药物动力学参数,结果黄芩苷及清热合剂口服给药后体存药量的表观动力学过程符合一室开放模型,中药复方清热合剂的达峰时间明显慢于单方黄芩苷。李成洪[2]等以血清一氧化氮变化为药理效应指标,研究了中药复方制剂禽病康在免疫抑制雏鸡体内的药代动力学特征。以时间标本存量进行数学模型拟合,符合一级吸收二室模型,禽病康药代动力学结果表明其口服后吸收较快,分布也快,而消除较慢,体内存留时间长,药效维持时间长。宋丽
中国医科大学2016年1月考试《药物代谢动力学》考查课试题参考答案 考查课试题 一、单选题(共 20 道试题,共 20 分。)V 1. 在碱性尿液中弱碱性药物:() A. 解离少,再吸收少,排泄快 B. 解离多,再吸收少,排泄慢 C. 解离少,再吸收多,排泄慢 D. 排泄速度不变 E. 解离多,再吸收多,排泄慢 正确答案:C 2016国考试题答案 2. 在进行口服给药的药物代谢动力学研究时,不适合用的动物是哪种?() A. 大鼠 B. 小鼠 C. 豚鼠 D. 家兔 E. 犬 正确答案:D 3. 在非临床药物代谢动力学研究中,其受试物的剂型不需要遵循以下哪些选项的要求?() A. 受试物的剂型应尽量与药效学研究的一致 B. 受试物的剂型应尽量与毒理学研究的一致 C. 特殊情况下,受试物剂型可以允许与药效学与毒理学研究不一致 D. 应提供受试物的名称、剂型、批号、来源、纯度、保存条件及配制方法,但不需要提供研制单位的质检报告 E. 以上都不对 正确答案:D 4. 药物代谢动力学对受试者例数的要求是每个剂量组:() A. 5~7例 B. 6~10例 C. 10~17例 D. 8~12例 E. 7~9例 正确答案:D 5. 某一弱酸性药物pKa=4.4,当尿液pH为5.4,血浆pH为7.4时,血中药物浓度是尿中药物浓度的:() A. 1000倍 B. 91倍 C. 10倍 D. 1/10倍 E. 1/100倍 正确答案:B 6. 药物经肝脏代谢转化后均:() A. 分子变小
B. 化学结构发性改变 C. 活性消失 D. 经胆汁排泄 E. 脂/水分布系数增大 正确答案:B 7. 恒量恒速给药,最后形成的血药浓度被称为:() A. 有效血浓度 B. 稳态血浓度 C. 致死血浓度 D. 中毒血浓度 E. 以上都不是 正确答案:B 8. 药物按零级动力学消除是指:() A. 吸收与代谢平衡 B. 单位时间内消除恒定比例的药物 C. 单位时间内消除恒定量的药物 D. 血浆浓度达到稳定水平 E. 药物完全消除 正确答案:C 9. 生物样品分析的方法中,哪种是首选方法?() A. 色谱法 B. 放射免疫分析法 C. 酶联免疫分析法 D. 荧光免疫分析法 E. 微生物学方法 正确答案:A 10. 静脉注射2g某磺胺药,其血药浓度为100mg/L,经计算其表观分布容积为:() A. 0.05L B. 2L C. 5L D. 20L E. 200L 正确答案:D 11. 静脉滴注给药途径的MRTinf表达式为:() A. AUC0→n+cn/λ B. MRTiv+t/2 C. MRTiv-t/2 D. MRTiv+t E. 1/k 正确答案:B 12. Ⅰ期临床药物代谢动力学试验时,下列的哪条是错误的?() A. 目的是探讨药物在人体的体内过程的动态变化 B. 受试者原则上男性和女性兼有 C. 年龄在18~45岁为宜
前言 药物代谢动力学是定量研究药物在生物体吸收、分布、排泄和代谢规律的一门学科。随着细胞生物学和分子生物学的发展,在药物体代谢物及代谢机理研究已经有了长足的发展。通过药物在体代谢产物和代谢机理研究,可以发现生物活性更高、更安全的新药。近年来,国外在创新研制过程中,药物代谢动力学研究在评价新药中与药效学、毒理学研究处于同等重要的地位。药物进入体后,经过吸收入血液,并随血流透过生物膜进入靶组织与受体结合,从而产生药理作用,作用结束后,还须从体消除。通过在实验的基础上,建立数学模型,求算相应的药物代谢动力学参数后,对可以药物在体过程进行预测。因此新药和新制剂均需要进行动物和人体试验,了解其药物代谢动力学过程。药物代谢动力学已成为临床医学的重要组成部分。中国药科大学药物代谢动力学研究中心为本科生、研究生开设《药物代谢动力学》课程教学已有二十多年历史,本书是在原《药物动力学教学讲义》基础,经多年修正、拓展而成的。全书十三章,三十余万字,重点阐述围绕药物代谢动力学理论及其在新药研究中的作用,与其它教材相比,创新之处在于重点阐述现代药物代谢动力学理论及其经典药物代谢动力学在新药及其新制剂研究中的应用以及目前迅 速发展的药物代谢动力学体外研究模型等新容。 本书编著者均是长期在药物代谢动力学教学和研究第一线的教师。因此,本书的实践性与理论性较强,可作为高年级本科生、硕士生教材使用,也可作为从事药物代谢动力学研究及相关科研人员的参考书。编者 药物代谢动力学 主编:王广基 副主编:晓东,柳晓泉 编者(姓氏笔画为序) 王广基、晓东、西敬、劲、柳晓泉
容提要: 药物代谢动力学是定量研究药物在机体吸收、分布、排泄和代谢规律的一门学科。在创新研制过程中,药物代谢动力学研究与药效学、毒理学研究处于同等重要的地位,已成为药物临床前研究和临床研究重要组成部分。本书重点阐述围绕药物代谢动力学理论及其在新药研究中的作用,与其它教材相比,创新之处在于重点阐述现代药物代谢动力学理论及其经典药物代谢动力学在新药及其新制剂研究中的应用以及目前迅速发展的药物代谢动力学体外研究模型等新容。共十三章,分别为概述、药物体转运、药物代谢、经典的房室模型理论、非线性药物代谢动力学、统计矩理论及其应用、生物利用度及其生物等效性评价、临床药物代谢动力学、药物代谢动力学与药效动力学结合模型、生理药物代谢动力学模型及其应用实践、手性药物代谢动力学、新药临床前药物代谢动力学研究和计算机在药物代谢动力学研究中的应用。本书的实践性与理论性较强,可作为高年级本科生、研究生教材使用,也可作为从事药物代谢动力学研究及相关科研人员 的参考书. 1 目录 第一章药物代谢动力学概述 一、什么是药物代谢和动力学 二、药物代谢动力学研究与医学其它学科的关系 第二章药物体转运 第一节概述 第二节药物跨膜转运及其影响因素 一、生物膜 二、药物的跨膜转运方式 第三节药物的吸收 一、药物在胃肠道中吸收 二、药物在其它部位吸收 第四节药物的分布 一、药物的分布及其影响因素 二、血浆蛋白结合率及常用的测定方法
附件5 药物非临床药代动力学研究技术指导原则 一、概述 非临床药代动力学研究是通过体外和动物体内的研究方法,揭示药物在体内的动态变化规律,获得药物的基本药代动力学参数,阐明药物的吸收、分布、代谢和排泄(Absorption, Distribution, Metabolism, Excretion, 简称ADME)的过程和特征。 非临床药代动力学研究在新药研究开发的评价过程中起着重要 作用。在药物制剂学研究中,非临床药代动力学研究结果是评价药物制剂特性和质量的重要依据。在药效学和毒理学评价中,药代动力学特征可进一步深入阐明药物作用机制,同时也是药效和毒理研究动物选择的依据之一;药物或活性代谢产物浓度数据及其相关药代动力学参数是产生、决定或阐明药效或毒性大小的基础,可提供药物对靶器官效应(药效或毒性)的依据。在临床试验中,非临床药代动力学研究结果能为设计和优化临床试验给药方案提供有关参考信息。 本指导原则是供中药、天然药物和化学药物新药的非临床药代动力学研究的参考。研究者可根据不同药物的特点,参考本指导原则,科学合理地进行试验设计,并对试验结果进行综合评价。 本指导原则的主要内容包括进行药物非临床药代动力学研究的 基本原则、试验设计的总体要求、生物样品的测定方法、研究项目(血
药浓度-时间曲线、吸收、分布、排泄、血浆蛋白结合、生物转化、对药物代谢酶活性及转运体的影响)、数据处理与分析、结果与评价等,并对研究中其他一些需要关注的问题进行了分析。附录中描述了生物样品分析和放射性同位素标记技术的相关方法和要求,供研究者参考。 二、基本原则 进行非临床药代动力学研究,要遵循以下基本原则: (一)试验目的明确; (二)试验设计合理; (三)分析方法可靠; (四)所得参数全面,满足评价要求; (五)对试验结果进行综合分析与评价; (六)具体问题具体分析。 三、试验设计 (一)总体要求 1. 受试物 中药、天然药物:受试物应采用能充分代表临床试验拟用样品和/或上市样品质量和安全性的样品。应采用工艺路线及关键工艺参数确定后的工艺制备,一般应为中试或中试以上规模的样品,否则应有充分的理由。应注明受试物的名称、来源、批号、含量(或规格)、保存条件、有效期及配制方法等,并提供质量检验报告。由于中药的特殊性,建议现用现配,否则应提供数据支持配制后受试物的质量稳定性及均匀性。当给药时间较
中国医科大学2016年12月考试《药物代谢动力学》考查课试题 一、单选题(共20道试题,共20分。) 1. 临床上可用丙磺舒增加青霉素的疗效,是因为:() A. 在杀菌作用上有协同作用 B. 两者竞争肾小管的分泌通道 C. 对细菌代谢有双重阻断作用 D. 延缓抗药性产生 E. 以上均不对 正确答案:B 2. 生物样品分析的方法中,哪种是首选方法?() A. 色谱法 B. 放射免疫分析法 C. 酶联免疫分析法 D. 荧光免疫分析法 E. 微生物学方法 正确答案:A 3. 被肝药酶代谢的药物与肝药酶诱导剂合用后,可使:() A. 其原有效应减弱 B. 其原有效应增强 C. 产生新的效应 D. 其原有效应不变 E. 其原有效应被消除 正确答案:A 4. 应用于药物代谢动力学研究的统计矩分析,是一种非房室的分析方法,它一般适用于体内过程符合下列哪一项的药物?() A. 房室 B. 线性 C. 非房室 D. 非线性 E. 混合性 正确答案:B 5. 药物的吸收与哪个因素无关?() A. 给药途径 B. 溶解性 C. 药物的剂量 D. 肝肾功能 E. 局部血液循环 正确答案:C
6. Ⅰ期临床药物代谢动力学试验时,下列的哪条是错误的?() A. 目的是探讨药物在人体的体内过程的动态变化 B. 受试者原则上男性和女性兼有 C. 年龄在18~45岁为宜 D. 要签署知情同意书 E. 一般选择适应证患者进行 正确答案:E 7. 关于药物与血浆蛋白的结合,叙述正确的是:() A. 结合是牢固的 B. 结合后药效增强 C. 结合特异性高 D. 结合后暂时失去活性 E. 结合率高的药物排泄快 正确答案:D 8. 有关药物从肾脏排泄的正确叙述是:() A. 改变尿液pH可改变药物的排泄速度 B. 与血浆蛋白结合的药物易从肾小球滤过 C. 解离的药物易从肾小管重吸收 D. 药物的排泄与尿液pH无关 E. 药物的血浆浓度与尿液中的浓度相等 正确答案:A 9. SFDA推荐的首选的生物等效性的评价方法为:() A. 体外研究法 B. 体内研究法 C. 药动学评价方法 D. 药效学评价方法 E. 临床比较试验法 正确答案:C 10. 药物代谢动力学对受试者例数的要求是每个剂量组:() A. 5~7例 B. 6~10例 C. 10~17例 D. 8~12例 E. 7~9例 正确答案:D 11. 按t1/2恒量反复给药时,为快速达到稳态血药浓度可:() A. 首剂量加倍 B. 首剂量增加3倍
药物毒代动力学研究技术指导原则 一、概述 毒代动力学研究目的是获知受试物在毒性试验中不同剂量水平 下的全身暴露程度和持续时间,预测受试物在人体暴露时的潜在风险(注释1)。毒代动力学是非临床毒性试验的重要研究内容之一,其研究重点是解释毒性试验结果和预测人体安全性,而不是简单描述受试物的基本动力学参数特征。 毒代动力学研究在安全性评价中的主要价值体现在: (一)阐述毒性试验中受试物和/或其代谢物的全身暴露及其与毒性反应的剂量和时间关系;评价受试物和/或其代谢物在不同动物种属、性别、年龄、机体状态(如妊娠状态)的毒性反应;评价非临床毒性研究的动物种属选择和用药方案的合理性。 (二)提高动物毒性试验结果对临床安全性评价的预测价值。依据暴露量来评价受试物蓄积引起的靶部位毒性(如肝脏或肾脏毒性),有助于为后续安全性评价提供量化的安全性信息。 (三)综合药效及其暴露量和毒性及其暴露信息来指导人体试验设计,如起始剂量、安全范围评价等,并根据暴露程度来指导临床安全监测。 本指导原则适用于中药、天然药物和化学药物。生物制品的毒代动力学研究可参考本指导原则(注释2)。 二、基本原则
毒代动力学研究需执行《药物非临床研究质量管理规范》(GLP)(注释3)。 毒代动力学试验通常伴随毒性试验进行,常被称为伴随毒代动力学试验。开展研究时可在所有动物或有代表性的亚组或卫星组动物中进行,以获得相应的毒代动力学数据(注释4)。 三、基本内容 (一)暴露量评估 毒代动力学试验的基本目的是评估受试物和/或其代谢物的全身暴露量,常通过适当数量的动物和剂量组来开展研究。伴随毒代动力学研究所用动物数量应保证能获得足够的毒代动力学数据。由于毒性试验中通常采用两种性别动物,暴露测定也应包括两种性别的动物。选择单性别动物时应说明理由(注释5)。 暴露评估应考虑以下因素(注释6):血浆蛋白质结合、组织摄取、受体性质和代谢特征的种属差异、代谢物的药理活性、免疫原性和毒理学作用。在血浆药物浓度相对较低时,特殊的组织或器官也可能会有较高水平的受试物和/或其代谢物。对于血浆蛋白结合率高的化合物,用游离(未结合)浓度来表示暴露更为合适。 暴露评估中需关注血浆或体液中代谢物浓度的情况有:1)受试物为“前体化合物”且其转化生成的代谢物为主要活性成分;2)受试物可被代谢为一种或多种具有药理或毒理活性代谢物,且代谢物可导致明显的组织/器官反应;3)受试物在体内被广泛代谢,毒性试验仅可通过测定血浆或组织中的代谢物浓度来进行暴露评估。
该指导原则为ICH(人用药品注册技术要求的国际协调会议)三方(欧盟、日本和美国)协调的指导原则。根据ICH程序,该指导原则由ICH专家工作组(安全性)起草,并提交管理部门讨论协商。1994年10月27日,在ICH程序的第4阶段会议上,该指导原则被ICH筹备委员会推荐给欧盟、日本和美国的行政管理部门采纳。1995年3月,该指导原则发布在美国FDA的Federal Register上(60 FR 11264),适用于化学药物和生物制品[医学教育网整理发布]。 1 前言本指导原则所涉及的毒物代谢动力学(毒代动力学)仅与拟开发作为人用的药品有关。毒代动力学是药代动力学在全身暴露评价中的延伸,为非临床毒性研究的一个组成部分,或为某一特殊设计的支持研究。研究结果可用于阐明毒理学发现及其与临床安全性的关系(文中其它术语的定义见注释1)。制定该指导原则是为了使人们理解毒代动力学的意义和应用,指导毒代动力学的试验设计。本指导原则强调毒性试验需与毒代动力学相结合,这将有助于解释毒理学发现和制定合理的试验设计。毒代动力学测定通常是结合于毒性研究中,故又被称为“伴随毒代动力学”。毒性试验的试验程序有助于获得受试动物多剂量的毒代动力学数据。如果在毒性试验中测定了合适的指标或参数,毒代动力学研究可避免重复的毒性试验。有时,模拟毒性试验的支持研究也可获得相应的毒代动力学数据。获取数据的优化设计可以减少试验动物数。非临床药代动力学和代谢过程的研究,对解释毒理学的发现可能有价值,但毒代动力学数据侧重于新药毒性研究中的动力学。因此,毒代动力学是非临床试验设计的组成部分,在理解毒性试验结果和临床人体用药风险性、安全性时可提高毒理学资料的价值。毒代动力学已成为毒性试验的组成部分,成为非临床和临床试验间的桥梁,其研究重点是解释毒性试验结果,而不是为描述受试物的基本药代动力学参数特征。由于药品开发是在非临床和临床间反馈的动态过程,因此毒代动力学研究无严格的、详细的试验程序,也无必要在全部研究中获取毒代动力学数据,应该科学地判断什么情况下需要进行。在考虑某个毒性试验是否需要获取毒代动力学数据和评估暴露量时,应灵活地、逐步地和逐例地作出判断,以获得足够资料来评价药物的危险性和安全性。 2 毒代动力学的目的和测定参数毒代动力学的主要目的是:●描述化合物在动物造成的全身暴露和其与毒性研究剂量和时间关系。次要目的是:●了解毒性研究中造成的暴露量与毒理学结果之间的关系,以评价这些结果与临床安全性之间的关系。●支持非临床毒性研究的动物种属选择和给药方案。●结合毒性研究结果,提供有助于后续非临床毒性研究的信息。要达到这些目的,可在某一项研究过程中通过选择合适的时间点进行采样测定而获得一个或多个毒代动力学参数2。这些测定通常包括血浆(全血或血清)的原型化合物和/或代谢物的浓度,应根据情况选择。血浆(或全血或血清)AUC,Cmax和C(time)是毒代动力学研究中评价暴露最常用的参数。对于某些药物,以非血浆蛋白结合(游离型)的药物浓度来评价暴露更为合适。毒代动力学数据可以从毒性研究的全部动物获得,也可从代表性的组或卫星组,或从单独设计的研究中获得。毒代动力学信息可来自单剂量、重复剂量、生殖毒性、遗传毒性和致癌性的试验研究,它有助于评价毒理学反应。对拟定改变临床给药途径的评价,毒代动力学信息也具有价值。 3 一般原则 3.1 引言下面段落中提出的一般原则在个体研究设计中应予考虑。必须注意,凡在GLP实验室进行的毒性研究,其伴随的毒代动力学也必须符合GLP的要求。在模拟毒性研究的条件下,回顾性地设计毒代动力学研究以获得系列特定数据用于安全性评价时,也应执行GLP。 3.2 暴露的定量全身暴露可用来评价动物对受试物的负荷量,并有助于解释动物种属间、剂量组间和性别间的毒性相似性和差异性。暴露程度可用原型化合物或其代谢物的血浆(血清或全血)浓度或AUC表示。某些情况下,可设计测定组织中的药物浓度。在进行动物毒性研究时,为使动物毒性研究的不同剂量能达到相应的暴露,应考虑人体治疗剂量(预期的或已采用的)的整体暴露和剂量依赖性,考虑受试物的药效学(定性或定量的)可能存在的种属差异性。药效作用或毒性也可为暴露提供支持性证据,某些情况下,甚至可替代药代动力学参数。应确定达到何种暴露程度来进行毒代动力学监测或特征的研究,应警惕引起非线性且剂量相关的动力学改变。毒代动力学资料信息可用于种属间的毒性比较,这优于简单以剂量/体重(或体表面积)进行的比较。 3.3 采样时间点的确定伴随毒代动力学研究中,采集体液的时间点应尽量达到所需的频度,但不可过于频繁以至于干扰正常进行的研究并引起动物过度的生理应激反应。在每项研究中,时间点的数量应满足暴露评价的要求(见3.2)。时间点的确定应以早期毒性研究、预试验或剂量范围毒性研究以及在相同动物模型或可以合理外推的其它动物模型上获得的动力学数据为基础。 3.4 达到适当暴露的给药剂量设置毒性研究的剂
指导原则编号: 【H】G P T 5-1 化学药物非临床药代动力学研究 技术指导原则 二○○五年三月
目 录 一、概述 (1) 二、基本原则 (2) 三、试验设计 (2) (一)总体要求 (2) (二)生物样本的药物测定方法 (3) (三)研究项目 (4) 四、数据处理与分析 (9) 五、结果与评价 (9) 六、常见问题与处理思路 (10) 七、参考文献 (13) 八、附录(生物样品的分析方法) (15) 九、著者 (21)
化学药物非临床药代动力学研究技术指导原则 一、概述 非临床药代动力学研究是通过动物体内、外和人体外的研究方法,揭示药物在体内的动态变化规律,获得药物的基本药代动力学参数,阐明药物的吸收、分布、代谢和排泄的过程和特点。 非临床药代动力学研究在新药研究开发的评价过程中起着重要作用。在药效学和毒理学评价中,药物或活性代谢物浓度数据及其相关药代动力学参数是产生、决定或阐明药效或毒性大小的基础,可提供药物对靶器官效应(药效或毒性)的依据;在药物制剂学研究中,非临床药代动力学研究结果是评价药物制剂特性和质量的重要依据;在临床研究中,非临床药代动力学研究结果能为设计和优化临床研究给药方案提供有关参考信息。 本指导原则是供药物研究开发机构进行化学药品新药的非临床药代动力学研究的参考,而不是新药申报的条框要求。研究者可根据不同药物的特点,参考本指导原则,科学合理地进行试验设计,并对试验结果进行综合评价。 本指导原则的主要内容包括进行非临床药代动力学研究的基本原则、试验设计的总体要求、生物样品的药物分析方法、研究项目(血药浓度-时间曲线、吸收、分布、排泄、血浆蛋白结合、生物转化、对药物代谢酶活性的影响)、数据处理与分析、结果与评价等,并对研究中的一些常见问题及处理思路进行了分析。
专业:药学(专升本,专)适用年级:2017级科目:药物代动力学满分:100分 总页数:4页出题日期:2019-5-8 一、概念解释(每概念2分,共10概念,共20分) 1. 血脑屏障 2. 肝药酶抑制剂 3. 肝肠循环 4. 零级动力学消除 5. 生物利用度 6. 血浆半衰期 7. 稳态血药浓度 8. 易化扩散 9. 体过程 10. 药物的排泄
二、问答题(共2题,每题4-6分,共10分) 1、Caco-2细胞作为体外吸收模型的优点?(4分) 2、举例说明药代动力学在药剂学中的应用。(6分) 三、选择题(共60题,每题1分,共60分) 1.大多数脂溶性药物跨膜转运是通过 A.易化扩散 B.简单扩散 C.膜孔滤过 D.主动转运 E.胞饮2.被动转运的特点是 A.从高浓度侧向低浓度侧转运 B.从低浓度侧向高浓度侧转运 C.需消耗能量 D.有竞争性抑制现象 E.有饱和限速现象 3.下列关于主动转运的叙述中,错误的是 A.从低浓度侧向高浓度侧转运 B.需特异性载体 C.不消耗能量 D.有竞争性抑制现象 E.有饱和限速现象 4.某弱酸药物的pka=3.4,在pH=7.4的血浆中其解离度为 A.90% B.99% C.99.9% D.99.99% E.10% 5.以下何种情况药物易通过简单扩散转运 A.解离型药物在酸性环境中 B. 解离型药物在碱性环境中 C. 弱碱性药物在酸性环境中 D. 弱酸性药物在碱性环境中 E. 弱酸性药物在酸性环境中 6.下列关于药物解离度的叙述中,错误的是( C ) A.弱酸性药物在酸性环境中解离度小,易吸收 B.弱碱性药物在碱性环境中解离度小,易吸收 C.弱酸性药物在酸性环境中解离度大,难吸收 D.弱酸性药物在碱性环境中解离度大,难吸收 E.弱碱性药物在酸性环境中解离度大,难吸收 7. 下列关于易化扩散的叙述中错误的是( B )
发布日期2007-11-01 栏目化药药物评价>>综合评价 标题群体药代动力学(译文) 作者康彩练 部门 正文内容 审评四部七室康彩练审校 I.前言 本指南是对药品开发过程中群体药代动力学的应用制定建议,目的是帮助确定在人群亚组中药品安全性和疗 效的差异。它概述了应当用群体药代动力学解决的科学问题和管理问题。本指南讨论了什么时候要进行群体 药代动力学研究和/或分析;讨论了如何设计和实施群体药代动力学研究;讨论了如何处理和分析群体药代动 力学数据;讨论了可以使用什么样的模型验证方法;讨论了针对计划申报给FDA的群体药代动力学报告,怎 样提供恰当的文件。虽然本行业指南中的内容是针对群体药代动力学,但是其中讨论的原则也同样适用于群 体药效学研究和群体毒代动力学研究2。 由于对药品在人群亚组中的安全性和疗效的分析是药品开发和管理中一个发展迅速的领域,所以在整个药品 开发过程中,鼓励主办者和FDA审评人员经常沟通。 制药行业科学家和FDA长期以来一直对群体药代动力学/药效学在人群亚组中药品安全性和疗效分析方面的 应用感兴趣[1]。在FDA的其他指南文件(包括“进行药品临床评价时一般要考虑的问题”(General Considerations for the Clinical Evaluation of Drugs) (FDA 77-3040))中和在国际协调会议(ICH)指南(包 括“E4支持药品注册的剂量-效应资料”(E4 Dose-Response Information to Support Drug Registration)和“E7 支持特殊人群的研究:老年医学”(E7 St udies in Support of Special Populations: Geriatrics))中,对这个主 题制定了参考标准3。这些指南文件支持使用特殊的数据收集方法和分析方法,例如群体药代动力学方法(群 体PK方法),作为药品开发中药代动力学评价的一部分。 1本指南由药品评审和研究中心(CDER)医药政策协调委员会临床药理学部群体药代动力学工作组与食品 药品监督管理局生物制品评审和研究中心(CBER)合作编写。本指南文件反映了当前FDA对药品评价中的 群体药代动力学的考虑。它不给任何人也不代表任何人创造或赋予任何权力,也不约束FDA或公众。如果其 他措施满足适用法令、法规或两者的要求,那么也可采用其他措施。
Key words :oxidative burst activity ;phagocytic activity The paths to becoming a toxicologic pathologist in the West Dale THURMAN (Global Safety Assessment ,AstraZeneca R&D Boston ,MA ,USA ) Abstract :This presentation will cover the most travelled path to becoming a toxicologic pathologist in North America. We will start the journey at the undergraduate level and proceed through graduate studies , board certification and then em-ployment.Additionally ,we will also touch on non-traditional paths in the US.Some of the options available in Europe for a career in toxicologic pathology will be covered.Finally ,the speaker will explore the topic of global credentialing for toxico-logic pathologists. 毒代动力学研究在新药开发中的的意义 郑维义,陈拯民,张雪峰,张江全,姚全胜 (江苏鼎泰药物研究有限公司生物分析中心南京康科诺德医药科技有限责任公司,江苏南京211800)摘要:随着新药研究的深入,不少待选化合物(包括小分子和大分子)因为安全性问题在研发过程中被淘汰。因此只有对新化合物进行了充分的临床前安全性评价,才可能考虑药物是否可进入临床试验。而毒代动力学研究已经成为新药安全 性评价中毒理学研究的重要手段之一。毒代动力学研究通常伴随毒性试验进行, 包括测定血浆(全血或血清)中原型化合物和(或)代谢物的浓度时程变化。测定血浆(或全血或血清)AUC , C max 和C (time )是毒代动力学研究中评价药物暴露水平最常用的参数。通常以非血浆蛋白结合(游离型)的药物浓度来评价暴露。毒代动力学数据可以从毒性研究的全部动物获得,也可从代表性的组或卫星组,或从单独设计的研究中获得。全身暴露可用来评价动物对受试物的负荷量,有助于解释动物种属间、剂量组间和性别间的毒性相似性和差异性。暴露程度可用原型化合物或其代谢物的血浆(血清或全血)浓度或AUC 表 示。某些情况下, 可设计测定注射部位或靶器官(组织)中的药物浓度。在进行动物毒性研究时,为使动物毒性研究的不同剂量能达到相应的暴露,应考虑人体治疗剂量(预期的或已采用的)的整体暴露和剂量依赖性,考虑受试物的药效学(定性或定量的)可能存在的种属差异性。毒代动力学研究中确定达到何种暴露程度来监测或进行特征的研究至关重要,应警惕引起非 线性且剂量相关的动力学改变。毒代动力学资料信息可用于种属间的毒性比较, 这优于简单以剂量/体重(或体表面积)进行的比较。国际上普遍已把毒代动力学研究作为常规毒理学研究的重要组成部分, ICH 制定了相应的试验研究技术指导原则。国外在新药非临床研究各阶段,包括急性毒性试验、长期毒性试验研究、生殖毒性试验、安全药理试验、致癌性试验,都会考虑 结合毒代动力学研究, 这有助于降低临床试验安全性风险,有助于缩短药物研发周期。我国在新的药品注册管理办法中也明确提出“属注册分类1的新药,一般应在重复给药毒性试验过程中进行毒代动力学研究” 。本研究将分析在本机构进行的几个大分子和小分子待选药物在急性毒性试验、长期毒性试验、生殖毒性试验、安全药理试验中毒代动力学研究,用实例来阐述毒代动力学在毒理研究中的重要作用。 关键词:毒代动力学;新药开发 E-mail :weiyi.zheng@concordpharmatech.com Information gathering and evaluation of data quality for safety assessment of chemicals-2013abstract Takeshi Morita (Division of Safety Information on Drug ,Food and Chemicals ,National Institute of Health Sciences ,Tokyo 158-8501,Japan ) Abstract :It is important to review existing toxicity data of chemicals as well as conduct of toxicity tests.It provides toxicological information on similar class of chemicals ,and avoids unnecessary tests.A critical first step is to assemble all of the available information on the chemical.There are many information sources of data on physic-chemical properties or mammalian toxicity (e.g.,human data ,in vivo or in vitro studies ,in silico outputs ).The sources include review docu-·805·中国药理学与毒理学杂志2013年6月第27卷第3期Chin J Pharmacol Toxicol ,Vol 27,No 3,Jun 2013