
思考与习题
一、选择题
1.分子组成符合CnH2n-2通式的化合物可能是 B
A 环烷烃
B 环烯烃
C 环状共轭二烯烃
D 单环芳烃
2.能使溴水溶液颜色褪去的物质可能是 B
A 环戊烷
B 甲基环丙烷
C 苯
D 乙基环己烷
3.不能发生傅-克反应的物质是 B
A 甲苯
B 硝基苯
C 氯苯
D 叔丁基苯
4.不能使酸性高锰酸钾溶液褪色的物质是 B
A 环己烯
B 环己烷
C 甲苯
D 1,3-丁二烯
5.能够活化苯环的第一类定位基是 C
A -Cl
B -CHO
C –NHCOCH3
D -SO3H
二、判断正误。正确的划“√”,错误的划“ⅹ”。
1.环己烷分子内碳原子间的键角为正常键角109.5°,不存在环张力,分子很稳定,体现
同饱和脂肪烃一样性质。(√)
2.芳香烃和卤素在催化剂的作用下发生反应,苯环上的氢原子被卤素取代,生成卤代芳烃。(√)
3.—NHCOR,—OCOR,—CONH2都是邻对位定位基。(×)
4.吡啶环碳原子的电子云密度相对于苯环小,是缺电子的芳杂环。(√)
5.五元芳杂环是富电子的芳杂环。噻吩与硫酸亲电取代反应易于苯,在室温条件下即可
发生反应。(√)
三、填空题
1.把下列化合物的结构式填在横线上面。
呋喃O, 1,1,2-三甲基环戊烷,
2
Cl
,
,噻吩O,吡啶N,8-羟
基喹啉
N
OH,2,4-二甲基环己烯
CH3
CH3。
2.硝基是间位定位基;烷氧基是邻、对位定位基3.完成下列反应方程式:
+
HBr
(1)
CH 2H C
C
CH 3
CH 3
3H
CH 2CH 3
24
KMnO4
(2)
HOOC CH 2CH 2CH 2CH 2CH 3
COOH
CH
CH 2CH 3
24
2Fe
H 2O
(3)
CH 2CH 3
3H
CH 2CH 3
SO 3H
Cl
CH 2CH 3
Cl
(4)
C 12H 25
24
40~50℃
NaOH
C 12H 25
SO 3H
C 12H 25
SO 3Na
(5)
CH 3
+CH 3
C
O
O
C
O CH 3
无水AlCl 3
CH 3
C O CH 3
(6)
浓H
SO
?
SO 3H
Cl
N
浓HNO 324
(7)
N
NO 2
S
室温
S
SO 3H
+
H 2O
(8)
N HNO 3
(9)
N COOH COOH
(10)
N
CH 3
HNO 3N
COOH
四、简答题
1.什么是角张力?
解答:偏离正常键角而产生的张力。 2.什么是芳香性?
解答:以苯为代表的一类高度不饱和的烃易取代而不易加成的性质。 3.如何用简单的化学方法区别下列各组化合物。 (1)环己烷、环己烯和1-己炔
解答:
环己烷环己烯1-
己炔
有沉淀生成的是1-己炔
无明显现象的是
环己烷环己烯
(2)丙烷、环丙烷和丙烯
解答:
丙烷环丙烷丙烯
KMnO 4
KMnO 4颜色褪去的是丙烯无明显现象的是
环丙烷
丙烷
无明显现象的是丙烷
(3)环己烯、苯和甲苯
解答:
甲苯苯环己烯
溴水褪色的是
无明显现象的是
甲苯
苯
+
KMnO 4
(4)乙苯、苯乙烯和苯乙炔
解答:
乙苯苯乙烯
苯乙炔
不能使溴水褪色的是乙苯
溴水颜色褪去的是
苯乙烯
苯乙炔
4.如何除去下列化合物中的少量杂质。
(1)将甲苯中混有少量的吡啶除去。
解答:在其中加入适量的H2SO4,充分混合振荡,吡啶的碱性与酸化合进入酸层,静置分层分离出H2SO4即可。
(2)苯中混有少量的噻吩。
解答:在其中加入适量的浓H2SO4,室温下噻吩与浓H2SO4发生磺化反应,产生溶于H2SO4层,静置分层分离出浓硫酸层即可。
5.简述邻对位定位基、间位定位基的特点。
解答:邻对位定位基在结构上与芳环直接相连的碳原子以单键与其它原子相连接,有些与芳环直接相连的原子带有负电荷或有未共用的孤电子对;多为活化苯环的基团。间位定位基在结构上与芳环直接相连的原子多以重键与其它原子相连接,有些与芳环直接相连的原子带正电荷;全为钝化苯环的基团。
五、综合题
1.某芳烃的分子式为C8H10,用高锰酸钾和浓硫酸氧化后,可得一种二元酸。将原来的芳烃进行硝化,所得一元硝基化合物只有一种。写出此芳烃的结构式,并写出有关反应式。解:依题意推知该芳烃的结构式为:
CH3
3
CH3
CH3
或
推导过程为:
CH 3
CH 3CH 3
CH 3
KMnO 424
COOH
H 2SO 43
COOH
COOH
NO 2
[O ]
COOH
COOH
HNO 3
24
COOH
COOH
NO 2
2.某化合物其分子式为C 6H 6OS ,它不发生银镜反应,但能与羟胺作用生成肟,与次氯酸钠作用生成α—噻吩甲酸钠。写出该化合物的结构式,并写出有关反应式。 解:依题意推知该化合物的结构为:
S
CH 3
O
推导过程为:
S
CH 3
O
NH 2-OH
S
CH 3
N
OH
+
H 2O
S
COONa
H +
S
COOH
一、选择题(本题包括10小题,每小题5分,共50分) 1.下列概念分类标准正确的是( ) A.强碱和弱碱:每个分子能电离的OH-数目 B.强电解质和弱电解质:溶液导电能力强弱 C.浊液、胶体、溶液:分散剂粒径大小 D.氧化剂、还原剂:在化学反应中元素化合价变化 解析:碱的强弱分类是根据碱溶于水后,能否完全电离出OH-,能完全电离的碱为强碱,不能完全电离的碱为弱碱,A项错误.强电解质与弱电解质划分的标准是溶于水的电解质是否完全电离,与其水溶液的导电能力的强弱无直接关系,B项错误.划分分散系的标准是根据分散质粒子直径大小,与分散剂无关,C项错误.在氧化还原反应中,元素化合价升高的物质作还原剂,元素化合价降低的物质作氧化剂,D项正确. 答案:D 2.(2011?佛山模拟)生物学家借助新的显微技术,成功观察到小于200纳米的粒子.下列分散系中,分散质粒子半径最小的是( ) A.雾B.蛋白质溶液 C.石灰乳D.KNO3溶液 解析:在分散系中溶液的分散质粒子最小,又因为蛋白质属于大分子,故D符合. 答案:D 3.(2011 ?济南模拟)下列事实与胶体性质无关的是( ) A.水泥厂和冶金厂常用高压直流电除去大量烟尘,减少对空气的污染
B.将植物油倒入水中用力搅拌形成油水混合物 C.一束平行光线射入蛋白质溶液里,从侧面可以看到一条光亮的通路 D.氢氧化铁胶体中滴入稀硫酸,先看到红褐色沉淀生成而后沉淀溶解 解析:烟尘是气溶胶,其中的胶粒带电,在直流电作用下可产生电泳现象,使烟尘沉降而除去;蛋白质溶液是胶体,能发生丁达尔现象;在氢氧化铁胶体中滴入稀硫酸,先发生胶体的聚沉,然后氢氧化铁与酸反应而溶解;将植物油倒入水中用力搅拌形成的油水混合物是乳浊液,不是胶体. 答案:B 4.(2011?抚顺重点高中协作模拟)磁流体是电子材料的新秀,它既具有固体的磁性,又具有液体的流动性,可用于潜水艇推进器等.制备某种磁流体时,将等物质的量的硫酸亚铁溶液和硫酸铁溶液混合,滴入稍过量的氢氧化钠溶液,随后加入油酸钠溶液,所得磁流体黑色粒子直径在5.5~36 nm之间.下列说法正确的是( ) A.所得的分散系属于悬浊液 B.所得的分散系中的分散质为Fe2O3 C.给分散系通电时阳极周围黑色不变 D.该分解系能产生丁达尔效应 解析:根据粒子直径为5.5~36 nm,判断该分散系属于胶体,A错误;Fe2O3是红色物质,B错误;磁流体是胶体,通直流电发生电泳现象,阴阳极周围黑色会发生改变,C错误;该分散系是胶体,有丁达尔效应. 答案:D 5.(2011?哈尔滨质检)将饱和FeCl3溶液滴入沸水并煮沸一段时间,可得到红褐
第二章 稀溶液依数性 练习题 一、是非题(共10题) 1. 溶液的沸点是指溶液沸腾温度不变时的温度。( ) 2. 溶液与纯溶剂相比沸点升高、凝固点降低是由于溶剂摩尔分数减小引起的。( ) 3. 等物质的量硝酸钾和碳酸钾分别加入等量的水中,该两溶液的蒸气压下降值相等。( ) 4. 凡是浓度相等的溶液都是等渗溶液。( ) 5. 溶液的蒸气压下降和沸点升高仅适用于难挥发的非电解质溶质,而凝固点降低及渗透压则 不受此限制。( ) 6. 电解质浓溶液也有依数性变化规律,但不符合拉乌尔定律的定量关系。( ) 7. 一定量的电解质加入纯水中,此溶液的沸点一定高于100℃,但无法定律计算。( ) 8. 任何两种溶液用半透膜隔开,都有渗透现象发生。( ) 9. 分散质粒子大小在合适的范围内,高度分散在液体介质中就能形成稳定的溶胶。( ) 10. AlCl 3、MgCl 2、KCl 三种电解质对负溶胶的聚沉值依次减小。( ) 二、选择题 ( 共11题 ) 1. 以下论述正确的是 ---------------------------------------------------------------------------( ) (A )饱和溶液一定是浓溶液 (B )甲醇是易挥发性液体,溶于水后水溶液凝固点不能降低 (C )强电解质溶液的活度系数皆小于1 (D )质量摩尔浓度数值不受温度变化 2. 已知乙醇和苯的密度分别为0.800 g ·cm -3 和0.900 g ·cm -3,若将86.3cm 3 乙醇和 901 cm 3 苯互溶, 则此溶液中乙醇的质量摩尔浓度为-----------------------------------------------------( ) (A) 1.52 mol ·dm -3 (B) 1.67 mol ·dm -3 (C) 1.71 mol ·kg -1 (D) 1.85 mol ·kg -1 3. 2.5 g 某聚合物溶于 100 cm 3水中, 20℃时的渗透压为 100 Pa, 则该聚合物的相对分子质量是----------------------------------------------------------------------------------------------------( ) (A) 6.1×102 (B) 4.1×104 (C) 6.1×105 (D) 2.2×106 4. 1.0 mol ·dm -3蔗糖的水溶液、1.0mol ·dm -3乙醇的水溶液和 1.0 mol ·dm -3乙醇的苯溶液, 这三种溶液具有相同的性质是 -----------------------------------------------------------------( ) (A) 渗透压 (B) 凝固点 (C) 沸点 (D) 以上三种性质都不相同 5. 1.17 % 的 NaCl 溶液产生的渗透压接近于-----------------------------------------------( ) (相对原子质量: Na 23, Cl 35.5) (A) 1.17 % 葡萄糖溶液 (B) 1.17 % 蔗糖溶液 (C) 0.20 mol ·dm -3葡萄糖溶液 (D) 0.40 mol ·dm -3蔗糖溶液 6. 同温同浓度的下列水溶液中, 使溶液沸点升高最多的溶质是--------------------------( ) (A) CuSO 4 (B) K 2SO 4 (C) Al 2(SO 4)3 (D) KAl(SO 4)2
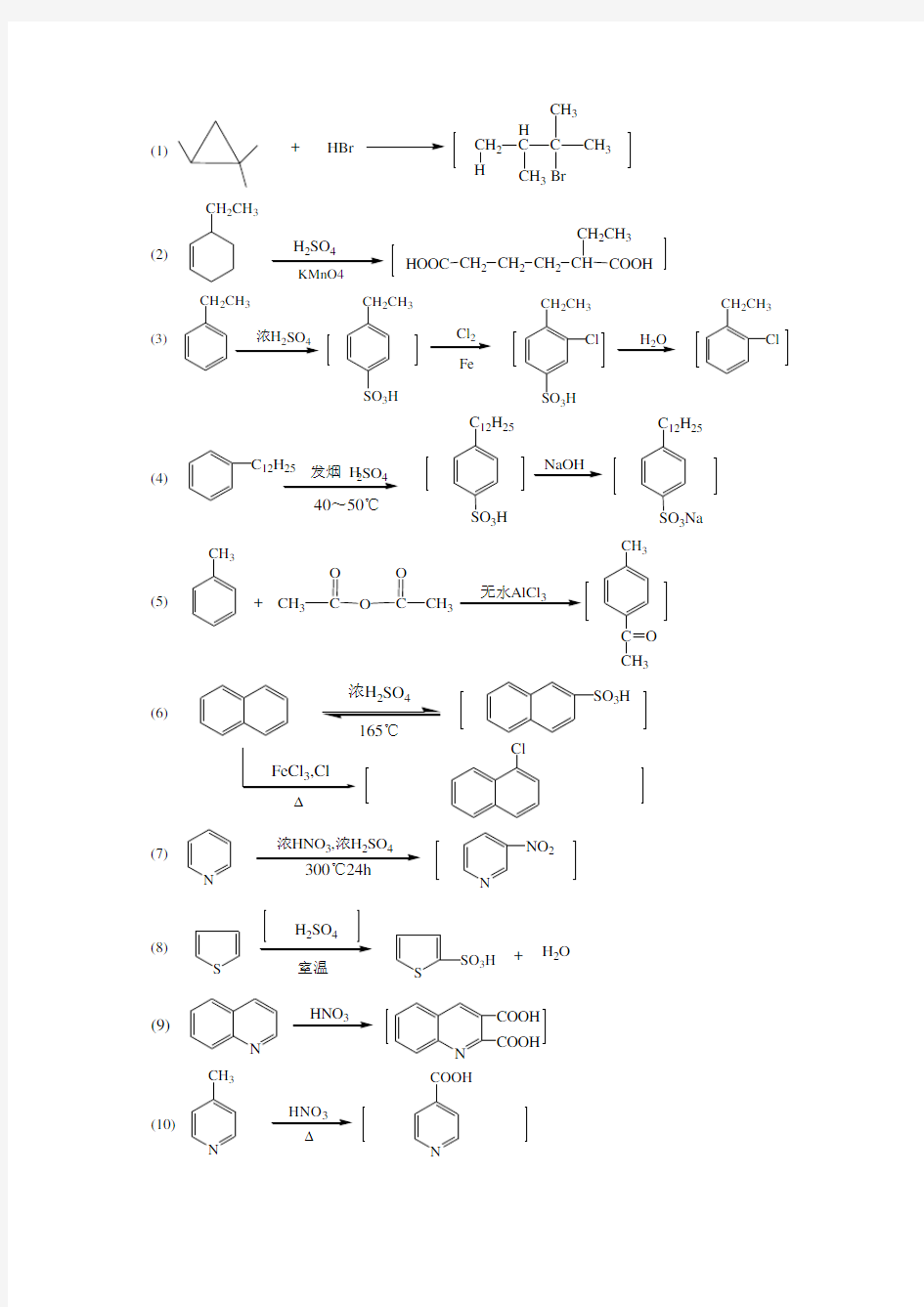
思考与习题 一、选择题 1.分子组成符合CnH2n-2通式的化合物可能是 B A 环烷烃 B 环烯烃 C 环状共轭二烯烃 D 单环芳烃 2.能使溴水溶液颜色褪去的物质可能是 B A 环戊烷 B 甲基环丙烷 C 苯 D 乙基环己烷 3.不能发生傅-克反应的物质是 B A 甲苯 B 硝基苯 C 氯苯 D 叔丁基苯 4.不能使酸性高锰酸钾溶液褪色的物质是 B A 环己烯 B 环己烷 C 甲苯 D 1,3-丁二烯 5.能够活化苯环的第一类定位基是 C A -Cl B -CHO C –NHCOCH3 D -SO3H 二、判断正误。正确的划“√”,错误的划“ⅹ”。 1.环己烷分子内碳原子间的键角为正常键角109.5°,不存在环张力,分子很稳定,体现 同饱和脂肪烃一样性质。(√) 2.芳香烃和卤素在催化剂的作用下发生反应,苯环上的氢原子被卤素取代,生成卤代芳烃。(√) 3.—NHCOR,—OCOR,—CONH2都是邻对位定位基。(×) 4.吡啶环碳原子的电子云密度相对于苯环小,是缺电子的芳杂环。(√) 5.五元芳杂环是富电子的芳杂环。噻吩与硫酸亲电取代反应易于苯,在室温条件下即可 发生反应。(√) 三、填空题 1.把下列化合物的结构式填在横线上面。 呋喃O, 1,1,2-三甲基环戊烷, 2 Cl , ,噻吩O,吡啶N,8-羟 基喹啉 N OH,2,4-二甲基环己烯 CH3 CH3。 2.硝基是间位定位基;烷氧基是邻、对位定位基3.完成下列反应方程式:
+ HBr (1) CH 2H C C CH 3 CH 3 3H CH 2CH 3 24 KMnO4 (2) HOOC CH 2CH 2CH 2CH 2CH 3 COOH CH CH 2CH 3 24 2Fe H 2O (3) CH 2CH 3 3H CH 2CH 3 SO 3H Cl CH 2CH 3 Cl (4) C 12H 25 24 40~50℃ NaOH C 12H 25 SO 3H C 12H 25 SO 3Na (5) CH 3 +CH 3 C O O C O CH 3 无水AlCl 3 CH 3 C O CH 3 (6) 浓H SO ? SO 3H Cl N 浓HNO 324 (7) N NO 2 S 室温 S SO 3H + H 2O (8) N HNO 3 (9) N COOH COOH (10) N CH 3 HNO 3N COOH
填空选择3 1、下列各组物质可能共存的是( A )。 A..Cu2+、Fe2+、Sn4+、Ag B. Cu2+、Fe2+、Ag+、Fe C Cu2+、Fe3+、Ag+、Fe D Fe3+、Fe2+、Sn4+、I- 2、通常配制FeSO4溶液时,加入少量铁钉,其原因与下列反应中的哪一个无关?( D ) A.O2(aq)+4H+(aq)+4e==2H2O(l) B. Fe3+(aq)+e== Fe2+(aq) C. Fe(s)+2Fe3+(aq)==3Fe2+(aq) D. Fe3+(aq)+3e== Fe(s)3、已知Φ°(Fe3+/ Fe2+)=0.771V,K稳(Fe(CN)63-)=1.0×1042,K稳(Fe(CN) 64-)=1.0×1035,则Φ°Fe(CN) 6 3-/ Fe(CN) 6 4-)=(A )。 A、0.36V B、1.19V C、-0.36V D、0.77V 4、若两电对在反应中电子转移分别为1和2,为使反应完成程度达到99.9%,两电对的条件电势之差ΔΦ°至少应大于( B)。 A、0.09V B、0.27V C、0.36V D、0.18V 5、影响氧化还原反应方向的因素有( B )。 A、压力 B、温度 C、离子强度 D、催化剂 6、在 1 mol·L-1 H2SO4介质中,Φ°(Ce4+/ Ce3+)=1.44VΦ°,(Fe3+/ Fe2+)=0.65V,以Ce4+滴定Fe2+时,最适宜的指示剂为( B )。 A、二苯胺碘酸纳[Φ°(In)=0.84V] B、邻二氮菲-亚铁[Φ°(In)=1.06V] C、硝基邻二氮菲-亚铁[Φ°(In)=1.25V] D、邻苯氨基苯甲酸[Φ°(In)=0.89V] 7、用K2Cr2O7法测定Fe时,若SnCl2量加入不足,则导致测定结果( B)。 A、偏高 B、偏低C、不变 D、无法判断 8、碘量法要求在中性或弱酸性介质中进行滴定,若酸度太高,将会( D)。 A、反应不定量B、I2易挥发C、终点不明显 D、I-被氧化,Na2S2O3被分解 9、标定Na2S2O3的基准物是下述哪一种?( B ) A、H2C2O4·H2O B、K2Cr2O7 C、As2O3D、Fe 10、用KMnO4滴定Fe2+之前,加入几滴MnSO4的作用是( A)。 A、催化剂 B、诱导反应剂 C、氧化剂 D、配合剂 11、用法扬司法测定Cl-时,用曙红为指示剂,分析结果会(B)。 A、偏高B、偏低 C、准确 12、在PH=4时,用莫尔法测定Cl-时,分析结果会( A)。 A、偏高 B、偏低 C、准确 13、化合物Ag2CrO4在0.001 mol·L-1的AgNO3溶液中的溶解度比在0.001 mol·L-1的KCrO 4液中的溶解度( B )。 A、较大 B、较小 C、一样 14、常温下,AgCl的溶度积为1.8×10-10,Ag2CrO4的溶度积为1.1×10-12,,CaF2的溶度积为2.7×10-11,(1)三种物质中溶解度最大的是( C),(2)三种物质中溶解度最小的是(A ) A、AgCl B、Ag2CrO4 C、CaF2 15、在沉淀形成过程中,与待测离子的半径相近的杂质离子常与待测离子一道与构晶离子形成( B )。
绪言化学使世界变得更加绚丽多彩 此部分内容从学生的角度提出了许多饶有趣味且又带有一定想象力的美好愿望,指出这些美好愿望“正在通过化学家的智慧和辛勤的劳动逐步实现”,从而激发学生学习化学的兴趣,使学生感受到化学学习的价值,并产生希望了解化学的强烈愿望。 教材从具体事例出发,先是引导学生了解化学是一门使世界变得更加绚丽多彩的自然科学,它主要研究物质的组成、结构、性质以及变化规律;接着教材以丰富多彩的图画和简明的语言,概述了人类认识化学、利用化学和发展化学的历史和方法,以及化学与人类进步和社会发展的关系,向学生展示了化学的魅力和学习化学的价值。 知识与技能 了解化学是研究物质的组成、结构、性质以及变化规律的自然科学,知道化学与人类进步和社会发展的密切关系。 过程与方法 引导学生通过资料搜集、展示等,逐步形成良好的学习习惯和学习方法,提高学生获取信息、表达信息的能力。 情感、态度与价值观 激发学生亲近化学、热爱化学并渴望了解化学的情感。 重点对学生进行情感、态度和价值观等方面的熏陶和培养。激发学生渴望了解化学的情感,认识化学学习的价值,从而产生学习化学的兴趣。 难点了解什么是化学。 多媒体、NaOH溶液(用啫喱水瓶盛装好)、用酚酞试液写有“化学大世界”字样的纸(表面为白纸)。 一、导入新课 请三名学生分别上台表演: 甲:(展示A、B两种无色液体)请大家猜测,如果把这两种液体混合在一起会有什么现象呢? (在同学们各抒己见后) 甲:[向盛有A液体(稀盐酸)的试管中滴加B液体(AgNO3溶液)。] (在同学们惊讶的目光中) 甲:我表演的节目叫“清水变牛奶”,可是不能喝! 乙:这有什么稀奇,我也会表演(展示C、D两种无色液体),我也请大家猜一猜,如果把它们混在一起会有什么现象呢? (在同学们各抒己见后) 乙:[向盛有C液体(NaOH溶液)的烧杯内,逐滴滴入D液体(无色酚酞)。] (在同学们期待的目光中) 乙:我的节目叫“我为液体添色彩”。
d区元素一 一、过渡元素有哪些特点? 二、铬酸洗液是怎样配制的?失效后现象如何?为何它有去污能力?如何使用 它比较合理? 三、根据锰的价层电子构型以及锰的元素电势图回答下列问题: 1. 在酸性或碱性介质中,锰的哪些氧化态的物质稳定? 2. 在酸性或碱性介质中,锰的哪些化合物可作氧化剂? 四、完成并配平下列反应式 1. Cr 3++ OH-+H 2 O 2 → 2. K 2 Cr 2 O 7 +HCl(浓)→ 3. Cr 3++S2-+H 2 O→ 4. Ag+ Cr 2 O 7 2- +H 2 O→ 5. Cr 2O 7 2-+S2-→ 6. K 2 Cr 2 O 7 +H 2 C 2 O 4 → 五、说明铬价化合物在酸性溶液中比在碱性溶液中的氧化性强。 六、有一钴的配合物,其中各组分的含量分别为钴23.16%、氢4.71%、氮33.01%、 氧25.15%和氯13.95%。如将配合物加热则失去氨,失重为该配合物原质量 的26.72%。试求该配合物中有几个氨分子,以及该配合物的最简式。 七、某绿色固体可溶于水,其水溶液中通人,即得棕黑色沉淀和紫红色溶 液。与浓溶液共热时放出黄绿色气体,溶液近乎无色,将此溶液和溶液混合,即得沉淀。将气体通入溶液,可得。判断A是哪种盐,写出有关的反应方程式。 八、某含铬和锰的钢样品10.00g,经适当处理后,铬和锰被氧化为Cr 2O 7 2-和MnO 4 - 的溶液共250ml。精确量取上述溶液10.00,加入BaCl 2 溶液并调节酸度,使铬
全部沉淀下来,得到0.0549gBaCrO 4 。另取一份上述溶液10.00ml,在酸性介质中用Fe2+溶液(浓度为0.075 mol?L-1)滴定,用去15.95ml。计算钢样中铬和锰的百分含量。 九、用盐酸处理Fe(OH) 3 、Co(OH)和NiO(OH)时各发生什么反应?写出反应式,并加以解释。 十、填空。 1.Cr 2O 7 2-色, Cr 2 O 4 2-色,CrO 5 色。 2.MnO 4-色,MnO 4 2-色,Mn2+色。 3.Fe(OH) 3色, Fe(OH) 2 色,Co(OH) 2 色,Ni2+色,Ni(NH 3 ) 4 2+ 色。 十一、举出鉴别Fe3+、Co2+、Ni2+、Cr3+、Mn2+离子常用的方法。 十二、金属M溶于稀HCl时生成MCl 2 ,其磁矩为5.0B.M。在无氧操作条件下,溶液遇NaOH溶液,生成一白色沉淀A。A接触空气就逐渐变绿,最后变成棕色沉淀B。灼烧时,B生成了棕红色粉末C,C经不彻底还原而生成了铁磁性的黑色物质D。 B溶于稀盐酸生成溶液E,它使KI溶液被氧化成I 2 ,但在加入KI前先加入NaF,则KI不能被E所氧化。 若向B的浓NaOH悬浮液中通Cl 2时,可得到一紫红色溶液F,加入BaCl 2 时, 就会沉淀出红棕色固体G。G是一种强氧化剂。 试确认各字母符号所代表的化合物,并写出反应方程式。 十三、在酸性介质中,用锌还原Cr 2O 7 2-时,溶液颜色由橙色经绿色而变成蓝色。 放置时又变回绿色。试解释之,并写出相应的化学反应方程式。
化学试题 一、选择题 1.下列表示物质结构的化学用语或说法正确的是() A.20278Pt和19878Pt的质子数相同,互称为同位素 B.8个中子的碳原子的符号:12C C.H2O2中氧元素的化合价是-2 D.Cl-离子的结构示意图: 2.根据原子序数,下列各组原子能以离子键结合的是() A.2与8 B.6与16 C.8与14 D.9与11 3.设N A为阿伏伽德罗常数,下列叙述正确的是() A.24g镁原子最外层电子数为N A B.1mol甲烷分子所含质子数为10N A C.1mol乙烯分子中的共价键是4N A D.标准状况下,22.4L乙醇的分子数为N A 4.苯加溴水后,溴水层颜色变浅,这是由于() A.溴挥发了 B.发生了取代反应 C.发生了萃取 D.发生了加成反应 )X Y Z A.X,Y,Z中X的单质最稳定 B.Y的氢化物为HY C.X能生成HXO D.能发生ZO2+2H2Z=3Z+2H2O的反应 6.下列说法正确的是() A.NH4Cl中含有共价键,所以NH4Cl是共价化合物 B.阴阳离子之间有强烈的吸引作用而没有排斥作用,所以离子键的核间距相当小 C.失电子难的原子获得电子的能力一定强 D.含有离子键的化合物必是离子化合物 7.下列有关有机物的说法正确的是() https://www.doczj.com/doc/0f7824650.html,l4可由CH4发生加成反应制得 B.乙醇、乙酸和乙酸乙酯能用饱和Na2CO3溶液制得 C.糖类、蛋白质、油脂均属于天然高分子化合物 D.苯不能使酸性高锰酸钾溶液褪色,因此苯不能发生氧化反应 8.下列有关有机物的说法正确的是( ) A.用聚氯乙烯塑料袋包装食品 B.等物质的量的乙醇和乙酸完全燃烧时所需氧气的质量相等 C.乙烯的结构简式为CH2CH2 D.检验乙醇中少量的水:加无水硫酸铜 9.下列实验能达到预期目的的是() A.向蛋白质溶液中加氯化钡溶液以提纯蛋白质 B.向淀粉中加稀硫酸加热,冷却后再加新制的氢氧化铜悬浊液加热检验淀粉是否水解
化学习题
在总浓度为0.10mol/L的银-硫代硫酸络合物的溶液中,当Ag(S2O3)35-型体的浓度等于Ag(S2O3)-型体浓度的1000倍时,溶液中游离S2O32-和 Ag(S2O3)-型体的浓度各为多少? (已知 Ag+-S2O32-形成逐级络合物的累积稳定常数b1=109.0, b2=1013. 2 在1L NH3-NH4Cl的缓冲溶液中, 含0.10 mol Zn2+-EDTA络合物, 溶液的pH=9.0,[NH3]=0.10 mol/L,计算Zn2+的浓度。已知lgK(ZnY)=16.5; 锌氨络离子的lgb1 -lgb4分别为2.27,4.61,7.01,9.06; pH=9.0时lga Y(H) =1.3。 3 在pH=5.0的缓冲溶液中, 以2×10-2mol/L EDTA滴定相同浓度的Cu2+溶液,欲使终点误差在±0.1%以内。试通过计算说明可选用PAN指示剂。 已知: pH=5.0时PAN的pCu t=8.8, a Y(H)=106.6, lgK(CuY)=18.8。 4 用0.0200 mol/L EDTA滴定pH=10.0每升含有0.020 mol游离氨的溶液中的Cu2+ [c(Cu2+)=0.0200 mol/L], 计算滴定至化学计量点和化学计量点前后0.1% 时的pCu'和pCu值。[lgK(CuY)=18.8; pH=10.0时 lga Y(H)=0.5, lga Cu(OH)=0.8; Cu-NH3络合物的各级累积常数 lgb1~lgb4: 4.13、7.61、10.48、12.59] 5 计算pH=10.0时, 以铬黑T作指示剂, 用0.0200 mol/L EDTA溶液滴定0.0200 mol/L Ca2+的终点误差。 [pH=10.0时 lga Y(H)=0.5、pCa t(铬黑T)=3.8, lgK(CaY)=10.7] 6 试计算在pH=10.0的氨性缓冲溶液中, 设化学计量点时[NH3]=0.10 mol/L, 用0.0200 mol/L EDTA溶液滴定0.0200 mol/L Zn2+溶液时,化学计量点的pZn和 pZn'值。 [lgK(ZnY)=16.5; pH=10.0时 lga Y(H)=0.5, lga Zn(OH)=2.4, Zn(NH3)42+的lgb1~lgb4分别是2.37、4.81、7.31、9.46] 7 于pH=10.0时, 以0.0100 mol/L EDTA溶液滴定50.00 mL同浓度的某金属离子M2+, 已知在此条件下滴定反应进行完全。当加入EDTA溶液49.95 mL和50.05 mL时,化学计量点前后的pM值改变2个单位。计算络合物MY2-的稳定常数K(MY)值。 (不考虑M2+的其它副反应,已知pH=10.0时, lga Y(H)=0.5)
一、填空题(共20分) 1、主量子数n为4时,其轨道总数为,电子层电子的最大容量为。 2、根据共价键形成时原子轨道重叠方式不同,共价键可分为和两种。 3、在等温等压条件下,系统的焓变ΔH=。 4、质量作用定律适用的范围是。 5、用有效数字表示下列计算结果: (3.202+0.01301)×12.9= ; 158.7÷2 - 5.11×10-3 = 。 6、已知NaHCO3注射液的质量浓度为50g/L,则其物质的量浓度为mol/L。(NaHCO3的摩尔质量为84 g/ mol)。 7、医学上的等渗溶液的渗透浓度范围是。 8、在NH4Cl-NH3•H2O的体系中,抗酸成分是。 9、用0.1 mol/L的NaOH溶液滴定0.1 mol/L的HC1溶液20 ml,选用的指示剂是 。 10、[Ag(NH3) 2]OH的名称是。 二、选择题(共20分) 1、下列各组量子数中不合理的是()。 A、n=2,l=1,m=0 B、n=3,l=2,m=1 C、n=2,l=2,m=l D、n =3,l=2,m=2 2、原子序数为7的氮元素,原子核外电子排布式为()。 A、1S22S22P1 B、1S22S22P2 C、1S22S22P3 D、1S22S22P4 3、已知PC13分子中,中心原子采用不等性SP3杂化,则分子的空间构型为()。 A、直线型 B、平面三角型 C、三角锥形 D、正四面体 4、在水分子之间存在的主要作用力是() A、氢键 B、取向力 C、色散力 D、诱导力 5、下列各种函数中,不属于状态函数的是()。 A、恒压反应热 B、反应的焓变 C、系统的内能 D、物质的标准生成自由能 6、今有反应:A+B=C,其速率方程式为:u=kCACB,下列说法正确的是()。 A、这反应一定是基元反应 B、这反应一定是复杂反应 C、这是个一级反应 D、这是个二级反应 7、用万分之一的天平称取的质量为2.3801g一级标准物质K2Cr2O7,则其相对误差是()。 A、±0.0001 g B、±0.0002 g C、±0.004% D、±0.008% 8、会使红细胞发生皱缩的溶液是() (A) 10.0g/LCaCl2•2H2O(Mr=147) (B) 12.5g/LNaHCO3(Mr=84.0) (C) 9.0g/LNaCl(Mr=58.5) (D) 112g/LC3H5O3Na(乳酸钠,Mr=80) 9、下列叙述错误的是() (A)在室温条件下,任何水溶液都有[H+] [OH-]=1×10-14
化学实验基本知识试题 6. a. 红色 b. 兰色 c. 无色 d. 7. 通常所说的浓硫酸的浓度为: a. 50% b. 75% c. 98% d. 100% 8. 1ng 为: a. 1X10 -3g b. 1X10 -6g c. 1X10 9. 摄氏 100o C 为: 绿褐色 (d ) (c ) -9 g d. 1X10 -12g (c ) a. 373.15K b. 273.15K c. 125K d. 473.15K 10. 有效数字 1.0079 、 32.06 和 26.017 相加,结果为: a. 59.0849 b. 59.09 c. 59.1 d. 59.085 11. 若需配置1M 的NaOH 溶液0.5L ,则需NaOH 固体: a. 10 g b. 20 g c. 30 g d. 40 g (b ) 12 . 若需配置1N 的KOH 溶液0.5L,则需KOH 固体: a. 10 g b. 28 g c. 56 g d. 33 g (b ) 13. 浓度为 98%,密度为 1.84g/cm -3 的硫酸的摩尔浓度为: a. 18.4 M b. 12.8 M c. 9.8 M d. 49 M (a ) 14. 实验试剂瓶的标签颜色为: a. 棕色 b. 蓝色 c. 红色 d. 绿色 (a ) 15. 化学纯试剂瓶的标签颜色为: a. 棕色 b. 蓝色 c. 红色 d. 绿色 (b ) 16. 分析纯试剂瓶的标签颜色为: a. 棕色 b. 蓝色 c. 红色 d. 绿色 (c ) 一、 单选题 1. 碱式滴定管内不宜装下列物质: a. 氧化剂 b. 还原剂 c. 水 d. 碱液 2. 酸式滴定管的下端具有: a. 玻璃珠 b. 橡皮管 c. 玻璃活塞 d. 其它 a ) c ) 3. 1升水的质量为 1000g 时的温度为: a. 0 o C b. 10 o C c. 25 o C d. 3.98 o C 4. 砂心漏斗不能用过滤下列液体: a. 水 b. 碱液 c. 酸液 d. 盐溶液 d ) b ) 5. 配置铬酸洗液时,加入浓硫酸应: a. 尽快地加 b. 缓慢的加 c. 无所谓 d. 静止时加入 b ) 洗液用到什么颜色时,就不能使用了 a ) b )
选择题 1.下列有关偶然误差的论述中不正确的是:(D) A、偶然误差具有随机性 B、偶然误差具有单向性 C、偶然误差在分析中是无法避免的 D、偶然误差的数值大小、正负出现的机会是均等的2.如果要求分析结果达到0.1%的准确度,使用灵敏度为0.1mg的天平称取试样时,至少应称取:(B) A、0.1g B、0.2g C、0.05g D、0.5g 3.已知T(H2C2O4/NaOH)= 0.004502g·mL-1则NaOH溶液的浓度是:(A) A、0.1000 mol·L-1 B、0.05000 mol·L-1 C、0.02000 mol·L-1 D、0.04000 mol·L-1 1毫升H2C2O4相当于0.004502g NaOH,1升H2C2O4相当于4.502g NaOH,4.502/40=0.113接近A 4.下列各组酸碱对中,属于共轭酸碱对的是:(C) A、H2CO3—CO32- B、H3O+—OH- C、HPO42-—PO43- D、NH3+CH2COOH—NH2CH2COO- 给出质子(H+)是酸→HPO42-,接受质子的是碱→PO43-。共轭酸碱对是二者之间仅差一个H+ 5.用25ml移液管移出的溶液体积应记录为:(C) A、25.0ml B、25ml C、25.00ml D、25.000ml 6.间接碘量法中正确使用淀粉指示剂的做法是:(D) A、滴定开始就应该加入指示剂 B、为使指示剂变色灵敏应适当加热 C、指示剂须终点时加入指示剂 D、指示剂必须在接近终点时加入 7.莫尔法测定Cl-所用标准溶液、PH条件和应选择的指示剂是:(D) A、AgNO3、碱性和K2CrO4 B、AgNO3、碱性和K2Cr2O7 C、KSCN、酸性和K2CrO4 D、AgNO3、中性弱碱性和K2CrO4 8.用佛尔哈德法测I-时,指示剂必须在加入过量AgNO3溶液后才能加入,这是因为:(C) A、AgI对指示剂的吸附性强 B、对I-的吸附性强 C、Fe3+氧化I- D、Fe3+水解 9.指出下列条件适于法扬斯测定Cl-的是:(D) A、PH=1~3 B、以K2CrO4为指示剂 C、滴定酸度威0.1~1mol·L-1 D、以荧光黄为指示剂 10、下列试剂中,可用直接法配制标准溶液的是:(A)。 A、K2Cr2O7 B、NaOH C、H2SO4 D、KMnO4 11.下列说法正确的是:(D)。 A、指示剂的变色点即为化学计量点 B、分析纯的试剂均可作基准物质 C、定量完成的反应均可作为滴定反应 D、已知准确浓度的溶液称为标准溶液 12.将Ca2+沉淀为CaC2O4,然后溶于酸,再用KMnO4标准溶液滴定生成的H2C2O4,从而测定Ca 的含量。所采用的滴定方式属于:(B)。 A、直接滴定法 B、间接滴定法 C、沉淀滴定法 D、配位滴定法13.下列误差中,属于终点误差的是:(B)。 A、在终点时多加或少加半滴标准溶液而引起的误差 B、指示剂的变色点与化学计量点不一致而引起的误差 C、由于确定终点的方法不同,使测量结果不一致而引起的误差 D、终点时由于指示剂消耗标准溶液而引起的误差 14.下列试剂中,可作为基准物质的是:(D)。 A、NaOH B、HCl C、KMnO4 D、K2Cr2O7 15.下列说法中,正确的是:(B)。
习题解答(第三章) 一、选择题 1.与环境只有能量交换,而没有物质交换的系统称为( C )。 (A )敞开系统 (B )隔离系统 (C )封闭系统 (D )孤立系统 2.某系统由状态A 变化到状态B ,经历了两条不同的途径,与环境交换的热和功分别为Q 1、W 1和Q 2、W 2。则下列表示正确的是( B )。 (A )Q 1=Q 2,W 1=W 2 (B )Q 1+W 1=Q 2+W 2 (C )Q 1>Q 2,W 1>W 2 (D )Q 1<Q 2,W 1<W 2 3.当系统状态发生变化后,其热力学能差值一定为零是( A )。 (A )循环过程 (B )绝热过程 (C )恒容过程 (D )恒压过程 4.某理想气体恒温压缩时,正确的说法是( B )。 (A )ΔU >0,ΔH <0 (B )ΔU =0, ΔH =0 (C )ΔU <0,ΔH <0 (D )ΔU <0, ΔH >0 5.1mol 单原子理想气体,从300K 压缩到500K ,则其ΔH 为( B )。 (A )300R (B )500R (C )-300R (D )-500R 6.298K 时,下列物质中θm f H ?=0的是( B )。 (A )CO 2(g ) (B )I 2(g) (C )Br 2(l ) (D )C (s ,金刚石) 7.下列热力学第二定律的数学表达式正确的是( A )。 (A )环T Q ds δ≥ (B )环T dQ ds ≥ (C )T Q ds R δ≥ (D )T dQ ds = 8.理想气体经不可逆循环,其熵变为( C )。 (A )0>?S (B )0
选择题(A)(B)(C)(D) 1.用酸性高锰酸钾溶液不能鉴别下列哪组物质() (A)丁烷和1,3-丁二烯(B) 丁烷和1-丁炔(C)乙烷和乙烯(D) 丙烷和环丙烷2.下列不是有机化合物的是() (A) C2H5OH (酒精) (B) (NH4)2CO3(碳酸铵) (C) (NH2)2CO (尿素) (D)CH3COOH(醋酸) 3.下列化合物能发生银镜反应的是() (A) CH3COCH3(B)CH3COOH (C)CH3CHO (D)CH3CH2OH (A) 丙酮(B) 乙醛(C) 乙醇(D)乙酸4.下列化合物中酸性最强的是() (A) H2O (B)CH3CH2OH (C)C6H5OH (D)CH3COOH (A) 乙醇(B) 水(C) 苯酚(D)乙酸 5.下列物质中沸点最高的是() (A) 乙醇(B) 甲醚(C) 乙酸(D)乙醛 (A) CH3CH2OH (B) CH3OCH3(C) CH3COOH (D)CH3CHO 6.下列化合物发生水解反应活性最强的是() (A) 酸酐(B) 酯(C) 酰胺(D) 酰卤 (A)(CH3CO)2O (B)CH3COOC2H5(C)CH3CONH2(D)CH3COCl 7.乙醇、丙醇混合后与浓硫酸共热,若反应生成醚类化合物,可能生成几种醚() (A) 2 (B) 3 (C) 4 (D) 5 8.禁止用工业酒精配制饮料酒,是因为工业酒精中含有少量的有毒的() (A) 甲醇(B) 乙二醇(C) 丁醇(D) 甘油 9.“来苏儿”的组成中有() (A) 苯酚(B) 乙醇(C) 甲酚(D) 甘油 10.以下各组化合物不为同分异构体的是()
实验 化学反应速率与活化能 一、教学要求: 1、掌握浓度、温度和催化剂对化学反应速率的影响; 2、学习测定过二硫酸铵与碘化钾反应的反应速率的方法; 3、利用实验数据会计算反应级数、反应速率常数和反应的活化能。 二、预习内容: 1、化学反应速率的表示方法; 2、浓度、温度和催化剂对化学反应速率的影响理论基础; 3、反应速率常数的意义; 4、化学反应活化能的意义 5、速率常数与活化能的关系; 6、如何使用作图法求反应的速率常数、反应级数和反应的活化能; 7、计时秒表的使用; 8、恒温水浴槽的使用; 三、基本操作: 四、实验原理: 在水溶液中过二硫酸铵与碘化钾反应为: (NH 4)2S 2O 8 + 3KI === (NH 4)2SO 4 + K 2SO 4 + KI 3 其离子反应为: S 2O 82- + 3I - === SO 42- + I 3- (1) 反应速率方程为: n I m O S c kc r --?=28 2 式中r 是瞬时速率。若-28 2O S c 、-I c 是起始浓度,则r 表示初速率(v 0)。在实验中只能测定出在一段 时间内反应的平均速率。 t c r O S ??-= - 28 2 在此实验中近似地用平均速率代替初速率: t c c kc r O S n I m O S ??-= =- - -28 2 28 20 为了能测出反应在△t 时间内S 2O 82-浓度的改变量,需要在混合(NH 4)2S 2O 8 和KI 溶液的同时,加入一定体积已知浓度的Na 2S 2O 3溶液和淀粉溶液,这样在(1)进行的同时还进行着另一反应: 2S 2O 32- + I 3- === S 4O 62- + 3I - (2) 此反应几乎是瞬间完成,(1)反应比(2)反应慢得多。因此,反应(1)生成的I 3-立即与S 2O 32-反应,生成无色S 4O 62-和I -,而观察不到碘与淀粉呈现的特征蓝色。当S 2O 32-消耗尽,(2)反应不进行,(1)反应还在进行,则生成的I 3-遇淀粉呈蓝色。 从反应开始到溶液出现蓝色这一段时间△t 里,S 2O 32-浓度的改变值为: )O S )O S )O S O S c c c c 始始终(((23 223 223 223 2][----=--=? 再从(1)和(2)反应对比,则得:
《基础化学Ⅱ》复习题 一、选择题 1、下列有机基团叫做异丁基的是() 2、将下列化合物按沸点降低的顺序排列正确的是() ①丁烷②己烷③3-甲基戊烷④2-甲基丁烷⑤2,3-二甲基丁烷 A ②>③>⑤>④>① B ③>②>⑤>④>① C ①>③>⑤>④>② D ②>③>④>⑤>① 3、下列碳正离子中,最稳定的是() A CH2=CH—CH2+ B CH3—CH2—CH2+ C CH3—CH+—CH3 D CH2=CH—CH+—CH3 4、结构CH3CH==C(CH3)2的烃中,下列哪种碳类型是不存在的() A 伯碳原子 B 仲碳原子 C 叔碳原子 D 季碳原子 5、下列各组物质中,用Br2/CCl4试剂不能加以区别的是() A 环丙烷和丙烷 B 环已烯和环已烷 C 1—丁炔和1—丁烯 D 苯和苯乙烯 6、分子式为C4H8化合物结构中,其中属于烯烃(包括顺反异构体)有() A 3种 B 4种 C 5种 D 6种 7、按照“次序规则”基团大小的比较方法,下列四种基团中,其中最大的是() A —OH B —CH2CH3 C —COOH D —NO2 8、正丁烷最稳定的构象是() 9、下列有机物结构中不存在顺反异构体的物质是() 10、(反)1,2—二甲基环己烷最稳定的构象是() 11、在室温下往下列化合物中加AgNO3醇溶液,即可生成沉淀的是() A氯苯B1-氯乙烷C苄氯D1-氯丙烯 12、下列化合物在AgNO3/C2H5OH体系中最不易生成沉淀的是() A CH3Cl B H2C=CH-Cl C CH3CH2Cl D CH2=CHCH2-X 13、下列关于卤代烃亲核取代反应历程特点描述,属于S N2反应的特点是() A 反应速率与碱的的浓度无关B反应分两步进行 C反应过程中生成活性中间体碳正离子D产物的构型完全转化 14、下列有机物发生硝化反应时,活性由强到弱顺序正确的是() A ①>②>③>④ B ④>③>②>① C ③>④>②>① D ①>②>④>③ 15、下列物质名称叫做(R)-2-溴丁烷的是() 16、根据休克尔规则,下列化合物具有芳香性的的是() 17、将下列化合物的沸点最高的是() A CH3CH2COOH B CH3CH2CH2OH C CH3CH2CHO D CH2CH2CH3
填空选择3 1、下列各组物质可能共存的是( A )。 A..Cu2+、Fe2+、Sn4+、Ag B. Cu2+、Fe2+、Ag+、Fe C Cu2+、Fe3+、Ag+、Fe D Fe3+、Fe2+、Sn4+、I- 2、通常配制FeSO4溶液时,加入少量铁钉,其原因与下列反应中的哪一个无关?(D) A.O2(aq)+4H+(aq)+4e==2H2O(l) B. Fe3+(aq)+e== Fe2+(aq) C. Fe(s)+2Fe3+(aq)==3 Fe2+(aq) D. Fe3+(aq)+3e== Fe(s) 3、已知Φ°(Fe3+/ Fe2+)=0.771V,K稳(Fe(CN)63-)=1.0×1042,K稳(Fe(CN)64-)=1.0×1035,则Φ°Fe(CN)63-/ Fe(CN)64-)=(A)。 A、0.36V B、1.19V C、-0.36V D、0.77V 4、若两电对在反应中电子转移分别为1和2,为使反应完成程度达到99.9%,两电对的条件电势之差ΔΦ°至少应大于(B)。 A、0.09V B、0.27V C、0.36V D、0.18V 5、影响氧化还原反应方向的因素有( B )。 A、压力 B、温度 C、离子强度 D、催化剂 6、在1 mol·L-1 H2SO4介质中,Φ°(Ce4+/ Ce3+)=1.44VΦ°,(Fe3+/ Fe2+)=0.65V,以Ce4+滴定Fe2+时,最适宜的指示剂为(B)。 A、二苯胺碘酸纳[Φ°(In)=0.84V] B、邻二氮菲-亚铁[Φ°(In)=1.06V] C、硝基邻二氮菲-亚铁[Φ°(In)=1.25V] D、邻苯氨基苯甲酸[Φ°(In)=0.89V] 7、用K2Cr2O7法测定Fe时,若SnCl2量加入不足,则导致测定结果(B)。 A、偏高 B、偏低 C、不变 D、无法判断 8、碘量法要求在中性或弱酸性介质中进行滴定,若酸度太高,将会(D)。 A、反应不定量 B、I2易挥发 C、终点不明显 D、I-被氧化,Na2S2O3被分解 9、标定Na2S2O3的基准物是下述哪一种?( B ) A、H2C2O4·H2O B、K2Cr2O7 C、As2O3 D、Fe 10、用KMnO4滴定Fe2+之前,加入几滴MnSO4的作用是( A )。 A、催化剂 B、诱导反应剂 C、氧化剂 D、配合剂 11、用法扬司法测定Cl-时,用曙红为指示剂,分析结果会(B)。 A、偏高 B、偏低 C、准确 12、在PH=4时,用莫尔法测定Cl-时,分析结果会(A)。 A、偏高 B、偏低 C、准确 13、化合物Ag2CrO4在0.001 mol·L-1的AgNO3溶液中的溶解度比在0.001 mol·L-1的K CrO4液中的溶解度( B )。 A、较大 B、较小 C、一样 14、常温下,AgCl的溶度积为1.8×10-10,Ag2CrO4的溶度积为1.1×10-12,,CaF2的溶度积为 2.7×10-11,(1)三种物质中溶解度最大的是(C),(2)三种物质中溶解度最小的是(A) A、AgCl B、Ag2CrO4 C、CaF2 15、在沉淀形成过程中,与待测离子的半径相近的杂质离子常与待测离子一道与构晶离子形成( B )。 A、吸留形成 B、混晶形成 C、包藏形成 D、后形成 16、将黄铁矿分解后,其中的硫沉淀为BaSO4,若以BaSO4的量换算黄铁矿中FeS2的铁量,则换算因素为(C)。 A、2M(FeS2)/M(BaSO4) B、M(FeS2)/M(BaSO4) C、M(FeS2)/2M(BaSO4)
第二章稀溶液依数性练习题 一、是非题(共10题) 1. 溶液的沸点是指溶液沸腾温度不变时的温度。() 2. 溶液与纯溶剂相比沸点升高、凝固点降低是由于溶剂摩尔分数减小引起的。() 3. 等物质的量硝酸钾和碳酸钾分别加入等量的水中,该两溶液的蒸气压下降值相等。() 4. 凡是浓度相等的溶液都是等渗溶液。() 5. 溶液的蒸气压下降和沸点升高仅适用于难挥发的非电解质溶质,而凝固点降 低及渗透压则不受此限制。() 6. 电解质浓溶液也有依数性变化规律,但不符合拉乌尔定律的定量关系。() 7. 一定量的电解质加入纯水中,此溶液的沸点一定高于100℃,但无法定律计 算。() 8. 任何两种溶液用半透膜隔开,都有渗透现象发生。() 9. 分散质粒子大小在合适的范围内,高度分散在液体介质中就能形成稳定的溶 胶。() 10. AlCl 3、MgCl 2 、KCl三种电解质对负溶胶的聚沉值依次减小。() 二、选择题 ( 共11题 ) 1. 以下论述正确的是---------------------------------------------------------------------------() (A)饱和溶液一定是浓溶液 (B)甲醇是易挥发性液体,溶于水后水溶液凝固点不能降低 (C)强电解质溶液的活度系数皆小于1 (D)质量摩尔浓度数值不受温度变化 2. 已知乙醇和苯的密度分别为0.800 g·cm-3和0.900 g·cm-3,若将86.3cm3乙醇和901 cm3苯互溶, 则此溶液中乙醇的质量摩尔浓度为-----------------------------------------------------( ) (A) 1.52 mol·dm-3 (B) 1.67 mol·dm-3 (C) 1.71 mol·kg-1 (D) 1.85 mol·kg-1 3. 2.5 g 某聚合物溶于 100 cm3水中, 20℃时的渗透压为 100 Pa, 则该聚合物的相对分子质量是----------------------------------------------------------------------------------------------------( ) (A) 6.1×102 (B) 4.1×104 (C) 6.1×105 (D) 2.2×106 4. 1.0 mol·dm-3蔗糖的水溶液、1.0mol·dm-3乙醇的水溶液和 1.0 mol·dm-3乙醇的苯溶液, 这三种溶液具有相同的性质是-----------------------------------------------------------------( )