
课题:原电池
教学目标:
知识与技能:了解原电池的组成条件,工作原理
过程与方法:利用学生已有的知识储备进行原电池的教学
情感态度和价值取向:通过原电池原理的讲解,让学生深刻体会利弊结合的道理教学重点:原电池的工作原理
教学难点:依据工作原理设计原电池
教学方法、手段:多媒体、讲解、讨论
教学时数:二课时
板书设计:原电池
原电池
1、概念:
2、组成条件
3、工作原理
教学过程:
思考:
1、锌片和铜片插入稀硫酸的现象是什么?
2、锌片和铜片用导线连接后插入稀硫酸中,
现象是什么?
3、铜片为什么有气泡产生?
4、如何检验证明是那种情况?
5、电子流向如何?
6、该装置实现了怎样的能量转化?
把化学能直接转化为电能的装置——原电池
1、原电池的构成条件
①两极:
正极:较不活泼的金属或非金属(如石墨)
负极:较活泼的金属
②电解质溶液
③形成闭合回路
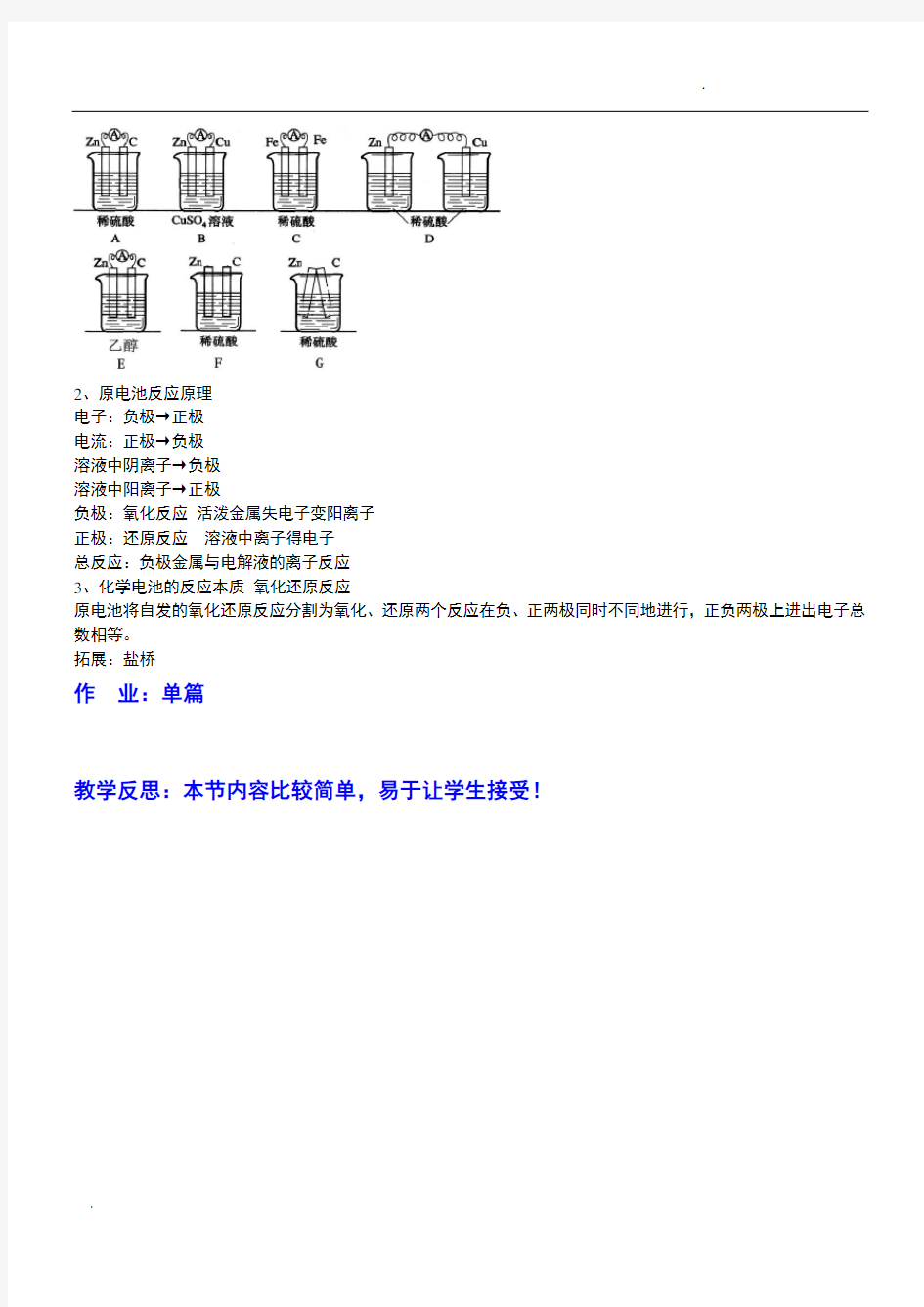
下列装置中属于原电池的是
2、原电池反应原理
电子:负极→正极
电流:正极→负极
溶液中阴离子→负极
溶液中阳离子→正极
负极:氧化反应活泼金属失电子变阳离子
正极:还原反应溶液中离子得电子
总反应:负极金属与电解液的离子反应
3、化学电池的反应本质氧化还原反应
原电池将自发的氧化还原反应分割为氧化、还原两个反应在负、正两极同时不同地进行,正负两极上进出电子总数相等。
拓展:盐桥
作业:单篇
教学反思:本节内容比较简单,易于让学生接受!
课题: 化学电源
教学目标:
知识与技能:了解各种电源
过程与方法: 通过学生的实际生活引入各种各样的化学电源
情感态度和价值取向:根据电池中的某些元素对环境的危害,让学生体会爱护环境 的重要性
教学重点:燃料电池电极反应式的书写 教学难点:燃料电池电极反应式的书写 教学方法、手段:多媒体、讲解、讨论 教学时数:一课时 板书设计: 化学电源
一、一次电池 二、二次电池 三、燃料电池
教学过程:
一、一次电池
放电之后不能充电(内部的氧化还原反应不可逆) 1、碱性锌锰电池
负极是Zn 、正极是MnO2 、电解质是KOH 负极:Zn +2OH --2e -=Zn(OH)2
正极:2MnO2+2H2O +2e -=2MnOOH +2OH - 总反应:2MnO2+2H2O +Zn =Zn(OH)2+2MnOOH 2、银锌纽扣电池
负极是Zn 、正极是Ag2O 、电解质是KOH 负极:Zn +2OH --2e -=ZnO+H2O 正极:Ag2O +H2O +2e -=2Ag +2OH - 总反应:Ag2O +Zn =ZnO +2Ag 二、二次电池
1、蓄电池放电过程工作原理
负极:Pb Pb -2e -+SO42- =PbSO4
正极:PbO2 PbO2 +2e - +SO42-+4H + =PbSO4 +2H2O 燃料
O 2
电解质
溶液
总反应:
Pb +PbO2 +2H2SO4 =2PbSO4 +2H2O
2、镍镉电池:负极:Cd 正极:NiO(OH) 电解质:KOH
镍镉电池应用:收录机、无线对讲机、电子闪光灯、电动剃须刀等
缺点:如不会回收会严重污染环境
3、锂电池:可充电的绿色电池
应用:常用在电话机、照相机、汽车、计算机等中,
此外在工业、医学、军事上也有广泛的应用。
三、燃料电池
1、燃料电池的构成
电解质溶液:
KOH等强碱、H2SO4等强酸、NaCl等盐溶液
电极材料:多孔性镍、铂
2、燃料电池的电极反应的书写
①先写总反应:燃料在氧气中的燃烧
若有CO2生成,且电解质为强碱时,
考虑CO2+2OH—=CO32—+H2O
②再写正极反应:O2+2H2O+4e-=4OH-
O2+4H++4e-=2H2O
③最后写负极反应:总反应减去正极反应
常见燃料:H2、NH3、CO、CH4、CH3OH等
作业:单篇
教学反思:化学电源作为学生了解的内容比较容易接受,但是对于燃料电池的反应原理和电极反应式的书写是本节的难点,需要重点讲解!
课题:电解池
教学目标:
知识与技能:了解电解池的构造及反应原理,并能应用原理处理简单的计算
过程与方法:在方法上,帮助学生学会用比较、归纳的方法将一些具体事物抽象化,以突出它们的内在联系和区别
情感态度和价值取向:在教学理念上,要让学生在学习过程中变被动为主动,促使学生的思维活动活跃起来
教学重点:电极反应和电极反应式的书写
教学难点:电解原理的应用
教学方法、手段:多媒体、讲解、讨论
教学时数:二课时
板书设计:电解池
一、电解原理
1、构成条件
2、反应原理
二、电解原理的应用
1、氯碱工业
2、电镀
3、电冶金
教学过程:
一、电解原理
1、电解池的构成条件
把电能转变为化学能的装置,又叫电解池
①两极阴极:与电源负极相连
阳极:与电源正极相连
两极材料可同可不同
石墨、Au 或Pt作为电极时称惰性电极
②电解质溶液
③形成闭合回路
④直流电源
2、电解池的反应原理(阳氧阴还)
电子:负极→阴极阳极→正极
电流:正极→阳极阴极→负极
溶液中阴离子→阳极溶液中阳离子→阴极
阳极:氧化反应电极金属或溶液阴离子失电子
阴极:还原反应溶液阳离子得电子变单质
总反应:阴阳极反应相加
3、电解池中离子放电顺序
①阳极:金属要求活动性Ag以前
金属>S2->I->Br->Cl->OH->含氧酸根>F-
②阳极:
Ag+>Hg2+>Fe3+>Cu2+>H+>
Pb2+>Sn2+>Fe2+>Zn2+>H+>较大浓度时先于H+放电
4、电解反应的书写
①找出溶液中所有离子
②按放电顺序写出阴阳极反应
③加和得到总反应
若H+、OH-由水电离
则总反应中需将其变成H2O
二、电解原理的应用
1、电解饱和食盐水制烧碱、氯气、氢气
工业上用电解饱和食盐水溶液的方法来制取NaOH、Cl2和H2,并以它们为原料生产一系列化工产品,称为氯碱工业
阳:2Cl-—2e-=Cl2↑
阴:2H++2e-=H2 ↑
总:2NaCl+2H2O = 2NaOH + H2↑+Cl2↑
2、电镀
①定义:是利用电解原理在某些金属表面镀上一薄层其他金属或合金的过程
②装置
阳极:镀层金属(与电源正极相连)
阴极:待镀金属制品(与电源负极相连)
电镀液:含镀层金属离子的溶液
③电极反应
阳极:(镀层)M —ne—= Mn+
阴极:(待镀)Mn++ne—=M
3、电冶金
①对象:钠、钙、镁、铝这样的活泼金属
②电解液:熔融的态电解质
③实例:2NaCl (熔融) ===== 2Na+Cl2↑
2Al2O3 (熔融) ==== 4Al+3O2↑
不能用AlCl3代替Al2O3 冰晶石用来降低Al2O3熔点
作业:
教学反思:
课题:金属的电化学腐蚀与防护
教学目标:
知识与技能:知道金属腐蚀的两种类型,能解释金属发生电化学腐蚀的原因
过程与方法:从实验探究过程中提高对实验现象的观察能力和分析能力
情感态度和价值取向:通过金属腐蚀和生产、生活实际相联系的内容,增强学生学
习兴趣
教学重点:金属的电化学腐蚀与防护
教学难点:析氢腐蚀、吸氧腐蚀
教学方法、手段:多媒体、讲解、讨论
教学时数:二课时
板书设计:金属的电化学腐蚀与防护
一、金属的电化学腐蚀
1、金属腐蚀
2、金属的电化学腐蚀
二、金属的电化学腐蚀
1、牺牲阳极法
2、外加电流法
教学过程: