
锂离子电池电解液添加剂物性数据
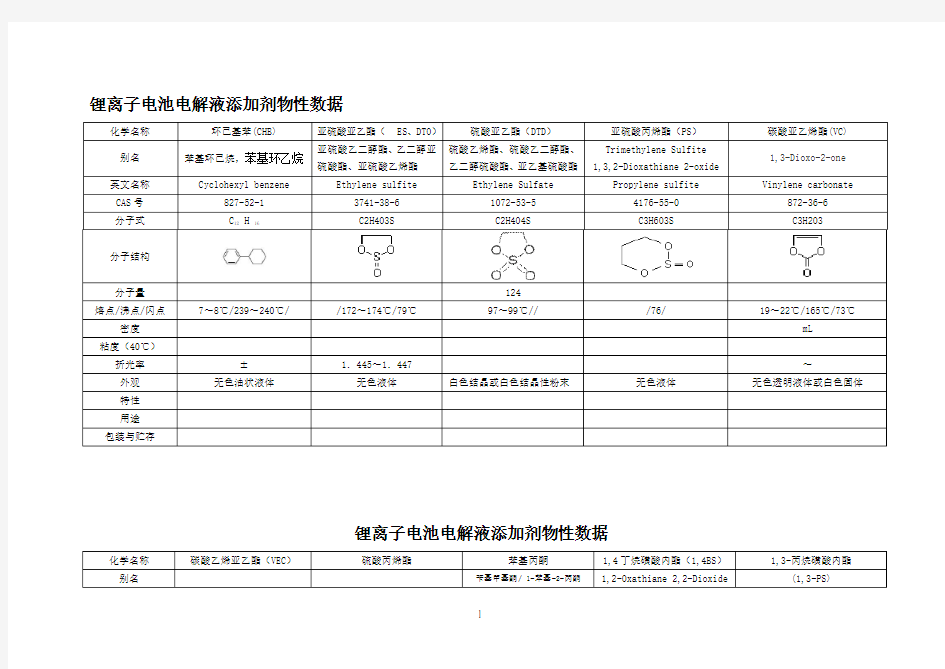
化学名称环己基苯(CHB)亚硫酸亚乙酯(ES、DTO)硫酸亚乙酯(DTD)亚硫酸丙烯酯(PS)碳酸亚乙烯酯(VC)
别名苯基环己烷,苯基环乙烷亚硫酸乙二醇酯、乙二醇亚
硫酸酯、亚硫酸乙烯酯
硫酸乙烯酯、硫酸乙二醇酯、
乙二醇硫酸酯、亚乙基硫酸酯
Trimethylene Sulfite
1,3,2-Dioxathiane 2-oxide
1,3-Dioxo-2-one
英文名称Cyclohexyl benzene Ethylene sulfite Ethylene Sulfate Propylene sulfite Vinylene carbonate CAS号827-52-13741-38-61072-53-54176-55-0872-36-6分子式C12 H 16C2H4O3S C2H4O4S C3H6O3S C3H2O3
分子结构
分子量124
熔点/沸点/闪点7~8℃/239~240℃//172~174℃/79℃97~99℃///76/19~22℃/165℃/73℃密度mL
粘度(40℃)
折光率±1.445~1.447~外观无色油状液体无色液体白色结晶或白色结晶性粉末无色液体无色透明液体或白色固体特性
用途
包装与贮存
锂离子电池电解液添加剂物性数据
化学名称碳酸乙烯亚乙酯(VEC)硫酸丙烯酯苯基丙酮1,4丁烷磺酸内酯(1,4BS)1,3-丙烷磺酸内酯别名苄基甲基酮/ 1-苯基-2-丙酮1,2-Oxathiane 2,2-Dioxide(1,3-PS)
1
英文名称Vinyl Ethylene Carbonate Trimethylene Sulfite Phenylacetone/
1-Phenyl-2-acetone
1,4-丁基磺酸内酯,
1,4-Butane sultone
1,3-Propanesultone;
1,2-Oxathiolane, 2,2-dioxide
CAS号4427-96-7 1073-05-8103-79-71633-83-61120-71-4分子式C5H6O3 C3H6O4S C9H10O C4H8O3S CHSO
分子结构
分子量
熔点/沸点/闪点/237℃/733mmHg/206 oF58~62℃//-15℃/216o C/86~87o C ~
密度(20o C )
粘度(40℃)14/153/146 °C (17mmHg)凝固点:≥℃折光率折射率折光率±(折光率/40℃)外观无色液体白色固体黄色油状液体/无色液体无色至浅黄色液体无色至淡黄色液体或针状结晶特性能与多种有机溶剂混溶,不溶于水
用途
包装与贮存德国RASCHIG生产
1
锂离子电池电解液添加剂物性数据
化学名称4-甲基硫酸亚乙酯4-甲基亚硫酸亚乙酯二乙基(氰基甲基)膦酸酯N,N-二甲基甲酰胺DMF甲烷二磺酸亚甲酯
别名4-甲基硫酸乙烯酯DECP N-甲酰二甲胺,DMFA Cyclic disulfonic ester
英文名称N,N-Dimethylformamide;
Formdimethylamide
1,5,2,4-dioxadithiane-2,2,4,4-tet
raoxide
CAS号5689-83-81469-73-468-12-299591-74-9分子式C3 H 6 O 4 S C3 H 6 O 3 S C3H7NO/HCON(CH3)2C2H4O6S2
分子结构
分子量
熔点/沸点/闪点(50 ℃ /1mmHg)//(40 ℃ /5mmHg)//-61 /153 /58 146~℃//密度
粘度(40℃)40811-14-1/40811-15-2
折光率~
外观比旋光度 º
特性
用途含磷阻燃添加剂二甲基甲酰胺(DMF)作为重要的
化工原料以及性能优良的溶剂。
用作溶剂,具有很强的溶解能力,
属极性惰性溶剂,能够溶解聚氨酯、
聚丙烯腈、聚氯乙烯等,对铁和软
钢没有腐蚀性,但钢和铝会使溶剂
变色。还可用作底涂剂。
包装与贮存
锂离子电池电解液添加剂物性数据
1
化学名称三(三甲基硅烷)亚磷酸酯三(三甲基硅烷)硼酸酯4-甲基亚硫酸乙烯酯亚硫酸丁烯酯N,N'-二甲基三氟乙酰胺别名TMSB4-甲基亚硫酸亚乙酯BS DTA
英文名称
CAS号1795-31-94325-85-31469-73-44426-51-11547-87-1
分子式[(CH3)3SiO]3P C9H27PSi3O3[(CH3)3SiO]3B C3H6O3S C4H8O3S C4H6F3NO
分子结构
分子量278.38136.17141.09
熔点/沸点/闪点~~~
/184/109℉44~45℃/4mmHg-42℃/132℃/
密度ml at 25℃(lit.)(sigma) 0.8311.23
粘度(40℃)
折光率比旋光度o外观
特性
用途
包装与贮存
1
锂离子电池电解液添加剂物性数据
化学名称三(三甲基硅烷)磷酸酯2,2-二苯丙烷4-甲基硫酸乙烯酯BP(联苯)二环己基碳二亚胺(DCC)别名TMSP2,2-DPP聯苯苯基苯;联苯;联二苯N,N'-二环己基碳二亚胺英文名称Tris(trimethylsilyl)phosphate2,2-diphenylpropane Propane 1,2-Cyclic suefate Biphenyl N,N'-dicyclohexylcarbodiimide CAS号10497-05-9778-22-35689-83-892-52-4538-75-0分子式[(CH3)3SiO]3P(O)(CH3)2C(C6H5)2C3H6O4S C12H10C13H22N2
分子结构
分子量314.54196.29138.14
熔点/沸点/闪
点
3~7℃/(228~229℃/720mmHg)/26~28℃/282℃//50℃/1mmHg/70~71℃/℃24/122/113密度0.992(d20)
粘度(40℃)
折光率折射率(n20)
外观H—NMR(C6D6):δ(27H) 淡黄色液体白色或略带黄色鳞片状结晶,
具备独特的香味
白色有气味的晶体
特性Moisture and Air Sensitive 不溶于水、酸及碱,溶于醇、
醚、苯等有机溶剂。化学性质
与苯相似,可被氯化、硝化、
碘化和氢化
可溶于二氯甲烷、四氢呋喃、乙腈
和二甲基甲酰胺,但不溶于水
用途
bp=78~81℃
/8mmHg(lit.)(sigma) , 90~
92/20mmHg 83~84/16mmHg ;
73℃/10mmHg ,℃ /18mmHg
锂离子电池电解液添加剂,可以起
防护过充作用。
锂离子电池电解液添加剂,有机合成
中间体,药物中间体等。
BP(联苯)和CHB(环己基苯)
在过充时,在电解液氧化前发
生电聚合,起到防过充作用
包装与贮存包装材料为PE包装材料为PE包装材料为PE
1
锂离子电池电解液添加剂物性数据
化学名称氟代碳酸乙烯酯 (F-EC)氯代碳酸乙烯酯二氯代碳酸乙烯酯碳酸亚乙烯酯别名4-Fluoro-1,3-dioxolan-2-one4-氯-1,3-二氧五环-2-酮
英文名称Fluoroethylene carbonate
1,3-Dioxolane,
4,5-dichloro-2-oxo-
Vinylene carbonate;
1,3-Dioxo-2-one
CAS号11 4435-02-83967-54-23967-55-3872-36-6分子式C3H3FO3C3H3ClO3C3H2Cl2O3C3H2O3
分子结构
分子量
熔点/沸点/闪点19 ~20 ℃/210 ℃/122℃(18 mmHg)/ >110 ℃/184/109℉19~22/162/73密度
粘度(40℃)
折光率~
外观无色透明液体通常为无色透明液体,冬季为固体
特性易吸水易吸水,水溶性 G/100 ML
用途主要的锂离子电池电解液添加剂,形成
SEI膜的性能更好,形成紧密结构层但又
不增加阻抗,能阻止电解液进一步分解,
提高电解液的低温性能和循环寿命。
合成锂离子电池电解液添加剂的中间
锂电池化学品
锂离子电池电解液添加剂
包装与贮存带快接头不锈钢桶。必须保存在干燥的
环境中,并充氮气体加以保护。
忖塑钢桶或塑料桶。须使用氮气密闭保护,
储存在通风干燥处
带快接头的不锈钢桶包装。须
用氮气密闭保护,储存在通风
干燥处。
1
一.电池常规知识 目录 1.什么是电池? 2.一次电池和二次电池有什么区别? 3、充电电池是怎样实现它的能量转换? 4、什么是Li-ion电池? 5、Li-ion电池的工作原理? 6、Li-ion电池的主要结构。 7、Li-ion电池的优缺点。 8、Li-ion电池安全特性是如何实现的? 9、什么是充电限制电压?额定容量?额定电压?终止电压? 10、Li-ion铝壳和钢壳电池比较它的区别有哪些? 11、目前常见的各种可充电电池之间有什么区别? 1、什么是电池? 电池是一种能源。当它正负极连接在用电器上时,因为正负极之间存在电势之差,电流从正极流向负极,储存在电池中的化学能直接转化成电能释放出来,一只电池必然由两种不同电化学活性的物质组成正负两极,正负极活性物质之间的电动势差形成电池的电压,根据其电化学系统的不同,各种类型的电池
电压各有不同。 2、一次电池和充电电池有什么区别? ?电池内部的电化学设计决定了该类型的电池是否可充。根据它 们的电化学成分和电极的结构可知,可充电电池的内部结构之 间所发生的反应是可逆的。 ?理论上,这种可逆性是不会受循环次数的影响,既然充放电会 在电极的体积和结构上引起可逆的变化,那么可充电电池的内 部设计就支持这种变化。而一次电池在给定的电池环境中两个 电极之间的电化学反应是不可逆的,因此,不可以将一次电池 拿来充电,这种做法很危险也很不经济。如果需要反复使用, 应选择真正的循环次数在1000次左右的充电电池,这种电池又 称为二次电池。 ?另一明显的区别就是它们具有较高的比能量和负载能力,以及 自放电率。一次电池能量密度远比一次电池高。然而他们的负 载能力相对要小。 ?二次电池具有相对较高的负载能力,可充电电池Li-ion,随着 近几年的发展,具有高能量容量。 ?不管何种一次电池的电化学系统属于哪种,所有的一次电池的 自放电率都很小。 3、充电电池是怎样实现它的能量转换? ?每种电池都具有电化学转换的能力,即将储存的化学能直接转 换成电能。就二次电池而言(另一术语也称可充电便携式电池),
锂离子电池电解液 1 锂离子电解液概况 电解液是锂离子电池四大关键材料(正极、负极、隔膜、电解液)之一,号称锂离子电池的“血液”,在电池中正负极之间起到传导电子的作用,是锂离子电池获得高电压、高比能等优点的保证。电解液一般由高纯度的有机溶剂、电解质锂盐(六氟磷酸锂,LiFL6)、必要的添加剂等原料,在一定条件下,按一定比例配制而成的。 有机溶剂是电解液的主体部分,与电解液的性能密切相关,一般用高介电常数溶剂与低粘度溶剂混合使用;常用电解质锂盐有高氯酸锂、六氟磷酸锂、四氟硼酸锂等,但从成本、安全性等多方面考虑,六氟磷酸锂是商业化锂离子电池采用的主要电解质;添加剂的使用尚未商品化,但一直是有机电解液的研究热点之一。 自1991年锂离子电池电解液开发成功,锂离子电池很快进入了笔记本电脑、手机等电子信息产品市场,并且逐步占据主导地位。目前锂离子电池电解液产品技术也正处于进一步发展中。在锂离子电池电解液研究和生产方面,国际上从事锂离子电池专用电解液的研制与开发的公司主要集中在日本、德国、韩国、美国、加拿大等国,以日本的电解液发展最快,市场份额最大。 国内常用电解液体系有EC+DMC、EC+DEC、EC+DMC+EMC、EC+DMC+DEC等。不同的电解液的使用条件不同,与电池正负极的相容性不同,分解电压也不同。电解液组成为lmol/L LiPF6/EC+DMC+DEC+EMC,在性能上比普通电解液有更好的循环寿命、低温性能和安全性能,能有效减少气体产生,防止电池鼓胀。EC/DEC、EC/DMC电解液体系的分解电压分别是4.25V、5.10V。据Bellcore研究,LiPF6/EC+DMC与碳负极有良好的相容性,例如在Li x C6/LiMnO4电池中,以LiPF6/EC+DMC为电解液,室温下可稳定到4.9V,55℃可稳定到4.8V,其液相区为-20℃~130℃,突出优点是使用温度范围广,与碳负极的相容性好,安全指数高,有好的循环寿命与放电特性。
1、一次电池和充电电池有什么区别? 电池内部的电化学性决定了该类型的电池是否可充,根据它们的电化学成分和电极的结构可知,真正的可充电电池的内部结构之间所发生反应是可逆的。 理论上,这种可逆性是不会受循环次数的影响,既然充放电会在电极体积和结构上引起可逆的变化,那么可充电电池的内部设计必须支持这种变化,既然,一次电池仅做一放电,它内结构简单得多且不需要支持这种变化,因此,不可以将一次电池拿来充电,这种做法很危险也很不经济,如果需要反复使用,应有尽有选择真正的循环次数在1000次左右的充电电池,这种电池也可称为一次电池或蓄电池。 2、一次电池和二次电池还有其他的区别吗? 另一明显的区别就是它们能量和负载能力,以及自放电率,二次电池能量远比一次电池高,然而他们的负载能力相对要小。 3、可充电便携式电池的优缺点是什么? 充电电池寿命较长,可循环1000次以上,虽然价格比干电池贵,但如果经常使用的话,是比较划算的。充电电池的容量比同规格的碱锰电池或锌碳电池低,比如,他们放电较快。 另一缺点是由于他们几近恒定的放电电压,很难预测放电何时结束。当放电结束时,电池电压会突然降低。假如在照相机上使用,突然电池放完了电,就不得不终止。 但另一方面可充电电池能提供的容量比太部分一次电池高。 但Li-ion电池却可被广泛地用照相器材中,因为它容量高,能量密度大,以及随放电深度的增加而逐渐降低的放电电压。 4、充电电池是怎样实现它的能量转换? 每种电池都具有电化学转换的能力,即将储存的化学能直接转换成电能,就二次电子(也叫蓄电池)而言(另一术语也称可充电使携式电池),在放电过程中,是将化学能转换成电能;而在充电过程中,又将电能重新转换成化学能。这样的过程根据电化学系统不同,一般可充放电500次以上,而我司产品li-ion可重复充放电1000次以上。Li-ion是一种新型的可充电便携式电池。它的额定电压为3.6V,它的放电电压会随放电的深度逐渐衰退,不象其他充电电池一样,在放电未,电压突然降低。 5、什么是Li-ion电池? Li-ion是锂电池发展而来。所以在介绍Li-ion之前,先介绍锂电池。举例来讲,以前照相机里用的扣式电池就属于锂电池。锂电池的正极材料是锂金属,负极是碳。当对电池进行充电时,电池的正极上有锂离子生成,生成的锂离子经过电解液运动到负极。而作为负极的碳呈层状结构,它有很多微孔,达到负极的锂离子就嵌入到碳层的微孔中,嵌入的锂离子越多,充电容量越高。同样,当对电池进行放电时(即我们使用电池的过程),嵌在负极碳层中的锂离子脱出,又运动回正极。回正极的锂离子越多,放电容量越高。我们通常所说的电池容量指的就是放电容量。在Li-ion的充放电过程中,锂离子处于从正极→负极→正极的运动状态。Li-ion就像一把摇椅,摇椅的两端为电池的两极,而锂离子就象运动员一样在摇椅来回奔跑。所以Li-ion又叫摇椅式电池。 6、Li-ion电池有哪几部分组成? (1)电池上下盖(2)正极——活性物质为氧化锂 钴(3)隔膜——一种特殊的复合膜
锂离子电池电解液简介 一、电解液概况 电解液是锂离子电池四大关键材料(正极、负极、隔膜、电解液)之一,号称锂离子电池的“血液”,在电池中正负极之间起到传导电子的作用,是锂离子电池获得高电压、高比能等优点的保证。电解液一般由高纯度的有机溶剂、电解质锂盐(六氟磷酸锂,LiFL6)、必要的添加剂等原料,在一定条件下,按一定比例配制而成的。 有机溶剂是电解液的主体部分,与电解液的性能密切相关,一般用高介电常数溶剂与低粘度溶剂混合使用;常用电解质锂盐有高氯酸锂、六氟磷酸锂、四氟硼酸锂等,但从成本、安全性等多方面考虑,六氟磷酸锂是商业化锂离子电池采用的主要电解质;添加剂的使用尚未商品化,但一直是有机电解液的研究热点之一。 二、电解液组成 2.1有机溶剂 有机溶剂是电解液的主体部分,电解液的性能与溶剂的性能密切相关。锂离子电池电解液中常用的溶剂有碳酸乙烯酯(EC)、碳酸二乙酯(DEC)、碳酸二甲酯(DMC)、碳酸甲乙酯(EMC)等,一般不使用碳酸丙烯酯(PC)、乙二醇二甲醚(DME)等主要用于锂一次电池的溶剂。PC用于二次电池,与锂离子电池的石墨负极相容性很差,充放电过程中,PC 在石墨负极表面发生分解,同时引起石墨层的剥落,造成电池的循环性能下降。但在EC 或EC+DMC复合电解液中能建立起稳定的SEI膜。通常认为,EC与一种链状碳酸酯的混合溶剂是锂离子电池优良的电解液,如EC+DMC、EC+DEC等。相同的电解质锂盐,如LiPF6或者LiC104,PC+DME体系对于中间相炭微球C-MCMB材料总是表现出最差的充放电性能(相对于EC+DEC、EC+DMC体系)。但并不绝对,当PC与相关的添加剂用于锂离子电池,有利于提高电池的低温性能。 2.2 电解质锂盐 LiPF6是最常用的电解质锂盐,是未来锂盐发展的方向。尽管实验室里也有用LiClO4,、LiAsF6等作电解质,但因为使用LiC104 的电池高温性能不好,再加之LiCl04本身受撞击容易爆炸,又是一种强氧化剂,用于电池中安全性不好,不适合锂离子电池的工业化大规模使用。 2.3添加剂 添加剂的种类繁多,不同的锂离子电池生产厂家对电池的用途、性能要求不一,所选择的添加剂的侧重点也存在差异。一般来说,所用的添加剂主要有三方面的作用: (1)改善SEI膜的性能 (2)降低电解液中的微量水和HF酸 (3)防止过充电、过放电 三、锂离子电池电解液种类 3.1液体电解液 电解质的选用对锂离子电池的性能影响非常大,它必须是化学稳定性能好尤其是在
邵 将等:纺织陶瓷基复合材料力学性能研究进展· 123 · 第35卷第1期 锂离子电池固态聚合物电解质研究进展 唐子龙1,胡林峰1,张中太1,粟付芃2 (1. 清华大学材料科学与工程系,新型陶瓷与精细工艺国家重点实验室,北京 100084; 2. 北京城建天宁耐火有限责任公司,北京 100053) 摘要:电解质是制备高功率密度和高能量密度、长循环寿命的锂离子电池的重要材料之一,而聚合物电解质是实现全固态锂离子电池的关键技术。总结近几年来为提高聚合物电解质电导率所作研究的新进展,并提出了今后的研究方向。 关键词:固态聚合物电解质;离子电导率;锂离子二次电池 中图分类号:TQ172 文献标识码:A 文章编号:0454–5648(2007)01–0123–06 RESEARCH PROGRESS OF SOILD POLYMER ELECTROLYTES FOR LITHIUM ION BATTERIES TANG Zilong1,HU Linfeng1,ZHANG Zhongtai1,SU Fupeng2 (1. State Key Laboratory of New Ceramics and Fine Processing, Department of Materials Science and Engineering, Tsinghua University, Beijing 100084; 2. Beijing Urban Construction Tianning Fire Protection Co., LTD., Beijing 100053, China) Abstract: Electrolytes are a key material for developing lithium ion batteries with high power and energy density and a long life cycle. Polymer electrolytes are one of the most important materials used in solid state lithium ion batteries. This paper presents a review of new progress in recent years in research to enhance the ionic conductivity of polymer electrolytes. The trend of this development is also reviewed. Key words: soild polymer electrolyte; ionic conductivity; lithium secondary battery Since the lithium secondary battery was first pro-duced by the Sony Corporation in 1990, Lithium secon-dary batteries have rapidly taken over the whole market in high performance rechargeable batteries.[1] Lithium ion secondary batteries are widely used in the electronic prod-ucts, such as mobile telephones, notebook personal com-puters (PCs), and digital cameras. Lithium ion batteries, which have high energy density and safe performance, also have excellent prospects for application in the fields of electric vehicles (EV), hybrid electric vehicles (HEV), aviation technology and high energy storage apparatuses.[2] Compared with other batteries, lithium ion batter-ies have many advantages, such as high discharge volt-age and energy density, good cyclability and no envi-ronment pollution. A schematic diagram of a lithium secondary battery is shown in Fig.1. As the public’s awareness of environmental protection has awakened, research on new green lithium batteries has grown. Electrolytes are the key component for lithium ion bat-teries. However, the application of liquid electrolytes is limited by unsatisfactory safety and cyclability and bad thermodynamic stability. In general, solid polymer elec-trolytes (SPEs) have the advantages such as no leakage of electrolytes, low density, safety, and ease of production. There has been increasing interest in the development of polymer electrolytes in recent years, which indicates the development direction of lithium battery electrolytes. Since Fenton et al. [3] found that the complex of polyenthylene oxide (PEO) and alkaline salts had the property of ionic conductivity in 1973, there has been much research on solid-state lithium-ion electrolytes. In 1979, Armand reported that PEO-LiX based electrolyte had a high ionic conductivity of 10–5 S/cm at temperatures between 40℃ to 60℃. [4] Moreover, it was easy to be prepared as a film, this aroused a worldwide interest in polymer electrolytes(PEs). PEs should have the following 收稿日期:2006–04–28。修改稿收到日期:2006–09–25。 基金项目:国家自然科学基金(50472005,50372033);清华大学基础研究基金(JC2003040)资助项目。 第一作者:唐子龙(1966~),男,副教授。Received date:2006–04–28. Approved date: 2006–09–25. First author: TANG Zilong (1966—), male, associate professor. E-mail: tzl@https://www.doczj.com/doc/ee5103613.html, 第35卷第1期2007年1月 硅酸盐学报 JOURNAL OF THE CHINESE CERAMIC SOCIETY Vol. 35,No. 1 January,2007
锂电池电解液特性 锂电池电解液是电池中离子传输的载体。一般由锂盐和有机溶剂组成。 基本信息 中文名称锂电池电解液 组成锂盐和有机溶剂 含义离子传输的载体 分类电池 锂电池电解液主要成分介绍 1.碳酸乙烯酯:分子式: C3H4O3 透明无色液体(>35℃),室温时为结晶固体。沸点:248℃/760mmHg , 243-244℃/740mmHg;闪点:160℃;密度:1.3218;折光率:1.4158(50℃);熔点:35-38℃;本品是聚丙烯腈、聚氯乙烯的良好溶剂。可用作纺织上的抽丝液;也可直接作为脱除酸性气体的溶剂及混凝土的添加剂;在医药上可用作制药的组分和原料;还可用作塑料发泡剂及合成润滑油的稳定剂;在电池工业上,可作为锂电池电解液的优良溶剂 2.碳酸丙烯酯分子式:C4H6O3 无色无气味,或淡黄色透明液体,溶于水和四氯化碳,与乙醚,丙酮,苯等混溶。是一种优良的极性溶剂。本产品主要用于高分子作业、气体分离工艺及电化学。特别是用来吸收天然气、石化厂合成氨原料其中的二氧化碳,还可用作增塑剂、纺丝溶剂、烯烃和芳烃萃取剂等。 毒理数据:动物实验经口服或皮肤接触均未发现中毒.大鼠经口LD50=2,9000 mg/kg. 本品应储存于阴凉、通风、干燥处,远离火源,按一般低毒化学品规定储运。 3.碳酸二乙酯分子式:CH3OCOOCH3 无色液体,稍有气味;蒸汽压1.33kPa/23.8℃;闪点25℃(可燃液体能挥发变成蒸气,跑入空气中。温度升高,挥发加快。当挥发的蒸气和空气的混合物与火源接触能
够闪出火花时,把这种短暂的燃烧过程叫做闪燃,把发生闪燃的最低温度叫做闪点。闪点越低,引起火灾的危险性越大。);熔点-43℃;沸点125.8℃;溶解性:不溶于水,可混溶于醇、酮、酯等多数有机溶剂;密度:相对密度(水=1)1.0;相对密度(空气=1)4.07;稳定性:稳定;危险标记7(易燃液体);主要用途:用作溶剂及用于有机合成 ①健康危害 侵入途径:吸入、食入、经皮吸收。 健康危害:本品为轻度刺激剂和麻醉剂。吸入后引起头痛、头昏、虚弱、恶心、呼吸困难等。液体或高浓度蒸气有刺激性。口服刺激胃肠道。皮肤长期反复接触有刺激性。 ②毒理学资料及环境行为 毒性:估计能通过胃肠道、皮肤和呼吸道进入机体表现为中等度毒性。刺激性比碳酸二甲酯大。 急性毒性:LD501570mg/kg(大鼠经口);人吸入20mg/L(蒸气)×10分钟,流泪及鼻粘膜刺激。 生殖毒性:仓鼠腹腔11.4mg/kg(孕鼠),有明显致畸胎作用。 危险特性:易燃,遇明火、高热有引起燃烧的危险。其蒸气比空气重,能在较低处扩散到相当远的地方,遇明火会引着回燃。 燃烧(分解)产物:一氧化碳、二氧化碳。 ③泄漏应急处理 迅速撤离泄漏污染区人员至安全区,并进行隔离,严格限制出入。切断火源。建议应急处理人员戴自给正压式呼吸器,穿消防防护服。尽可能切断泄漏源。防止进入下水道、排洪沟等限制性空间。小量泄漏:用或其它惰性材料吸收。也可以用不燃性分散剂制成的乳液刷洗,洗液稀释后放入废水系统。大量泄漏:构筑围堤或挖坑收容。用泡沫覆盖,降低蒸气灾害。用防爆泵转移至槽车或专用收集器内,回收或运至废物处理场所处置。 ④防护措施 呼吸系统防护:空气中浓度较高时,建议佩戴自吸过滤式防毒面具(半面罩)。 眼睛防护:戴安全防护眼镜。 身体防护:穿防静电工作服。
锂离子电池电解质添加剂(综述) 作者信息 摘要 这篇文章综述了应用在锂离子电池上面的电解质添加剂。根据添加剂的功能,他们可以分为六类:(1)固体电解质界面膜形成剂、(2)阴极保护剂、(3)六氟磷酸锂(LiPF6)盐稳定剂、(4)安全保护剂、(5)锂沉积剂、(6)其他(溶解增强剂、铝腐蚀抑制剂和润湿剂)。下面将说明和讨论每种分类添加剂的功能和机理。 关键词:电解质、添加剂、固体电解质表面膜、负荷过载、锂离子电池 目录 1. 引言 2.SEI 形成剂 2.1 SEI 形成介绍 2.2还原型添加剂 2.3反应型添加剂 2.4 SEI形貌修饰剂 3.阴极保护剂 4.LiPF6盐稳定剂 5.安全保护剂 5.1 过载保护剂 5.2阻燃添加剂 6.Li沉淀剂 7.其他 7.1 离子救助剂 7.2 Al防蚀剂 7.3 湿润剂和粘性稀释剂 8.总结 参考文献 1、引言 电解质添加剂的使用是提升锂离子电池性能最经济有效的方式之一。通常,无论从质量或是体积上来说,电解质中添加剂的量不超过5%,然而它的存在显著的提升了锂离子电池的循环能力和循环寿命。为了得到更好的电池性能,添加剂能够:1,促进固体电解质界面膜(SEI)在石墨表面的形成;2,在SEI膜的形成与长期循环过程中减少不可逆容量和气体的产生;3,增强LiPF6在有机电解质溶剂中的热稳定性;4,保护阴极材料不被溶解和过载;5,提升电解质的离子导电性、粘度、对聚烯烃分离器的湿润性等物理性质。为了电池的安全性,添加剂能够:1,降低有机电解质的可燃性;2,提供过载保护或提升过载限度;3,在非正常情况下终止电池的运作。本文总结了这些添加剂并讨论了他们在提升锂离子电池性能方面上的功能。
开题报告 应用化学 锂离子电池固态电解质制备及性能研究 一、选题的背景与意义 锂无机固态电解质(ion conductor)又称锂快离子导体(super ion conductor),按其晶体结构分为晶态电解质和非晶态电解质。晶态电解质又称导电陶瓷,目前已研究的有钙钛矿(ABO3)型结构锂离子电解质、NASICON型结构锂离子电解质、LISICON型结构锂离子电解质等;非晶态电解质又称玻璃态电解质,目前已研究的有氧化物玻璃态锂离子电解质、硫化物玻璃态锂离子电解质等[1-5]。其导电机制是,锂无机固态电解质具有载流子,在导电过程中伴随着Li+的迁移,并且导电能力跟温度有密切关系。图1.列举了部分重要的晶态和非晶态无机固态电解质的离子电导率[3]。 图1. 部分重要的晶态和非晶态无机固态电解质的离子电导率的Arrhenius曲线Fig. 1. Arrhenius plot of ionic conductivity of important crystalline and amorphous inorganic solid lithium ion conductor. NaA(PO)(A =Ge, Ti and Zr)发现于1968年。这个结构被描述成AO6 NASICON晶体结构IV 243 正八面体和PO4正四面体组成的共价键结构[A2P3O12]-,形成3D相互联系通道和两种分布导电离子间隙位置(M·和M··)。导电离子越过瓶颈从一个位置移动到另一个位置,瓶颈的大小取决于两种间隙位置(M·和M··)的骨架离子性质和载体浓度。结果是,NASICON类型化合物的结构和电化学性质随着骨架组成的不同而变化。比如,在化学通式为LiA’IV2-x A’’IV x(PO4)3的化合物,晶胞参数a 和 LiGe(PO)。通过三价阳离子(Al, Cr, Ga, Fe, c取决于A’IV和A’’IV阳离子大小。已获得的最小晶胞是 243 Sc, In, Lu, Y, La)取代八面体中的Ti4+位置,可以提高陶瓷的烧结性能,降低晶粒边界电阻,提高材
液态电解质对锂离子电池安全性能影响因素 摘要:锂离子电池的安全安全问题成为近年来制约其迅速发展的瓶颈。那么要如何才能解决其安全问题呢?本文从影响电池安全性能的因素出发,以液态电解质为例,从优化电解液的组成到使用特殊的添加剂等方面论述了液态电解质与电池安全问题的关系。 引言 锂离子电池由于具有能量密度高、输出电压高、循环寿命长、环境污染小等优点,在小型数码电子产品中获得了广泛应用,在电动汽车、航空航天等领域也具有广阔的应用前景。然而,近年来用于手机、数码相机和笔记本电脑中的锂离子电池爆炸伤人事件已经屡见不鲜,锂离子电池的安全问题引起人们广泛的关注。目前安全问题已成为制约锂离子电池向大型化、高能化方向发展的瓶颈。 一、引起锂离子电池安全问题的主要原因 1、电池系统的安全问题。锂离子电池作为一个系统,其安全问题主要源于滥用情况下热失控的发生。电池系统的热失控即为系统产生的热量大于释放的热量而导致热量积累,温度迅速升高的过程。锂离子电池发生热失控,主要是由电极和电解液间的化学反应引起的。 2、易燃的电解质。锂离子电池具有较高的能量密度,在于其较高的输出电压。在通常的正负极材料的工作电位下,水溶液难以稳定使用,所以锂离子电池电解液使用有机溶剂。而有机溶剂通常极易燃烧,特别是电解液中的线型碳酸酯具有较高的蒸气压和较低的闪点,使锂离子电池在安全性上背上了沉重的负担。 3、电池材料的热稳定性。锂离子电池安全性能的另一个更重要的方面即是其热稳定性。在一些滥用状态下,如高温、过充电、针刺穿透以及挤压等情况下,导致电极和有机电解液的强烈相互作用,如有机电解液的剧烈氧化、还原或正极分解产生的氧气进一步与有机电解液反应等,这些反应产生的大量热量如不能及时散失到周围环境中,必将导致热失控的产生,最终导致电池的燃烧、爆炸。 二、改善电池安全性能的途径 电池安全性能的改善主要途径有: 1、使电池系统更稳定,以避免热失控的发生; 2、使用更安全的电解液体系,即使热失控发生,也不会因为易燃电解质存在而导致电池燃烧或者爆炸。
锂离子电池电解液材料及生产工艺详解液体电解液生产工艺---流程图 电解液生产工艺---精馏和脱水 –对于使用的有机原料分别采取精馏或脱水处理以达到锂电池电解液使用标准。 –在精馏或脱水阶段,需要对有机溶剂检测的项目有:纯度、水分、总醇含量。
液体电解液生产工艺---产品罐 –在对有机溶剂完成精馏或脱水后,检测合格后经过管道进入产品罐、等待使用。 –根据电解液物料配比,在产品罐处通过电子计量准确称取有机溶剂。 –如果产品罐中的有机溶剂短时间未使用,需要再次对其进行纯度、水分、总醇含量的检测,继而根据生产的需要准确进入反应釜。 体电解液生产工艺---反应釜 –依据物料配比和加入先后顺序,有机溶剂依次加入反应釜充分搅拌、混匀,然后通过锂盐专用加料口或手套箱加入所需的锂盐和电解液添加剂。 –在加入物料开始到结束,应控制反应釜的搅拌速度、釜内温度等。不同的物料配比搅拌混匀的时间不同,但都必须使电解液混合均匀,此时对电解液检测的项目有:水分、电导率、色度、酸度 液体电解液生产工艺---灌装 –经检测合格的液体电解液被灌入合格的包装桶,充入氩气保护,最终进入仓库等待出厂。 –由于电解液自身的物理、化学性质等因素,入库的电解液应在短时间内使用,防止环境等因素导致电解液的变质 液体电解液---使用注意事项 –电解液桶有氩气保护,有一定压力,在使用中切勿拆卸气相阀头和液相阀头,也不允许随意按下快开接头的凸头,以免造成泄漏或其它危险。接管时一定要戴防护眼罩,使用时一定要使用专用快开接头
–检测合格的电解液建议一次性用完,开封的电解液很容易因为没有气氛保护等原因而变质,请客户在使用过程中注意及时充入氩气保护,防止变色电解液不建议使用玻璃器皿盛放,玻璃的主要成分是氧化硅,氧化硅和氢氟酸反应生成腐蚀性、易挥发的气体四氟化硅,此气体有毒会对人造成伤害 –现场可以使用的电解液容器和管道材料包括:不锈钢、塑料PP/PE、四氟乙烯等 –本产品对人体有害,有轻微刺激和麻醉作用。使用过程中避免身体直接接触 液体电解液的组成 –有机溶剂 –锂盐 –添加剂 有机溶剂---有机溶剂的选择标准 –有机溶剂对电极应该是惰性的,在电池的充放电过程中不与正负极发生电化学反应 –较高的介电常数和较小的黏度以使锂盐有足够高的溶解度,从而保证高的电导率 –熔点低、沸点高,从而使工作温度范围较宽 –与电极材料有较好的相容性,即电极能够在电解液中表现出优良的电化学性能 –电池循环效率、成本、环境因素等方面的考虑 液体电解液的组成---有机溶剂 –碳酸酯 –醚 –含硫有机溶剂
锂离子电池的电解质 目前使用和研究的电解质包括液态有机电解质?凝胶型聚合物电解质和全固态电解质?而商品化的锂离子电池多数使用液态有机电解质和凝胶型聚合物电解质?有机电解液是由有机溶剂和电解质锂盐组成的非水液体电解质?用于锂离子电池体系的液态有机电解质应满足以下要求: (1)锂离子电导率高,在较宽的温度范围内电导率在3×10-3~2×10-2S/cm; (2)电化学窗口宽,即在较宽的电压范围内稳定(对于锂离子电池而言,要稳定在4.5V)而不发生分解反应,即具有良好的氧化稳定性; (3)化学稳定性强,即与电池体系的电极材料如正极?负极?集流体?隔膜?胶黏剂等基本不发生反应; (4)在较宽的温度范围内保证成液态,一般温度范围为-40~ +70℃; (5)对离子具有较好的溶剂化性能; (6)没有毒性,蒸气压低,使用安全; (7)能尽量促进电极可逆反应的进行,与电极之间有良好的相容性;
(8)制备容易,成本低? (一)液体电解质 电解质的选用对锂离子电池的性能影响非常大,它必须是化学稳定性好尤其是在较高的电位下和较高温度环境中不易发生分解,具有较高的离子导电率( >10-3S/cm),而且正?负极材料必须是惰性的?不能腐蚀电极?由于锂离子电池充放电电位较高而且阳极材料嵌有化学活性较大的锂,所以电解质必须采用有机化合物而不能含有水?但有机物离子导电率都不好,所以要在有机溶剂中加入可溶解的导电盐以提高离子导电率? 目前锂离子电池主要是用液态电解质,其溶剂为无水有机物,如EC(ethylcarbonate)?PC(propylenecarbon-ate)? DMC(dimethylcarbonate)?DEC(diethylcarbonate),多数采用混合溶剂,如EC2DMC和PC2DMC等? 导电盐有LiClO4?LiPF6?LiBF6?LiAsF6和LiOSO2CF3,它们导电率大小依次为LiAsF6>LiPF6>LiClO4>LiBF6>LiOSO2CF3?LiClO4因具有较高的氧化性容易出现爆炸等安全性问题,一般只局限于实验研究中;LiAsF6离子导电率较高易纯化且稳定性较好,但含有有毒的As,使用受到限制;LiBF6化学及热稳定性不好且导电率不高;LiOSO2CF3导电率差且对电极有腐蚀作用,较少使用;虽然LiPF6会发生分解反应,但具有较高的离子导电率,因此目前锂离子电池基本上是使用LiPF6?目
锂离子电池电解液概况 电解液是锂离子电池四大关键材料(正极、负极、隔膜、电解液)之一,号称锂离子电池的“血液”,在电池中正负极之间起到传导电子的作用,是锂离子电池获得高电压、高比能等优点的保证。电解液一般由高纯度的有机溶剂、电解质锂盐(六氟磷酸锂,LiPF6)、必要的添加剂等原料,在一定条件下,按一定比例配制而成的。 表1:电解液材料组成 二、锂离子电池电解液种类 1、液体电解液 电解质的选用对锂离子电池的性能影响非常大,它必须是化学稳定性能好尤其是在较高的电位下和较高温度环境中不易发生分解,具有较高的离子导电率(>10- 3 s/cm ),而且对阴阳极材料必须是惰性的、不能侵腐它们。由于锂离子电池充放电电位较高而且阳极材料嵌有化学活性较大的锂,所以电解质必须采用有机化合物而不能含有水。但有机物离子导电率都不好,所以要在有机溶剂中加入可溶解的导电盐以提高离子导电率。目前锂离子电池主要是用液态电解质,其溶剂为无水有机物如EC(ethyl carbonate) 、PC (propylenecarbonate)、DMC(dimethyl carbonate)、DEC(diethyl carbonate),多数采用混合溶剂,如EC2DMC 和PC2DMC 等。导电盐有L iClO4、LiPF6、LiBF6、LiA sF6 和LiOSO2CF3,它们导电率大小依次为LiAsF6> LiPF6> LiClO4>LiBF6> LiOSO 2CF3。LiClO4因具有较高的氧化性容易出现爆炸等安全性问题,一般只局限于实验研究中;LiAsF6离子导电率较高易纯化且稳定性较好,但含有有毒的As,使用受到限制;LiBF6化学及热稳定性不好且导电率不高,LiO SO2CF3导电率差且对电极有腐蚀作用,较少使用;虽然LiPF6会发生分解反应,但具有较高的离子导电率,因此目前锂离子电池基本上是使用LiPF6。目前商用锂离子电池所用的电解液大部分采用LiPF6的EC2DMC,它具有较高的离子导电率与较好的电化学稳定性。
锂离子电池电解液概述 一、锂离子电池电解液 电解液是锂离子电池四大关键材料之一,号称锂离子电池的血液,是锂离子电池获得高压、高比能等优点的保证。电解液主要由高纯度有机溶剂、电解质锂盐、必要添加剂等原料,在一定条件下,按一定比例配制而成。 1.1有机溶剂 有机溶剂一般用高介电常数溶剂于低粘度溶剂混合使用。常用的电解质锂盐有高氯酸锂、六氟磷酸锂、四氟硼酸锂等,从成本、安全性等多方面考虑,六氟磷酸锂是商业化锂离子电池采用的主要电解质。 锂离子电池电解液中常用的有机溶剂有碳酸乙烯酯(EC)、碳酸二乙酯(DEC)、碳酸二甲酯(DMC)、碳酸甲乙酯(EMC)、碳酸丙烯酯(PC)、丙烯酸乙酯(EA)、丙烯酸甲酯(MA)等。有机溶剂在使用前必须严格控制质量,溶剂的纯度于稳定电压之间有密切联系,有机溶剂的水分,对于配制合格电解液起着决定作用。水分降低至10-6之下,能降低六氟磷酸锂的分解、减缓SEI膜的分解、防止气涨等。利用分子筛吸附、常压或减压蒸馏、通入惰性气体的方法,可以使水分含量达到要求。为了获得具有高离子导电性的溶液,以便锂离子在其中快速移动,溶剂一般采用混合材料,如碳酸乙烯酯(EC)+碳酸二甲酯(DMC),碳酸乙烯酯(EC)+碳酸二乙酯(DEC)。 1.2电解质锂盐 电解质锂盐占电解液成本最大,约占到电解液成本的40%左右。LiPF6是最常用的电解质锂盐,其对负极稳定,电导率高,放电容量大,内阻小,充放电速度快。但对水分和HF及其敏感,易发生反应,其操作应在干燥气氛(如手套箱)中进行,不耐高温,80℃~100℃发生分解反应,生成五氟化磷和氟化锂。从成本、安全性等多方面考虑,六氟磷酸锂具有突出的离子电导率、较优的氧化稳定性和较低的环境污染等优点,是目前首选的锂离子电池电解质,也是商业化锂离子电池采用的主要电解质。除此之外还有LiBF4、LiPF6、LiBOB、LiFSI、LiPF2、LiTDI等一系列安全性高、循环性能好的锂盐电解质体系得到关注。
高考必考题锂离子电池习题汇总 材料:锂离子电池实际上是一种锂离子浓差二次电池(充电电池),正负电极由两种不同的锂离子嵌入化合物组成。它主要依靠锂离子在正极和负极之间移动来工作。在充放电过程中,Li+在两个电极之间往返嵌入和脱嵌:充电时,Li+从正极脱嵌,经过电解质嵌入负极,负极处于富锂状态,正极处于贫锂态;放电时则相反,Li+从负极脱嵌,经过电解质嵌入正极,正极处于富锂态 在充放电过程中,负极材料的化学结构基本不变。因此,从充放电反应的可逆性看,锂离子电池反应是一种理想的可逆反应。目前,用作锂离子电池的正极材料是过渡金属和锰的离子嵌入化合物,负极材料是锂离子嵌入碳化合物,常用的碳材料有石油焦和石墨等。国内外已商品化的锂电池正极是LiCoO2,LiNiO2,LiMn2O2,负极是层状石墨 锂离子电池:锂系电池分为锂电池和锂离子电池。手机和笔记本电脑使用的都是锂离子电池,通常人们俗称其为锂电池,而真正的锂电池由于危险性大,很少应用于日常电子产品1、某可充电的锂离子电池以LiMn2O4为正极,嵌入锂的碳材料为负极,含Li+导电固体为电解质。放电时的电池反应为:Li+LiMn2O4=Li2Mn2O4。下列说法正确的是() A.放电时,LiMn2O4发生氧化反应B.放电时,正极反应为:Li++LiMn2O4+e-=Li2Mn2O4 C.充电时,LiMn2O4发生氧化反应D.充电时,阳极反应为:Li++e-=Li 2、(2014天津6)已知:锂离子电池的总反应为:LixC+Li(1-x)CoO2=C+LiCoO2锂硫电池的总反应为:2Li+S=Li2S 有关上述两种电池说法正确的是( ) A.锂离子电池放电时,Li+向负极迁移 B.锂硫电池充电时,锂电极发生还原反应 C.理论上两种电池的比能量相同 D.右图表示用锂离子电池给锂硫电池充电 3、天津是我国研发和生产锂离子电池的重要基地。锂离子电池正极材料是含锂的二氧化钻(LiCoO2),充电时LiCoO2中Li被氧化,Li+迁移并以原子形式嵌入电池负极材料碳(C6)中,以LiC6表示。电池反应为,下列说法正确的是()A.充电时,电池的负极反应为LiC6-e-Li+C6 B.放电时,电池的正极反应为CoO2+Li++e-LiCoO2 C.羧酸、醇等含活泼氢气的有机物可用作锂离子电池的电解质 D.锂离子电池的比能量(单位质量释放的能量)低
链状季铵盐类电解质 四氟硼酸四乙基铵盐( TEA-BF4 ): 优点电导率高、电化学稳定性好、制作成本低的优点。 缺点:TEA-BF4 因分子对称性较高,在极性溶剂中的溶解度不够大。 季铵盐四氟硼酸三乙基甲基铵盐( TEMA-BF4 ) 因不对称的分子结构,在溶剂中的溶解度高于TEA-BF4 ,且在同样的条件下,可 获得比TEABF4 更低的工作温度。 环状季铵盐类电解质 N-二烷基吡咯烷鎓盐、N-二烷基哌啶鎓盐:电化学稳定性好,电导率高。 N,N-二甲基吡咯烷鎓四氟硼酸盐、N,N-二乙基吡咯烷鎓四氟硼酸盐、N-甲基,N-乙基吡咯烷鎓四氟硼酸盐:与开环结构的季铵盐相当的电导率和电势窗口,且环状结构可增大在有机溶剂中的溶解度。电解液的浓度与电容器的工作电压成正比,浓度越高,工作电压越高; 电解液浓度的不同,还会导致凝固点的变化。 双吡咯烷螺环季铵盐( SBP-BF4 ) 具有螺环的分子结构,可在有机溶剂中获得更高的浓度和更稳定的电化学性能。 金属阳离子电解质 LiPF6 锂盐电解液在超级电容器循环的过程中会发生分解,不适用于超级电容器体系。
钠离子电池电解液用于超级电容器。 R. Vali 等[14]研究了NaClO4、NaPF6 和NaN( SO2 F)2 等 3 种钠盐溶于混合溶剂( EC、DMC、PC 和EA 的体积比为2∶2∶2∶1)后,用于碳电极超级电容器的情况。前两种钠盐电解液的耐电压都在 3. 2 V 以上,且在-40 ~60 ℃均可正常充放电。高温( 60 ℃) 、高压( 3 V) 浮充测试结果表明: NaPF6 的性能优于NaClO4 ,而NaN( SO2 F) 2 的性能最差,耐电压只有2. 5 V 离子液体具有很好的热稳定性和电化学稳定性,是近年 来研究的热点。无溶剂纯离子液体作为电解液,仍存在成本 高、黏度高和低温性能差等缺点。将含有醚键与不含醚键的一系列离子液体作对比,发现含有醚键的离子液体黏度和熔点更低,液态范围更大。用于超级电容器电解液时,在相同测试条件下,含有醚键的离子液体的比电容是不含醚键的两倍。 有机溶剂
锂电池基础知识讲解 理想的锂离子电池,除了锂离子在正负极之间嵌入和脱出外,不发生其他副反应,不出现锂离子的不可逆消耗。实际的锂离子电池,每时每刻都有副反应存在,也有不可逆的消耗,如电解液分解,活性物质溶解,金属锂沉积等,只不过程度不同而己。实际电池系统,每次循环中,任何能够产生或消耗锂离子或电子的副反应,都可能导致电池容量平衡的改变。一旦电池的容量平衡发生改变,这种改变就是不可逆的,并且可以通过多次循环进行累积,对电池性能产生严重影响。 ⑴正极材料的溶解 尖晶石LiMn2O4中Mn的溶解是引起LiMn2O4可逆容量衰减的主要原因,对于Mn的溶解机理,一般有两种解释:氧化还原机制和离子交换机制。氧化还原机制是指放电末期Mn3+的浓度高,在LiMn2O4表面的Mn+会发生歧化反应: 2Mn3+(固)Mn4+(固)+Mn2+(液) 歧化反应生成的二价锰离子溶于电解液。离子交换机制是指Li+和H+在尖晶石表面进行交换,最终形成没有电化学活性的HMn2O4。 Xia等的研究表明,锰的溶解所引起的容量损失占整个电池容量损失的比例随着温度的升高而明显增大(由常温下的23%增大到55℃时的34%)[14]。 ⑵正极材料的相变化[15] 锂离子电池中的相变有两类:一是锂离子正常脱嵌时电极材料发生的相变;二是过充电或过放电时电极材料发生的相变。 对于第一类相变,一般认为锂离子的正常脱嵌反应总是伴随着宿主结构摩尔体积的变化,同时在材料内部产生应力,从而引起宿主晶格发生变化,这些变化减少了颗粒间以及颗粒与电极间的电化学接触。 第二类相变是Jahn-Teller效应。Jahn-Teller效应是指由于锂离子的反复嵌入与脱嵌引起结构的膨胀与收缩,导致氧八面体偏离球对称性并成为变形的八面体构型。由于Jahn-Teller效应所导致的尖晶石结构不可逆转变,也是LiMn2O4容量衰减的主要原因之一。在深度放电时,Mn的平均化合价低于3.5V,尖晶石的结构由立方晶相向四方晶相转变。四方晶相对称性低且无序性强,使锂离子的脱嵌可逆程度降低,表现为正极材料可逆容量的衰减。 ⑶电解液的还原[15] 锂离子电池中常用的电解液主要包括由各种有机碳酸酯(如PC、EC、DMC、DEC 等)的混合物组成的溶剂以及由锂盐(如LiPF6 、LiClO4 、LiAsF6 等)组成的电解质。在充电的条件下,电解液对含碳电极具有不稳定性,故会发生还原反应。电解液还原消耗了电解质及其溶剂,对电池容量及循环寿命产生不良影响,由此产生的气体会增加电池的内部压力,对系统的安全造成威胁。 ⑷过充电造成的量损失[15] 负极锂的沉积:过充电时,发生锂离子在负极活性物质表面上的沉积。锂离子的沉积一方面造成可逆锂离子数目减少,另一方面沉积的锂金属极易与电解液中的溶剂或盐的分子发生反应,生成Li2CO3、LiF或其他物质,这些物质可以堵塞电极孔,最终导致容量损失和寿命下降。 电解液氧化:锂离子电池常用的电解液在过充电时容易分解形成不可溶的Li2CO3等产物,阻塞极孔并产生气体,这也会造成容量的损失,并产生安全隐患。 正极氧缺陷:高电压区正极LiMn2O4中有损失氧的趋势,这造成氧缺陷从而导致容量损失。 ⑸自放电 锂离子电池的自放电所导致的容量损失大部分是可逆的,只有一小部分是不可逆的。造成不可逆自放电的原因主要有:锂离子的损失(形成不可溶的Li2CO3等物质);电解液氧化产物堵塞电极微孔,造成内阻增大。