氨、硝酸和硫酸(课件PPT)
- 格式:ppt
- 大小:846.50 KB
- 文档页数:46


第四节氨硝酸硫酸课时1 氨气知识分层讲解学知识基础知识讲解敲黑板知识点 1 氨气【重点】1.氮的固定(1)氮元素的存在游离态:N2,占空气总体积的78%或总质量的75%。
氮元素化合态:硝酸盐等无机盐,蛋白质等有机物。
(2)氮的固定:将游离态的氮转变为氮的化合物叫做氮的固定。
【易错1】目前工业制取氨气的反应原理即人工固氮的反应。
2. 氨气的物理性质及喷泉实验(1)氨的物理性质①氨气是无色、有刺激性气味的气体。
②氨气的密度为0.771 g/L,比空气小;氨气极易溶于水,常温下,1体积水大约能溶解700体积NH3。
因此一般用向下排空气法收集氨气。
③氨气的沸点为-33.5℃,易液化,常用作制冷剂。
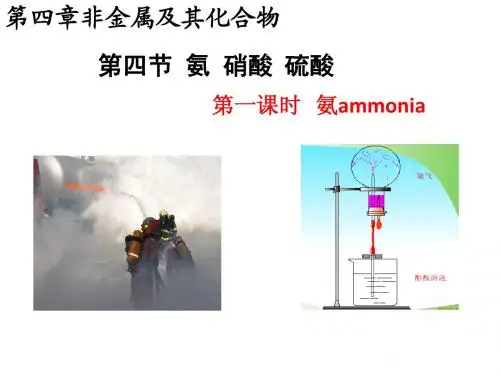
(2)氨气溶于水的喷泉实验示例1实验装置实验准备实验操作实验现象在干燥的圆底烧瓶中充满氨气,用带有玻璃管和滴管(滴管里预先吸入水)的塞子塞紧瓶口,倒置烧瓶,使玻璃管插入盛有水(含酚酞)的烧杯中打开橡胶管上的夹子,轻轻挤压滴管的胶头使少量水进入烧瓶。
烧杯中的溶液由玻璃管进入烧瓶,形成美丽的喷泉,烧瓶内液体颜色呈红色。
氮的循环【易错1】在判断氮的固定时,学生往往把由气态的含氮化合物转化为固态的含氮化合物的过程认为是氮的固定。
如:由氨气合成碳酸氢铵的过程。
喷泉划重点:氨气喷泉实验的解释①能形成喷泉说明氨气极易溶于水,使烧瓶内的压强迅速减小,烧杯内的水在大气压的作用下进入烧瓶;烧瓶内液体呈红色,说明氨气溶于水得到的溶液呈碱性。
②氨气喷泉实验成功的关键是:①装置气密性良好;②圆底烧瓶要干燥;③装置内气体的纯度要高。
3. 氨气的化学性质(1)氨与水的反应氨气溶于水时,大部分NH3与H2O反应生成一水合氨(NH3·H2O);常温下,一水合氨中有一小部分(约1%)电离成NH4+和OH-,所以氨水显弱碱性,发生反应的化学方程式为:NH3+H2O NH3·H2O、NH3·H2O NH4++OH-,或表示为:NH3+H2O NH3·H2O NH4++OH-。







氨硝酸硫酸(第一课时)学习目标:1.了解氨的物理性质,掌握喷泉实验,掌握氨的化学性质。
2.通过实验,培养学生的观察能力和分析问题、解决问题的能力。
重点难点:1、喷泉实验。
2、掌握氨的化学性质学习过程:1、氨气的物理性质颜色:气味:密度:水溶性:收集方法:(喷泉实验)观察思考:烧瓶内发生什么现象?氨气溶解只是一个物理过程吗?解释现象发生的原因。
描述现象;分组讨论现象发生的原因。
实验现象:现象解释:a、实验成功的关键?b、进一步阅读教材实验4-8,利用该实验装置完成喷泉实验时,叙述引发喷泉实验的步骤。
c、氨气的喷泉实验说明氨气具有那些性质?2、氨的化学性质a.氨气与水反应①写出氨气与水反应的化学方程式及NH3•H2O的电离方程式。
②氨气的水溶液叫氨水,氨水中存在那些微粒?分组讨论分子:离子:③氨水与液氨是同一种物质吗?为什么?④如何证明氨水中有OH-?用什么方法检验氨气的存在?分组讨论b、与酸反应解释现象发生的原因思考:将浓盐酸换成浓硝酸或浓硫酸还会看到白烟吗?为什么?分别写出NH3与硝酸和硫酸反应的化学方程式。
写完同位互批NH3+HClNH3+HNO3NH3+H2SO4c、氨催化氧化思考:氨中的氮元素的化合价价,从化合价的角度分析,氨还可能具有那些性质?能与那些物质反应?写出化学方程式3、氨气有哪些用途?4、怎样检验氨气?当堂检测:1、在1L1mol/L的氨水中()A、含有1mol NH3分子B、含NH3和NH4+之和为1molC、含1molNH3•H2OD、含NH3、NH3•H2O、NH4+之和为1mol2、下列气体易液化,遇挥发性酸冒白烟,而适宜作制冷剂的是()A. N2B. NH3C. NOD.NO23、在下面的装置中,烧瓶中充满干燥的气体a,将滴管中的液体b挤入烧瓶内,轻轻振荡烧瓶,然后打开弹簧夹f,烧杯中的液体c成喷泉状喷出,最终几乎充满烧瓶。
则a和b可能分别是表中的()A(干燥气体)B(液体)A NO2水B CO24mol/LNaOH溶液C Cl2 饱和NaCl溶液D NH3 1mol/L盐酸4、以空气和氢气为原料,写出工业生产硝酸的的化学方程式。
教师辅导讲义
溶解于水且溶解速度O
实验室其它简易的制氨气方法:①将浓氨水滴入固体烧碱或生石灰中;②加热浓氨水制氨气。
△
;NH4Cl
NaOH 。
的检验:取少量的铵盐,与强碱溶液共热,生成的气体能使湿润的色试纸变色,证明原
.金属与硝酸反应计算题的一般方法
在如下图的实验装置中,实验开始一段时间后,对看到的现象叙述不正确的是( )
胆矾晶体表面有“白斑”
小试管内有晶体析出
下列离子在溶液中因发生氧化还原反应而不能大量共存的是( )
B. Ag+、NO3-、Cl-、K+
的混合液分为两等份:一份加入b mol烧碱并加热,恰好把的溶液,使沉淀反应刚好完全进行,则NO3-的物质的量浓度是(
,C ,D
中所用的试剂只能从下列物质中选取:
①硝酸铵;②碳酸铵;③碳酸氢铵;④氯化铵;⑤熟石灰;⑥氢氧化钠。
中制取气体时只用了一种药品,则该药品可以是__________(填选项编号),在只用一种药品制取氨气时,____________(选填下列仪器编号,固定装置省略)。
三、氨硝酸(xiāo suān) 硫酸——氨教学(jiāo xué)目的1. 掌握(zhǎngwò)氨的物理(wùlǐ)、化学性质(huàxué xìngzhì),理解氨水显弱碱性。
2. 掌握氨气的实验室制法,铵根离子的检验。
3. 学会通过实验验证物质性质的方法。
教学重点氨的化学性质及铵根离子的检验。
教学难点氨的化学性质及铵根离子的检验。
教学时数1课时。
教学用品PPT浓氨水、浓盐酸、酚酞、碳酸氢铵、酒精灯、试管、试管夹、玻璃棒、红色石蕊试纸。
教学过程教学环节教师活动学生活动前面我们学习了氮的氧化物的性质,知道氮元素有多种可变价态,今天新课导入我们学习其最低价态的化合物——氨气的性质。
思考交流展示一瓶氨气,引导学生观察:1.氨气的色、味、态,根据其相对分子质量推导氨气的密度(与空气比较)。
2.设计怎样的实验可以证明氨气是否溶于水?观察实验,阅读教材P97。
总结氨的物理性质。
交流设计的实验方案。
归纳整理氨的物理性质:无色、刺激性气味的气体,易溶于水(1︰700)。
探究实验演示实验4.8。
回答上述思考与交流问题2。
问题提纲学习交流1.请描述实验现象。
2.讨论产生现象的原因。
3. 喷泉是如何形成的?胶头滴管的作用是什么?4.若要产生喷泉,应具备什么样的条件?5.通过氨的喷泉实验你对氨的性质有什么认识?烧杯内的水由玻璃管进入烧瓶内形成喷泉,烧瓶内溶液呈红色。
a.氨极易溶于水。
b.氨水显碱性。
原因:当滴管中的水挤入到烧瓶中时,烧瓶内的氨溶解,使瓶内压强小于大气压强。
空气将烧杯内的溶液压入到烧瓶,形成喷泉。
a.干燥的烧瓶;b.瓶内压强减小应用提高上述实验,如果没有胶头滴管,如何引发喷泉实验?你可否设计一个可以产生喷泉的其他装置?广开言论交流,同学之间评价方案的可行性。
老师给予肯定。
自学释疑阅读课本P97~99页有关内容,读完后,请向大家介绍你对氨气(NH3)这种物质的认识?阐释氨水显碱性的原因?阅读,讨论,交流。