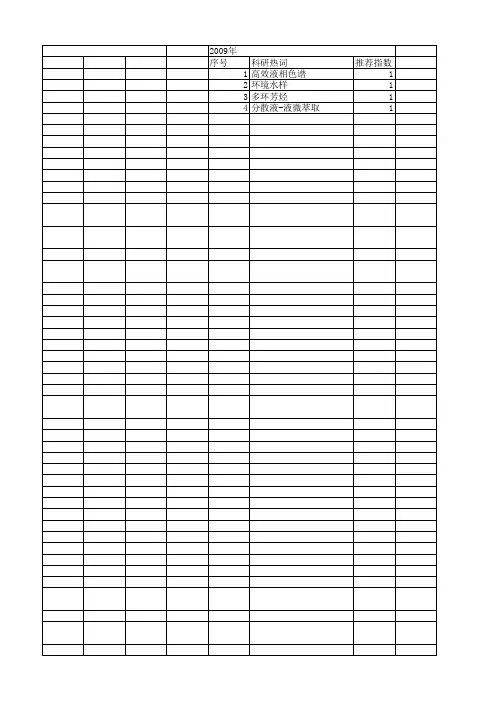
分散液相微萃取
- 格式:pdf
- 大小:274.69 KB
- 文档页数:2

●所谓的传统的样品预处理方法有哪些?各适用于什么情况?(1)浸提法(浸泡法):用于从固体混合物或有机体中提取某种物质,所选的提取剂应能大量溶解被提取的物质,同时不破坏其性质。
适用情况:适用于从固体或有机体中提取某种特定物质,如使用索氏抽提法提取脂肪。
特点:提取剂是关键因素,可以是单一溶剂或混合溶剂;为了提高溶解度,常采用加热的方法。
(2)溶剂萃取法:利用组分在两种互不相溶的试剂中分配系数的不同,使目标组分从一种溶液中转移至另一种溶剂中,从而与其他组分分离。
适用情况:适用于从溶液中提取某一组分,特别是当目标组分与溶液中的其他成分存在显著差异时。
特点:设备简单、操作迅速、分离效果好;但成批试样分析时工作量大,且萃取溶剂可能易挥发、易燃、有毒。
(3)沉淀分离法:利用沉淀反应进行分离,即向溶液中加入某种试剂,使其与溶液中的某些组分发生反应生成沉淀。
适用情况:适用于当溶液中某些组分之间存在显著化学差异时,通过沉淀反应将其分离。
(4)消解方法:将样品中的有机物质通过化学反应转化为无机物质,以便后续分析。
湿式消解法:如硝酸消解法(适用于清澈的水溶液样品)、硝酸-高氯酸消解法(用于消解含有难氧化有机物的样品)等。
干灰化法(高温分解法):用于分解样品,不使用或仅使用少量化学试剂,处理较大量的样品。
适用情况:湿式消解法适用于不同性质的样品,干灰化法则更适用于处理大量样品和提高微量元素的测定准确度。
(5)索氏提取法(Soxhlet Extraction),又称连续提取法或索氏抽提法,是一种常用的从固体物质中萃取化合物的方法,特别适用于从固体样品中提取有机物或非挥发性物质时表现优异。
(6)顶空法是一种广泛应用于化学分析中的样品前处理技术,特别适用于气体、液体或固体样本中挥发性组分或气味物质的检测。
静态顶空法:用于气样中被测组分含量大于气相色谱检测器检测限的组分。
其主要特点是样品在恒温密闭容器中达到热力学平衡后,直接抽取顶部气体进行分析。

液相微萃取技术在农药残留检测中的应用摘要:大多数农药残留物质属于有毒有害物质,它们以各种危害形式持续存在于环境当中,并通过不同的途径进入人体后危害人体健康。因此建立快速、准确、有效的农产品中农药残留量检测分析方法势在必行。液相微萃取(LPME)技术集采样、萃取、浓缩为一体,具有成本低、设备简单、有机溶剂用量少、富集倍数高、易与气相色谱(GC)、高效液相色谱(HPLC)、质谱(MS)仪器联用等优点,属于环境友好型的绿色样品前处理技术。对液相微萃取技术的原理、技术模型及其在农药残留检测中的应用和发展前景进行了综述。关键词:液相微萃取(LPME);农药残留;检测Application of LPME in Pesticide Residues DetectionAbstract:Most pesticide residues are toxic and harmful substances, which exist in various harmful forms in the environment. They come into human body through various means, and are harmful to human health. Therefore, a rapid and effective method for accurate detection of environmental pollutants and residues is imperative. Liquid phase microextraction(LPME) is a environment-friendly and green sample pre-treatment technology. It is a method of combining concentrating, extracting and sampling, and a method with the advantages of low cost, simple device, less organic solvent and high enrichment factors. It could be combined with gas chromatography(GC), high performance liquid chromatography(HPLC) and mass spectrometry (MS). The principle, model, application and prospect of LPME in detection of pesticide residues were reviewed.Key words: LPME; pesticide residue; detection常见的农药按用途可分为杀虫剂、杀螨剂、杀菌剂和除草剂等,按结构则可分为含氯类农药、含磷类农药、有机硫类农药、取代苯类农药、唑类农药、氨基甲酸酯类农药、拟除虫菊酯类农药等。农药在防治病虫害、保护农作物生长、增加农产品产量、提高国民经济收入等方面产生了一定的积极效应,但是在使用过程中也会产生农药残留(一般简称农残),并给人类和动物的健康带来了一些负面影响。1 不同国家的蔬菜农残限量标准及常用农残检测方法随着人民生活水平的不断提高,农残问题已成为各国政府日益关注的问题。农药作为持久性污染物中的一大类,其残留量必须加以控制,农残限量标准是各国控制农药使用的一个重要参数,但由于各国国情和地域的不同,农残限量标准也有所差别。滕葳等[1]将中国蔬菜农药残留量与美国、日本、欧盟等发达国家和组织限量标准进行了对比(表1)。结果表明,中国的许多标准都采用了国际先进标准,尤其是关系到人身健康的安全卫生标准。控制农残是防止有残留超标的农药进入食物链危害人和动物健康安全的关键环节之一。目前主要的农残检测方法有免疫分析法、气相色谱(GC)法、高效液相色谱(HPLC)法、气-质联用(GC-MS)法、液-质联用(HPLC-MS)法等。但由于免疫分析法开发难度较大,且只适用于单一化合物或结构相似的化合物;色-质联用技术价格较为昂贵,在实际应用中没有GC和HPLC那样普及[2]。在农残分析过程中,研发省时、高效、有机溶剂用量少的样品前处理新技术是农残分析研究的一个热点[3]。近年来,人们提出了多种样品前处理技术,如固相萃取(SPE)、固相微萃取(SPME)、超临界流体萃取(SFE)、微波萃取(MAE)、液相微萃取(LPME)等。LPME是在液-液萃取(LLE)和SPME技术的基础上发展起来的新型微萃取技术,不仅克服了SPME 技术不能与HPLC、毛细管电色谱(CEC)等仪器联用的缺点,还优化了传统LLE技术费时、有机溶剂用量大、萃取率低等诸多不足,它集采样、萃取和浓缩为一体,属于环境友好型的绿色分析技术[4]。2 液相微萃取(LPME)技术及其在农残检测中的应用2.1 液相微萃取(LPME)技术LPME技术[4]的基本原理是建立在样品与微升级甚至纳升级的萃取溶剂之间的分配平衡基础上的,按照操作模式的不同一般可分为:单滴液相微萃取(SDME)、膜液相微萃取(MLPME)、分散液-液微萃取(DLLME)等(表2)。它们的区别在于样品和萃取液的接触方式不同,其中每种模式又包括一些不同的方法,如SDME中又可分为常规单滴液相微萃取(SDME)和顶空单滴液相微萃取(HS-SDME)等方式;膜液相微萃取又包含了静态顶空液相微萃取(SHS-LPME)、动态顶空液相微萃取(DHS-LPME)、静态中空膜液相微萃取(SHF-LPME)和动态中空纤维膜液相微萃取(DHF-LPME)等;DLLME模式下又有上浮溶剂固化液-液分散微萃取(DLLME-SFO)、离子液体-液-液分散微萃取(IL-DLLME)等。2.1.1 单滴液相微萃取(SDME) SDME[5,6]是LPME的一种,分为常规的SDME和HS-SDME。SDME 技术是将一滴萃取溶剂悬于GC微量注射器针头尖端,然后浸于样品溶液或者悬于样品顶部空间,使分析物从水相转移至有机相,经过一定的时间后将微滴抽回注射器并转移至色谱系统进行分析(图1)[7,8]。1996年,Jeannot等[9]对顶空液相微萃取(HS-LPME)的理论基础进行了初步探讨。顶空液相微萃取[10-12]是顶空取样和液相微萃取的结合,是指将有机溶剂液滴悬于样品的顶空或者采用吸有微量有机溶剂的微量注射器抽取样品的顶空气体来萃取样品顶空中的挥发、半挥发性成分的技术。1997年,He等[13]根据萃取溶剂在萃取过程中所处的状态将LPME分为静态液相微萃取(SLPME)和动态液相微萃取(DLPME)。影响SDME的主要因素有:萃取剂的种类和单滴体积、萃取的时间、搅拌速率以及温度等条件。房贤文等[14]采用SDME-GC的联用技术测定了水中的酞酸二甲酯(DMP)和酞酸二丁酯(DBP),发现萃取率随萃取时间的延长而增加,但时间太长会影响分析时间,而搅拌速度过快会影响萃取液滴的稳定性。SDME具有有机溶剂用量少、设备简单、操作时间短的优点;但有机溶剂的易挥发性使萃取效率和方法的重复性受到影响。2.1.2 膜液相微萃取(MLPME) MLPME[15,16]主要包括SHS-LPME、DHS-LPME、SHF-LPME和DHF-LPME,是利用膜对混合物中各组分的选择渗透性的差异来实现分离、提纯和浓缩的新型分离技术。SHS-LPME是将萃取用的有机溶剂液滴(1~5 μL)悬挂在微量注射器的针尖上,置于样品基质的顶空中,对样品中的挥发成分进行富集的一种萃取方式[10]。影响HS-LPME萃取效率的因素有:样品的温度和pH、萃取剂的种类、体积、温度、萃取时间、盐效应等。陈士恒等[17]利用半导体制冷技术,采用挥发性溶剂进行HS-CLPME,扩展了HS-LPME可选择溶剂的范围,减少了溶剂峰与挥发性样品峰的干扰,提高了顶空液相微萃取与气相色谱的兼容性。HS-LPME技术具有有机溶剂耗量少、选择性强、干扰物质少、富集倍数高、操作步骤少、易于与其他仪器联用等优点。HF-LPME是1999年由Stig等[18]首次提出的。HF-LPME按照萃取相的状态则可分为SHF-LPME和DHF-LPME;HF-LPME按照萃取相的数目可以分为两相式和三相式:即液-液微萃取(LLME)和液-液-液微萃取(LLLME)。HF-LPME技术的基本原理是基于萃取目标物在两相间的分配系数不同而达到分离的目的(装置详见图2和图3)。LLME主要用于在有机相中有较高溶解度的样品萃取,且有机相和水相不能互溶;而LLLME则仅用于能离子化的酸碱性样品。影响萃取效率的主要因素有:萃取溶剂、pH、萃取时间、盐效应、温度等[19]。丁健桦等[20]建立了浸入式三相液相微萃取与高效液相色谱联用(LLLME-HPLC)来测定复杂基质中柠檬酸的分析方法,发现对于有机酸类样品萃取时间并不与萃取率成正比,原因可能是随萃取时间的增加,待测物质的逆向传质加快,同时中空纤维膜上的有机相溶解加剧;盐浓度越高,有机酸的萃取率反而越低。HF-LPME技术具有集采样、萃取和浓缩于一体,有机溶剂用量少,富集倍数高的优点[5,6]。2.1.3 分散液-液微萃取(DLLME) DLLME是2006年由Rezaee等[21]发展起来的一种新型微萃取技术,它可以分为DLLME-SFO和IL-DLLME两种方法。DLLME是基于目标分析物在样品溶液和小体积的萃取剂之间平衡分配的过程,适用于亲脂性高或中等的分析物;对于具有酸碱性的分析物,可以通过控制样品溶液的pH,使分析物以非离子化状态存在,从而提高分配效率。DLLME具体操作步骤为:在带塞的离心管中加入一定体积的样品溶液(水相,A);将含有有机溶剂(萃取剂)的分散剂通过注射剂或移液枪快速注入离心试管中,轻轻振荡,从而形成一个水/分散剂/萃取剂的乳浊液体系(B);此时萃取剂能被均匀地分散在水相中,与待测物有较大的接触面积,待测物可以迅速由水相转移到有机相且达到两相平衡,萃取时间短是微萃取的一个突出优点。最后通过离心使分散在水相中的有机溶剂(萃取剂)沉积到试管底部(C),用微量进样器吸取一定量的有机溶剂(萃取剂)后直接进样测定(D),DLLME装置示意图如图4[3]。影响DLLME萃取效率[22]的主要因素:萃取剂的种类(一般有卤苯、二氯乙烷、四氯乙烷、四氯化碳、氯仿等);萃取剂的体积(一般为5.0~100.0 μL);分散剂的种类(甲醇、乙醇、乙腈、丙酮、四氢呋喃等);分散剂的体积(一般为0.5~1.5 mL);萃取时间的选择以及盐浓度等。翦英红等[23]利用DLLME-HPLC-UVD建立了水样中痕量硝基苯的分析方法,考察了分散剂对萃取率的影响,指出了分散剂应是既能溶于水又能溶于萃取剂的有机溶剂。DLLME集采样、萃取和浓缩于一体,具有操作简单、快速、成本低、富集效率高、有机溶剂用量少等优点,可与GC、HPLC、MS等仪器联用,是一种环境友好的LPME新技术[3]。DLLME-SFO[24]的基本原理和DLPME基本相同,不同的是DLLME-SFO所用萃取剂的熔点接近室温且密度较低,便于萃取剂和样品的分离。影响SFO-LPME 萃取率的主要因素有:萃取剂的种类(一般为十一醇、1-十二醇、2-十二醇、正十六烷等)、萃取温度(一般在55~65 ℃)、萃取剂的体积(一般为10.0~150.0 μL)、搅拌速率、萃取时间、离子强度等。IE-DLLME则是以离子液体为萃取剂,结合DLLME技术形成的一种新型微萃取技术,离子液体对许多有机物质有良好的溶解性能,且克服了传统有机溶剂易挥发的缺点等,从而使其受到了人们的重视。秦九红等[25]建立了以十一醇为萃取剂,吡咯烷二硫代甲酸铵(APDC)为螯合剂的DLLME-SFO-FAAS测定环境中痕量镉的分析方法。优化了分散剂,萃取剂(十一醇)的类型和体积(300.0 μL),考察了溶液的pH(pH=5),APDC浓度(0.70 μg/L)以及萃取温度(40 ℃)和时间(10 min)对萃取效率的影响,获得了较为满意的富集(18.0倍)结果。2.2 液相微萃取(LPME)在农药检测中的应用2.2.1 水体环境中农药的检测水体中的农残量是环境污染程度的一个重要参数,对其进行检测和控制有助于更好地解决环保问题。水体环境中农残的分析经常用到SDME技术,Pinheiro等[26]运用SDME和GC-FID的联用技术对水样中的有机磷类农药和拟除虫菊酯类农药进行了检测,用1.0 μL甲苯作萃取剂,该类农药的检出限为0.30~3.00 μg/L,检测范围大于饮用水中的规定范围,具有现实的使用价值。然而李星星等[27]则利用辛基-3-甲基咪唑六氟磷酸盐离子液体作萃取剂,将SDME与HPLC技术结合起来,成功地测定了水中杀螨隆农药的残留量,同时还考察了萃取剂的种类和体积、液滴大小等对萃取效率的影响,在确定的最佳条件下,该方法的线性范围为50.00~5 000.00 μg/L,R2=0.999 4,RSD为2.1%(n=6),检出限为30.00 μg/mL(S/N=3),富集倍数为217.0倍,用此方法测定地下水和矿泉水水样中杀螨隆的农残,加标回收率为88.0%~106.0%。在水体环境中检测农残,HF-LPME技术与其他仪器联用较为常见,杨秀敏等[28]应用HF-LPME与HPLC建立了水样中的氨基甲酸酯类农残测定的分析方法,该方法以甲苯为萃取溶剂,在室温条件下以720 r/min的转速,在4.5 mL的样品溶液中萃取20 min后进行检测分析,结果显示富集倍数均大于45.0倍,线性范围为10.00~100.00 μg/L,相关系数均大于0.990 0。而李刚等[29]则利用HF-LPME和GC-MS的联用技术成功地测定了水中拟除虫菊酯类农药的残留,他们以甲苯为萃取剂,富集倍数为63.0~292.0倍,在实际水样中的回收率为92.4%~98.0%。Basheer 等[30]探索了利用HF-LPME来监测海水中的12种有机氯农药,均获得了良好的重复性(RSD<14.00%)。DLLME技术也是水体中农残检测经常用到的样品前处理技术。Wei等[31]应用DLLME与HPLC-VWD联用技术建立了水样中(河水、湖水)灭多威的测定方法,富集倍数达70.7倍,检出限为1.00 μg/L。谢洪学等[32]将DLLME与GC-FID的检测技术相结合,建立了水样中甲拌磷农药残留的测定方法;该方法经优化后是以10.0 μL的四氯乙烯为萃取剂,1.0 mL的丙酮为分散剂,样品体积5.0 mL,在20 ℃的试验温度下,获得了富集倍数达到300.0倍的良好效果。Zhao等[33]应用DLLME-GC-FPD的联用技术分析了水样(河水、井水和农业用水)中13种有机磷农药的残留,该方法富集倍数高达789.0~1 070.0倍,平均加标回收率为78.9%~107.0%,获得了令人满意的结果。Nagaraju等[34]建立了DLLME与GC-MS 联用测定水样中三嗦类除草剂的新方法,该类除草剂的检出限为0.02~0.12 μg/L,实际样品河水和自来水的加标回收率分别为85.2%~114.5%和87.8%~119.4%,获得了较为满意的结果。为了能够简便、快速测定水中敌敌畏的残留量,孔娜等[35]选择了一种较为新颖的样品前处理技术:微波辅助-顶空液相微萃取(MAE-HS-LPME),再与HPLC方法联用建立了水样中敌敌畏残留的分析方法,他们将条件进行了优化:以二甲苯为萃取剂,NaCl含量为5.0%,将pH调节到2.5,萃取15 min后进行试验,富集倍数达到54.0倍,实际水样的加标回收率为87.4%~103.0%,结果发现该方法节省溶剂、选择性好、应用范围较为广泛。2.2.2 蔬菜中农药的检测蔬菜是人们日常生活中不可或缺的食品,其农残量的控制和检测更易引起人们的关注,蔬菜的基质比水体要复杂得多,所以对样品前处理技术的要求也更高。为了优化样品前处理的过程,林海禄等[36]将HF-LPME 与HPLC联用,以六氟磷酸盐离子液体作萃取剂,建立了蔬菜中对硫磷农药残留的分析方法;该方法将离子液体作为液-液-液三相微萃取的接受相,正辛醇为有机萃取溶剂,转速800 r/min,萃取时间为30 min,得到的线性范围为1.00~50.00 μg/L,富集倍数高达132.0倍,方法快速、简单、灵敏度高、无需进行过滤等前处理过程,具有较好的应用前景。在蔬菜的农残检测中,由于其样品基质复杂,为了使其基质干扰较小,样品前处理过程采用DLLME技术的较为多见。杜晓婷等[37]利用DLLME-GC-MS联用技术建立了蔬菜中有机磷农药残留的分析方法,该方法以氯苯为萃取剂,丙酮为分散剂,取样品溶液萃取3 min后进行测试分析,获得了良好的线性范围,其加标回收率为60.0%~95.0%,RSD为2.8%~9.1%,结果令人较为满意。为了建立番茄中有机磷农药残留的测定方法,Araz[38]将DLLMP与GC-FPD技术联用,以氯苯为萃取剂,丙酮为分散剂,将样品萃取30 min后进行测定,其相关系数均大于0.991 7,而RSD 均小于10.0%。郝家勇等[39]应用IL-DLLME的样品前处理技术和HPLC仪器联用,建立了番茄样品中4种氨基甲酸酯类农药的测定方法,该方法以1-丁基-3-甲基咪唑六氟磷酸盐为萃取溶剂,样品经2 min萃取后进样检测,4种氨基甲酸酯类农药的检出限(S/N=3)为0.12~0.43 μg/L,富集倍数达到317.0~625.0倍,且回收率为75.0%~120.0%(RSD为5.3%~5.5%),与传统方法相比而言,此方法简便、灵敏、消耗溶剂少,被认为是一种具有潜力的农残检测技术。2.2.3 水果中农药的检测水果能够补充人体所必需的水分和微量元素,是人体获得微量元素的重要途径,为了使果树在生长过程中不受病虫的危害,农药的使用是不可避免的,但农药的残留是必须控制的,否则会危害人类的健康。为了获得简单、快速、准确、环境友好的农残检测方法,孙玉珍等[40]以LLLME和HPLC的联用技术为检测手段,利用三相中空纤维磁力搅拌的新型LPME技术模式对待测样品做了前处理,快速分离并富集了橘子中残留的吡虫啉农药,以正辛醇为萃取剂,以KH2PO4溶液为接受相,以KOH溶液为给出相介质;在一定的条件下萃取20 min后进行测定,富集倍数为19.2倍,在5.00~200.00 μg/L的范围内获得了理想的结果。在水果样品前处理过程中,复杂的基质效应也会影响待测组分的测定。一般情况下,人们都以富集能力较强的DLLME前处理技术作为首选。赵文婷等[41]将DLLME与GC-FPD的检测技术结合起来建立了苹果中有机磷农药残留检测的新方法,该方法以二氯苯为萃取溶剂,丙酮为分散剂;经过萃取和离心后注入GC进行检测,发现3种含磷类农药在500.00~20 000.00 μg/L的范围内具有良好的线性。焦琳娟等[42]将DLLME与GC技术结合到一起,建立了果汁中3种含磷农药的测定方法,该方法以甲苯为萃取溶剂,经过25次萃取后注入色谱系统进行检测,结果发现该方法在40.00~400.00 μg/L范围内具有良好的线性,富集倍数达到22.3~51.5倍,具有广阔的应用前景。3 结语随着中国农业的发展和农产品进出口贸易的扩大,特别是加入WTO以后,对农产品农残的分析研究也越来越重视,因此发展集采样、萃取、浓缩于一体,操作简便、成本低廉、基质干扰小、环境友好的分析技术已成为一种趋势。而LPME技术是农残检测中一个具有广阔应用前景的前处理技术;以LPME技术为基础,结合现代色谱方法如高分辨的气质法(GC-HRMS)、快速气相色谱法、二维色谱(GC×GC)和超高效液相色谱(UPLC)等将发展成为快速、高效、灵敏的农残分析技术中的最佳选择。参考文献:[1] 滕葳,柳琪,郭栋梁.国内外农药残留量标准限量水平的比较[J].食品研究与开发,2003,24(2):34-35.[2] 蔡德玲,司士辉,陈九星,等.含氟拟除虫菊酯类农药残留检测分析研究进展[J].农药研究与应用,2008,12(3):9-14.[3] 臧晓欢,吴秋华,张美月,等.分散液相微萃取技术研究进展[J].分析化学,2009,37(2):161-168.[4] SARAFRAZ-YAZDI A, AMIRI A. Liquid-phase microextraction[J]. Trends Anal Chem,2010,29:1-14.[5] REZAEE M, ASSADI Y, MILANIHOSSEINI M R,et al.Determination of organic compounds in water using dispersive liquid-liquid mieroextraction[J]. J Chromatogr A,2006,1116:1-9.[6] BERIJANI S,ASSADI Y,ANBIA M,et al. Dispersive liquid—liquid microextraction combined with gas chromatography-flame Photometric detection very simple,rapid and sensitive method for the determination of organophosphorus pesticides in water[J]. J Chromatogr A,2006,1123:1-9.[7] HOU L,LEE H K.Determination of pesticides in soil by liquid-phase microex—traction and gas chromatography—mass spectrometry[J]. J Chromatogr A,2004,1038:37-42.[8] 徐冬辉,刘俊亭,郭晓明.单滴液相微萃取技术的原理与应用[J].河北医药,2007,29(11):1258-1259.[9] JEANNOT M A, CANTIVELL F F. Solvent microextraction into a single drop [J]. Anal Chem,1996,68:2236-2240.[10] 孙世豪,宗永立,谢剑平,等. 顶空液相微萃取技术综述[J]. 烟草科技,2006(5):41-46.[11] 王炎,张永梅,梁志华,等. 顶空液相微萃取测定溶剂型涂料中挥发性有机物[J]. 分析试验室,2008,27(3):115-118.[12] 熊玉宝,张勇, 廖春华,等.液相微萃取在农药残留物检测中的应用[J]. 现代农药,2011,10(3):12-16.[13] HE Y,LEE H K. Liquid-phase microextraction in a single drop of organic solvent by using a conversional microsyring[J].Anal chem,1997,69:4634-4640. [14] 房贤文,谭培功,董新春,等.单滴液相微萃取气相色谱测定水中的酞酸酯类化合物[J].分析实验室,2007,26(7):100-103.[15] 张兰英.环境样品前处理技术[M].北京:清华大学出版社,2008. 152-282.[16] 岳永德.农药残留分析[M].北京:中国农业出版社,2003.48.[17] 陈士恒,王建伟,李伟伟,等.顶空低温液相微萃取技术分析水中杂醇油和啤酒挥发性成分[J].分析化学,2011,39(5):675-679.[18] STIG P B, RASMUSSEN K E. Liquid-liquid-liquid micro-extraction for sample preparation of biological fluids prior to capillary electrophoresis[J].Ana1 Chem,1999,71:2650-2652.[19] 罗明标,刘维,李伯平,等. 多孔中空纤维液相微萃取技术的研究进展[J]. 分析化学,2007,35(7):1071-1077.[20] 丁健桦,何海霞,杨新磊,等.复杂基质中柠檬酸的液相微萃取[J]. 色谱,2008,26(1):88-92.[21] REZAEE M, ASSADI Y, AHMADI F, et a1. Determination of organic compounds in water using dispersive liquid-liquid microextraction[J]. J Chromatogr A,2006,1116:1-9.[22] 熊力. 绿色样品前处理技术——液相微萃取技术简介[J].气象水文海洋仪器,2009(2):91-94.[23] 翦英红,范宁伟,张德. 分散液液微萃取高效液相色谱法测定环境水样中的硝基苯[J].天津化工,2011,25(1):51-54.[24] 王莹莹,赵广莹,常青云,等. 悬浮固化液相微萃取技术研究进展[J].分析化学,2010,38(10):1517-1522.[25] 秦九红,杨君,向国强.浮动液滴固化分散液相微萃取-火焰原子吸收光谱法测定环境样品中的镉[J].化学研究,2011,22(3):74-78.[26] PINHEIRO A, ANDRADE J. Development, validation and application of a SDME/GC-FID methodology for the multiresidue determination of organophosphate and pyrethroid pesticides in water[J]. Talanta,2009,79:1354-1359.[27] 李星星,汪路路,孙福生.基于离子液体的单滴液相微萃取-高效液相色谱法测定水中杀螨隆农药残留[J].分析实验室,2011,30(3):73-76.[28] 杨秀敏,王志,王春,等.中空纤维液相微萃取-高效液相色谱法测定水中残留的氨基甲酸酯类农药[J].色谱,2007,25(3):362-366.[29] 李刚,张占恩.中空纤维膜液相微萃取-气相色谱-质谱法测定水样中的拟除虫菊酯类农药[J].理化检验:化学分册,2010,46(3):227-231.[30] BASHEER C, LEE H K, OBBARD J P. Determination of organochlorine pesticides in seawater using hollow fiber menbrane microextraction and gas chromatography-mass spectrometry[J]. J Chromatogr A,2002,968:191-199. [31] WEI G,LI Y,WANG X. Application of dispersive liquid-liquid microextraction combined with high-Performance liquid chromatography for the determination of methomyl in natural Waters[J]. J Sep Sci,2007,30:3262-3267.[32] 谢洪学,何丽君,吴秀玲,等.分散液液微萃取-气相色谱法测定水样中甲拌磷农药[J]. 分析化学,2008,36(11):1543-1546.[33] ZHAO E C, ZHAO W T, HAN L J, et al. Application of dispersive liquid-liquid mieroextraction for the analysis of organophosphorus pesticides in watermelon and cucumber[J]. J Chromatogr A,2007,1175:137-140.[34] NAGARAJU D, HUANG S D. Determination of triazine herbicides in aqueous samples by dispersive liquid-liquid microextraction with gas chromatography-ion trap mass spectrometry[J]. J Chromatogr A,2007,1161:89-97.[35] 孔娜,邹小兵,黄锐,等.微波辅助-顶空液相微萃取在线联用高效液相色谱法测定环境水样中的敌敌畏[J].色谱,2010, 28(12):1200-1203.[36] 林海禄,闫红.中空纤维离子液体液相微萃取测定蔬菜中有机磷农药[J].食品科技,2010,35(11):292-294.[37] 杜晓婷,周敏,张剑,等.蔬菜中甲胺磷等5种有机磷农药残留量的分散液-液微萃取/气质联用技术检测[J].分析测试学报,2010,29(7):751-754.[38] ARAZ B. Sample preparation method for the analysis of some organophosphorus pesticides residues in tomato by ultrasound-assisted solvent extraction followed by dispersive liquid-liquid microextraction[J]. Food Chem,2011,126:1840-1844.[39] 郝家勇,罗小玲,唐宗贵,等.离子液体分散液相微萃取-高效液相色谱法测定番茄中的氨基甲酸酯类农药[J]. 分析测试学报,2010,29(11):1169-1172.[40] 孙玉珍,朱荣林,胡琳珍,等.液相微萃取-高效液相色谱法测定桔子和蚯蚓中吡虫啉的残留降解[J]. 安徽农学通报,2011,17(9):32-35.[41] 赵文婷,杨中华,魏朝俊,等.分散液相微萃取测定苹果中灭线磷马拉硫磷和毒死蜱残留[J]. 农业环境科学学报,2010,29(9):1840-1844.[42] 焦琳娟,陈燕施.果汁中有机磷农药残留的动态液相微萃取/气相色谱法检测[J].分析测试学报,2008,27(7):779-781.。


原位生成离子液体分散液液萃取-高效液相色谱法测定水样中的莠去津潘闽君;曹茜;景明;李晋阳;陈家玮【摘要】本文引入绿色溶剂离子液体作为萃取剂,建立了超声辅助-原位生成离子液体分散液液微萃取水样中莠去津的方法。
即处理5 mL 水溶液样品,以80μL 的[HMIM]Cl 为萃取剂,加入400μL 配对离子交换剂双三氟甲磺酰亚胺锂盐(LiNTf2),通过原位生成的疏水性离子液体[HMIM]NTf2,对水中莠去津进行液液微萃取,经辅助超声10 min 后4000 r/min 离心8 min,结合高效液相色谱测定莠去津。
莠去津的检出限为0.01 mg/L,方法线性范围为0.01~0.5 mg/L,加标回收率(100.4%~106.7%)显著优于直接离子液体分散液液萃取法(<67%)。
这种原位生成离子液体微萃取技术有望应用于更广泛的有机污染物分析检测中。
%A kind of green solvent,ionic liquid,was introduced as an extracting agent,and a new method of dispersive liquid-liquid microextraction based on ultrasonic-assisted in situ ionic liquid formation (DLLM-UAISLF) was established for the High Performance Liquid Chromatography (HPLC)determination of atrazine in water.Five mL of water was treated using 80 μL of [HMim]Cl as the extracting agent,400 μL of LiNTf2 as the ion-exchange material,ultrasound time of 10 minutes and centrifuge time of 8 minutes at 4000 r/min.During this process,the droplets of ionic liquid [HMim ]NTf2 were formed in water and the precipitates were then separated for determination of atrazine by HPLC.The detection limit of atrazine is 0.01 mg/L and the detection values range from 0.01 to 0.5 mg/L.The proposed method yielded recoveries of 100.4% -106.7%,which are obviously better than those (<67%)of direct liquid-liquid microextraction.This method has potential in the determination of organic pollutants.【期刊名称】《岩矿测试》【年(卷),期】2015(000)003【总页数】6页(P353-358)【关键词】水样;莠去津;原位生成离子液体;分散液液微萃取;高效液相色谱法【作者】潘闽君;曹茜;景明;李晋阳;陈家玮【作者单位】生物地质与环境地质国家重点实验室,北京 100083; 中国地质大学北京地球科学与资源学院,北京 100083;生物地质与环境地质国家重点实验室,北京 100083; 中国地质大学北京地球科学与资源学院,北京 100083;生物地质与环境地质国家重点实验室,北京 100083; 中国地质大学北京地球科学与资源学院,北京 100083;生物地质与环境地质国家重点实验室,北京 100083;生物地质与环境地质国家重点实验室,北京 100083; 中国地质大学北京地球科学与资源学院,北京 100083【正文语种】中文【中图分类】S482.32;O658.2;O657.63原位生成离子液体分散液液萃取-高效液相色谱法测定水样中的莠去津潘闽君1,2,曹茜1,2,景明1,2,李晋阳1,陈家玮1,2*( 1.生物地质与环境地质国家重点实验室,北京100083;2.中国地质大学(北京)地球科学与资源学院,北京100083)摘要:本文引入绿色溶剂离子液体作为萃取剂,建立了超声辅助-原位生成离子液体分散液液微萃取水样中莠去津的方法。

环境水体中四乙基铅测定方法研究进展赖永忠【摘要】综述了20世纪90年代以来的有关环境水体中四乙基铅分析方法的研究报道.对各种样品前处理方法和检测技术的优缺点进行了评价,其中吹脱捕集-气相色谱/质谱联用法(P&T-GC/MS),样品前处理过程可全自动化、灵敏度高及无需有机萃取试剂,检测技术具有高效分离、定性及定量的能力,值得在环境水体四乙基铅的监测中推广使用.部分文献报道的P&T-GC/MS法测定水样中四乙基铅时,出现的疑似捕集阱或质谱检测器“中毒”现象,可能是由四乙基铅在水样中的短期稳定性较差造成,影响其稳定性的关键因素及解决办法还需进一步研究.【期刊名称】《冶金分析》【年(卷),期】2013(033)009【总页数】8页(P14-21)【关键词】四乙基铅;含铅汽油;吹脱捕集法;气相色谱/质谱联用法;地表水【作者】赖永忠【作者单位】汕头市环境保护监测站,广东汕头515041【正文语种】中文【中图分类】O655四乙基铅(Tetraethyl lead,Et4 Pb)属于有机金属化合物,易挥发,易溶于有机溶剂、脂肪及类脂质,沸点约200℃。
1921年,Et4 Pb被发现加入汽油中可起到增加辛烷值的作用,1923年含Et4 Pb汽油正式进入燃油市场[1]。
然而,汽车尾气已成为当今环境铅污染的主要来源之一,含铅汽油因环境污染问题而被逐渐淘汰,1986年被美国市场禁用,欧洲则从2000年起禁用含铅汽油[1];我国自2000年7月1日起将90号、93号和95号汽油的含铅量由不大于0.013 g/L降至不大于0.005 g/L(见 GB 17930-1999 车用无铅汽油),可见我国现阶段使用的“无铅汽油”并非真正无铅。
Et4 Pb在水体和土壤中不稳定,逐步降解为三乙基铅阳离子(Et3 Pb+)、二乙基铅阳离子(Et2 Pb2+)和无机铅阳离子(Pb2+),尤其是在光照条件下更容易发生[2],在水体中,降解速度随保存温度的提高而加快[3]。

新科技 新名词液相微萃取的概念及应用淡美俊 赵 怡(国家知识产权局专利审查协作北京中心,北京 100000)摘 要:液相微萃取是近十几年发展起来的一种新型的样品前处理技术,集采样㊁萃取和浓缩几个步骤于一体,具有快速㊁简便㊁绿色环保等优势,已被广泛应用于各个领域化学分析检测的样品前处理过程㊂文章对液相微萃取的概念㊁特点㊁技术分支及应用进行了介绍㊂关键词:液相微萃取,样品前处理中图分类号:N04;O6 文献标识码:A 文章编号:1673-8578(2015)01-0057-03Concept and Technology of Liquid⁃Phase MicroextractionDAN Meijun ZHAO YiAbstract :Liquid⁃phase microextraction (LPME )is a kind of novel sample pretreatment technique that in⁃tegrates sampling ,extraction and concentration into a single step.LPME has many advantages ,such as rapid ,simple ,convenient ,environment⁃friendly ,and is widely used in various fields.This paper introduced LPME in the aspects of conception ,features ,technology and application.Keywords :liquid⁃phase microextraction ,sample preparation收稿日期:2014-10-21作者简介:淡美俊(1984 ),女,汉族,硕士,助理研究员,主要从事色谱领域专利审查㊂通信方式:danmeijun@㊂引 言在任何化学分析检测过程中,特别是对于复杂样品中微量/痕量有机成分的分析检测,样品前处理是整个过程中十分重要的一个环节㊂有报告显示,在一次完整的分析检测过程中,超过80%的时间都被用于样品前处理㊂迄今为止,各种传统的样品前处理技术多达几十种,最常用的有液液萃取㊁索氏萃取㊁超声萃取㊁蒸馏及固相萃取等㊂传统的样品前处理技术,样品萃取后还需要进行净化㊁浓缩富集等多个步骤才能进行分析检测㊂这些技术往往操作步骤烦琐,过程复杂,处理时间长,而且还需要使用大量对人体和环境有毒害的有机溶剂,难以实现自动化和分析仪器联用化㊂因此,开发快速㊁简便㊁有机溶剂消耗少㊁环境污染小的样品前处理技术一直都是分析检测研究领域中的热点㊂一 液相微萃取的概念及特点液相微萃取(liquid⁃phase microextraction,LPME)是1996年首次开发出的一种新型绿色环保的样品前处理技术㊂液相微萃取的基本原理是利用分析物和微量萃取溶剂(微升级甚至是纳升级)之间不同的分配系数,实现目标物的萃取富集,整个过程集采样㊁萃取和浓缩几大步骤于一体㊂中国科技术语/2015年第1期与传统的样品前处理相比,液相微萃取具有以下特点[1-2]:(1)该技术集采样㊁萃取和浓缩于一体,操作简单快捷;(2)萃取效率高,富集效果好,灵敏度高,有时富集效果甚至可达1000倍以上;(3)所需的有机溶剂非常少(几到几十微升),是一项环境友好的样品前处理新技术,且所需样品溶液的量较少,因此特别适合于环境样品中痕量㊁超痕量污染物和生物样品等复杂基质中低浓度分析物的测定;(4)便于实现仪器联用化和自动化㊂二 液相微萃取的技术分支液相微萃取按照萃取模式可以分为直接液相微萃取㊁顶空液相微萃取㊁分散液相微萃取㊁中空纤维液相微萃取㊁气流吹扫微注射器萃取㊂1.直接液相微萃取(direct liquid⁃phase micro⁃extraction,Direct⁃LPME)利用悬挂在微量进样器的顶端的有机溶剂微滴直接浸入到样品中萃取分析物的技术,称作直接液相微萃取㊂1996年首次提到的液相微萃取就属于直接液相微萃取技术,利用悬挂在特氟龙(teflon)棒末端的有机溶剂微滴直接浸入一个水溶液中对目标分析物进行萃取,萃取结束后,取出萃取液,直接用于气相色谱分析㊂1997年用微量注射器取代了特氟龙棒作为有机溶剂微滴的载体,对水溶液中分析物进行萃取㊂随后的直接液相微萃取技术都是基于微量注射器进行开发的㊂该技术已被广泛应用于水样㊁环境㊁固体蔬菜水果等样品中目标分析物的萃取㊂研究发现,该技术适合萃取较为洁净的气体或液体样品,对于固体样品通常要先将目标分析物通过一定的方式转移到液体中才行,不适合复杂基质样品的萃取㊂该技术的优点是装置简单㊁易于操作㊁有机溶剂用量少,但存在有机溶剂微滴在操作中容易脱落㊁可选用的萃取溶剂有限㊁重复性差等缺点㊂2.顶空液微萃取(headspace liquid⁃phase micro⁃extraction,HS⁃LPME)利用悬挂在微量注射器针尖的有机溶剂悬于样品上部空间进行萃取的技术,称作顶空液相微萃取㊂它的操作步骤和直接液相微萃取基本一致,只是有机溶剂微滴不是浸入样品中,而是悬于顶空样品瓶上部空间,不与样品直接接触,这种技术适用于分析物容易进入样品上方空间的挥发性或半挥发性有机化合物㊂2009年提出一种新的顶空液相微萃取模式 气流式顶空液相微萃取(GF⁃HS⁃HPME),通常的HS⁃HPME为封闭式,该技术是一个半开放的萃取体系,有机溶剂与微注射器针尖部分处在一个进气流管中,插入顶空样品瓶的上部空间,注射器上部用冷凝水冷却,分析物从样品中挥发出来,在气流的吹扫下被带走,从进气流管向外输出时一部分被有机溶剂捕获㊂利用该技术对16种PAHs进行了萃取,结果表明,与通常的HS⁃LPME相比,萃取效率提高了3~4倍[3]㊂与Direct⁃LPME相比,HS⁃LPME由于分析物在气相中具有较大的扩散系数,因此分析物在液上空间的传质速度非常快,且由于萃取溶剂不与样品直接接触,不会在有机溶剂微滴外形成稳定的扩散层,因此大大缩短了萃取时间,同时可以消除样品基质干扰㊂因此,在一般情况下HS⁃LPME相对于Direct⁃LPME会被优先采用㊂但其由于使用有机溶剂微滴,可选用的萃取溶剂有限,在操作过程中容易造成液滴脱落,重现性差等缺点㊂3.中空纤维液相微萃取(Hollow fiber based liquid⁃phase microextraction,HF⁃HPME)萃取溶剂以中空纤维为载气进行液相微萃取的技术,称作中空纤维液相微萃取㊂1999年出现了一种自动化的HF⁃HPME装置㊂该装置将棒状接口接于中空纤维的一端,使微量进样器进入纤维腔底注入或移出受体溶液㊂HF⁃HPME包括三种模式:两相HF⁃HPME㊁三相HF⁃HPME和载体转运[4]㊂与Direct⁃LPME和HS⁃LPME相比,HF⁃HPME 以中空纤维为有机溶剂的载体,能有效防止有机溶剂的脱落并降低了挥发损失,中空纤维价格低廉,易于实现自动化㊂因此,近年来已被广泛应用于血样㊁尿样㊁唾液㊁水样㊁土壤㊁食品等样品中痕量有机污染物的样品前处理㊂4.分散液相微萃取(Dispersive liquid⁃phase mi⁃croextraction,DLLME)将数十微升的萃取溶剂和一定体积分散溶剂新科技 新名词混合后,加入样品溶液中,混合液经过振荡形成了一个水/萃取溶剂/分散溶剂的体系对目标分析物进行萃取的技术[4],称作分散液相微萃取㊂该技术最初是在2006年由伊朗学者提出,属于一种新型的样品前处理技术㊂与HF⁃HPME相比,DLLME的萃取溶剂与样品之间的接触面积大,萃取时间短,效率高㊂DLLME 可以与气相色谱仪㊁液相色谱仪㊁分光光度计等多种仪器联用,因此在较短的时间内得到了快速发展㊂DLLME已经广泛应用于水样分析,同时还被应用于西瓜㊁黄瓜㊁饮料㊁葡萄㊁稻米等样品的分析[4],但其易受样品基质的干扰和影响,因此对于复杂基质的样品受到了限制㊂5.气流吹扫微注射器萃取将萃取溶剂置于微量注射器的针筒内,利用微量注射器的针头将萃取溶剂和样品池的高温体系隔开,样品池设有加热器以使目标物快速从样品中释放,微量注射器外部设有冷凝器以减少萃取溶剂的损失,气态的分析物在气流的带动下被送入微量注射器针筒内的萃取溶剂中进行萃取的技术,称作气流吹扫微注射器萃取㊂该技术首先是由中国延边大学的李冬浩㊁杨翠㊁朴相范小组于2009年提出,并自主研发了ME⁃101多功能微萃取仪[5],并于2010年4月22日申报了实用新型专利申请(授权公告号CN201662565U)㊂随后,该小组对GP⁃MSE的加热器和冷凝器进行了改进,加热器采用MCH氧化铝陶瓷发热片,冷凝器采用半导体冷凝器㊂该技术是一种全新的萃取技术,萃取体系为开放或半开放式,具有萃取速度快㊁效率高㊁操作简单㊁定量准确㊁实验结果重现性好㊁自动化程度高等优点㊂目前已被应用于植物㊁土壤㊁药材㊁原油中挥发性和半挥发性化合物的处理㊂三 结 语液相微萃取是一种新型㊁高效㊁绿色环保型的样品前处理方法,经过十几年的发展,已经取得了显著进步,并在医学㊁代谢组学㊁食品化学㊁生物化学㊁环境科学等领域获得了广泛应用㊂随着人们对液相微萃取的理论研究的不断深入,特别是近几年出现的新型液相微萃取技术,液相微萃取技术有望在更多领域㊁更复杂的样品分析中大显身手㊂参考文献[1]邓育平,周婷婷.液相微萃取技术研究进展[J].科技创新与应用,2013(18):8-9.[2]Yang C,Qiu J X,Ren C,et al.Gas flow headspace liquid phase microextraction[J].Journal of Chromatography A, 2009,1216(45):7694-7699.[3]朱艳梅,焦必宁.中空纤维液相微萃取技术及其在食品有机污染物检测中的应用[J].食品工业科技,2013,34(15):384-389.[4]臧晓欢,吴秋华,张美月,等.分散液相微萃取技术研究进展[J].分析化学,2009,37(2):161-168.[5]毕金虎,尹哲,朴相范.ME⁃101多功能微萃取仪的研究与开发[J].延边大学学报:自然科学版,2011,37(2): 115-118.书讯:‘英汉钢铁冶金技术详解词典“问世由徐树德和赵予生主编㊁姜钧普等主审的‘英汉钢铁冶金技术详解词典“已由机械工业出版社于2015年1月出版㊂该词典16开,精装,263万字,约1200页㊂中国译协前副会长兼科技翻译委员会主任李亚舒教授为该词典作序㊂该词典是我国第一部详解型英汉钢铁技术词典,在英汉专科词典中首创词义辨析框㊁新词新义框㊁术语翻译框㊁例句分析框㊁词语搭配框㊁词序分析框等,对钢铁专业术语常见误译,科学剖析㊁翔实论证㊁析误匡谬㊁给出正译;对新词翻译,详加分析㊁指明规律,以例为镜介绍新词翻译知识;对源语译语字面意思南辕北辙而实为异名同物者,依据原文㊁阐明内涵㊁释疑解惑㊁归一概念㊂此外,该词典还从浩瀚的英文原版钢铁文献中精挑细选,为诸多词条配置例句㊁给出译文,以利读者正确理解词义㊁熟悉用法;对一些涉及新工艺㊁新技术㊁新设备的词条,给出技术含义简释,方便读者查阅㊂凡此种种,满足了读者的多视角需求,提高了词典的学术性和实用性㊂。

分散液相微萃取-液相色谱串联质谱法快速测定猪尿中的盐酸克伦特罗和氯霉素摘 要:建立了同时快速测定猪尿中盐酸克伦特罗和氯霉素残留的高效液相色谱-串联质谱分析方法。
5 mL猪尿样品,加入D9-盐酸克伦特罗和D5-氯霉素内标,调节pH至10,加入10 % NaCl,经250 µL三氯甲烷和750 µL异丙醇分散萃取后,离心,转移下层沉淀体积,氮吹后定容,液相色谱-串联质谱电喷雾正负离子切换扫描同时分析盐酸克伦特罗和氯霉素,内标法定量。
结果表明,添加浓度为0.l~2 µg/L,猪尿中盐酸克伦特罗和氯霉素的回收率为82.5%~97.2%,相对标准偏差(RSD,n=5)为5.4%~9.6%,盐酸克伦特罗和氯霉素的方法检出限(LOD)分别为0.02和0.03 µg/L,定量限(LOQ)分别为0.06和0.1 µg/L。
本方法操作简单,灵敏度、回收率和重复性均良好。
关键词:分散液相微萃取;猪尿;盐酸克伦特罗;氯霉素1 引言盐酸克伦特罗和氯霉素曾作为饲料添加剂广泛应用于畜牧业生产,但在使用中发现其在动物源性食品中残留会引起多种急性和慢性毒副作用,危害人体健康。
目前两种化合物已被列为禁用兽药,但在生猪养殖中仍有非法使用现象。
分析猪尿中这两种违禁药物残留是监控生猪安全养殖的有效手段。
检测猪尿中氯霉素的报道较少[1],测定猪尿中盐酸克伦特罗有用于筛选的半定量免疫分析法[2-3],用于定量分析的高效液相色谱法[4]、液质联用[5-6]及气质联用法[7-9]。
仪器定量法,前处理较复杂,需经HLB柱[6]、阳离子交换柱[5,9]、免疫亲和柱[7]净化,或固相微萃取装置富集[8]。
分散液相微萃取是一种简单、快速、经济的样品前处理技术,2006年Rezaee[10]首次提出,目前已用于水中的多种农药残留测定[11-13],人尿中的精神类药物分析[14-16],但尚未见用于兽药残留测定。

萃取跟分液的区别分液是一种实验操作,在分液漏斗里完成两种互不相溶的液体的分离,下层的液体从下管放出注意及时关闭活塞,上层的液体从上口倒出。
提取也是一种实验操作。
以溴水中苯萃取溴为例说明操作步骤。
在分离漏斗中混合溴水和苯后,摇动并静止。
静置后,液体分层。
Br2溶解在苯中。
苯和水互不溶。
苯在上层比水轻。
因为Br2溶解了,所以呈橙红色。
下层水无色,萃取完成。
可见萃取步骤中包含分液操作。
1.使用前,玻璃活塞应进行泄漏测试。
如果有漏水,应涂上一层薄薄的凡士林,但不要太多,以免堵塞流孔。
使用时,用左手虎口握住漏斗球,用拇指和食指转动活塞以控制液体填充。
此时,玻璃塞的小槽应对准并与漏斗口侧面的小孔连接,以便顺利进行液体填充。
2、作加液器时,漏斗下端不能浸入液面下。
3.振动时,塞子的小槽应与漏斗口侧面的小孔对齐,并密封严密。
在液体分离过程中,较低的液体从漏斗颈流出,并靠近烧杯壁。
上部液体应从漏斗口倒出。
及时关闭活塞,防止上部液体流入烧杯。
4、长期不用分液漏斗时,应在活塞面夹一纸条防止粘连。
并用一橡筋套住活塞,以免失落。
向待分离的溶液中加入不互溶或最多部分互溶的萃取剂,以形成两个共存的液相。
利用原溶剂和萃取剂对各组分的溶解度,包括化学反应后溶解的差异,使其在两液相中不均匀分布,然后通过两液相的分离实现组分之间的分离。
如果用四氯化碳萃取碘的水溶液,几乎所有的碘都会转移到四氯化碳中,碘可以从大量水中分离出来。
最基本的操作是单级萃取。
它是使料液与萃取剂在混合过程中密切接触,让被萃组分通过相际界面进入萃取剂中,直到组分在两相间的分配基本达到平衡。
然后静置沉降,分离成为两层液体,即由萃取剂转变成的萃取液和由料液转变成的萃余液。
单级萃取达到相平衡时,被萃组分b的相平衡比,称为分配系数k,即:k=yb/xb式中yb和xb分别为b组分在萃取液中和萃余液中的浓度。
浓度的表示方法需考虑组分的各种存在形式,按同一化学式计算。
如果还提取进料液中的另一组分D,则组分B的分配系数与组分D的分配系数之比,即B与D的分离系数,称为选择性系数α,即:α=kb·kd=yb·xd/xb·ydα> 1、优先提取组分B;α=1表明,两种组分在两相中的分布是相同的,用这种萃取剂无法实现两种组分的分离。

液相微萃取技术简介及应用1.引言z样品的前处理技术对分析的结果有着重要影响,一直倍受关注z液相微萃取(Liquid Phase Microextraction,LPME) 或(Solvent Micro-Extraction,SME)的思想源于液-液萃取,最早文献报道是Jeannot和Cantwell采用8ul辛烷对水性样品中目标物4-甲基苯乙酮的萃取z该技术可独立作为样品的前处理技术,也可与气相色谱、液相色谱联用2.液相微萃取的特点z有机溶剂用量小,一般为几到几十微升,污染少z集目标物的萃取、纯化、浓缩于一步,操作简单,劳动强度小z无需特殊设备,成本低z通过调节萃取用溶剂的极性或者酸碱性,可实现选择性萃取,可减少基质干扰3.液相微萃取的萃取模型z静态液相微萃取(Static Liquid-Phase Micro-Extraction, Static-LPME)z动态液相微萃取(Dynamic Liquid-Pphase Micro-Extraction, Dynamic-LPME)A.静态液相微萃取z萃取由目标物在相间的平衡实现z操作简单z富集效果较差z灵敏度较低B.动态液相微萃取z操作相对复杂z灵敏度较Static-LPME高z富集效果较好z重现性较Static-LPME稍差z采用自动化操作有望获得较高的重现性动态液相微萃取自动化的实现z CTC CombiPAL多功能自动进样器液体/顶空/SPME/SPDE/热解析…...z Matrix 多功能前处理仪SPME/SPDE/LPME/HS4.液相微萃取的取样方式z直接液相微萃取(Direct Liquid-Phase Micro-Extraction,Direct-LPME)z顶空液相微萃取(Head Space Lliquid-Phase Micro-Extraction,HS-LPME)z液相微萃取/反萃取(Liquid-Phase Micro-Extraction with back extraction,LPME/BE)A.直接液相微萃取z液体基质中的分析物,基质一般较为纯净z液滴稳定性z膜保护措施B.顶空液相微萃取z液相微萃取与顶空取样分析的结合z特别适合于挥发性或半挥发性微量有机化合物的萃取z复杂基质:如生物样品C.液相微萃取/反萃取z萃取过程:接受相z用于有机溶剂富集效率不高的目标物5. 影响萃取效率的因素z有机溶剂z有机溶剂体积z萃取时间z萃取温度z搅拌速率z盐效应z pH值z对于Dynamic–LPME还有如下影响因素:活塞拉动速率,活塞往复次数,取样体积6. 研究现状z研究主要集中在液态基质上,分析方法主要为GC/MS,HPLC/MS及毛细管电泳z环境监测:水或土壤中污染物如芳香胺、多环芳烃、有机氯农药、除草剂等z饮料分析:酒中醇类,及污染物赭曲霉素Az生物分析:如血液7. 烟草中挥发性成分析z烟叶中成分复杂,到目前为止已检测到的成分有2500多种z挥发性成分:酸、碱等z影响烟草的感官特性及吃味特征z吸烟与健康z如何建立一种快速有效的分析方法8.HS-LPME/MALDI-FTMS分析z顶空取样与液相微萃取的结合z顶空液相微萃取适合于烟草中挥发性成分的分析前处理z基质辅助激光解析电离-傅里叶变换质谱(MALDI-FTMS)具有较高的检测灵敏度9.HS-LPME/MALDI-FTMS对挥发性酸碱进行定性分析z A.试验流程图B.顶空液相微萃取装置图液相微萃取操作过程C. MALDI靶制备过程D. HS-LPME/MALDI-FTMS分析试验内容z萃取溶剂,萃取溶剂体积,萃取温度,萃取时间一定z不同加热温度的影响,考察了60、80、100、120、140摄氏度下萃取情况,结果如图z不同NaOH溶液体积的影响,分别考察了1,2,3,4ml,结果如图z不同浓度NaOH处理的影响,现仅考察了0.1mol/l及0.5mol/l的NaOH 溶液,结果如图①不同加热温度的图谱②加入不同体积的0.1mol/l的NaOH处理后的图谱③不同浓度的NaOH(0.1mol/l,0.5mol/l)处理的图谱通过试验初步确定了以下条件z据目标物性质而选定的萃取溶剂---[水:丙酮(1:1)+ 三氟醋酸(几滴)+ 2,5-二羟基苯甲酸],在室温,萃取溶剂2μl,萃取时间10min的前提下z用2ml 0.1mol/lNaOH溶液处理烟样后,在95摄氏度下加热,所得的图谱效果较好z经典图谱如下:通过该图谱及精确分子量计算,基本可以确定所测到的碱的可能结构如下,可通过二级质谱进一步确认。
离子液体原位交换分散液相微萃取—紫外分光光度法测定环境水的莠去津王钰;沙鸥;崔博文;冯艳丽;刘华;刘莹;孙阳;赵伟强【摘要】应用原位交换离子液体分散微萃取技术,建立了紫外分光光度法测定水中莠去津的新方法.研究了萃取剂种类及体积、交换剂体积、pH、振荡时间、冰浴时间、离心时间对萃取率的影响,确定了最佳萃取条件.莠去津在0.1~10.0 mg/L质量浓度范围内呈良好线性关系,线性回归方程为Y=0.178 34X+0.026 91,相关系数为0.999 68.该方法用于实际水样的分析,回收率在90.4%~110.6%之间,结果令人满意.【期刊名称】《淮海工学院学报(自然科学版)》【年(卷),期】2018(027)003【总页数】5页(P34-38)【关键词】原位生成离子液体;紫外分光光度法;莠去津【作者】王钰;沙鸥;崔博文;冯艳丽;刘华;刘莹;孙阳;赵伟强【作者单位】淮海工学院化学工程学院,江苏连云港222005;淮海工学院化学工程学院,江苏连云港222005;江苏省海洋资源开发研究院,江苏连云港222005;淮海工学院化学工程学院,江苏连云港222005;淮海工学院药学院,江苏连云港222005;淮海工学院化学工程学院,江苏连云港222005;淮海工学院化学工程学院,江苏连云港222005;淮海工学院化学工程学院,江苏连云港222005;淮海工学院化学工程学院,江苏连云港222005【正文语种】中文【中图分类】O6570 引言莠去津(atrazine,ATZ)是一种三嗪类除草剂,学名2-氯-4-乙氨基-6-异丙氨基-1,3,5-三嗪,又名阿特拉津,主要用于玉米、高粱、甘蔗等旱田作物除草.莠去津自1959年投入生产以来,目前已被世界各国所广泛应用[1].但同时人们也发现,当莠去津被喷洒到土壤和作物表面时,仅少部分作用于目标,其大部分进入土壤,渗入地下水,造成地下水污染,或直接污染地表水.莠去津在自然环境中不易被降解,会对土壤和水质形成不同程度的污染[2].因此,莠去津浓度成为环境污染监测的一项重要指标.目前文献报道莠去津的检测方法有气相色谱法[3-4]、紫外分光光度法[5-6]、高效液相色谱法[7-8]、酶联免疫吸附法[9-10]和伏安法[11]等.对于莠去津的前处理方法也有较多研究,常见的有固相萃取(SPE)和液液萃取(LLE)两种.而这两种方法在提取或者洗脱过程中需要大量有机溶剂,给环境造成一定的负担.近年来,微萃取技术发展迅速,较为突出的有固相微萃取[12-13]和液相微萃取[14-16],其中的原位交换离子液体分散微萃取体系无需加入有机分散剂,疏水性离子液体直接于水中合成,与被分析物接触表面积大,同时完成萃取过程,具有环保、节约、操作简单快速等特点[17-18].本文采用亲水性的溴化1-辛基-3甲基咪唑([C8MIM]Br)为萃取剂、六氟磷酸铵(NH4PF6)为交换剂,在水中直接交换生成疏水性离子液体[C8MIM]PF6,然后再以[C8MIM]PF6作为萃取剂对莠去津进行萃取,并将该法应用于水样中莠去津的萃取测定.1 实验部分1.1 仪器与试剂TU-1901紫外-可见分光光度计(北京普析通用仪器有限责任公司),PHS-3C测量仪(上海宜电科学仪器有限公司),TDZ4-WS台式低速自动平衡离心机(上海市湘仪离心机仪器有限公司),XK80-A快速混匀器(江苏新康医疗器械有限公司).溴化1-辛基-3甲基咪唑(纯度99.0%)购买于上海成捷化学有限公司;六氟磷酸铵购买于上海达瑞精细化学品有限公司;莠去津原药(纯度99.0%)购买于武汉易泰科技有限公司;乙醇、甲醇均为分析纯,购买于国药集团.莠去津标准溶液(20.0 mg/L):准确称取0.020 0 g莠去津原药粉末,加水定容至1 L超声溶解,配成20.0 mg/L的标准液存放备用.溴化1-辛基-3甲基咪唑([C8MIM]Br)标准液(120.0 g/L):准确称取12.12 g溴化1-辛基-3甲基咪唑,加水定容至100.0 mL,配成120.0 g/L的标准液,置于棕色瓶中,避光保存备用.六氟磷酸铵(NH4PF6)标准液(240.0 g/L):准确称取60.0 g六氟磷酸铵粉末,加水定容至250.0 mL,存放备用.Britton-Robinson缓冲溶液:参照文献[19]配制,pH为6.0~9.0.实验中所用试剂除特别说明外,均为分析纯,实验用水为去离子水.1.2 萃取方法在体积为5.0 mL的尖底玻璃离心管中,依次加入20.0 μg莠去津或样品溶液、1 mL 120.0 g/L的[C8MIM]Br标准液、0.3 mL 240.0 g/L的NH4PF6标准液,加水定容至5.0 mL,形成浑浊溶液.然后置于快速混匀器上振荡1.5 min,接着冰浴4.0 min,以4 000 r/min速度离心3 min,完成水相和离子液体相的分离,离子液体相体积约70.0 μL.移去上层溶液,下相用无水乙醇稀释到1.0 mL后直接用微量石英比色皿进行光度法测定.2 结果与讨论2.1 萃取剂碳链长度的影响离子液体的水溶性、黏度以及吸附能力等在莠去津的富集与回收过程中起着关键作用.本实验选取[C4MIM]Br,[C6MIM]Br和[C8MIM]Br 3种离子液体进行莠去津回收率实验.以NH4PF6为阴离子交换剂与水溶性[CnMIM]Br反应生成疏水性的[CnMIM]PF6 (n=4,6,8),并以此为萃取剂对莠去津进行萃取.试验固定240.0 g/L NH4PF6加入量为0.3 mL,加入1.0 mL质量浓度均为120.0 g/L的[C4MIM]Br,[C6MIM]Br,[C8MIM]Br对莠去津进行萃取研究,结果如图1所示.由图1可以看出,随着亲水性离子液体碳链长度的增加,体系萃取率增加,且[C8MIM]Br可以对莠去津进行定量萃取.这主要是由于碳链越长,相应生成的离子液体疏水性越强,其在水中溶解度降低而导致萃取剂体积增加所致,故选择[C8MIM]Br作为萃取剂进行后继研究.图1 离子液体种类的影响Fig.1 Effect of kinds of ionic liquids2.2 pH对萃取率的影响pH是影响萃取率的重要参数,这是因为在不同的pH环境下分析物的存在形式不同.文献报道莠去津在pH=6.0~9.0时稳定存在[20],且环境水体的pH多为弱酸、中性或弱碱性,因此本研究考察pH=6.0~9.0范围内离子液体对莠去津的萃取率.实验结果如图2所示.由图2可以看出,随着pH的增加,莠去津在该pH范围内均能够定量萃取,故实验选择在中性条件下操作.在此条件下水样可直接进行萃取. 图2 pH的影响Fig.2 Effect of pH2.3 [C8MIM]Br用量对萃取率的影响[C8MIM]Br与NH4PF6混合所生成的疏水性离子液体[C8MIM]PF6用量的大小,将对萃取率产生直接影响.本实验在固定240.0 g/L的NH4PF6加入体积为0.3mL的情况下,探讨了120.0 g/L[C8MIM]Br 加入体积在0.1~1.5 mL范围内对萃取率的影响,结果如图3所示.由图3可以看出,随着[C8MIM]Br加入体积的增加,萃取率逐渐升高.当辛基咪唑的加入体积为1.0 mL时,萃取率高于95%.所以实验最终选择1.0 mL的120.0 g/L [C8MIM]Br进行莠去津吸附.图3 [C8MIM]Br体积的影响Fig.3 Effect of volume of [C8MIM]Br2.4 NH4PF6用量对萃取率的影响在原位交换分散液液萃取的过程中,NH4PF6的用量对萃取率也有一定影响.若用量过小,则置换不完全,交换所生成疏水性 [C8MIM]PF6离子液体的量过少,导致萃取不完全;过量则产生盐效应,不利于萃取.本实验固定120.0 g/L[C8MIM]Br体积为1.0 mL,加入240.0 g/L NH4PF6的体积在0.1~1.0 mL范围内进行试验,结果如图4所示.随着加入NH4PF6体积的增加,萃取率逐渐增大,当NH4PF6加入体积为0.3 mL时,萃取率最高,此后萃取率随着NH4PF6加入体积的增加而下降,故实验选择加入NH4PF6的体积为0.3 mL.图4 NH4PF6体积的影响Fig.4 Effect of volume of NH4PF62.5 振荡时间、冰浴时间以及离心时间对萃取率的影响原位交换分散液液微萃取需要通过振荡来提高交换反应的动力学,进而加快萃取进程并增强提取的效果.对此,本实验在固定其他操作条件不变的情况下,通过改变振荡时间,对莠去津的吸附进行了研究.试验结果表明,振荡时间在1.0~5.0 min内时,萃取率均高于95%;超过5.0 min后,萃取率开始下降.故实验选择振荡时间为1.5 min进行莠去津吸附.一般来说,离子液体溶解度会随着温度的降低而降低.在本实验的冰浴操作中,部分溶解在水中的离子液体会因温度降低而生成小液滴析出,再次增加与莠去津的接触面积,进而提高萃取率.但冰浴时间过久,被萃取物会由于萃取相与被萃取相存在浓度差而在此发生扩散.试验考察发现,冰浴4.0 min时,萃取率最高.因此,实验选取冰浴时间4.0 min进行莠去津吸附.实验同时考察了离心时间对于萃取率的影响.固定转速为4 000 r/min,在2.0~12.0 min内研究离心时间对萃取率影响.结果表明,离心时间大于3.0 min,离子液体相与水相分相完全,萃取率大于95%,因此选择离心时间为3.0 min.2.6 性能分析在上述优化条件下,考察了本方法的性能.莠去津溶液在0.1~10.0 mg/L的质量浓度范围内呈线性,线性方程为Y=0.178 34X+0.026 91,相关系数为0.999 68,最低检测限为0.089 6 mg/L.与进行萃取前相比,采用离子液体萃取后,莠去津的富集倍数为5倍.2.7 共存离子的影响本文考察了实际样品中可能存在的干扰情况,按照实验方法对4.0 μg/mL的莠去津标准溶液进行干扰实验,以回收率在95.0%~105.0%计为不干扰测定.结果表明,100倍的葡萄糖,淀粉,苯,Mn2+,Mg2+,Zn2+,Na+,K+,Ca2+,Al3+;20倍的氰戊菊酯、草甘膦和联苯菊酯;10倍的甲胺磷对莠去津的测定无干扰.2.8 实际水样检测应用将本法应用于实际水样(河水、自来水以及矿泉水)中莠去津的含量测定,并进行加标回收实验,结果见表1.由表可知,自来水、河水以及矿泉水中莠去津含量均低于方法检出限,加标回收率在90.4%~110.6%之间.表1 样品加标测定结果Table 1 Test results of samples and recovery样品加标量/(μg ·mL-1)检测量/(μg·mL-1)回收率/%河水0ND-5.3335.051±0.251 597.2自来水0ND-2.6672.694±0.331 1108.75.3335.713±0.301 3110.6矿泉水0ND-2.6672.509±0.249 392.85.3334.834±0.301 690.4注:ND表示未检测到.3 结论应用原位交换离子液体分散微萃取技术,建立了紫外分光光度法测定水中莠去津的新方法.该方法操作简单,绿色环保且成本较低.在对实际水样的检测中,回收率令人满意,可用于水中莠去津的快速测定.参考文献:【相关文献】[1] 苏少泉.莠去津特性与使用中的问题[J].农药研究与应用,2010(3):1-5.[2] FREER J, BAEZA C, CONTRERAS D, et al. Simultaneous determination of atrazine and sodium diclofenac in natural water by spectrophotometry approaches[J]. Journal of the Chilean Chemical Society, 2014, 59(3): 2632-2635.[3] 郭和光,吴丹青,邵国健,等.顶空-固相微萃取-气相色谱法测定甘蔗中的莠去津[J].中国卫生检验杂志,2016,26(18):2614-2615.[4] 韩静,李良,卜庆状,等.利用气相色谱法测定玉米和土壤中莠去津的方法[J].蔬菜,2015(6):11-13.[5] MARTINS E C, MELO V D F, ABATE G. Evaluation of flow injection analysis method with spectrophotometric detection for the determination of atrazine in soil extracts[J]. Journalof Environmental Science and Health, Part B, 2016, 51(9): 609-615.[6] SHAH J, JAN M R, ARA B. Determination of ametryn in sugarcane and ametryn-atrazine herbicide formulations using spectrophotometric method[J]. Environmental Monitoring and Assessment, 2012, 184(6): 3463-3468.[7] 桂学琴.固相萃取富集-高效液相色谱法测定土壤·水质中的莠去津[J].安徽农业科学,2007,35(1):6,35.[8] 潘闽君,曹茜,景明,等.原位生成离子液体分散液液萃取-高效液相色谱法测定水样中的莠去津[J].岩矿测试,2015,34(3):353-358.[9] SAI Na, SUN Wenjing, WU Yuntang, et al. A highly sensitive immunoassay for atrazine based on covalently linking the small molecule hapten to a urea-glutaraldehyde network on a polystyrene surface[J]. International immunopharmacology, 2016, 40: 480-486. [10] EL-GENDY K S, ALY N M, MOSALLAM E M, et al. Preparation of antibodies and development of an enzyme immunoassay for determination of atrazine in environmental samples[J]. Journal of Environmental Science and Health, Part B, 2011, 46(4): 321-327. [11] VORC L, RIEVAJ M, BUSTIN D. Green electrochemical sensor for environmental monitoring of pesticides: determination of atrazine in river waters using a boron-doped diamond electrode[J]. Sensors and Actuators B: Chemical, 2013, 181(5): 294-300.[12] 沙鸥,王钰,王苏南,等.固相萃取分光光度法测定敌草快含量[J].淮海工学院学报(自然科学版),2016,25(4):30-33.[13] SHA Ou, WANG Yu, YIN Xin, et al. Magnetic solid-phase extraction usingFe3O4@SiO2 magnetic nanoparticles followed by UV-Vis spectrometry for determination of paraquat in plasma and urine samples[J]. Journal of Analytical Methods in Chemistry, 2017, 2017(10): 8704639.[14] SHA Ou, LIAO Yin, ZHOU Yun, et al. Simplified cloud point extraction-flame atomic absorption spectrometry for the preconcentration/analysis of trace palladium[J]. Asian Journal of Chemistry, 2013, 25(1): 144-146[15] SHA Ou, ZHU Xiashi. Determination of gold(Ⅲ) by simplified room-temperature ionic liquid extraction with flame atomic absorption spectrometry[J]. Analytical Letters, 2014, 47(6): 1052-1062[16] SHA Ou, ZHU Xiashi. Simultaneous ionic liquid aqueous two-phase extraction and spectrophotometric determination of amaranth and brilliant blue in foodsamples[J].Journal of Analytical Chemistry, 2015, 70(5): 557-564[17] 沙鸥.离子液体液液萃取分析应用研究[D].扬州:扬州大学,2014.[18] SHA Ou, CHEN Juan, CHEN Li, et al. In situ ionic liquid dispersive liquid-liquid microextraction and d etermination of Au(Ⅲ) by flame atomic absorption spectrometry[J].Journal of the Iranian Chemical Society, 2015, 12(8): 1391-1398. [19] Division of Analytical Chemistry of the Department of Chemistry of Hangzhou University. Analytical Chemistry Handbook (Ⅰ): Basic Knowledge and Safety Knowledge[M]. Beijing: Chemical Industry Press, 1997.[20] 王振荣,李布青.农药商品大全[M].北京:中国商业出版社,1996:724-725.。
化学检测样品前处理技术摘要:近年来,在科学和信息技术不断进步的背景下,一定程度土推动了我国化学检测领域的发展,为我国工业生产效率、产品质量的提升以及技术的创新奠定了良好的基础,更重要的是,通过有效的化学检测,也对环境保护工作的顺利开展具有促进作用。
关键词:化学检测;样品;处理技术随着科学技术的不断进步发展,使得很多基础学科的研究分析工作发生了很大变化,与传统的样品检测分析技术相比较而言,当前很多化学检测在检测之前均需要不同程度地进行样品前处理,从而能够使其具有更加精确无误的检测结果。
尤其是在分析化学发展过程中,为了能够有效促进对检测样品的分析研究,其样品的前处理技术具有重要的学科地位。
并且对于分析化学来说,其样品检测技术将直接影响化学检测技术的良性发展,只有在更加精确、严谨的分析技术支持下,才能从根本层面推动我国化学分析学科的发展。
1化学检测与样品前处理技术之间的相关性分析通常情况下所谓的样品前处理技术主要应用在被检测物质进行实际检测之前,为了能够显著提升检测结果的有效性以及准确性,就需要对其进行一定的技术处理,从而保证样品不被外界环境所破坏或者变质,从而引起重大的测量误差。
例如在对环境样品进行分析检测之前,由于会受到有机物中其他杂质、所含物质的浓度偏低或者其组成成分种类相似等外界因素的干扰,往往就需要对被检测的样品进行系列地提取、净化、浓缩等处理过程,从而在使得该被检测的样品达到某个特定的标准之后再进行相对应的分析检测。
所以说,为了能够让被检测的物品达到某个特定标准,在检测之前的所有技术手段均可以称之为样品前处理技术,故上面论述中的提取、净化、浓缩等均可以视为样品前处理技术。
在化学学科的建设与发展过程中,样品前处理技术与分析化学等内容密不可分,其在很大程度上是整个化学检测的基础力量。
因此,可以认为所有的化学检测过程可以为样品前处理技术的发展提供众多的创新与发展的平台,而样品前处理技术又会反哺与化学检测,为化学检测的精确性、有效性提供重要支持,从而最终在很大程度上提升化学检测的科学性与严谨性。
分散液相微萃取
发表时间:
2019-06-06T14:15:05.083Z 来源:《健康世界》2019年4期 作者: 霍鑫
[导读] 除虫脲、灭幼脲、氟铃脲属于苯酰基脲类农药,具有杀虫、杀螨、杀线虫等生物活性,广泛用于粮食、蔬菜和水果的有害生物防
治。
——
高效液相色谱法测定水果中3种农药的残留量
乐信乐美(海南)生物科技有限公司 海南省 570311
摘要:将分散液相微萃取与高效液相色谱技术相结合,建立了水果样品中除虫脲、灭幼脲和氟铃脲残留农药分析的新方法。对影响萃
取和富集效率的因素进行优化。萃取条件选定为:在
5.0 mL水果样品溶液中迅速加入60.0 μL萃取剂四氯化碳和1.0mL乙腈分散剂,分散均
匀后以
3200 r min-1 离心5 min,四氯化碳沉积到试管底部,取尽吹干用流动相复溶后高效液相色谱测定。3种杀虫剂的检出限在0.5 ~ 1.5
μg·kg -1
(S / N = 3:1)之间;线性范围为10 ~ 160 μg·kg -1;相关系数在0.9981 ~ 0.9988之间;平均添加回收率在83.0 % ~ 94.7 % 之
间;相对标准偏差小于
6.1 %。本方法已成功应用于实际水果样品中3种残留农药的测定,方法的准确度、精密度和灵敏度均达到农残分析
要求。
关键词:分散液相微萃取;高效液相色谱;苯甲酰脲类农药
1 引言
除虫脲、灭幼脲、氟铃脲属于苯酰基脲类农药,具有杀虫、杀螨、杀线虫等生物活性,广泛用于粮食、蔬菜和水果的有害生物防治。
对人畜毒性相对较低,是我国农业部推荐的无公害农药品种,但其残留对人体有潜在危险。因此,建立水果中这类残留农药测定方法具有
十分重要的意义。
苯甲酰脲类农药残留的样品前处理方法主要有液液萃取[1]、固相萃取[2]、基质分散固相萃取[3]等。这些前处理方法操作繁琐、灵敏
度、准确度和重现性差,且样品用量较大;需要使用大量对人体和环境有毒或有害的有机溶剂。
2006年,Rezaee等首次提出了分散液相微
萃取技术(
DLLME)[4],该技术集采样、萃取和浓缩于一体,操作简单、快速、成本低,有机溶剂用量少,对环境友好,灵敏度和富集效
率高。分散液相微萃取技术大多应用于环境和水样中痕量物质残留的分析。目前将分散液相微萃取高效液相色谱法应用于水果苯甲酰脲类
残留农药的检测还未见报道,本实验建立了苹果样品中
3种农药的分散液相微萃取高效液相色谱的分析方法,取得了满意的结果。
2 实验部分
2.1 仪器与试剂
Agilent 1100 高效液相色谱仪、G1315B DAD 检测器;农药对照品(购于农业部环境保护科研监测所);二氯甲烷、氯仿、四氯化
碳、四氯乙烷、甲醇、丙酮、四氢呋喃、乙腈和无水乙醇等有机溶剂均为色谱纯;
2.2 高效液相色谱条件
色谱柱:Kromasil C18 柱(250 mm × 4.6 mm,5 μm);线性梯度洗脱方式:流动相A为水,流动相B为甲醇,洗脱程序为B从80%线
性增加至
100;分析时间:25min。检测波长:254nm;流速:1.0 mL·min-1;柱温:25 °C。进样量:20.0 μL。
2.3 样品前处理
将水果样品在组织捣碎匀浆机中捣碎后,称取20.0 g分装于5 mL离心试管中,振荡摇匀后,12000 r ·min-1离心10 min,0.45 μm滤膜
过滤,用水定容到
25 mL量瓶中。得到的水果样品溶液按“2.4实验方法”进行萃取、测定。
2.4 实验方法
精密移取5.0 mL水果样品溶液,置10 mL带塞尖底离心管中,加入0.25 g NaCl,将含有60.0 μL四氯化碳的1.0 mL乙腈溶液快速注入离
心管中,轻轻振荡
30 s,混合液则形成一个水/乙腈/四氯化碳的乳浊液体系,四氯化碳均匀地分散在水相中。室温放置5.0 min,以3200 r
·min-1
离心5 min,四氯化碳沉积到试管底部,用微量进样器吸尽萃取溶剂并转移到0.5 mL离心管中,室温下吹干,用100.0 μL流动相溶
解,取
20.0 μL进行色谱分析。
3 实验结果与讨论
3.1 萃取剂种类和体积的选择
萃取剂需满足一定的要求:①密度必须大于样品溶液和分散剂;②对待测物有较高的萃取能力;③不易溶于样品溶液易溶于分散剂。
本试验分别考察了二氯甲烷、二氯乙烷、氯仿、四氯化碳、四氯乙烷对农药的萃取能力,结果表明四氯化碳有较高的萃取效率。为了评价
萃取剂体积对萃取效率的影响,在分散剂体积不变的条件下,依次分别加入
40.0,60.0,80.0和100.0 μL四氯化碳,结果表明:当四氯化碳
体积为
60.0 μL时,萃取效率最高。
3.2 分散剂种类和体积的选择
分散液相微萃取方法要求分散剂必须与水和萃取剂有良好的溶解能力。这样可以使萃取溶剂在水相中均匀的分散成细小的液滴,使溶
液形成一个水
/分散剂/萃取剂的乳浊液体系,增大萃取溶剂与待测物的接触面积,从而提高萃取效率。本实验以乙腈、丙酮、四氢呋喃、甲
醇为考察对象。结果表明:乙腈的萃取效率最高。分散剂的体积直接影响乳浊液体系的形成,它会通过影响萃取剂在水中的分散程度来影
响萃取效率。乙腈体积小时,萃取剂不能均匀的分散在水相中,体积较大时,待测物在水中的溶解度加大不易被四氯化碳萃取。考察了乙
腈体积(
0.3,0.5,0.8,1.0和1.2 mL)对萃取效率的影响。结果显示:乙腈体积为1.0 mL时萃取效率最高。
3.3 萃取时间的选择
在分散液相微萃取中,萃取时间是指在水相中注入了含有四氯化碳的乙腈混合液后到开始离心之前这段时间。将萃取时间分别设置为
5.0
,10.0,15.0,20.0和30.0 min。实验结果表明:萃取时间对萃取效率没有显著地影响。故实验选取萃取时间为5.0 min。
3.4 盐浓度的影响
由于盐析效应,在样品基质中加入盐能降低待测物在基质中的溶解度,使更多的待测物转移到有机相中,从而提高萃取效率。分别考
察了
NaCl浓度在0 %,1 %,3 %,5 %和10 %(w/v)时对5种农药萃取效率的影响。结果表明:当样品中加入NaCl浓度为5 %时,5种农
药的萃取效率最高。
3.5 方法的线性关系和检出限
分别准确称取20.0 g已经匀浆的空白水果样品分装于5 mL带塞离心试管中,加入适量除虫脲、灭幼脲、氟铃脲、氟虫脲的混合标准溶
液,然后按
“2.3 样品前处理”方法进行处理,得到系列混合标准溶液。按“2.4 实验方法”萃取,以待测物的峰面积Y对浓度X(μg·kg -1)作标
准曲线进行测定。
3种农药的线性关系良好,结果见表1。检出限(S/N=3)在 0.5~1.5 μg·kg -1 之间,可满足实际样品的测定。
表 1 苹果样品中DLLME-HPLC方法的分析数据
4 结论
本实验建立了分散液相微萃取高效液相色谱技术快速、灵敏的分析苹果样品中3种杀虫剂残留的新方法。实验结果表明,与传统的萃取
方法相比,本方法具有操作简单、快速、准确、低成本、环境友好等优点。目前分散液液微萃取技术主要用于水样中痕量成分的测定,而
本实验将该技术用于复杂基质的水果样品的测定,取得满意的结果,这对于拓宽分散液相微萃取技术的应用范围具有指导意义。
参考文献:
[1] LI Jing(李晶),DONG Feng-Shou(董丰收),LIU Xin-Gang(刘新刚),YAO Jian-Ren(姚建仁),DU Chuan-Yu(杜传
玉),
ZHENG Yong-Xin(郑永权).Pesticide Science and Administration,(农药科学与管理),2008,29(2):19~22
[2] ZHANG Qing-Ming(张清明),HUA Ri-Mao(花日茂),TANG Feng(汤 锋),LI Xue-De(李学德),CAO Hai-Qun(操海
群)
.AGROCHEMICALS,(农药),2008,47(7):519~520
[3] DING Hui-Ying(丁慧瑛),XIE Wen(谢文),ZHOU Zhao-Qian(周召千),LI BO(李铂),JIANG Qin-Ting(蒋沁
婷)
.Journal of Instrumental Analysis,(分析测试学报),2009,28(8):970~974
[4] RezaeeM,Assadi Y,Milani HosseiniM R,Aghaee E,Ahmadi F,Berijani S.J.Chrom atogr.A,2006,1116:1~