高温液态水中烟腈水解反应动力学
- 格式:pdf
- 大小:616.87 KB
- 文档页数:5

硕士学位论文论文题目DMF水解动力学研究作者姓名揭才兴指导教师南碎飞学科(专业) 化学工程所在学院材料与化工学院提交日期二零零八年九月A Dissertation Submitted to Zhejiang Universityfor The Degree of MasterResearch on hydrolysis dynamics of DMFWritten byJie CaixingSupervised byAssociate Prof.Nan SuifeiMajoring in Chemical EngineeringCollege of Materials Science & Chemical EngineeringZhejiang UniversitySeptember, 2008摘要二甲基甲酰胺(DMF)是一种优良的工业溶剂和有机合成材料,它在中性条件下性质稳定,但在酸性或碱性条件下易发生水解。
工业生产DMF工艺或在DMF回收工艺中,常含有甲酸导致DMF容易发生水解,而使生产过程中的酸度增大,对设备造成损害,同时也产生不合格的产品。
本文分别研究了常压下反应时间、含水量、温度、酸度的变化对DMF水解的影响;然后以水解实验数据为基础,建立了DMF水解反应的动力学模型,并计算出实验温度条件下DMF水解反应的活化能(E a)。
实验研究结果表明:常压下,DMF在酸性条件下易水解,水解率随反应时间线性增大,反应7小时后水解率达到0.0346%;当水含量较大时(>15%),随着水分含量的增加,DMF的水解率增大,当水含量较小时(<5%),DMF水溶液反应3小时后酸度反而减小,且水分含量越小,酸度减小幅度越大;当温度小于110℃时反应3小时基本不水解,温度高于110℃后水解率大幅度增大;当温度为130℃,水分含量约为20%时DMF溶液水解3小时后,水解前后酸度变化幅度随着反应前溶液酸度增加先减小后增大并趋于稳定。

高温条件下蛋白质水解酶催化反应动力学参数计算模型推导蛋白质水解酶是一种广泛存在于生物体内的酶类,并在许多生物过程中起到重要的催化作用。
在高温条件下,蛋白质水解酶的催化反应动力学参数计算模型成为研究的一个重要方向。
本文将介绍一个基于热力学和动力学原理的计算模型,用于推导高温条件下蛋白质水解酶催化反应动力学参数。
首先,我们需要了解蛋白质水解酶的催化机制。
蛋白质水解酶将底物蛋白质分子切割成小片段,其中关键的步骤是底物与酶的结合以及底物水解过程。
在高温条件下,酶和底物分子的热运动变得更加剧烈,催化反应的速率也会发生变化。
基于催化反应的速率方程,我们可以推导出蛋白质水解酶催化反应的动力学表达式。
根据酶底物复合物的形成速率和解离速率,可以得到酶底物复合物的动力学参数。
在高温条件下,酶底物复合物的动力学参数可能会发生变化。
为了计算这些参数,我们可以使用热力学模型。
热力学模型考虑了高温下酶和底物分子的热运动效应,并将其纳入到动力学方程中。
具体地,我们可以使用Arrhenius方程来描述高温条件下酶的活性。
Arrhenius方程表示了活化能与反应速率之间的关系。
在高温条件下,活化能会发生变化,因此我们需要重新计算反应速率常数。
通过推导出的动力学表达式和热力学模型,我们可以对高温条件下蛋白质水解酶催化反应的动力学参数进行计算。
这些参数包括反应速率常数、活化能和催化常数等。
为了验证我们的计算模型的准确性,我们可以进行实验。
在实验中,我们可以通过测量蛋白质水解酶催化反应的速率,并与计算模型预测的结果进行比较。
如果实验结果与计算模型相符,那么我们可以认为这个计算模型是可靠的。
总结起来,高温条件下蛋白质水解酶催化反应动力学参数的计算模型是一项重要的研究课题。
通过推导动力学表达式和应用热力学模型,我们可以计算出反应速率常数、活化能和催化常数等参数。
通过实验证实模型的准确性,这将为我们更好地理解和研究蛋白质水解酶的催化机制提供重要的帮助。

五硼酸钾高温水解反应动力学的初步研究卞佳;杨刚;王云山;张金平【摘要】五硼酸钾过热的水蒸气气氛发生水解反应.其中温度与蒸汽流量是反应最重要的影响因素.温度在1173 K时,熔体的B2O3/K2O降至3.1;加大蒸汽流量,可将熔体的B2O/K2O降至2.6.对水解反应的机理进行了初步的研究,认为在高温与蒸汽的作用下KB5O8结构中一部分硼氧键断裂与水分解后产生的H+离子结合形成挥发性的HBO2.分离出羟基与剩下的硼酸盐网络结构进行连接,在高温条件下,两个羟基中的一个O进入硼氧网络结构中,剩下的形成水释出,同时K2O的浓度相对增加.反应动力学研究表明五硼酸钾低于熔点时与水蒸汽的反应受外扩散控制;对高于熔点的动力学实验数据进行了线性拟合,获得了线性方程.【期刊名称】《天津化工》【年(卷),期】2015(029)003【总页数】5页(P15-18,23)【关键词】五硼酸钾;高温水解;动力学;线性拟合【作者】卞佳;杨刚;王云山;张金平【作者单位】天津厚普技术检测有限公司,天津300071;中国科学院过程工程研究所湿法冶金清洁生产技术国家工程实验室,天津300071;中国科学院过程工程研究所湿法冶金清洁生产技术国家工程实验室,天津300071;中国科学院过程工程研究所湿法冶金清洁生产技术国家工程实验室,天津300071【正文语种】中文【中图分类】TQ128+.54五硼酸钾,是一种非线性光学晶体,可作为良好的激光材料,已有不少的学者进行过研究[1~3]。
同时五硼酸钾在特种玻璃、金属焊接、金属精炼、润滑油添加剂等领域具有较为广泛的用途,也可作为氮化硼的原料[3]。
鉴于KB5O8在高温下的应用,一些学者对其高温熔融状态的性质进行了研究,包括物理性质如密度、粘度及表面张力等[4,6]。
一些学者借助特定的分析仪器对K2O-B2O3体系熔融结构进行了研究,包括Raman光谱分析[7,8]、中子衍射[9]等,重点研究高温熔融态碱金属硼酸盐随碱金属氧化物浓度变化对结构的影响。

uf4水解反应动力学研究
uf4水解反应动力学研究主要集中于该反应的活性,反应条件,反应产物以及影响反应速率的因素。
以下为uf4水解反应动力学研究的几个方面:
一、反应活性:uf4水解反应具有很高的活性,可在pH=4-10范围内进行。
二、反应条件:uf4水解反应的反应条件主要由反应温度,反应物浓度,离子强度,缓冲液种类以及反应时间等条件来决定。
三、反应产物:uf4水解反应的反应产物主要有氟离子,氢离子,氧离子,氮离子等。
四、影响反应速率的因素:uf4水解反应速率会受反应温度,反应物浓度,pH值,催化剂类型以及配体种类等因素的影响。
;。
第七章 化学动力学 四、精选题及解例7-1某溶液中反应 A+B → C,设开始时 A 与 B 物质的量相等,没有C , 1小时后 A 的转化率为75%,求2小时后 A 尚余多少未反应 ? 假设 (1)对 A 为1级,对 B 为0级 (2) 对 A 、B 皆为1级 (3)对 A 、B 皆为0级。
解A A B d d c kc c tαβ-= (1)AA d d c kc t-=22111ln111ln 1y t y t k -=-= 代入 211ln2175.011ln11y -=- 解得未转化的A 为21y -=6.25% (2)2A AB A d d c kc c kc t -==)111(1)111(12211--=--=y t y t k 代入 )111(21)175.011(112--=--y 解得未转化的A 为21y -=14.29%(3)d d A c k t -=A,0A,0A,0A,0(1)1()c c y c y k c c t t t--=-== 即A,01A,0212c y c y t t =代入2175.02y =2 1.51y => 说明反应物不到2小时以前已消耗完。
【点评】 本题抓住具有简单级数化学反应的动力学规律以及转化率的定义。
如对一级反应,若以产物表示反应速率,则111ln ln1a k xt a x t a==-- 其中,xa为反应物A 的转化率,写为y 时,得11ln1k t y=- 当温度不变时,k 不变,这样可通过联立方程求解,可求得2h 后尚余A 的百分比(1-y )。
对其他简单级数的反应也可类似求解。
例7-2 恒温恒容的反应器中进行某一级的气相反应A B + C反应刚开始时,只有 A 存在,压力为A,0p ;反应进行到 t 时刻时,反应器的压力可测为p ,请设计实验及实验表格,以求解该反应的速率系数。
解A B C →+0t =A,O p 0 0t t =A A,O B p p p =-B p C B p p =体系总压力 A,O B B B A,O B p p p p p p p =-++=+ ; B A,O p p p =- 反应物A 分压力 A A,O B A,O A,O A,O ()2p p p p p p p p =-=--=-对一级反应: A,O A,O A A,O 111ln ln ln2o p p c k t c t p t p p===- 若在实验中,测定A,O p 及不同时间的总压力p ,代入上式可求速率系数k ,实验记录设计见附表,附表如下时间/单位 /p k P a A ,0/p k P a A ,0(2)/p p k P a -A,0A ,0ln 2p p p -A ,0A ,01ln 2p k t p p =-: : : : :或将上式变形 A,O A,O 1ln2p t k p p =- ,以 A,O A,O ~ln 2p t p p-作图,从斜率1m k = 求速率系数k 。
高温液态水中木糖无催化分解反应动力学1.高温液态水中木糖分解反应机理研究:1.高温液态水中木糖分解反应机理研究木糖是一种天然的有机物质,具有较高的抗氧化性和抗菌性,可用于食品加工、药物制剂和精细化工等领域。
木糖在高温液态水中的分解反应机理研究一直是研究者关注的焦点。
研究表明,在高温液态水中,木糖分解反应是一个复杂的过程,包括水解、热解、缩合、氧化等反应。
在水解反应中,木糖经过水解分解,产生糖醛和糖酸;在热解反应中,糖醛和糖酸经过热解分解,产生糖醇、糖酯、糖醛酸和糖酸酯;在缩合反应中,糖醇和糖酯经过缩合反应,产生芳香醇、芳香酯等;在氧化反应中,芳香醇和芳香酯经过氧化反应,产生醛和酮类物质。
此外,研究还发现,木糖在高温液态水中的分解反应受到温度、pH值、添加剂等多种因素的影响,因此,控制这些因素对于改善木糖分解反应的效率具有重要意义。
2.高温液态水中木糖分解反应动力学模型高温液态水中木糖分解反应动力学模型是基于热力学和化学反应原理,用于描述木糖在高温液态水中的分解反应过程。
它可以用来研究木糖分解反应的动力学参数,如反应速率常数、反应活化能、反应机理等。
该模型可以帮助研究人员更好地理解木糖分解反应的机理,从而提高木糖分解反应的效率。
首先,该模型需要确定木糖分解反应的反应机理,以及反应过程中参与的物质和反应物。
其次,需要确定反应速率常数,以及反应活化能,这些参数可以通过实验测量得到。
最后,需要建立木糖分解反应的动力学方程,以描述木糖分解反应的变化过程。
通过建立高温液态水中木糖分解反应动力学模型,可以更好地理解木糖分解反应的机理,从而提高木糖分解反应的效率。
3.高温液态水中木糖分解反应参数研究木糖是一种重要的植物多糖,具有多种生物活性,广泛应用于食品、医药、农药、化妆品等领域。
木糖在高温液态水中的分解反应具有重要的理论意义和实际应用价值。
本文以高温液态水为介质,研究了木糖分解反应的动力学参数。
首先,确定了木糖分解反应的反应器、介质、反应温度和催化剂等实验条件。
近临界水自催化下亚氨基二乙腈水解反应研究段培高;王炫;戴立益【摘要】亚氨基二乙腈在没有外加催化剂的近邻界水中可以顺利发生水解.实验测定了亚氨基二乙腈在近临界水中(压力10MPa,温度200~260℃,反应时间10~60min)的水解反应动力学数据并考察了时间、温度、压力和初始反应物/水比对反应物转化率和产物产率的影响.在最佳反应条件下,210℃、压力10MPa、反应时间20min,反应物几乎完全转化,此时亚氨基二乙酸的产率可达到92.3mol%.根据一级反应动力学,得到反应的表观活化能Ea和lnA(min-1)分别为(45.77±5.26)kJ/mol 和8.6±0.1.最终反应产物主要包括亚氨基二乙酸和氨以及少量的副产物,反应过程中除生成的氨气外其它气体的生成可以忽略.近临界水中亚氨基二乙腈的水解反应机理和普通碱催化条件的水解反应机理相似.【期刊名称】《功能材料》【年(卷),期】2007(038)011【总页数】5页(P1845-1848,1852)【关键词】近临界水;自催化;亚氨基二乙腈;亚氨基二乙酸;水解【作者】段培高;王炫;戴立益【作者单位】华东师范大学,上海市绿色化学与化工过程绿色化重点实验室,上海,200062;华东师范大学,上海市绿色化学与化工过程绿色化重点实验室,上海,200062;华东师范大学,上海市绿色化学与化工过程绿色化重点实验室,上海,200062【正文语种】中文【中图分类】工业技术段培高等:近临界水自催化下亚氨基二乙腈水解反应研究近临界水自催化下亚氨基二乙腈水解反应研究’段培高,王炫,戴立益(华东师范大学上海市绿色化学与化工过程绿色化重点实验室,上海 200062)摘要:亚氨基二乙腈在没有外加催化剂的近邻界水中可以顺利发生水解。
实验测定了亚氨基二乙腈在近临界水中(压力 lOMPa ,温度 200 —260 ℃ ,反应时间10 —60min) 的水解反应动力学数据并考察了时间、温度、压力和初始反应物/水比对反应物转化率和产物产率的影响。
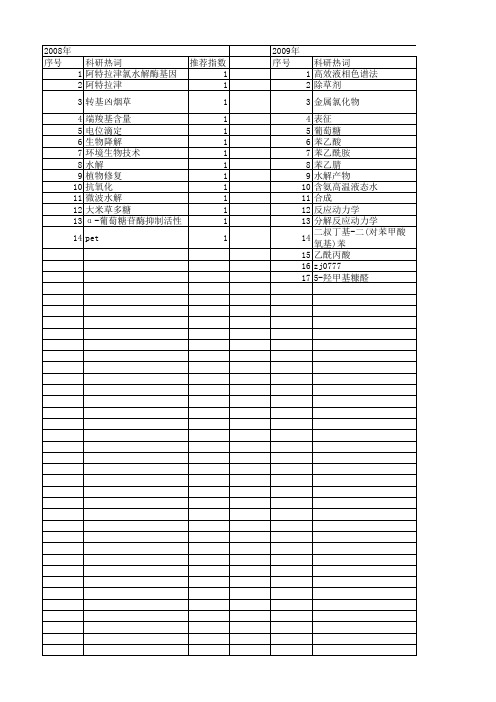
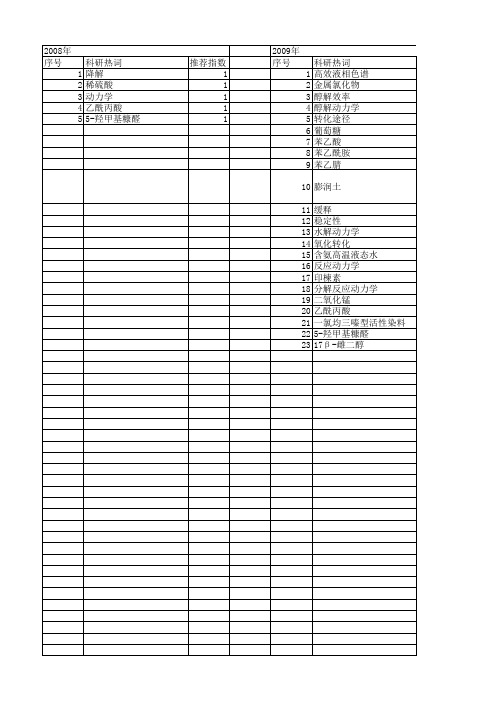
第43卷第9期2009年9月浙 江 大 学 学 报(工学版)Journal of Zhejiang U niver sity (Eng ineering Science)Vol.43No.9Sep.2009收稿日期:2008-06-20.浙江大学学报(工学版)网址:w w w.journals.z /eng基金项目:国家自然科学基金资助项目(20674068);高等学校博士学科点专项科研基金资助项目(20050335099).作者简介:石超君(1984-),女,湖南常德人,硕士生,从事近临界水中化学反应的研究.E -mail:yyshi926@通信联系人:吕秀阳,男,研究员,博导.E -mail:lu xiuyang@DOI:10.3785/j.issn.1008-973X.2009.09.026高温液态水中烟腈水解反应动力学石超君,吕秀阳(浙江大学化学工程与生物工程学系,浙江杭州310027)摘 要:为了开发烟酸和烟酰胺的绿色制备方法以及探讨高温液态水中腈类物质的水解规律,研究了高温液态水中烟腈的无催化水解反应动力学.考察了实验数据的重现性以及烟腈初始质量浓度对反应动力学的影响,测定了483115~523115K 下烟腈及其水解的中间产物烟酰胺的水解反应动力学数据.结果表明,在不同的实验条件下,烟腈水解可以高选择性地得到烟酰胺或烟酸;烟腈水解为一级连串反应;烟腈和烟酰胺水解反应活化能分别为6512和8518kJ/mol;本研究为烟酸和烟酰胺的绿色制备以及高温液态水中腈类化合物水解规律的探讨提供了重要的基础数据.关键词:高温液态水;烟腈;烟酸;烟酰胺;无催化水解;反应动力学中图分类号:T Q 031.5;O 643.12 文献标志码:A 文章编号:1008-973X(2009)09-1692-05Kinetics of 3-cyanopyridine hydrolysis in high temperature liquid waterSH I Chao -jun,LV Xiu -yang(D ep ar tment of Chemical and Biochemical Engineer ing ,Zhej iang Univ er sity ,H angz hou 310027,China)Abstract:H y dro lysis of 3-cyanopyridine in hig h temperature liquid w ater w as determ ined w ithout added catalysts in order to ex ploit gr een preparation technolog y of nicotinic acid and nicotinam ide.The hy dro lysis reactio n kinetics of 3-cyanopy ridine and its inter mediate nicotinam ide was studied from 483115to 523115K after inv estig ating the r epeatability of experiment data and the influence o f initial concentration of 3-cyan -o py ridine o n r eaction.Results show ed that selective pr oduction of nicotinam ide or nicotinic acid w as poss-i ble at differ ent reaction conditio ns;the hydrolysis of 3-cyanopy ridine w as consecutiv e first -order reaction;the activ ation energ ies ev aluated w er e 6512kJ/m ol for 3-cy anopyridine hy dro lysis and 8518kJ/mo l fo r nic -o tinamide hydroly sis.The r esults pro vide an important basic data for the green preparation of nicotinic acid and nicotinamide and explor ing the rule of nitriles hydr olysis in high temperature liquid w ater.Key words:hig h temperatur e liquid w ater;3-cy anopyridine;nicotinic acid;nicotinamide;non -catalyzed hy dro lysis;kinetics腈类化合物的水解已经被广泛应用于氨基酸、酰胺、羧酸及其衍生物的合成,在有机合成中占有非常重要的地位[1-3].烟腈,学名为3-氰基吡啶(CP),其水解中间产物烟酰胺(学名为吡啶-3-甲酰胺,NSA )和最终产物烟酸(学名为吡啶-3-甲酸,NA ),同属于维生素B 族,是一类很有发展前景的重要精细化学品.烟酸和烟酰胺作为一种常用维生素,广泛应用于医药行业、饲料和食品添加剂、染发助剂、聚合物稳定剂、感光材料的抗氧化剂和抗灰雾剂等[4-5].因此,研究烟酸和烟酰胺系列化合物的合成具有重要的现实意义.目前烟酸和烟酰胺的生产方法多达十几种[6-10],在工业上,烷基吡啶氨氧化法是广泛采用的一种方法.但是上述合成方法均存在催化剂选择和回收不完善、反应过程污染严重、原料利用率低等问题.高温液态水(high temperatur e liquid water,H TLW),通常是指温度在200~350e的压缩液态水.由于H T LW自身具有酸催化与碱催化的功能、能同时溶解有机物和无机物以及H TLW物性的可调性等[11-12]特性,在反应、分离、废弃物再资源化等领域具有广阔的应用前景[13-14],具有能减少甚至消除无机酸、碱的使用,过程绿色等优点.Kramer 等[2-3]研究了脂肪族腈类(如乙腈、异丁腈)、芳香族腈类(如苯甲腈)在高温液态水中的水解,但是关于含吡啶环的腈类在高温液态水中的水解,国内外未见相关报道.本文拟利用高温液态水的特性,开展在高温液态水中不添加任何催化剂情况下烟腈水解制备烟酸和烟酰胺的研究,通过对烟腈水解反应动力学的测定,揭示其反应规律,为烟酸和烟酰胺的绿色制备提供新的思路,为系统探讨腈类化合物在高温液态水介质中的水解提供重要的基础数据.1实验部分1.1实验材料、装置与实验过程烟腈:上海邦成化工有限公司(质量分数大于9910%);烟酸、烟酰胺:成都科龙化工有限公司(质量分数大于9915%);甲醇、乙腈:默克,色谱纯;磷酸:上海试剂厂,分析纯.实验装置与实验过程同文献[15].1.2分析检测方法水解产物由GC-M S(Agilent6890GC/ 5973MSD气质联用仪)和标准品对照定性.水解产物的质量浓度测定采用外标法,由Agilent1100定量分析.采用的液相色谱条件如下:KNAUER-C18色谱柱( 4mm@250mm);流动相为0105mol/L 磷酸水溶液、甲醇和乙腈的混合物,其中0105 mol/L磷酸水溶液、甲醇和乙腈的体积比为47B50 B3;体积流量为014mL/m in;柱温为35e;进样量为5L L,检测波长为210nm.2实验结果及讨论2.1烟腈初始质量浓度对水解反应的影响在8MPa,温度T=493115K,转速为300 r/min的条件下,测定了0150、0175、1100g/L3个烟腈初始质量浓度对水解反应转化率C的影响,结果如图1所示.从图1可见,在实验范围内,烟腈的初始质量浓度对水解反应的影响很小.在下面的实验中,烟腈的初始质量浓度均选定为0150g/L.图1烟腈初始质量浓度对水解反应转化率的影响F ig.1Effects of initial co ncentrat ion of on3-cyanopyr-idine co nv ersio n2.2烟腈水解重现性实验在8M Pa,493115K,转速为300r/m in,烟腈初始质量浓度为0150g/L的条件下进行了3次重现性实验,结果如图2所示.从图2可以看出,实验数据的重现性良好.图2高温液态水中烟腈水解重现性实验Fig.2R epeatability tests fo r3-cy ano py ridine hy dr oly-sis in H T L W2.3温度对烟腈水解的影响在8M Pa,转速为300r/min,烟腈初始质量浓度为0150g/L的条件下,测定了不同温度(483115 ~523115K)下烟腈的水解反应动力学数据,图3~ 5分别为不同温度下烟腈转化率、烟酰胺收率Y NSA 和烟酸收率Y NA随反应时间t的变化曲线.从图3可以看出,温度对烟腈的水解反应影响很大,在t=90m in,523115K时烟腈的转化率已经达到90%以上,而483115K时的转化率只有4417%.烟酰胺收率的极大值随T变化的数据如图6所示,图6给出了在实验范围内烟酰胺收率到达极值点Y max N SA所需的时间.从图5可见,温度对烟酸收率的影响较大,烟酸收率随着反应温度的升高和反应时间的延长而增大.图7是温度和反应时间对烟腈水解产物烟酰胺和烟酸总选择性S的影响.1693第9期石超君,等:高温液态水中烟腈水解反应动力学2.4温度对烟酰胺水解反应的影响为了进一步研究烟腈水解反应动力学,在与烟腈水解相同的反应条件下,测定了不同温度(483115 ~523115K)下烟酰胺的水解反应动力学数据,图8为温度和反应时间对烟酰胺转化率的影响,图9为温度和反应时间对烟酸收率的影响.从图8可以看出,温度对烟酰胺的转化率有较大的影响.从图9可以看出,烟酰胺水解生成烟酸具有很好的选择性,同时烟酸在近临界水中具有较好的稳定性.2.5反应动力学烟腈的水解反应是一个典型的连串反应,中间产物是烟酰胺,最终产物是烟酸,其水解反应式如下:1694浙江大学学报(工学版)第43卷由图1可知,初始质量浓度对烟腈的水解基本上没有影响,假定烟腈水解是一级连串反应,设Q CP、Q NS A和Q NA分别为烟腈、烟酰胺和烟酸的质量浓度, Q CP,0为烟腈的起始质量浓度.一级连串反应的反应速率可以表达如下:-d Q CPd t=k1Q CP,(1)d Q NSAd t=k1Q CP-k2Q NS A,(2)d Q NAd t=k2Q NSA.(3)式中:k1、k2分别为烟腈水解和烟酰胺水解的反应速率常数.将式(1)积分可得Q CP=Q CP,0ex p(-k1t).(4)将式(4)代入式(2)、(3),再积分可得Q NS A=k1Q CP,0k2-k1[ex p(-k1t)-ex p(-k2t)],(5)Q NA=Q CP,0[1-k2k2-k1ex p(-k1t)+k1k2-k1#ex p(-k2t)].(6)将式(4)变形为ln(1-x)=-kt,以ln(1-x)对t 作图拟合烟腈水解(图3)和烟酰胺水解(图8)的实验数据,即可求得k1、k2(表1).用A rrhenius方程关联表1中的数据,如图10所示,得到烟腈连串水解反应的活化能E a1、E a2分别为6512和8518kJ/m ol,指前因子分别为8171@104和1153@106m in-1.于是可知烟腈水解反应的速率常数的表达式如下: k1=8.71@104ex p(-6.52@104/(RT)),k2=1.53@106ex p(-8.58@104/(RT)).式中:R为摩尔气体常量.再将k1、k2代入式(5)、(6),可以计算出烟腈水解反应中烟酰胺和烟酸的收率(图4、5)和烟酰胺水解反应中烟酸的收率(图9),可以看出,在实验范围内,计算值与实验值非常接近,证明模型假设是合理的,烟腈水解反应是一级连串反应.表1不同温度下烟腈水解反应速率常数T ab.1Ev aluated k1and k2o f3-cyano py ridine hydro lysis at differ ent t emperat ur eT/K k1/min-1k2/min-148311501007901000721493115010113010013205031150101460100206051311501018001002770523115010255010038102.6实验结果讨论烟腈在高温液态水中有较大的溶解度,同时实图10烟腈水解反应的Arrhenius图F ig.10A r rhenius plo t for3-cyanopy ridine hydrolysis验表明转速(200~400r/min)对烟腈水解反应的影响不大,因此在实验浓度范围内烟腈在高温液态水中水解是在均相中进行的.常温常压下的腈类水解或酰胺水解需加入强酸强碱催化剂,但在HTLW环境中,作为反应介质的水的电离常数明显增大,对水解反应有一定的催化作用.由图7可知,在实验范围内,反应温度和反应时间对产物的选择性影响很小,烟腈水解产物有较高的选择性,几乎没有副反应发生.温度对烟腈水解反应有很大的影响,主要体现在两个水解反应的活化能差异上,由于E a1<E a2,当温度升高时,k1/k2的比值减少,即k1随温度的增加倍数小于k2的增加倍数,由此可见,高温有利于活化能较高的烟酰胺水解成烟酸的反应,而低温则有利于活化能较低的烟腈水解成烟酰胺的反应.因此,可以通过控制水解反应的温度来高选择性地制备烟酰胺或烟酸.从图4、6可知,烟酰胺的收率有一极大值,随着温度的升高,达到极大值的时间缩短,且极大值有下降的趋势,温度越高,中间产物烟酰胺一旦生成后很快就转化为烟酸.因此,采用相对较低的温度可以高选择性地制备烟酰胺.3结论(1)本文建立了一种在高温液态水中烟腈水解高选择性制备烟酸或烟酰胺的新方法.在研究了实验数据的重现性和烟腈初始质量浓度对反应动力学影响的基础上,系统地测定了不同温度(483115~ 523115K)下烟腈及其分解的中间产物烟酰胺的水解反应动力学.(2)烟腈水解反应实验数据符合一级连串反应动力学模型,通过拟合不同反应温度下的速率常数,可求得烟腈和烟酰胺水解反应的活化能分别为6512和8518kJ/mol.1695第9期石超君,等:高温液态水中烟腈水解反应动力学参考文献(References):[1]DU A N Pe-i g ao,WA N G Xuan,DA I L-i y i.No ncatalytichydro ly sis of iminodiacetonitr ile in near-crit ical w ater-cg reen pro cess o f the manufacture of iminodiacetic acid[J].Chemical Engineering and Technology,2007,30(2):265-269.[2]KR AM ER A,M IT T EL ST A DT S,V OG EL H.H y-dr oly sis of nitriles supercritical wat er[J].Chemical En-gineering and Technology,1998,21(6):494-500. [3]V ENA RD OU E,G AR CI A-V ERDU G O E,BA RLO W SJ,et al.On-line monito ring of the hydro ly sis o f aceto n-i trile in near-cr itical w ater using Raman spectr oscopy[J].Vibrational Spectroscopy,2004,35(2):103-109. [4]李艳云,尹振晏,宫彩红.烟酸的研究进展[J].北京石油化工学院学报,2006,14(1):59-64.L I Yan-yun,YI N Zhen-y an,GO NG Ca-i hong.Develop-ment o f nico tinic acid[J].Journal of Beijing Institute of Petro-chemical Technology,2006,14(1):59-64. [5]李钟玉,李临生.烟酸、烟酰胺的研究进展[J].化工纵横,2003,17(2):6-9.L I Zhong-yu,L I L in-sheng.Pr og ress on research of nicotinic acid and nicot inam ide[J].C omments&Re-views in C.I.,2003,17(2):6-9.[6]朱冰春,王宇光,卢晗峰,等.烟酸的合成方法进展[J].化工时刊,2004,18(2):1-4.ZH U Bing-chun,W A NG Yu-guang,LU H an-feng,et al.Pr og ress in synthesis methods of nicotinic acid[J].Chemical Industry Times,2004,18(2):1-4.[7]CHU CK R J,Z ACH ER U.P rocess for the pr epar ationof nicot inic acid fr om aqueous solut ions o f ammo nium nicotinate:EP,1440967A[P].2004-07-28.[8]张永华.液相催化氧化3-甲基吡啶制备烟酸[J].精细石油化工,2006,23(3):10-13.ZH A NG Y ong-hua.Pr epar ation of nicotinic acid by o x-i dation of3-met hy lpyr idine with dio xy gen in liquid phase [J].Speciality Petrochemicals,2006,23(3):10-13.[9]张玉敏,张横彬,曹学静,等.3-甲基吡啶电氧化合成烟酸的研究[J].高等学校化学学报,2003,24(3): 509-512.ZHA N G Y u-min,ZH A NG H eng-bin,CA O X ue-jing, et al.Studies o n electr oo xidatio n o f3-pico line to nicotin-ic acid[J].Chemical Journal of Chinese Universities, 2003,24(3):509-512.[10]SH A RM A N.N,SH A RM A M,K U M A R H,et al.N ocar dia globerula N HB-2:bench sca le pr oductio n o f nicot inic acid[J].Process Biochemistry,2006,41(9):2078-2081.[11]K RA M ER P,VO GEL H.H y dr olysis of ester s in sub-crit ical and super cr itical w ater[J].Journal of Super-critical Fluids,2000,16(3):189-206.[12]孙辉,吕秀阳,陈良.不同植物油脂在近临界水中水解反应动力学的比较[J].化工学报,2006,58(4):925-929.SU N H ui,LV X iu-yang,CH EN L par ison of hy dr olysis kinetics of different vegetable o ils in near-critical w ater[J].Journal of Chemical Industry and En-gineering(C hina),2006,58(4):925-929.[13]DA I Z-i yue,H AT A NO B,T A G AY A H.Cataly tic de-hy dr atio n o f pr opylene glycol w ith salts in near-cr itical water[J].Applied C atalysis A:General,2004,258(2):189-193.[14]刘志敏,张建玲,韩布兴.超(近)临界水中的化学反应[J].化学进展,2005,17(2):266-274.L IU Zh-i min,ZH AN G Jian-ling,H A N Bu-x ing.Chemica l reactions in super-and subcr itical w ater[J].Progress in C hem istry,2005,17(2):266-274. [15]石超君,吕秀阳.近临界水中苯乙腈无催化水解反应动力学[J].高校化工学报,2009,23(2):252-257.SH I Chao-jun,L V X iu-yang.Kinetics of non-cataly zed hy dr olysis of pheny lacetonit rile in near-critical water [J].Journal of C hemical Engineering of C hinese Univer-sities,2009,23(2):252-257.1696浙江大学学报(工学版)第43卷。