高考化学一轮复习 第5章 物质结构 元素周期律 第1讲 原子结构课件
- 格式:ppt
- 大小:2.73 MB
- 文档页数:42

回夺市安然阳光实验学校第5章 物质结构 元素周期律
第1节 原子结构
考纲定位
考情播报 1.了解元素、核素和同位素的含义。
2.了解原子构成。了解原子序数、核电荷数、质子数、中子数、核外电子数及它们之间的相互关系。
3.了解原子的核外电子排布规律和原子结构示意图、原子符号、元素符号。 2016·全国甲卷T9/全国丙卷T12
2015·全国卷ⅠT8(A)、T12/全国卷ⅡT9、T10(D)
2014·全国卷ⅠT10
2013·全国卷ⅡT9(D)
2012·全国卷T13
考点1| 原子结构和核素、同位素
[基础知识自查]
1.原子结构
(1)原子的构成
(2)核素(原子)符号表示
AZX表示质子数为Z、质量数为A、中子数为A-Z的核素原子,如氘21H。
(3)微粒中的“各数”间的关系
①质量关系:质量数(A)=质子数(Z)+中子数(N) ②电性关系
原子AZX:核外电子数=质子数Z=
核电荷数=原子序数阴离子o\al(A,Z)Xn-:核外电子数=Z+n阳离子AZXn+:核外电子数=Z-n
2.元素、核素、同位素
(1)“三素”关系及含义
(2)几种重要的核素及其应用
核素 235 92U 14 6C 21H 31H 18 8O
用途 核燃料 用于考古断代 制氢弹 示踪原子
(3)氢元素的三种核素
11H:名称为氕,不含中子
21H:用字母D表示,名称为氘或重氢
31H:用字母T表示,名称为氚或超重氢
[应用体验]
现有下列9种微粒:11H、21H、13 6C、14 6C、14 7N、5626Fe2+、5626Fe3+、16 8O2、16 8O3。按要求完成以下各题:
(1)11H、21H、31H分别是氢元素的一种________,它们互称为________。
(2)互为同素异形体的微粒是____________。
(3)5626Fe2+的中子数为________,核外电子数为________。

1 第17讲 原子结构 化学键
一、选择题
1.(2020·咸宁重点高中模拟)下列有关化学用语表示正确的是( )
A.H2O2的电子式为
B.质子数为67、中子数为99的放射性同位素钬(Ho)原子为16667Ho
C.氯离子的结构示意图为
D.乙醇分子的球棍模型为
解析:选B。H2O2是共价化合物,其电子式为,A项错误;氯离子最外层电子数为8,其结构示意图为,C项错误;D项所给是乙醇分子的比例模型,D项错误。
2.23592U是重要的核工业原料,在自然界的丰度很低。23592U的浓缩一直为国际社会关注。下列有关23592U的说法正确的是( )
A.23592U原子核中含有92个中子
B.23592U原子核外有143个电子
C.23592U与23892U互为同位素
D.23592U与23892U互为同素异形体
解析:选C。23592U有92个质子和电子,143个中子。
3.下列关于化学键的说法中正确的是( )
A.构成单质分子的粒子一定含有共价键
B.由非金属元素组成的化合物不一定是共价化合物
C.非极性键只存在于双原子单质分子里
D.不同元素组成的多原子分子里的化学键一定是极性键
解析:选B。稀有气体元素构成的单原子分子中不含共价键,A项错误;如NH4Cl、NH4NO3等铵盐是由非金属元素组成的离子化合物,B项正确;如H2O2、Na2O2等物质中O—O键为非极性键,C项错误;如H2O2多原子分子中也含有非极性键,D项错误。
4.核内中子数为N的R2+,质量数为A,则n g R的氧化物所含电子的物质的量为( ) 2 A.nA+16(A-N+8) mol B.nA+16(A-N+10) mol
C.(A-N+2) mol D.nA(A-N+6) mol
解析:选A。R的氧化物的化学式为RO,则ngR的氧化物所含电子的物质的量为nA+16(A-N+8) mol。
5.下列说法不正确的是( )
![【配套K12】[学习]2019届高考化学一轮复习 第5章 原子结构与元素周期律 第1节 原子结构 化](https://uimg.taocdn.com/039426612b160b4e767fcffd.webp)
精品K12教育教学资料
精品K12教育教学资料 第1节 原子结构 化学键
[课后达标检测]
一、选择题
1.(2018·宝鸡模拟)美日科学家因在研究“钯催化交叉偶联反应”所作出的杰出贡献,曾获得诺贝尔化学奖。钯(Pd)元素的原子序数为46,下列叙述错误的是( )
A.102 46Pd和103 46Pd互为同位素
B.钯是第五周期元素
C.Pd2+核外有48个电子
D.108 46Pd的原子核内有62个中子
解析:选C。Pd原子核外有46个电子,则Pd2+核外有44个电子。
2.(2018·豫东名校联考)化学键使得一百多种元素构成了世界的万物。下列关于化学键的叙述中正确的是( )
A.离子化合物中一定含有共价键,共价化合物中不含离子键
B.共价化合物中可能含离子键,离子化合物中只含离子键
C.构成单质分子的粒子一定含有共价键
D.在氧化钠中,除氧离子和钠离子的静电吸引作用外,还存在电子与电子、原子核与原子核之间的排斥作用
解析:选D。离子化合物必含离子键,不一定含有共价键,但共价化合物必含共价键,一定不含离子键,A、B错误;稀有气体分子为单原子分子,不含共价键,C错误;离子键中既存在静电吸引,也存在静电排斥,D正确。
3.化学科学需要借助化学专用语言来描述,下列化学用语正确的是(
)
4.有以下六种原子:63Li、73Li、2311Na、2412Mg、14 6C、14 7N,下列相关说法不正确的是( )
A.63Li和73Li在元素周期表中所处的位置相同
B. 14 6C和14 7N质量数相等,二者互为同位素 精品K12教育教学资料
精品K12教育教学资料 C.2311Na和2412Mg的中子数相同但不属于同种元素
D.73Li的质量数和14 7N的中子数相等
解析:选B。二者质量数相等,但质子数不同,二者不是同位素。
5.(2018·南阳高三模拟)某原子的核电荷数是其电子层数的5倍,质子数是其最外层电子数的3倍,则该原子的核电荷数为( )
第1页共15页
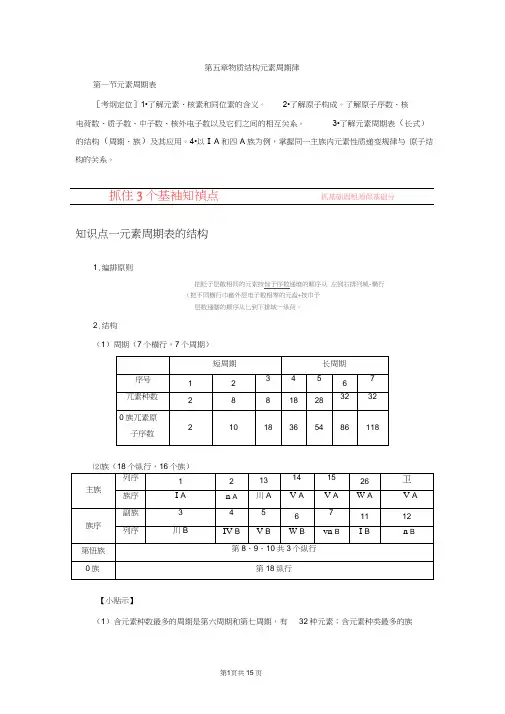
第五章物质结构元素周期律
第一节元素周期表
[考纲定位]1•了解元素、核素和同位素的含义。 2•了解原子构成。了解原子序数、核
电荷数、质子数、中子数、核外电子数以及它们之间的相互关系。 3•了解元素周期表(长式)
的结构(周期、族)及其应用。4•以I A和四A族为例,掌握同一主族内元素性质递变规律与 原子结构的关系。
抓住3个基袖知禎点 抓基础固根源保基础分
知识点一元素周期表的结构
1.编排原则
把贬子层散相同的元索按惊子序数递堆的顺序从 左到右排列城-横行°
(把不同横行巾厳外层电子数相零的元盍+按巾予
层数递瞎的顺序从匕到下排城一纵荷。
2.结构
(1)周期(7个横行,7个周期)
短周期 长周期
序号 1 2 3 4 5 6 7
兀素种数 2 8 8 18 28 32 32
0族兀素原
子序数 2 10 18 36 54 86 118
⑵族(18个纵行,16个族)
主族 列序 1 2 13 14 15 26 卫
族序 I A n A 川A V A V A W A V A
族序 副族 3 4 5 6 7 11 12
列序 川B IV B V B W B vn B I B n B
第忸族 第8、9、10共3个纵行
0族 第18纵行
【小贴示】
(1)含元素种数最多的周期是第六周期和第七周期,有 32种元素;含元素种类最多的族第2页共15页
是川B族,共有32种元素。
(2) 过渡元素包括 7个副族和第忸族,全部都是金属元素,原子最外层电子数不超过 2
个(1〜2个)。
(3) 最外层电子数为3〜7个的原子一定属于主族元素,且最外层电子数即为主族的族序 数。
⑷同一周期n A族与川A族的原子序数可能相差 1(二、三周期)或 11(四、五周期)或
25(六、七周期)。
【巩固练习】
1 •下列说法是否正确(用或“x”填写)。
(1) 最外层电子数为2的元素一定在n A族( )

目夺市安危阳光实验学校课时1 原子结构
[2018备考·最新考纲]
1.了解元素、核素和同位素的含义。2.了解原子的构成;了解原子序数、核电荷数、质子数、中子数、核外电子数以及它们之间的相互关系。3.了解原子核外电子排布。4.掌握原子结构示意图。
考点一 原子的构成
(考点层次A→自学、识记、辨析)
1.原子的构成
2.原子内的等量关系
(1)质量数(A)=质子数(Z)+中子数(N); (2)质子数=原子序数=核电荷数=核外电子数; 图示: (3)阳离子:质子数=核外电子数+电荷数; (4)阴离子:质子数=核外电子数-电荷数。 3.一个信息丰富的符号
4.元素、核素、同位素
(1)“三素”概念的辨析:
(2)几种重要的核素及其应用 核素 235 92U 14 6C
21H 31H 18 8O
用途 核燃料 用于考古断代 制氢弹 示踪原子
提醒:①同位素的中子数不同,质子数相同,最外层电子数相同,其化学性质相同。
②不同核素可能具有相同的质子数,如21H、31H;也可能具有相同的中子数,如14 6C、16 8O;也可能具有相同的质量数,如14 6C、14 7N。
③1H2和2H2既不是同位素,也不是同素异形体。
④一种元素可以有多种核素,也可能只有一种核素。
⑤元素有多少种核素,就有多少种原子。
教材VS高考
1.(RJ必修2·P114改编)放射性同位素钬166 67Ho的原子核内的中子数与质子数之差为32。
2.(RJ必修2·P115改编)有以下六种原子:63Li、73Li、2311Na、2412Mg、14 6C、14 7N,下列相关说法不正确的是( )
A.63Li和73Li在元素周期表中所处的位置相同
B.14 6C和14 7N质量数相等,二者互为同位素
C.2311Na和2412Mg的中子数相同但不属于同种元素
D.73Li的质量数和14 7N的中子数相等
答案 B 3.(溯源题)(2015·上海,1)中国科学技术名词审定会已确定第116号元素Lv的名称为。关于293116Lv的叙述错误的是( )

质对市爱慕阳光实验学校高三化学物质结构、元素周期律〔一〕
【本讲主要内容】
物质结构、元素周期律〔一〕
了解物质的分子、原子、离子、元素、同素异形体、同位素概念的含义;
了解原子的结构;了解元素周期表〔长式〕的结构〔周期、族〕及其用;
理解原子序数、核电荷数、质子数、中子数、核外电子数,以及质量数与质子数、中子数之间的相互关系;
掌握电子式、原子结构示意图的表示方法;
掌握元素周期律的实质,以第3周期为例,掌握同一周期内元素性质〔如:原子半径、化合价、单质及化合物性质〕的递变规律与原子结构的关系;以IA和ⅦA族为例,掌握同一主族内元素性质递变规律与原子结构的关系。
【知识掌握】
【知识点精析】
1. 同位素、同素异形体概念的区分
同位素:指质子数相同,中子数不同的同一类原子之间的互称。是同一种元素的中子数〔或质量数〕不同的原子。如1H、2D。
同素异形体:指同种元素形成的不同单质。如石和石墨。 2. 质量数、质子数〔核电荷数〕、中子数的关系
质量数〔A〕=质子数〔Z〕+中子数〔N〕
原子中:质子数=核电荷数=核外电子数
阳离子中:质子数=核电荷数=核外电子数+离子所带电荷数
阴离子中:质子数=核电荷数=核外电子数-离子所带电荷数
3. 电子式、原子结构示意图的表示
〔1〕各种粒子的电子式的书写:
原子:元素符号+最外层电子。如:氯原子的电子式 。
离子:阳离子的电子式在元素符号的右上角说明所带电荷及电性。如:Na+。
阴离子的电子式在元素符号的四周说明最外层电子数,并用“[]〞括起来,右上角说明所带电荷及电性。如:氯离子的电子式 。
单质及共价化合物:
单质:如N2的电子式 。
共价化合物分子:如HCl的电子式 。
离子化合物的电子式:阴阳离子的电子式组合到一起。
如:氯化氨的电子式
。 注意在电子式书写中区别离子化合物与共价化合物,所有的阴离子及带正电的原子团都要用“[]〞括起来。

第五章 物质结构 元素周期律
第16讲 元素周期律和元素周期表(精讲)
【考情分析】
本讲内容是本章的核心,在高考中占有很重要的地位。从几种常见的短周期元素出发,考查元素及其化合物的性质、元素在周期表中的位置与性质的关系等知识。常以选择题、推断题形式出现。主要考查方式为以元素化合物知识为载体,结合物质的性质、性质的递变规律、定性推断、规律总结与运用等设置相关问题情境,通过图表、文字或相关数据分析等推断同主族、同周期元素性质的递变规律,或以陌生元素在元素周期表中的位置,推断其可能具有的性质等,对考生的化学素养、知识与能力水平进行考查,而联系元素周期律、元素周期表与元素化合物之间的桥梁就是“位—构—性”的三角关系。
【核心素养分析】
1.宏观辨识与微观探析:从元素和原子、分子水平认识物质的组成、结构、性质和变化,形成“结构决定性质”的观念,能从宏观和微观相结合的视角分析元素周期律的递变性。
2.证据推理与模型认知:具有证据意识,基于实验现象和事实对物质的组成、结构及其变化分析得出元素周期律;基于元素周期律理解元素周期表的编排方法,能运用元素周期表揭示元素周期律。
3.科学探究与创新意识:发现和提出有探索价值的原子结构与性质的问题,如核外电子排布、元素的特殊性等,面对异常现象敢于提出自己的见解。
【网络构建】
【知识梳理】
智能点一 元素周期表的结构
1.原子序数:按照元素在周期表中的顺序给元素编号,称之为原子序数,原子序数=核电荷数=质子数=核外电子数。
2.编排原则
(1)周期:把电子层数相同的元素,按原子序数递增的顺序,从左至右排成的横行。
(2)族:把最外层电子数相同的元素,按电子层数递增的顺序,从上至下排成的纵行。
3.元素周期表的结构 (1)结构
元素周期表 周期7个 短周期 第一、二、三周期元素种数分别为2、8、8种长周期 第四、五、六、七周期元素种数分别为18、18、32、32排满时种族16个 主族:由短周期和长周期共同构成,共7个副族:完全由长周期元素构成,共7个第Ⅷ族:第8、9、10共3个纵行0族:第18纵行

第四章 物质结构 元素周期律
第一节 原子结构与化学周期表
一、原子结构
1、原子的构成
原子由原子核和核外电子组成(原子核包括质子和中子),质子带 正电 ,电子带 负电 ,中子中立 不带电 。
2、质量数
(1)概念:将核内所有 质子 和 中子 的相对质量取近似整数值相加,所得的数值。
(2)构成原子的粒子间的两个关系
①质量数(A)= 质子数(Z) + 中子数(N)
②质子数= 核电荷数 =核外电子数
3、原子的表示方法
如作为相对原子质量标准的12 6C表示质子数为 6 ,质量数为 12 的碳原子。
4、粒子符号(AZX±bn±m)中各数字的含义
5、原子核外电子排布的表示方法
(1)原子结构示意图
用小圆圈和圆圈内的符号及数字表示 原子核 及 核内质子数 ,弧线表示各电子层,弧线上的数字表示该电子层上的电子数。以钠原子为例:
(2)离子结构示意图
①金属元素原子失去最外层所有电子变为离子时,电子层数减少一层,形成与上一周期的稀有气体元素原子相同的电子层结构(电子层数相同,每层上所排的电子数也相同)。如 Mg :→ Mg2+ :。 ②非金属元素的原子得电子形成简单离子时,形成和同周期的稀有气体元素原子相同的电子层结构。
如 F :→
F- :。 Na+ 与稀有气体Ne的核外电子排布相同; Cl-
与稀有气体Ar的核外电子排布相同。
二、元素在周期表
1、周期的分类与包含元素
类别 周期序数 行序数 核外电子层数 包含元素种数 起止元素
短周期 1 1 1 2 H~He
2 2 2 8 Li~Ne
3 3 3 8 Na~Ar
长周期 4 4 4 18 K~Kr
5 5 5 18 Rb~Xe
6 6 6 32 Cs~Rn
7 7 7 32 Fr~Og
2、族的分类
16个族分为 7 个主族、 7 个副族、1个第 Ⅷ 族和1个 0 族。
3、元素周期表中的方格中各符号的意义

Z 第一章 物质结构 元素周期律
一、原子结构
质子(Z个)
原子核
注意:
中子(N个) 质量数(A)=质子数(Z)+中子数(N)
1.原子( A X ) 原子序数=核电荷数=质子数=原子的核外电子数
核外电子(Z个)
★熟背前20号元素,熟悉1~20号元素原子核外电子的排布:
H He Li Be B C N O F Ne Na Mg Al Si P S Cl Ar K Ca
2.原子核外电子的排布规律:①电子总是尽先排布在能量最低的电子层里;②各电子层最多容纳的电子数是2n2;③最外层电子数不超过8个(K层为最外层不超过2个),次外层不超过18个,倒数第三层电子数不超过32个。
电子层: 一(能量最低) 二 三 四 五 六 七
对应表示符号: K L M N O P Q
3.元素、核素、同位素
元素:具有相同核电荷数的同一类原子的总称。
核素:具有一定数目的质子和一定数目的中子的一种原子。
同位素:质子数相同而中子数不同的同一元素的不同原子互称为同位素。(对于原子来说)
二、元素周期表
1.编排原则:
①按原子序数递增的顺序从左到右排列
②将电子层数相同......的各元素从左到右排成一横行..。(周期序数=原子的电子层数)
③把最外层电子数相同........的元素按电子层数递增的顺序从上到下排成一纵行..。
主族序数=原子最外层电子数
2.结构特点:
核外电子层数 元素种类
第一周期 1 2种元素
短周期 第二周期 2 8种元素
周期 第三周期 3 8种元素

82014届三厂中学高三化学 一轮复习讲义 基本理论 编制:陈达 审核:备课组 2013-09-25 总编号:19
- 1 - 专题九 物质结构、元素周期律
第一课时 原子结构、元素周期律、元素周期表
【课堂目标】
1.了解原子构成、核素含义。
2.熟悉1~36号元素电子排布式(构造原理),重点掌握1~18号元素原子结构与性质。
3.了解元素周期律的实质,理解电离能、电负性应用。
4.重点掌握第三周期元素性质的递变规律与原子结构的关系。
5.以ⅠA和ⅦA族为例,掌握同一主族内元素性质递变规律与原子结构的关系。
【知识网络】
【基础梳理】
活动一:原子结构与核外电子排布
1.原子表示及含义
2.原子核电子排布与构造原理
书写电子排布式
①26号元素的符号 ,在周期表中的位置 。
其原子的核外电子排布式为 。
②Fe2+的核外电子排布式为 。 82014届三厂中学高三化学 一轮复习讲义 基本理论 编制:陈达 审核:备课组 2013-09-25 总编号:19
- 2 - ③Cu的外围电子排布式为 。
④Cr的价电子排布式为 。
⑤O价电子的轨道排布式为 。
⑥(12江苏21部分)Mn2+基态的电子排布式可表示为 。