iTRAQ定量蛋白质组学..
- 格式:ppt
- 大小:817.50 KB
- 文档页数:21

iTRAQTMT技术iTRAQ(isobaric tags for relative and absolute quantitation)技术是一种多肽体外标记技术。
该技术采用4-plex或8-plex同位素的标签,通过特异性标记多肽的氨基基团,进行LC-MS/MS分析,可同时比较多种不同样本中蛋白质的相对表达含量。
TMT(Tandem Mass Tag)技术也是一种多肽体外标记的方法,采用2-plex、6-plex或10-plex同位素的标签,通过特异性标记多肽的氨基基团,然后进行串联质谱分析,可同时比较2组、6组或10组不同样品中蛋白质的相对含量。
iTRAQ是由AB SCIEX公司研发的一种体外同重同位素标记的相对与绝对定量技术; TMT技术是由美国Thermo Scientific公司研发的一种多肽体外标记技术。
TMT与iTRAQ试剂在结构和检测原理上基本类似,都是由报告基团、平衡基团和肽反应基团三部分组成。
一、科沿有道服务内容1、服务项目:iTRAQ/ TMT;2、要求:干冰运输(详细要求见样品要求);3、交付:蛋白鉴定及定量结果表、肽段鉴定及定量结果表、差异蛋白结果表、生物信息学分析结果、质谱原始数据、实验报告;4、周期:5-7周。
二、服务流程:iTRAQ/TMT定量蛋白质组学实验的基本流程。
第一步,从样品中提取蛋白。
第二步,对提取后的蛋白样品进行还原烷基化处理,打开二硫键以便后续步骤充分酶解蛋白。
第三步,用Brandford法进行蛋白的浓度测定。
第四步,SDS(十二烷基磺酸钠)-PAGE。
第五步,取等量蛋白Trypsin酶解。
第六步,用iTRAQ/TMT试剂标记肽段。
第七步,将标记后的肽段进行等量混合。
第八步,对混合后的肽段使用强阳离子交换色谱(Strong Cation ExchangeChoematography,SCX)进行预分离。
第九步,通过Orbitrap Fusion Lumos分析鉴定。

非靶向蛋白组学定量技术: SILAC, iTRAQ, TMT定量蛋白组学的研究意义人类基因组完整图谱于2003年正式公布,这标志着生命科学的里程碑性事件——人类基因组计划的顺利完成,生命科学研究也进入了后基因组时代。
这一计划的初始目的是在基因层面研究人类疾病机制,设计基因药物,进行精准医疗。
但是时隔十多年年过去了,效果远没预期的理想。
其中主要原因可能是,我们现有的研究工作和背景知识不足以将庞杂的基因组数据直接同人类疾病联系起来。
而蛋白组学能更直观的将基因与疾病联系起来,逐渐成为研究热点之一。
定量蛋白组学是将某一基因组或者某一复杂体系表达的全部蛋白质进行鉴定和精准定量的学科,是蛋白组学研究的重要分支。
基于质谱的蛋白质定量20实际80年代中期出现了MALDI(基质辅助激光解吸附电离)和ESI(电喷雾电离)两种软电离方法,可以将蛋白质或者多肽离子化,从而引入质谱仪种进行定性和定量分析,从此生物质谱技术成为蛋白组学最重要的分析工具之一。
图1. 生物质谱仪器。
利用生物质谱技术,主要有两种蛋白组学研究策略:Top-down strategy:Top-down(自上而下法)通常的做法是,先利用二维凝胶电泳分离蛋白,再将完整蛋白直接离子化后引入质谱分析,借助生信分析工具和蛋白数据库进行数据比对,从而实现对蛋白的鉴定。
Bottom-up strategy:Bottom-up(自下而上法)通常的做法是,先将样品用酶进行处理,多维色谱分离后引入质谱分析,再借助生信分析工具和蛋白数据库进行数据比对,最后实现对蛋白的鉴定。
蛋白定量分为相对定量和绝对定量,由于电泳技术具有重复性差等缺点,而多维色谱能将样品酶解物稳定分离,因此蛋白的绝对定量多采用自下而上的方法。
虽然绝对定量似乎更为理想,但是绝对定量更为复杂和昂贵,而相对定量在很多时候就能满足科研需求,因此,相对定量更为常用。
利于质谱技术,可根据特定质谱峰的信号强度来确定蛋白质含量,主要的方法又分为非靶向定量蛋白组学(标记定量和非标记定量)和靶向定量蛋白组学。

定量蛋白质组学
定量蛋白质组学是一门研究蛋白质组含量及其变化的学科。
百泰派克生物科技提供基于质谱的定量蛋白组分析服务。
定量蛋白质组学
定量蛋白质组学,就是对一个基因组表达的全部蛋白质或者一个复杂混合体系中所有的蛋白质进行精确的定量与鉴定。
定量蛋白组学是蛋白质组学研究的一个重要分支。
蛋白质的表达水平与生命活动息息相关,因此对蛋白质进行定量分析对阐明蛋白质的生物学功能和细胞的各种生物进程十分重要。
定量蛋白质组学研究技术
现在常用的蛋白质组定量的方法根据定量手段的不同可以分为荧光定量技术、蛋白质芯片技术和基于质谱的定量技术。
荧光定量技术是二维凝胶电泳技术与荧光染色技术相结合的一种技术,运用荧光染料标记蛋白质,在2D胶上进行分离和鉴定,按照荧光强度差异来比较蛋白量的变化。
蛋白质芯片技术是通过蛋白质芯片从待测样品中捕获配体后,利用激光共聚焦显微镜或质谱等检测技术进行蛋白质组定量分析的。
基于质谱的蛋白组定量技术通过比较具有相同离子化能力的蛋白或多肽的质谱峰强弱,可以对它们进行相对定量。
相对于其他技术,该技术不仅可以测定肽序列,而且可以准确定量蛋白质。
目前基于质谱的定量蛋白质组学技术主要分为标记(Label)和非标记的(Label Free)两大类,其中标记的又可分为体内标记(如SILAC标记)以及体外标记(如 iTRAQ、TMT 标记)。
定量蛋白质组学。

蛋白质组学iTRAQ研究的内容、方法及意义生物有机体的生理活动、病理活动以及**的功用主要是通过蛋白质来实现的,然而仅凭目前已知的蛋白质根本无法阐明各种复杂的生命活动过程,因此,以基因组的调研成果为基础,以各种先进工艺为支撑,进一步调研生物有机体的全部蛋白质结构、功能及其相互功用已经成为必然。
目前大量工作者致力于蛋白质组学的调研,本文现对此作一简述。
1 蛋白质组学的定义及调研内容蛋白质组学(proteomics)是调研在特定时间或环境下某个细胞或某种组织的基因组表达的全部蛋白质。
蛋白质组学的真正含义在于:它不是按照传统的方式孤立地调研某种蛋白质分子的功能,而是应用各种蛋白质组学工艺调研某种蛋白质在复杂的细胞环境中的功能。
蛋白质组学旨在列出全部蛋白质的细目,弄清每一个蛋白质的结构和功能及蛋白质群体内的相互功用,对比在**和健康状态下它们的表达水平的变化。
蛋白质组学分为表达蛋白质组学和细胞图谱蛋白质组学。
前者利用各种先进工艺调研蛋白质表达的整体变化,即调研在机体的生长发育、**和死亡的不同阶段中,细胞与组织的蛋白质组分的变化;后者主要通过分离蛋白质复合物系统地调研蛋白质间的相互功用。
2 蛋白质组与基因组的关系基因是遗传信息的携带者,蛋白质则是生命活动的执行者。
实际上每一种生命运动形式,都是特定蛋白质群体在不同时间和空间出现并发挥功能的结果。
因而蛋白质组调研是我们理解细胞功能和**发**展过程的中心环节。
如果不能共同致力于蛋白质组的调研,那么基因组的调研成果将无法兑现。
DNA序列所提供的信息仅仅是一种静止的资源,而细胞的生命活动是通过各种蛋白质来实现的一种动态过程。
一个机体内所有不同的细胞都共享同一基因组,然而同一个机体的不同细胞和不同组织却有不同的蛋白质组,而且机体在不同发育阶段,直至后消亡的全过程中蛋白质组也在不断变化。
因而蛋白质组要比基因组复杂得多。
由于对转录产物的选择性剪切、**起止点的变化或者mRNA上三联体密码发生移码突变等均可以明显促进蛋白质多样性的产生,而且mRNA的水平并不能反映蛋白质水平,即使一个开放阅读框(ORF) 呈现在面前,也根本无法证实某种蛋白质存在与否。

ITRAQ技术收费标准ITRAQ技术是一种用于蛋白质组学研究的定量分析方法,它可以同时比较多个样本中蛋白质的表达水平,因此在生物医学领域得到了广泛的应用。
在使用ITRAQ技术进行实验时,研究人员需要考虑到实验所需的费用,因此本文将介绍ITRAQ技术的收费标准。
首先,ITRAQ技术的收费标准会受到实验室设备、技术人员水平、实验样本数量等因素的影响。
一般来说,ITRAQ技术的收费包括实验材料费、实验操作费、数据分析费等方面。
实验材料费主要包括ITRAQ试剂盒、质谱分析所需的色谱柱、溶剂等,而实验操作费则包括技术人员的操作费用以及实验室设备的使用费用。
数据分析费则是指对实验结果进行统计分析和解读所需的费用。
其次,ITRAQ技术的收费标准还会因不同实验室或服务机构而有所不同。
一些大型实验室或专业的生物医学研究机构通常会提供ITRAQ技术服务,并根据实验的具体要求和样本数量制定相应的收费标准。
而一些小型实验室或科研团队可能会选择外包ITRAQ技术服务,此时收费标准则会受到外包服务机构的影响。
此外,ITRAQ技术的收费标准还会因实验的复杂程度而有所不同。
一般来说,对于样本数量较少、实验操作相对简单的ITRAQ技术服务,收费标准会相对较低;而对于样本数量较多、实验操作较为复杂的ITRAQ技术服务,收费标准则会相对较高。
总的来说,ITRAQ技术的收费标准是根据实验所需材料、操作、数据分析等方面的费用综合考虑而确定的。
研究人员在选择ITRAQ技术服务时,应该根据实验的具体要求和预算情况来选择合适的服务机构,并在与服务机构进行合作时,要充分了解收费标准,以便做好预算和实验安排。
在使用ITRAQ技术进行蛋白质组学研究时,研究人员需要考虑到实验所需的费用。
ITRAQ技术的收费标准会受到实验室设备、技术人员水平、实验样本数量等因素的影响。
一般来说,ITRAQ技术的收费包括实验材料费、实验操作费、数据分析费等方面。
实验材料费主要包括ITRAQ试剂盒、质谱分析所需的色谱柱、溶剂等,而实验操作费则包括技术人员的操作费用以及实验室设备的使用费用。
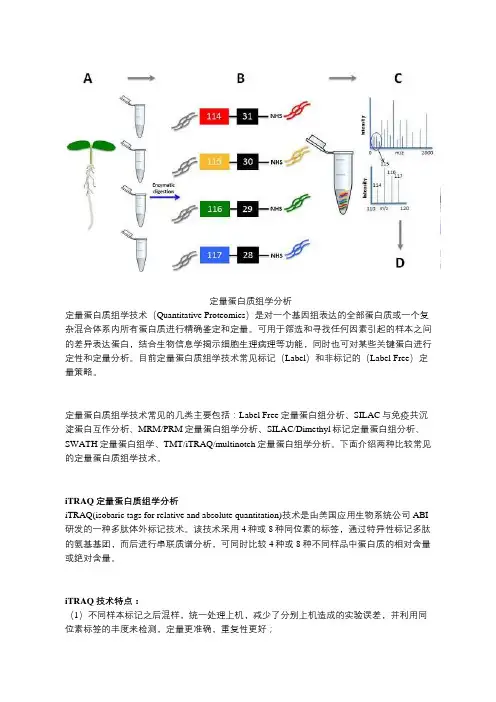
定量蛋白质组学分析定量蛋白质组学技术(Quantitative Proteomics)是对一个基因组表达的全部蛋白质或一个复杂混合体系内所有蛋白质进行精确鉴定和定量。
可用于筛选和寻找任何因素引起的样本之间的差异表达蛋白,结合生物信息学揭示细胞生理病理等功能,同时也可对某些关键蛋白进行定性和定量分析。
目前定量蛋白质组学技术常见标记(Label)和非标记的(Label Free)定量策略。
定量蛋白质组学技术常见的几类主要包括:Label Free定量蛋白组分析、SILAC与免疫共沉淀蛋白互作分析、MRM/PRM定量蛋白组学分析、SILAC/Dimethyl标记定量蛋白组分析、SWATH定量蛋白组学、TMT/iTRAQ/multinotch定量蛋白组学分析。
下面介绍两种比较常见的定量蛋白质组学技术。
iTRAQ定量蛋白质组学分析iTRAQ(isobaric tags for relative and absolute quantitation)技术是由美国应用生物系统公司ABI 研发的一种多肽体外标记技术。
该技术采用4种或8种同位素的标签,通过特异性标记多肽的氨基基团,而后进行串联质谱分析,可同时比较4种或8种不同样品中蛋白质的相对含量或绝对含量。
iTRAQ技术特点:(1)不同样本标记之后混样,统一处理上机,减少了分别上机造成的实验误差,并利用同位素标签的丰度来检测,定量更准确,重复性更好;(2)由于需要标记试剂标记,因此成本相对较高;(3)通量高,在一次实验中最多可同时比较8个样品;(4)利用基于同一个参考样品的办法,可以进行多于8个样品的定量比较;(5)iTRAQ的覆盖度高、灵敏度高。
Label-Free定量蛋白质组学分析Label-Free定量,即非标记的定量蛋白质组学,不需要对比较样本做特定标记处理,只需要比较特定肽段/蛋白在不同样品间的色谱质谱响应信号便可得到样品间蛋白表达量的变化,通常用于分析大规模蛋白鉴定和定量时所产生的质谱数据。

1、iTRAQ和label-free所用的搜库软件及其版本、定量分析软件是否一致?答:搜库软件是不一致的:iTRAQ数据采用Mascot(2.3.0);label-free则是maxquant(1。
4。
1.2)。
2、iTRAQ/TMT和Label-free技术都有哪些优缺点?答:(1)定量准确性:iTRAQ/TMT的定量准确性和重现性要明显优于Label—free,Label-free的样本之间不能直接混合,导致定量的结果受到的影响因素多,因此定量结果的准确度较低;(2)鉴定通量:Label-free通量相对较高,而iTRAQ/TMT由于标记基团的影响,鉴定通量较label-free 低;(3)修饰组学:label-free定量,修饰肽段的富集(即IP)是各组分开进行的,很可能造成富集的不平行,最终造成定量不准确。
因此,我们通过加入内标肽段来归一化以减少富集步骤引入的误差。
而iTRAQ/TMT标记的修饰组,修饰肽段的富集是各组标记、混合后同时进行的,所以不会存在富集的不平行。
因此,修饰组的定量,iTRAQ/TMT方法的定量准确性优于label—free;(4)其它:目前泛素化修饰定量组学只能用label—free来做。
3、常用的蛋白质翻译后修饰参考数据库有哪些?4、HPLC分级的标准及作用是什么?是否组分越多通量越高?答:HPLC分级有两个目的:1。
降低每个组分中蛋白的复杂度,利于质谱鉴定;2.增加每个组分中每个蛋白的含量,同样利于质谱的鉴定。
组分的多少和样品的复杂程度有关,如果分级数太少,没有达到降低样品复杂度的作用,如果分级数目太多,反而会降低每个组分中每个蛋白的含量,并且组分越多蛋白损失越大,因此分级太少和太多都不利于质谱鉴定,我们公司的分级数目是经过系统考察得到的最优选择.5、公司目前使用的蛋白浓度测定方法是什么?答:我们的蛋白浓度测定使用GE公司的2D Quant kit完成,该试剂盒可耐受8 M urea和2% SDS,明显优于其它浓度测定方法。

iTRAQ定量蛋白质组学筛选与DAI相关的生物标志物Itraq定量蛋白质组学技术和生物信息学分析鉴定大鼠弥漫性轴索损伤的血浆标志物题目:Identification of plasma biomarkers for diffuse axonal injury in rats byiTRAQ-coupled LC–MS/MS and bioinformatics analysis期刊:Brain Research Bulletin影响因子:3.440合作技术:iTRAQ研究背景DAI(弥漫性轴索损伤)是一种严重且复杂的脑损伤,目前临床上没有相关可靠的生物标志物帮助其进行早期DAI诊断。
因此,作者建立了DAI大鼠模型,并利用iTRAQ定量蛋白质组学技术筛选与DAI相关的血浆生物标志物,该研究既有助于DAI临床诊断的发展,也对DAI潜在分子机制有了进一步了解。
研究内容结果1. 大鼠脑组织病理学检查作者采用HE染色法和Bielschowsky神经纤维银染法对构建的DAI大鼠模型(1h、6h、1d、3d、7d)进行脑组织病理学检查,结果显示对照组脑组织样本未发生任何类型的病理改变,模型组的胼胝体中则观察到不同程度的轴突肿胀、紊乱、断开及轴缩球(图1)。
这些结果证实,研究中使用的大鼠样本适合于进行iTRAQ的定量蛋白质组学分析以鉴定大鼠中的DAI生物标志物。
图1 大脑组织样本HE染色(A-F)和Bielschowsky神经纤维银染色(G-L)结果2. DAI大鼠模型蛋白质组学结果在对血浆样品进行iTRAQ蛋白质组学分析中,共鉴定到374个蛋白质,其中共有58个显著差异蛋白(FC > 1.5,p-values<0.05),和对照组相比,不同时期的模型组中差异蛋白数目如图2。
针对这些差异蛋白,作者进行了GO功能分析和KEGG Pathway分析(图3)。
根据58个差异蛋白的层次聚类分析结果,在3d和7d中的蛋白质丰度发生显著改变(图4A)。



定量蛋白质组学定量蛋白质组学hplc2-液色迷人蛋白质组学研究的核心内容是蛋白质的动态变化和动态行为,即蛋白质的动态表达、动态定位、动态修饰和动态相互作用等,最终的研究目的是以大规模的尺度研究细胞内蛋白质的功能,这种研究要走向成熟必然要脱离对蛋白质的简单鉴定,实现对蛋白质的表达水平及其存在形式变化的检测。
因此,定量技术应该说是整个蛋白质组学的精华部分。
而这种定量通常不必是检测蛋白质在细胞内的绝对含量,而只需对其相对含量进行定量即可。
目前,蛋白质组研究中应用的比较成熟和可信的定量策略和方法主要有两种。
一种是基于传统双向凝胶电泳及染色基础上的定量,另外一种是基于质谱检测技术的定量。
1、基于双向凝胶电泳及其染色的蛋白质组学定量技术建立在传统的双向凝胶电泳和染色基础上的定量方法,通过比较不同胶上蛋白质点的染色强度来进行相对定量。
现有的染色方法包括银染、考马斯亮蓝染色,还有最新的荧光燃料。
染色在显示蛋白质的存在的同时,还提供了其表达水平的信息。
传统的双向凝胶电泳(Two-dimensional electrophoresis,2-DE)技术由O’Farrell和Klose等人于1975年建立。
第一向为等电聚焦(Isoelectrofocusing,IEF),使蛋白质根据等电点不同进行分离,第二向为SDS-聚丙烯酰胺凝胶电泳(SDS-polyacrylamide gel electrophoresis,SDS-PAGE),即将等电聚焦后的胶条放在SDS-PAGE上再根据蛋白质分子量不同进行电泳分离。
由于具有高分辨率的特点,双向凝胶电泳在蛋白质组学的研究当中始终占据着重要的地位。
现在的双向凝胶电泳技术第一向利用固相pH梯度(Immobilized pH Gradient,IPG)等电聚焦技术,具有上样量大、分辨率高、重复性好等优点,并且可以提供蛋白质的等电点(pI)和分子量(MW)数值信息,有助于蛋白质的鉴定,而且双向凝胶电泳胶上常见的isoform多是蛋白质翻译后修饰的结果,对于这些蛋白质点的分析有助于了解对蛋白质功能影响重大的翻译后修饰。
百泰派克生物科技
itraq技术
蛋白质组学即对一种细胞甚至一种生物所表达的所有蛋白质进行研究的科学,通过质谱平台对蛋白质进行全面研究以实现对生物体生理活动的整体认识。
随着蛋白组学的快速发展,研究蛋白质组学的技术也在不断开发并推动着蛋白组学的发展,相对和绝对定量同位素标记技术(iTRAQ)与串联质谱、多维液相色谱技术联用已成为蛋白质定性和定量研究的主流技术之一。
iTRAQ技术操作流程:首先,不同蛋白质样品分别用胰蛋白酶裂解为肽段,再用iTRAQ多重标签试剂对肽段进行差异化标记。
之后,将标记的不同样品等量混合为一体,用液相色谱串联质谱(LC-MS/MS)技术进行检测,根据质谱平台所检测出的大量光谱信息结合生物信息学分析可对多肽和蛋白质进行定量鉴定。
iTRAQ技术可以同时对多达8种不同样本中的蛋白质进行定量比较,它将离子抑制效应、背景噪音等系统误差的影响降到了最小,使其灵敏度和准确性远高于非标记定量技术(label-free quantitation)。
此外,iTRAQ试剂可对样本中的磷酸化、糖基化等翻译后修饰蛋白进行标记,从而进行定性、定量分析且能得到详尽的差异数据。
百泰派克生物科技采用Thermo Fisher的Q ExactiveHF质谱平台,Orbitrap Fusion质谱平台,Orbitrap Fusion Lumos质谱平台结合Nano-LC,提供
TMT/iTRAQ/MultiNotch定量蛋白组学分析服务,您只需要将实验目的告诉并将样品寄出,我们会负责项目后续所有事宜,包括细胞培养、细胞标记、蛋白提取、蛋白酶切、肽段分离、质谱分析、质谱原始数据分析、生物信息学分析。
正确理解定量蛋白质组学上期分享的蛋白组学内容,是不是有些小伙伴还绕在云里雾里呀?这次,小编用实例说话,帮您梳理清楚。
Label-free定量Label-free定量,顾名思义就是不需要对比较样本做特定标记处理,只需要比较特定肽段/蛋白在不同样品间的色谱质谱响应信号便可得到样品间蛋白表达量的变化,通常用于分析大规模蛋白鉴定和定量时所产生的质谱数据。
Label-free技术又可分为基于谱图数(Spectra Count,简称SC)和基于肽段母离子强度(或色谱离子流的峰面积即XIC)两种方法,后者更准确,使用更广泛。
技术特点无需标记,操作简单;不受比较样品数限制;对实验操作稳定性、重复性要求高;准确性较标记定量差;要求至少做三次技术重复或生物重复。
适用范围适合大样本量的定量比较;对无法用标记定量实现的实验设计,易用label-free技术;经典案例题目:Label-free global serumproteomic profiling reveals novel celecoxib-modulated proteins infamilial adenomatous polyposis patients(利用Label-free定量技术进行家族性腺瘤息肉病患者血清的全蛋白质组分析,寻找Celecoxib调控蛋白)期刊:Cancer genomics proteomics主要技术:Label-free定量文章摘要:Celecoxib是一种环氧合酶选择性抑制剂,能够对患有预防家族性腺瘤性息肉病(FAP)和散发性大肠癌的病人进行防治。
为了识别其具体的作用机制,本文采用多维色谱分离方法结合电喷雾串联质谱,使用Label-free定量技术,比较经Celecoxib 处理前、后血清样品的蛋白质组表达量差异。
发现了83个可能为Celecoxib响应的表达量显著差异蛋白。
通过Western blotting方法,在FAP病人和结肠直肠癌细胞系中进一步确认了一些Celecoxib调控蛋白,为进一步进行Celecoxib作用机制的大规模临床试验奠定了基础。
iTRAQTMT蛋白质组学分析基本知识点蛋白质组(Proteome)一词源于蛋白质(protein)与基因组(genome)两个词的组合,意指“一种基因组所表达的全套蛋白质”,即包括一种细胞乃至一种生物所表达的全部蛋白质。
蛋白质组与转录组有许多相似之处,也具有时空特异性,会随着环境、组织或个体的改变而改变。
蛋白质组学本质上指的是在大规模水平上研究蛋白质的特征,包括蛋白质的表达水平,翻译后的修饰,蛋白与蛋白相互作用等,由此获得蛋白质水平上的关于疾病发生、细胞代谢、生长发育以及各种胁迫反应等过程的整体而全面的认识。
iTRAQ和TMT的结构与区别iTRAQ和TMT是近年来应用最广泛的差异蛋白质组学技术,它们均采用体外标记的方法,利用同位素试剂标记蛋白质酶解后产生的多肽,对两个或多个样本,在全蛋白质组层面上展开相对定量分析。
说到这里,很多人可能会认为iTRAQ和TMT是两种不同的定量技术,其实二者只是不同厂家生产的(iTRAQ是AB SCIEX研发,TMT 是Thermo Fisher研发),在标记规格(iTRAQ是4标和8标的;TMT是2标、6标以及10标的)、标签分子结构上有些许差异,其他原理基本一样。
Questions and Answers1、iTRAQ/TMT与Label free相比有什么优势?Label free无需同位素标记,不受样本条件的限制,定性没有问题,但是定量的准确性不高,会受到质谱重复性等因素的影响。
iTRAQ/TMT的覆盖度高、灵敏度高、重复性好。
但是在混标上机时要充分考虑样品的情况,样品数量较多时,实验设计会较为复杂。
2、做iTRAQ/TMT蛋白质组学分析,不同老师的样本可否放在一组上机?不同老师的样品或者同一个老师不同实验的样品,都不能放在一组上机。
不同的物种的样品,在搜库的时候选择的数据库不一样,无法进行搜库比较。
同一个物种的不同处理的样品,经过不同实验室处理后,样品里的蛋白种类和丰度会有较大差别,混在一起后会影响两组不同来源的样品的蛋白鉴定。