化学热力学初步
- 格式:ppt
- 大小:384.50 KB
- 文档页数:77


化学热力学初步学号姓名一、是非题(判断下列叙述是否正确,正确的在括号中画√,错误的画)1、系统的焓等于系统的热量。
...................... .................. .........................()2、在恒温恒压下,某化学反应的热效应Q p=△H=H2-H1,因为H是状态函数,故Q p也是状态函数。
............................................................ ....................()3、已知298K时,△f Gθm(SbCl5,g)=-334.3kJ·mol-1,△f Gθm(SbCl3,g)=-301.0kJ·mol-1,则反应SbCl5(g)→SbCl3(g)+Cl2(g)在298K、标准状态下不能自发进行。
....................()4.如果一个反应的△r Hθm和△r Sθm均为正值,当温度升高时,△r Gθm将减小.................()5.冰在室温下自发地融化成水,是熵增起了主要作用。
..................................()6、如果一个反应的△r Hθm和△r Sθm均为正值,当温度升高时,△r Gθm将减小................()二、选择题(在下列各题中,选择出符合题意的答案,将其代号填入括号内)1、已知反应C2H2(g)+5/2 O2(g)→2CO2(g)+H2O(l)的△r Hθm (1)=-1301.0kJ·mol-1,C(s)+O2(g)→CO2(g)+H2O(l)的△r Hθm (2)=-393.5kJ·mol-1,H2(g)+1/2 O2(g)→H2O(l)的△r Hθm (3)=-285.8kJ·mol-1,则反应2C(s)+H2(g)→C2H2(g)的△r Hθm为.......................... .....................................()。

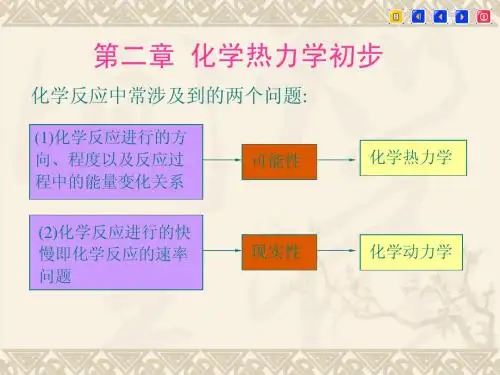





第二章化学热力学初步思考题1.状态函数的性质之一是:状态函数的变化值与体系的始态与终态有关;与过程无关。
在U、H、S、G、T、p、V、Q、W中,属于状态函数的是U、S、G、T、p、V。
在上述状态函数中,属于广度性质的是U、H、S、G、V,属于强度性质的是T、p。
2.下列说法是否正确:⑴状态函数都具有加和性。
⑵系统的状态发生改变时,状态函数均发生了变化。
⑶用盖斯定律计算反应热效应时,其热效应与过程无关。
这表明任何情况下,化学反应的热效应只与反应的起止状态有关,而与反应途径无关。
⑷因为物质的绝对熵随温度的升高而增大,故温度升高可使各种化学反应的△S大大增加。
⑸△H,△S受温度影响很小,所以△G受温度的影响不大。
2.⑴错误。
强度状态函数如T、p就不具有加和性。
⑵错误。
系统的状态发生改变时,肯定有状态函数发生了变化,但并非所有状态函数均发生变化。
如等温过程中温度,热力学能未发生变化。
⑶错误。
盖斯定律中所说的热效应,是等容热效应ΔU或等压热效应ΔH。
前者就是热力学能变,后者是焓变,这两个都是热力学函数变,都是在过程确定下的热效应。
⑷错误。
物质的绝对熵确实随温度的升高而增大,但反应物与产物的绝对熵均增加。
化学反应△S的变化要看两者增加的多少程度。
一般在无相变的情况,变化同样的温度,产物与反应物的熵变值相近。
故在同温下,可认为△S不受温度影响。
⑸错误。
从公式△G =△H-T△S可见,△G受温度影响很大。
3.标准状况与标准态有何不同3.标准状态是指0℃,1atm。
标准态是指压力为100kPa,温度不规定,但建议温度为25℃。
4.热力学能、热量、温度三者概念是否相同试说明之。
4.这三者的概念不同。
热力学能是体系内所有能量的总和,由于对物质内部的研究没有穷尽,其绝对值还不可知。
热量是指不同体系由于温差而传递的能量,可以测量出确定值。
温度是体系内分子平均动能的标志,可以用温度计测量。
5.判断下列各说法是否正确:⑴热的物体比冷的物体含有更多的热量。


第二章化学热力学初步1. 热力学第一定律WU-=Q∆,由于U为状态函数,所以Q和W也是状态函数,对吗?为什么?答:不对。
Q和W只有在能量交换的时候才会有具体的数值,并且随途径不同,共和热的数值都会有变化,所以不是状态函数。
2. 解释下列名词(1) 体系与环境(2) 热(Q)(3) 功(W)(4) 焓(H)和焓变(H∆)(5) 热力学能U(6) 恒容反应热(Q V)和恒压反应热(Q p)答:(1) 热力学中称研究的对象为体系,称体系以外的部分为环境。
(2) 体系在变化过程中吸收的热量为Q。
(3) 体系对环境所做的功。
(4) H=U+PV当泛指一个过程的时候,其热力学函数的改变量为焓变。
(5) 体系内一切能量的总和叫热力学能。
(6) 在恒容过程中完成的化学反应,其热效应称为恒容反应热。
在恒压过程中完成的化学反应,其热效应称为恒压反应热。
3. 什么叫状态函数?它具有何特性?答:藉以确定体系状态的物理量称为体系的状态函数。
它具有加和性。
4. 何谓热效应?测量方法有哪两种?答:化学反应的热效应为当生成物和反应物的温度相同时,化学反应过程中的吸收或放出的热量。
可以选择恒压和恒容两种条件下测量。
5. 什么叫热化学方程式?书写热化学方程式要注意哪几点?答:表示出反应热效应的化学方程式叫做热化学方程式。
书写化学方程式时要注意一下几点:(1)写热化学方式式,要注意反应的温度和压强条件,如果反应是在298K和1.013×105Pa下进行时,习惯上不予注明。
(2)要注明物质的聚集状态和晶形。
(3)方程式中的配平系数只是表示计量数,不表示分子数。
但计量数不同时,同一反应的反应热数值也不同。
6. ①无机化学中常用的反应热有哪几种?反应热的实质是什么?什么类型的化学反应Q V=Q p?等摩尔的NaOH和NH3·H2O溶液分别与过量的HCl溶液中和所放热量是否相等?为什么?②反应2N2(g)+O2(g)=2N2O(g)在298K时,ΔrH mø=164K J·mol-1, 求反应的ΔU?答:①无机化学中常用的反应热有恒压反应热和恒容反应热。