(2)Na、Cl的原子结构示意图分别为
、
。钠元素具有较强的 金属性 ,反应中钠原
子易 失去 电子,氯元素具有较强的 非金属性 ,反应中
氯原子易 得到 电子。
(3)从原子结构的角度来看NaCl的形成过程。根据钠原子和
氯原子的核外电子排布,钠原子要达到8电子的稳定结构,就需
失去1个电子 ;而氯原子要达到8电子的稳定结构则需
获得1个电子 。钠与氯气反应时, 钠原子 的最外电子
层上的 1个电子 转移到 氯原子 的最外电子层上,形成
带 正电荷 的钠离子和带 负电荷 的氯离子。带 相反
电荷的钠离子和氯离子通过 静电作用 结合在一起,从而
形成与单质钠和氯气性质完全不同的氯化钠。
(4)定义: 带相反电荷离子 之间的相互作用叫做离子
及相互作用角度说明物质性质的共性、差异及其原因,解释
同类物质性质变化的规律。
4.知道分子存在一定的空间结构。认识化学键的断裂和形成
是化学反应中物质变化的实质及能量变化的主要原因。
知识概览
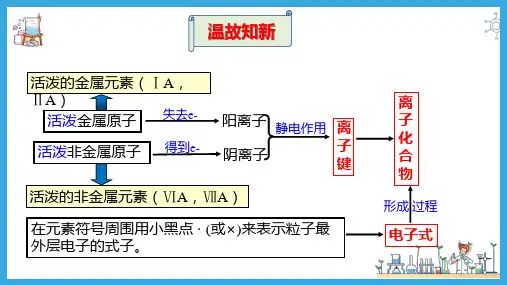
一、离子键
1.离子键的形成。
以NaCl的形成过程为例。
(1)钠与氯气反应的化学方程式为
2Na+Cl2
2NaCl 。
电;D项中N+ 与酸钠的形成过程。下列叙述中不正
确的是(
)。
A.钠原子易失去1个电子,
氯原子易得到1个电子
B.钠离子与钠原子具有
相似的化学性质
C.钠原子与氯原子作用生成NaCl后,其结构的稳定性增强
D.氯化钠是离子化合物
答案:B
解析:钠原子的最外层只有1个电子,易失去1个电子达到稳
( × )
(2)离子键是阴、阳离子间的相互吸引作用。( × )