反应精馏
- 格式:docx
- 大小:135.29 KB
- 文档页数:13


实验一反应精馏法制乙酸乙酯一、实验目的1.了解反应精馏是既服从质量作用定律又服从相平衡规律的复杂过程。
2.掌握反应精馏的操作。
3.能进行全塔物料衡算和塔操作的过程分析。
4.了解反应精馏与常规精馏的区别。
5.学会分析塔内物料组成。
二、实验原理1.实验仪器和药品:气相色谱仪GC−910及计算机数据采集和处理系统:载气1柱前压:0.05MPa桥电流:100mA 讯号衰减:32柱箱温度:125℃气化室温度:100℃检测器温度:125℃进样量:0.2μL无水乙醇( 分析纯) ,含量99. 0% ( 质量分数,下同) ; 冰乙酸( 分析纯) ,含量99. 0%; 浓硫酸( 化学纯) ,含量> 98. 0%2.反应精馏原理:反应精馏过程不同于一般精馏,它既有精馏的物理相变之传递现象,又有物质变性的化学反应现象。
反应精馏对下列两种情况特别适用:(1)可逆平衡反应。
一般情况下,反应受平衡影响,转化率只能维护在平衡转化的水平;但是,若生成物中有低沸点或高沸点物质存在,则精馏过程可使其连续地从系统中排出,结果超过平衡转化率,大大提高了效率。
(2)异构体混合物分离。
通常因它们的沸点接近,靠一般精馏方法不易分离提纯,若异构体中某组分能发生化学反应并能生成沸点不同的物质,这时可在过程中得以分离。
反应精馏存在以下优点:1.破坏了可逆反应平衡,增加了反应的选择性和转化率,使反应速度提高,从而提高了生产能力2.精馏过程可以利用反应热,节省了能量3.反应器和精馏塔合成一个设备,节省投资4.对某些难分离的物系,可以获得较纯的产品3.主要物质物性:4.汽液色谱法原理:采用气液色谱测定无限稀释溶液活度系数,样品用量少,测定速度快,仅将一般色谱仪稍加改装,即可使用。
目前,这一方法已从只能测定易挥发溶质在难挥发溶剂中的无限稀释活度系数,扩展到可以测定在挥发性溶剂中的无限稀释活度系数。
因此,该法在溶液热力学性质研究、气液平衡数据的推算、萃取精馏溶剂评选和气体溶解度测定等方面的应用,日益显示其重要作用。

胡競民白希耐一、裂解C5馏分分离现状1.双环戊二烯产品的分离国内一般通过加热和蒸馏的方法从裂解C5馏分中分离出工业级双环戊二烯,再由工业级双环戊二烯制取高纯度的双环戊二烯产品。
⑴精馏将工业级的双环戊二烯(80%纯度)通过减压蒸馏塔,在一定的塔高和一定回流比下进行蒸馏。
根据工业级双环戊二烯的组成不同,蒸馏操作可以是一台塔或者二台塔串联操作。
例如上海石化的分离装置采用一台塔,有的化工厂要获得高纯度的双环戊二烯产品则采用两台塔。
精馏获得的双环戊二烯纯度一般在90%~94%。
⑵解聚-二聚-蒸馏通过解聚-二聚-蒸馏法获得的双环戊二烯产品的纯度均比较高,一般在96%~98%,有的还可达到99%左右。
目前国内公布了很多有关该方法的专利技术,并已有1000t/a的工业规模装置,装置采用带搅拌的釜式结构,工艺流程简单,操作方便。
2.异戊二烯的分离国内实现工业化的异戊二烯分离技术为溶剂二甲基甲酰胺(DMF)萃取蒸馏法。
此外,业界在共沸精馏、反应精馏、加氢分离、一段萃取、共沸和萃取结合工艺等进行了很多研发工作,取得了一定成绩和进展。
二、新型C5分离工艺的开发1.C5馏分的加氢分离工艺C5馏分中含有大量的不饱和烃,根据产品用途的不同,可通过选择加氢或全加氢将其转化为烯烃或烷烃,再通过分离加以利用。
目前国内已利用由裂解汽油加氢装置得到的混合C5烷烃开发了新型C5烷烃分离工艺。
该工艺由加氢和烷烃分离过程组成,可同时得到环戊烷、异戊烷和正戊烷。
其工艺投资小,操作费用少,能耗低,可依市场需求灵活调整产品方案。
2.反应精馏技术采用反应精馏技术从C5馏分中分离双烯烃的方法,即将C5馏分进行反应精馏,使环戊二烯发生二聚反应, 异戊二烯由塔顶分离出去,物料经精馏分离得到间戊二烯、双环戊二烯和异戊二烯。
针对现有技术在脱除环戊二烯过程中存在的问题,反应精馏技术有其独特之处:(1)由于在脱除环戊二烯过程中能有效抑制除环戊二烯二聚反应外的其他二聚反应,因而减少了副产物的生成,既提高了双环戊二烯产品的质量又减少了C5双烯的损失;(2)由一个反应精馏塔替代现有技术中的二聚反应器和预脱重塔,简化了工艺流程和操作;(3)由于简化了工艺流程,减少了设备的投资,降低了生产过程中的能耗。

连续反应精馏生产丁酸酐的工艺开发一、引言丁酸酐是一种重要的有机化工原料,广泛应用于涂料、塑料、橡胶、医药等行业。
目前,丁酸酐的生产主要采用连续反应精馏工艺。
本文将重点介绍该工艺的开发过程及关键技术。
二、工艺流程连续反应精馏生产丁酸酐的工艺流程主要包括原料处理、反应装置设计、反应控制和产品分离等环节。
1. 原料处理丁酸酐的生产原料主要为丁醇和氧气。
在进料前,需要对原料进行预处理,如提纯、脱水等。
这可以避免杂质对反应过程的干扰,提高产品的质量和产率。
2. 反应装置设计连续反应精馏的关键是反应装置的设计。
一般采用催化剂床和精馏塔相结合的方式。
反应器中使用合适的催化剂,通过氧化反应将丁醇转化为丁酸酐。
而精馏塔则用于分离产物和副产物,提高丁酸酐的纯度和收率。
3. 反应控制在连续反应精馏过程中,反应温度、压力、催化剂用量和进料速率等参数的控制十分重要。
合理的反应温度和压力可以提高反应速率和选择性,催化剂的用量和进料速率则直接影响产物的质量和产率。
因此,需要对反应过程进行实时监测和控制,以确保工艺的稳定性和高效性。
4. 产品分离反应结束后,产物需要进行分离和提纯。
一般采用精馏和萃取等方法进行分离。
精馏过程中,通过不同组分的沸点差异,将丁酸酐从副产物中分离出来。
而萃取则可以进一步提高产品的纯度和质量。
三、关键技术在连续反应精馏生产丁酸酐的工艺开发中,有几个关键技术需要重点研究和解决。
1. 催化剂的选择催化剂是反应的关键,直接影响反应速率和选择性。
优选合适的催化剂可以提高丁酸酐的产率和质量。
目前,常用的催化剂有氧化铜、氧化锌等。
2. 反应温度和压力的控制反应温度和压力是影响反应速率和选择性的重要因素。
通过合理的控制,可以提高反应效率和产物质量。
一般情况下,较高的温度和压力有利于提高反应速率,但同时也会增加副反应的发生。
3. 反应控制技术连续反应精馏过程中,需要实时监测和控制反应参数。
现代化的自动化仪表系统可以实现对温度、压力、流量等参数的准确监测和控制,提高工艺的稳定性和可控性。

..实验一反应精馏法制乙酸乙酯一、实验目的1.了解反应精馏是既服从质量作用定律又服从相平衡规律的复杂过程。
2.掌握反应精馏的操作。
3.能进行全塔物料衡算和塔操作的过程分析。
4.了解反应精馏与常规精馏的区别。
5.学会分析塔内物料组成。
二、实验原理反应精馏过程不同于一般精馏,它既有精馏的物理相变之传递现象,又有物质变性的化学反应现象。
反应精馏对下列两种情况特别适用:(1)可逆平衡反应。
一般情况下,反应受平衡影响,转化率只能维护在平衡转化的水平;但是,若生成物中有低沸点或高沸点物质存在,则精馏过程可使其连续地从系统中排出,结果超过平衡转化率,大大提高了效率。
(2)异构体混合物分离。
通常因它们的沸点接近,靠一般精馏方法不易分离提纯,若异构体中某组分能发生化学反应并能生成沸点不同的物质,这时可在过程中得以分离。
对于本实验来说,适于第一种情况,但但该反应若无催化剂存在,单独采用反应精馏存在也达不到高效分离的目的,这是因为反应速度非常缓慢,故一般都用催化反应方式。
酸是有效的催化剂,常用硫酸。
反应精馏的催化剂用硫酸,是由于其催化作用不受塔内温度限制,在全塔内都能进行催化反应,而应用固体催化剂则由于存在一个最适宜的温度,精馏塔本身难以达到此条件,故很难实现最佳化操作。
本实验是以乙酸和乙醇为原料,在催化剂作用下生成乙酸乙酯的可逆反应。
反应的方程式为:CH3COOH + C2H5OH ↔ CH3COOC2H5+H2O实验的进料有两种方式:一是直接从塔釜进料;另一种是在塔的某处进料。
前者有间歇和连续式操作;后者只有连续式。
可认为反应精馏的分离塔也是反应器。
若采用塔釜进料的间歇式操作,反应只在塔釜内进行。
由于乙酸的沸点较高,不能进入到塔体,故塔体内共有3组分,即水、乙醇、乙酸乙酯。
本实验采用间歇式进料方式,物料衡算式和热量衡算式为:(1)物料衡算方程对第j块理论板上的i组分进行物料横算如下(2)气液平衡方程对平衡级上某组分i的有如下平衡关系:每块板上组成的总和应符合下式:(3)反应速率方程(4)热量衡算方程(5)对平衡级进行热量衡算,最终得到下式:三、实验装置示意图实验装置如图2所示。

强耦合反应精馏成套技术及工业应用一、技术概述强耦合反应精馏成套技术是一种先进的化工技术,它将反应过程与精馏过程紧密结合,实现了在同一设备中同时完成化学反应和产物分离。
这种技术的优点在于能够提高生产效率、降低能耗和减少设备投资。
二、技术原理强耦合反应精馏技术的核心在于将反应釜与精馏塔合二为一,形成一个整体设备。
在设备中,化学反应与精馏分离过程相互促进,形成一个高效的耦合系统。
反应物在反应釜中发生化学反应,生成产物和副产物。
由于反应过程产生的热量和浓度梯度,可以同时为精馏过程提供所需的能量和驱动力。
三、技术特点1.高效性:强耦合反应精馏技术能够在同一设备中完成化学反应和产物分离,避免了传统工艺中的多次分离和能量回收过程,提高了生产效率。
2.低能耗:由于反应过程与精馏分离过程相互耦合,能量得以充分利用,降低了能耗。
与传统的分离技术相比,强耦合反应精馏技术能够节省大量的能源。
3.紧凑性:强耦合反应精馏成套技术使用的设备数量较少,占地面积小,降低了投资成本和运行费用。
4.灵活性:该技术可根据不同的化学反应和产物分离需求,进行工艺流程的调整和优化,具有很高的灵活性。
5.环保性:强耦合反应精馏技术能够减少废水和废弃物的产生,降低环境污染。
同时,由于该技术的能耗低,也减少了温室气体的排放。
四、工业应用强耦合反应精馏成套技术在许多化工领域都有广泛的应用,如石油化工、精细化工、制药等。
以下是一些具体的工业应用实例:1.石油化工:在石油化工行业中,强耦合反应精馏技术可用于生产燃料油、润滑油等产品。
通过该技术,可以实现烃类化合物的选择性氧化和水合反应,提高产品的质量和收率。
2.精细化工:在精细化工领域,强耦合反应精馏技术可用于生产高纯度化学品、功能性材料等。
例如,通过该技术可以生产高纯度醇类、酯类、醚类等化学品,以及功能性聚合物和复合材料。
3.制药:在制药领域,强耦合反应精馏技术可用于生产原料药、中间体和药物制剂等。
该技术可以用于实现药物的有效成分和杂质的分离纯化,提高药物的纯度和收率。

反应精馏实验报告实验目的,通过反应精馏实验,掌握精馏技术,了解反应精馏原理,提高化学实验操作能力。
实验原理,反应精馏是在精馏过程中,将反应物加入精馏瓶中,通过加热使其发生反应,然后进行精馏,从而得到产物。
这种方法适用于需要在高温下进行反应的情况。
实验仪器,反应精馏设备、精密恒温加热器、精密恒温控制仪、精密磁力搅拌器、精密温度计、精密压力计等。
实验步骤:1. 将反应精馏设备装好,连接好冷凝管和接收瓶。
2. 在精馏瓶中加入反应物,并加入适量的溶剂。
3. 装上精密恒温控制仪,设置好反应温度。
4. 打开精密恒温加热器,开始加热反应精馏瓶。
5. 在反应过程中,通过精密磁力搅拌器进行搅拌,保持反应均匀。
6. 根据产物的沸点,控制好冷凝管的温度,收集产物。
实验结果分析:通过反应精馏实验,我们成功地得到了产物,并通过测定其物理性质和化学性质,确认了产物的结构和纯度。
实验结果表明,反应精馏是一种有效的方法,可以在高温下进行反应,并得到纯净的产物。
实验结论:反应精馏是一种重要的精馏方法,它可以在反应过程中进行精馏,从而得到纯净的产物。
通过本次实验,我们掌握了反应精馏的操作技巧,加深了对反应精馏原理的理解,提高了化学实验操作能力。
实验总结:反应精馏实验是化学实验中的重要内容,通过实验可以加深对精馏技术和反应原理的理解,提高实验操作能力。
在今后的学习和工作中,我们将继续努力,不断提升自己的实验技能,为将来的科研工作打下坚实的基础。
通过本次反应精馏实验,我们不仅学会了操作反应精馏设备,还加深了对精馏原理和反应过程的理解,为今后的学习和科研工作奠定了基础。
希望在今后的实验中,我们能够继续努力,不断提高自己的实验技能,为科学研究做出更大的贡献。

反应精馏过程中的多稳态分析
稳态精馏过程中,当流动相和气体分子的碰撞次数足够多时,就能形成热力学平衡。
当反应物系的温度等于或高于临界温度时,反应的平衡常数最大;随着反应进行到一定程度后,反应速率下降,产品浓度上升,使得平衡向右移动,直至达到新的稳态。
若反应过程为可逆反应,则这个过程会无限制地重复下去。
在该反应器内进行的精馏操作称为“稳态精馏”,其主要特点是:①由于气、液相间发生的反应为放热反应,故只需将温度控制在反应的平衡温度以上即可实现;②在保持平衡不变的条件下,提高产品浓度比较容易。

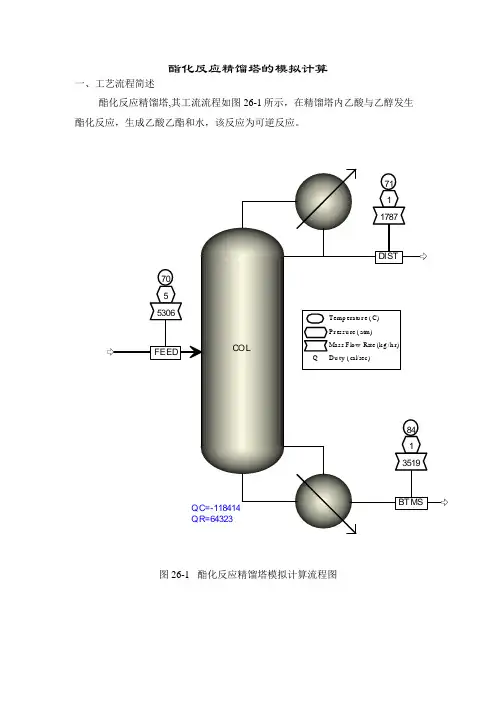
酯化反应精馏塔的模拟计算
一、工艺流程简述
酯化反应精馏塔,其工流流程如图26-1所示,在精馏塔内乙酸与乙醇发生酯化反应,生成乙酸乙酯和水,该反应为可逆反应。
图26-1 酯化反应精馏塔模拟计算流程图
二、需要输入的主要参数
1、 装置进料数据
表26.1 进料数据
物流号 FEED
温度,℃ 70
压力,atm 5.0 组份流量,kmol/h
乙酸(AA) 50
乙醇(ETOH) 50
2、 单元操作参数
DA501塔操作压力atm 1.00
全塔压降MPa 0.03
理论板数 15
进料板7
冷凝器类型 全凝器
塔顶产品 30kmol/h
回流比 0.70
3、反应数据
乙酸(AA)+乙醇(ETOH)←→乙酸乙酯(EA)+水
正反应
R=1.9E8-5.95E7/RT[AA][ETOH]
逆反应
R=5.0E7-5.95E7/RT[AA][ETOH]
浓度单位 kmol/m3
反应速率单位 kmol/m3.S
活化能J/kmol
液相反应,滞液量再沸器1.0L,其它板0.3L.
三、软件版本
采用ASPEN PLUS 软件V7.2版本,保存文件名KINETICS.APW。

一、实验目的1. 了解反应精馏是既服从质量作用定律又服从相平衡规律的复杂过程。
2. 掌握反应精馏的操作。
3. 学会分析全塔物料衡算的方法。
二、实验原理反应精馏过程不同于一般精馏,它既有精馏的物理相变现象,又有反应的化学变化现象。
两者同时存在,相互影响,使过程更加复杂。
因此,反应精馏对以下两种情况特别适用:(1)可逆平衡反应。
一般情况下,反应受平衡影响,转化率只能维持在平衡转化的水平;但是,若生成物中有低沸点或高沸点物质存在,则精馏过程可使其从系统中排出,结果超过平衡转化率,大大提高了效率。
(2)异构体混合物分离。
通常因它们的沸点接近,靠精馏方法不易分离提纯,若异构体中某组分能发生化学反应并能生成沸点不同的物质,这时可在过程中得以分离。
醇酸酯化反应属于第一种情况。
但该反应在无催化剂存在时反应速度非常缓慢,反应精馏操作达不到高效分离的目的,故一般需要添加催化剂。
酸是有效的催化剂,反应随酸浓度增高而加快,浓度在0.2~1.0%(wt.)。
本实验是以醋酸和乙醇为原料、在硫酸催化剂作用下生成醋酸乙酯的可逆反应。
反应的化学方程式为:实验的进料方式有两种:一是直接从塔釜进料;另一种是在塔的某处进料。
前者有间歇和连续式操作;后者只有连续式。
本实验采用塔釜间歇式进料。
反应精馏过程中,塔内有四组元。
由于醋酸在气象中有缔合作用,除醋酸外,其他三个组分形成三元或者二元共沸物。
水-酯,水-醇共沸物沸点较低,醇和酯能不断地从塔顶排出。
若控制反应原料比例,可使某组份全部转化。
因此,可认为反应精馏的分离塔同时也是反应器。
全过程可用物料衡算式和热量衡算式描述。
三、装置流程与面板布置图OH CH COOCH CH COOH CH OH CH CH 2323323+↔+1. 装置流程示意图符 号说 明BV 二通球阀RV 调节阀HV 热 阀F转子流量计V 储 罐EW 电子称HE 换热器MV 电磁阀MC电磁线圈L 液面计P泵W 预热器TE 温度传感器TIC 控 温TY 加热原件PI 测 压TI 测 温L-12. 面板布置图四、实验装置与试剂反应精馏塔用不锈钢制成,直径20 mm,塔内填料高度1400 mm,塔内装填Φ2.5×2.5mm不锈钢θ网环型填料(316L)。
北京化工大学硕士研究生课程论文题目精馏塔反应器的研究现状及应用研究生XXX专业化学工程与技术指导教师XXX日期: 二○ 一四年四月三日精馏塔反应器的研究现状及应用摘要反应精馏是化学反应和精馏过程藕合为一体的单元操作,已成为当今的重要研究领域。
目前,反应精馏技术已在多个领域实现了产业化,在某些新领域也取得了一定进展。
反应精馏和传统精馏技术相比,具备显著的节能和降低投资的优点。
因此,如何最大程度地挖掘反应精馏系统的潜在节能优势,有很高的研究价值。
本文对反应精馏技术的研究现状及其应用进行了综述,介绍了反应精馏塔及催化剂,对催化剂床中传质及流体力学特征,数学模型和反应精馏塔设计方程进行了总结,同时介绍了反应精馏技术的应用现状及其可能的应用领域。
关键字:反应精馏塔流体力学催化剂装填过程模拟ABSTRACTIn recent years,reactive distillation which combined with reaction and separation in one unit,is given extensive attention. At present,the reactive distillation technology has been implemented in many industrial areas,and has also made some progress in some new areas. Contrast to the conventional distillation process,the reactive distillation process can offer more benefits in utility consumption and capital investment. So it makes sense to activate the potential advantage of the reactive distillation columns in the chemical process industry.The development and the application of the reactive distillation were reviewed, and the reactive distillation colum and the catalyst bed were introduced. The mathematic models and the design equation of the reactive distillation column were summarized. The application and the possible field of the reactive distillation were also mentioned.KEY WORDS:reactive distillation, fluid mechanics, catalyst filling, process simulation目录1简介 (1)1.1反应精馏塔概念 (1)1.2反应精馏塔结构 (2)1.3反应精馏技术的应用 (2)2反应精馏塔结构详解 (3)2.1对催化剂的要求 (3)2.2催化剂装填方式 (4)3传质及流体力学特征 (7)3.1流体力学特征 (7)3.2传质 (8)3.3过程模拟 (9)3.4强化混合与传质的措施 (12)4适用反应体系及工业应用实例 (13)4.1适用反应体系 (13)4.2工业应用实例 (14)5结论 (14)1简介1.1反应精馏塔概念蒸馏的基本原理是将液体混合物多次部分气化和部分冷凝,利用其中各组份挥发度不同(相对挥发度,α)的特性,实现分离目的的单元操作。
什么是特殊精馏?共沸、萃取、反应、真空......这些特殊精馏你知道几种?2018年的国考报名大幕拉开了!今年有120多个单位招考,计划招录2.8万余人。
又是一年国考时,几家欢喜几家愁......祝参加考试的旁友逢考必过,不忘初心!不参加考试的就安安静静当个吃瓜群众。
亲爱的旁友们,你们知道什么是特殊精馏吗?特殊精馏有哪些种类?添加剂精馏和复合精馏有什么特点?什么是非常规条件下的精馏?今天小七就跟大家说说什么是特殊精馏。
come on,旁友们!什么是特殊精馏?当待分类组分之间形成共沸物或相对挥发度接近1时,用普通精馏是无法实现分离或是经济上不合理的。
此时,向体系中加入一种适当的新组分,通过与原体系中各组分的不同作用,改变组分之间的相对挥发度,使系统变得易于分离,这类既加入能量分离剂又加入质量分离剂的精馏称为特殊精馏。
特殊精馏分类(按操作条件)•添加剂精馏:例如共沸、萃取•加盐精馏复合(或耦合)精馏:例如反应精馏•非常规条件下的精馏:例如分子精馏什么是添加剂精馏?添加剂精馏方法通过加入某一组分(称为夹带剂)去与被分离物系中的一个或几个组分形成共沸物或是破坏原物料组分间可能存在的共沸物的方式达到分离效果,可分为萃取精馏、恒沸精馏和加盐精馏。
恒沸精馏在恒沸精馏中,第三组分与原溶液中的一个组分形成恒沸物,原有组分间的相对挥发度增大,使该溶液能用一般精馏方法分离。
第三组分称为恒沸剂或夹带剂。
恒沸精馏中合适夹带剂的选用:(1)恒沸物恒沸点与溶液中纯组分沸点有相当差值,一般不小于10℃。
(2)恒沸物易分离,以便回收夹带剂,夹带剂含量越少操作费用越省。
(3)热稳定性好、无腐蚀性、无毒性。
工业酒精恒沸精馏(用苯作恒沸剂)制取无水酒精乙醇-水二元恒沸物(恒沸点78.15℃,乙醇摩尔分率为0.894)只要苯量适当,原料液中的水分可全部转移到三元恒沸液中,因而使乙醇-水溶液得到分离。
萃取精馏萃取精馏也是向原料液中加入第三组分,称为萃取剂。
化工反应精馏塔组装清单计价表摘要:1.化工反应精馏塔概述2.精馏塔组装清单3.精馏塔计价表解析4.组装与施工注意事项5.总结正文:化工反应精馏塔是化工行业中常见的一种设备,主要用于进行物质分离和提纯。
本文将为您介绍精馏塔的组装清单计价表,帮助大家了解精馏塔的组成部分以及组装过程中需要注意的事项。
一、化工反应精馏塔概述化工反应精馏塔是一种塔式设备,通常由塔体、塔板、填料、进出口管道、保温层等部分组成。
它利用不同物质在塔内不同位置的汽液相平衡原理,实现物质分离和提纯。
二、精馏塔组装清单1.塔体:塔体是精馏塔的基础部分,通常采用不锈钢、碳钢等材料制成。
2.塔板:塔板是精馏塔内实现物质分离的关键部分,包括圆形孔板、条形孔板等类型。
3.填料:填料用于增加塔内表面积,提高分离效果。
常见填料有拉西环、矩形环、陶瓷球等。
4.进出口管道:进出口管道连接精馏塔与上下游设备,通常包括法兰、阀门、流量计等附件。
5.保温层:保温层用于降低热量损失,保证精馏过程的稳定进行。
常见保温材料有岩棉、玻璃棉等。
6.其他附件:其他附件包括液位计、温度计、压力表等,用于实时监测塔内参数。
三、精馏塔计价表解析精馏塔计价表是根据精馏塔的组装清单,结合各种材料、附件和施工费用编制的。
以下是精馏塔计价表的主要内容:1.材料费用:包括塔体、塔板、填料等材料的购买费用。
2.附件费用:包括法兰、阀门、流量计等附件的购买费用。
3.施工费用:包括组装、焊接、调试等施工环节的费用。
4.保温费用:包括保温材料和施工的费用。
5.人工费用:包括设计、采购、施工、管理等方面的人员工资。
6.运输费用:包括设备运输、安装等费用。
四、组装注意事项1.严格按照设计图纸和组装清单进行组装。
2.确保各部件质量合格,特别是塔体、塔板、填料等关键部件。
3.焊接质量要求高,避免出现焊缝不合格等问题。
4.组装过程中要注意防止零部件损伤,避免划痕、碰伤等。
5.施工过程中要遵守安全规定,确保人身和设备安全。
异丙醇醚化反应精馏制备异丙醚是一种新型工艺,通过该工艺可以有效地生产高纯度的异丙醚产品。
本文将对异丙醇醚化反应和精馏工艺进行详细介绍,以期为相关领域的研究和应用提供参考。
一、异丙醇醚化反应1. 异丙醇醚化反应的原理异丙醇醚化反应是指在催化剂的作用下,异丙醇与醚化剂发生反应,生成异丙醚。
该反应通常在一定的温度和压力下进行,需要精确控制反应条件,以提高产物的纯度和产率。
2. 催化剂的选择催化剂在异丙醇醚化反应中起着至关重要的作用,常用的催化剂包括酸性离子交换树脂、固体酸和金属氧化物等。
这些催化剂能够有效催化异丙醇与醚化剂之间的化学反应,加速产物的生成。
3. 反应条件的控制反应温度、压力和物料比对异丙醚的产率和纯度有重要影响。
通常情况下,较低的温度和较高的压力有利于提高产物的纯度,而适当的物料比可以提高产率。
二、精馏工艺1. 精馏的原理精馏是一种将液体混合物按照沸点的不同,在加热的条件下分离成纯度较高的组分的方法。
在异丙醚生产中,精馏工艺可以有效地将产物中的杂质去除,提高产物的纯度。
2. 精馏塔的设计在异丙醚精馏工艺中,精馏塔的设计至关重要。
采用适当的精馏塔结构和填料设计能够有效地提高分离效率,减少能耗,降低生产成本。
3. 工艺参数的优化精馏过程中,操作参数的优化对产品质量有着重要的影响。
对精馏温度、回流比、进料速率等参数的控制和调整,可以有效地提高异丙醚的纯度和产率。
三、新工艺的优势和应用前景1. 高纯度的产品通过异丙醇醚化反应精馏制备异丙醚的新工艺,可以获得高纯度的异丙醚产品,满足各种工业领域对高纯度溶剂的需求。
2. 资源利用效率高该工艺具有资源利用效率高、能耗低的优势,有望成为工业生产中的重要技术手段。
3. 应用前景广阔异丙醚作为一种重要的工业原料,在化工、合成材料等领域有着广泛的应用前景。
通过新工艺生产的高纯度异丙醚产品,将有望在各个行业得到广泛应用。
异丙醇醚化反应精馏制备异丙醚的新工艺具有重要的研究和应用价值。
化工专业实验报告实验名称:反应精馏法制乙酸乙酯实验人员:聂子杨同组人:任天宇、唐剑鑫实验地点:天大化工技术实验中心624室实验时间:2013年5月21号年级2010 ;专业化学工程与工艺;组号9 ;学号3010207103 指导教师:李丽实验成绩:天津大学化工技术实验中心印制反应精馏法制乙酸乙酯一.实验目的1.了解反应精馏是既服从质量作用定律又服从相平衡规律的复杂过程。
2.掌握反应精馏的操作。
3.能进行全塔物料衡算和塔操作的过程分析。
4.了解反应精馏与常规精馏的区别。
5.学会分析塔内物料组成。
二.实验原理1.过程原理反应精馏是精馏技术中的一个特殊领域。
在操作过程中,化学反应与分离同时进行,故能显著提高总体转化率,降低能耗。
此法在酯化、醚化、酯交换、水解等化工生产中得到应用,而且越来越显示其优越性。
反应精馏过程不同于一般精馏,它既有精馏的物理相变之传递现象,又有物质变性的化学反应现象。
二者同时存在,相互影响,使过程更加复杂。
因此,反应精馏对下列两种情况特别适用:(1)可逆平衡反应。
一般情况下,反应受平衡影响,转化率只能维护在平衡转化的水平;但是,若生成物中有低沸点或高沸点物质存在,则精馏过程可使其连续地从系统中排出,结果超过平衡转化率,大大提高了效率。
(2)异构体混合物分离。
通常因它们的沸点接近,靠一般精馏方法不易分离提纯,若异构体中某组分能发生化学反应并能生成沸点不同的物质,这时可在过程中得以分离。
对醇酸酯化反应来说,适于第一种情况。
但该反应若无催化剂存在,单独采用反应精馏存在也达不到高效分离的目的,这是因为反应速度非常缓慢,故一般都用催化反应方式。
酸是有效的催化剂,常用硫酸。
反应随酸浓度增高而加快,浓度在0.2~1.0%(wt)。
此外,还可用离子交换树脂,重金属盐类和丝光沸石分子筛等固体催化剂。
反应精馏的催化剂用硫酸,是由于其催化作用不受塔内温度限制,在全塔内都能进行催化反应,而应用固体催化剂则由于存在一个最适宜的温度,精馏塔本身难以达到此条件,故很难实现最佳化操作。
本实验是以乙酸和乙醇为原料,在催化剂作用下生成乙酸乙酯的可逆反应。
反应的方程式为:CH3COOH+C2H5OH↔CH3COOC2H5+H2O实验的进料有两种方式:一是直接从塔釜进料;另一种是在塔的某处进料。
前者有间歇和连续式操作;后者只有连续式。
若用后一种方式进料,即在塔上部某处加带有酸催化剂的乙酸,塔下部某处加乙醇。
釜沸腾状态下塔内轻组分逐渐向上移动,重组分向下移动。
具体地说,乙酸从上段向下段移动,与向上段移动的乙醇接触,在不同填料高度上均发生反应,生成酯和水。
塔内此时有4组分。
由于乙酸在气相中有缔合作用,除乙酸外,其它三个组分形成三元或二元共沸物。
水-酯,水-醇共沸物沸点较低,醇和酯能不断地从塔顶排出。
若控制反应原料比例,可使某组分全部转化。
因此,可认为反应精馏的分离塔也是反应器。
若采用塔釜进料的间歇式操作,反应只在塔釜内进行。
由于乙酸的沸点较高,不能进入到塔体,故塔体内共有3 组分,即水、乙醇、乙酸乙酯。
全过程可用物料衡算式和热量衡算式描述:(1)物料衡算方程对第j 块理论板上的i 组分进行物料衡算如下(如图1 所示):L j−1X i,j−1+V j+1Y i,j+1+F j Z j,i+R i,j=V j Y i,j+L j X i,j(1)2≤j≤n,i=1,2,3,4(2)气液平衡方程对平衡级上某组分i 的有如下平衡关系:K i,j·X i,j−Y i,j=0 (2)每块板上组成的总和应符合下式:∑Y i,j ni=1=1 ; ∑X i,jni=1=1 (3)(3)反应速率方程R i,j=K j·P j(X i,j∑Q i,j·X i,j)2×105 (4)式(4)指原料中各组分的浓度相等条件下才能成立,否则应予修正。
(4)热量衡算方程对平衡级上进行热量衡算,最终得到下式:L j−1ℎj−1−V j H j−L jℎj+V j+1H j+1+F j H fj−Q j+R j H rj=0 (5)符号说明:F j——j版进料量ℎj——j板上液体焓值H j——j板上气体焓值H fj——j板上原料焓值H rj——j板上反应热焓值L j——j板下降液体量K i,j——i组分的汽液平衡函数P j——j板上液体混合物体积(持液量)R i,j——单位时间j板上单位液体体积内i组分反应量V j——j板上升蒸汽量X i,j——j板上组分i的液相摩尔分数Y i,j——j板上组分i的气相摩尔分数Z j,i——j板上组分i的原料组成Q j——j板上冷却或加热的热量2.设备原理实验装置如图2 所示。
反应精馏塔用玻璃制成。
直径20mm ,塔高1500mm,塔内填装φ3×3mm不锈钢填料(316L)。
塔外壁镀有金属膜,通电流使塔身加热保温。
塔釜为一玻璃容器,并有电加热器加热。
采用XCT -191,ZK-50可控硅电压控制釜温。
塔顶冷凝液体的回流采用摆动式回流比控制器操作。
此控制系统由塔头上摆锤、电磁铁线圈、回流比计数拨码电子仪表组成。
所用的试剂有乙醇、乙酸、浓硫酸、丙酮和蒸馏水。
1 测温热电阻2 冷却水3 摆锤4 电磁铁5 塔头6 馏出液收集瓶7 回流比控制器8 取样口9 塔体10 数字是温度显示器11 控温仪12 加料口13 塔釜14电加热器15 卸料口图2 反应精馏流程及装置三.实验流程间歇操作①乙醇、乙酸各80g(误差±0.1g),浓硫酸3滴倒入塔釜内,开启釜加热系统(0.4A)。
开启塔身保温电源(上下段均为0.1A)。
开启塔顶冷凝水。
②塔顶摆锤上有液体出现时,进行全回流操作。
15分钟后,设定回流比为3:1,开启回流比控制电源。
③20 分钟后,用微量注射器在塔身三个不同高度取样,应尽量保证同步。
④分别将0.2μl 样品注入色谱分析仪,记录结果。
⑤重复3,4 步操作。
⑥关闭塔釜及塔身加热电源及冷凝水。
对馏出液及釜残液进行称重和色谱分析(当持液全部流至塔釜后才取釜残液),关闭总电源。
四.实验数据记录实验装置:1 上下段加热电流:0.1A 釜加热电流:0.4A 加入乙酸质量:80.2g 加入乙醇质量:79.5g 浓硫酸量:3滴表1 精馏过程实验记录馏出液质量:182.65g (瓶重92.83g ) 釜残液质量:138.53g (瓶重:99.66g ) 色谱条件:柱前压:0.05MPa 桥流:100μA 汽化室温度:99.9℃ 柱箱温度:100.3℃ 检测气温度:120.1℃ 进样量:0.2μl 相对校正因子:F 水=0.40027 F 乙醇=1 F 乙酸=0.5329 F 乙酸乙酯=1.52176表2 色谱分析记录五.数据处理1. 乙酸和乙醇的全塔物料衡算表3 全塔物料衡算表其中,原料数据为实验前测得,塔顶塔釜数据为根据色谱分析结果计算所得,计算举例(以塔顶物料为例)如下:馏出液质量:m 馏=182.65−92.83=89.82g根据实验数据,第一次取样各物质含量百分比为:x水1=A水F水∑A i F i=0.40027×91270.40027×9127+1×27354+1.52176×88963×100%=2.20%x醇1=A醇F醇∑A i F i=1×273540.40027×9127+1×27354+1.52176×88963×100%=16.44%x酯1=A酯F酯∑A i F i=1.52176×889630.40027×9127+1×27354+1.52176×88963×100%=81.36%同理计算出第二次取样各物质百分比:x水2=2.16% x醇2=16.44% x酯2=81.40%由此看出,两次分析相差不大,取平均值得:x 水=2.18% x醇=16.44% x酯=81.38%故塔顶馏出液各物质质量为:m水=89.82×2.18%=1.96gm醇=89.82×16.44%=14.77gm酯=89.82×81.38%=73.09g残留以及挥发物料量:釜残液质量:m釜=138.53−99.66=38.87g残留以及挥发物料量:∆m=原料量−馏出液量−釜残液量=80.20+79.50−89.82−38.87=31.01g粗略计算反应消耗的物料:乙醇反应质量: m醇反=79.50−14.77−9.39=55.34g物质的量: n醇反=55.34/46.07=1.20mol乙酸反应质量:m酸反=80.20−6.59=73.61g物质的量:n酸反=73.61/60.05=1.22mol由此可以看出乙酸和乙醇的消耗量并不严格相等,加上上面计算得出的较大的残留及挥发量,这说明实验存在较大的误差。
2.塔内浓度分布 1)15:57时浓度分布表4 15:57取样分析结果计算举例(以上段为例): x 水=A 水F 水∑A i F i=0.40027×42980.40027×4298+1×15966+1.52176×51682×100%=1.79%x 醇=A 醇F 醇∑A i F i =1×159660.40027×4298+1×15966+1.52176×51682×100%=16.57%x 酯=A 酯F 酯∑A i F i=1.52176×516820.40027×4298+1×15966+1.52176×51682×100%=81.64%根据表4作图得:图3 15:57取样分析各物质浓度分布2)16:17时浓度分布表5 16:17取样分析结果作图得:图4 16:17取样分析各物质浓度分布从以上两图可以看出,在两个时间取样分析的结果均显示为乙酸乙酯的含量由下至上逐渐升高,乙醇和水的含量由下至上逐渐减少。
所有物料含量变化幅度均是下段较大,上段相对稳定。
3.反应收率因为乙醇过量,所以乙酸是关键物质,摩尔收率计算如下:Y=实际生成的酯的物质的量理论生成酯的物质的量×100%=m塔顶酯M酯⁄m原料酸M酸⁄×100%=73.0988.11⁄80.2060.05⁄×100%=62.1%4.反应转化率公式:α=转化量原料量则乙酸转化率为:α酸=m酸反m原料酸×100%=73.6180.20×100%=91.78%乙醇转化率为:α醇=m醇反m原料醇×100%=55.3479.50×100%=69.61%六.误差分析本实验可能的误差来源有:1. 塔内残留的原料、产物以及从塔顶挥发的原料、产物对实验结果的计算分析带来了较大的误差。