人教2011初中化学九年级上册《第三单元 物质构成的奥秘 课题2 原子的结构 相对原子质量》_72
- 格式:docx
- 大小:66.89 KB
- 文档页数:7

第三单元原子的结构(参考课时:2课时)1 教学目标1.1 知识与技能:①了解原子是由质子,中子和电子构成的。
②了解原子结构中的一些规律及构成原子的粒子间的关系。
③理解原子不显电性的原因。
④知道原子核外电子是分层排布的。
⑤了解离子的形成,初步理解离子是构成物质的一种粒子。
1.2过程与方法:①充分利用教材提供的图、表等资料,借助模型,多媒体等教学手段。
化抽象为直观,初步学会使用类比,想象,归纳,概括等方法获取信息并实行加工。
②通过讨论与交流,启发学生的思维,逐步养成良好的学习习惯。
1.3 情感态度与价值观:①激发学生对微观世界的好奇心和探究欲,增强学生学习化学的兴趣。
②对学生实行世界的物质性,物质的可分性的辩证唯物主义观点的教育。
③通过对原子结构探究,初步学会化学理论的探究方式及方法。
2 教学重点/难点/易考点2.1 教学重点①对原子结构的探究理解。
②原子的结构:核电荷数、核内质子数和核外电子数的关系。
③离子的形成过程、核外电子排布。
2.2 教学难点①知道原子的结构,建立物质无限可分的观点。
②相对原子质量概念的形成。
③离子的形成过程。
3 专家建议重点建立原子结构的概念及其关系。
通过观察、讨论与交流、领悟等系列群体探究方式来逐步完善对原子结构的理解。
通过对具体原子质量的实际数据展示的观察,感受引入相对原子质量的意义,并学习查阅相对原子质量分方法。
5 教学用具多媒体。
6 教学过程6.1第一课时6.1.1 引入新课引导学生回顾分子、原子的定义,提出问题:“上节课我们学习了物质的构成,知道了物质是由分子或原子构成的,谁能说说分子、原子的定义及区别呢?”学生回答:“分子是保持物质化学性质的微粒,原子是化学变化中的最小粒子。
区别是:在化学变化中,分子不能再分,原子可再分。
”我们知道了分子是由原子构成的,那么,你们是否思考过这些问题:原子是否能够再分呢?如果能够,它又是由什么构成的呢?这堂课我们一起来学习原子的构成。

相对原子质量一、教学目标(一)知识与技能目标1.能应用概念计算原子的相对原子质量2.能说出原子的实际质量与相对原子质量的区别与联系3、会查相对原子质量表(二)过程与方法目标法(三)情感态度价值观目标1.体会科学计量的重要性,培养学生科学的计量观和计量意识以及敢于向权威质疑的科学精神。
2.结合张青莲教授的卓越贡献资料,对学生实行爱国主义教育。
二、教学重点和难点教学重点:相对原子质量的概念和计算教学难点:相对原子质量和原子的实际质量的比较。
三、教学过程(一)知识点回顾1、构成物质的粒子:分子——保持物质化学性质的最小粒子在化学反应中能够再分原子——化学变化中的最小粒子在化学反应中不能再分2、原子的结构:质子(+)原子核(+)—原子——中子核外电子(-)(二)知识新授1、提出问题:原子很小,那么原子有没有质量呢?每个原子都有它相对应的质量2、列举原子的质量一个碳原子的质量是:0.00000000000000000000000001993千克即1.993×10-26千克一个氧原子的质量是:0.00000000000000000000000002657千克即2.657×10-26千克一个氢原子的质量是:0.00000000000000000000000000167千克即1.67×10-27千克提出问题:原子的质量很小,书写、使用都很不方便,怎么办?引出相对原子质量的概念3、相对原子质量以一种碳原子质量的1/12为标准,其他原子的质量跟它相比较所得的比,作为这种原子的相对原子质量。
(符号为Ar)碳原子质量的1/12=1/12×一种碳12原子的质量≈ 1.66×10-27Kg已知:氢原子的质量=1.67×10-27Kg氢的相对原子质量= 1.67×10-27Kg/ 1.66×10-27Kg=1(1)核电荷数=核内质子数=核外电子数(2)相对原子质量≈质子数+中子数(3)跟质子、中子相比,电子质量很小,通常忽略不计,所以原子的质量主要集中在原子核上。
第 相对原子质量
【学习目标】
初步了解相对原子质量的概念,并会查相对原子质量表。
【教学重难点】相对原子质量的概念
【教学过程】
《自主预习》
阅读课本第56页的相关内容,完成下列填空:
2.相对原子质量是指以 一种碳原子质量的1/12为标准,其他原子的质量与它相比较所得到
的比 。相对原子质量是一个比值,它的单位是1。
3.阅读课本第62页表3—4,查找各原子的相对原子质量,两人一组,看谁查得快。
《小组讨论》
为了更方便地使用相对原子质量,一般化学计算多采用它的近似值。相对原子质量的近似值
的公式是如何推导的呢?(提示:计算中子、质子的相对质量,电子的质量忽略不计。)
《知识小结》相对原子质量= 质子数 + 中子数 。
《教师点拨》
相对原子质量不是原子的实际质量,它的单位是1。相对原子质量=质子数+中子数。
《课堂练习》
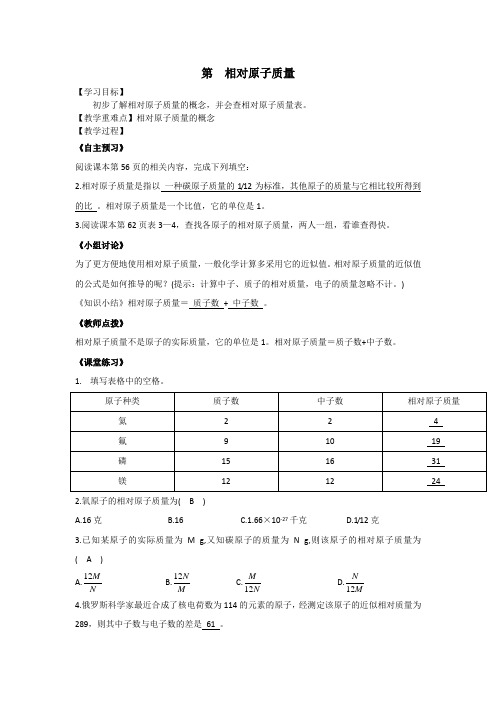
1. 填写表格中的空格。
原子种类 质子数 中子数 相对原子质量
氦
2 2 4
氟
9 10 19
磷
15 16 31
镁
12 12 24
2.氧原子的相对原子质量为( B )
A.16克 B.16 C.1.66×10-27千克 D.1/12克
3.已知某原子的实际质量为M g,又知碳原子的质量为N g,则该原子的相对原子质量为
( A )
A.NM12 B.MN12 C.NM12 D.MN12
4.俄罗斯科学家最近合成了核电荷数为114的元素的原子,经测定该原子的近似相对质量为
289,则其中子数与电子数的差是 61 。
【作业布置】课本第58页3、4、5、6
课题2 原子的结构 教学目标 知识与技能 (1)了解原子是由质子、中子和电子构成的。 (2)初步了解原子核外电子是分层排布的,了解原子结构的表示方法。 (3)了解离子的形成过程,理解离子是构成物质的一种粒子。 (4)初步了解相对原子质量的概念,并会查相对原子质量表。 (1)充分利用教材提供的图、表资料,借助模型、多媒体等教学手段,化抽象为直观,初步学会使用类比、想象、归纳、概括等方法对获取的信息实行加工。 (2)通过讨论交流、启发学生思维,增强归纳知识、获取知识的水平,逐步养成良好的学习习惯和方法。 (3)使用多媒体动画片、课文插图等辅助手段,演示离子的形成过程,化抽象为直观,增强学习效果。 情感、 态度与价值观 (1)激发学生对微观世界的探究欲和学习化学的兴趣。 (2)初步体会物质构成的奥秘,培养学生的抽象思维水平、想象力和分析推理水平。 (3)对学生实行世界的物质性、物质的可分性的辩证唯物主义观点的教育。 重点难点 重点 原子的内部结构;了解离子形成的过程,理解离子是构成物质的一种粒子;相对原子质量。 难点 对“原子不显电性”的理解;原子核外电子分层运动的想象。 教学准备 1.原子结构模型图片:“原子结构简图”、“离子的形成”、“氯化钠的形成过程”投影片。 2.原子内部结构动画:原子内部结构动画、离子的形成动画。 3.常见原子的质量表:常见原子的构成微粒数目及相对原子质量表。 教学流程
教学设计 教师活动 学生活动 设计意图 一、新课引入 【投影】教材第53页图3-8。 同学们,请你们想象一下:如果把一个原子跟一个乒乓球放在一起,你们有什么感想呢? 【讲解】那就相当于乒乓球跟地球体积之比。(对照投影)。
展开想象,并将想象的结果相互交流。 欣赏图片并会露出惊讶的表情。 借身边的事物实行类比,引导学生从熟悉的宏观世界步入充满神奇色彩的微观世界,激起无穷的想象。
二、合作探究 【提问】原子这么小,还能不能再分呢? 【投影】原子结构的发现史。 可见,原子内部还有更小的粒子。那么,原子的结构空间是怎样的呢? 【板书】一、原子的构成 我们先来观察一下模型。 【展示】原子结构的放大模型。 介绍:原子核(质子、中子)和电子。 我们知道,分子、原子都在持续地运动着,那么,你们能否想象一下:构成原子的原子核和电子是如何运动的呢? 【播放】动画片:原子内部的运动。 请同学们看教材第53页图3-9,谁能概括一下原子的结构?(提示:可从位置、电性、数量、所占体积等不同角度描述。) 【投影】教材第53页表3-1。思考并回答下列问题: 1.构成原子的三种粒子的电性、质量如何?整个原子的质量主要集中在哪部分? 2.原子中有带电的粒子,那么整个原子是否带电?为什么? 3.是否所有原子核内部都有中子? 4.同种原子核内的质子数和中子数有何特点? 5.不同种类原子的内部结构有何不同? 意见不一: ① 能;②不能;③不确定。 观察模型,理解原子的各结构。 自由想象 边欣赏边与刚才的想象实行对比。 个别回答,相互补充,持续完善:原子是由居于原子中心的带正电的原子核和核外带负电的绕核作高速运动的电子构成的。 分组讨论。 查表交流。 学生小结。 猜测; 查阅资料; 回答。 设疑引起思考,通过对科学史实的了解,体会严谨的科学态度。
通过模型,化抽象为直观,协助学生用微粒的观点初步理解原子结构和物质的微粒性。 调动学生的形象思维,提升想象水平。
使用现代教育技术,把抽象的知识形象化,让学生感觉微观世界的神奇,激发学习化学的兴趣。 让学生学会使用归纳、概括等方法对获取的信息实行加工,培养表达水平。 从问题入手,让学生在讨论与交流中相互启迪,获得新知,形成良好的学习习惯和方法,从中培养学生的合作意识。 续表 教师活动 学生活动 设计意图 通过以上学习,你们对原子的结构了解了多少?小结后板书: 核电荷数=核内质子数=核外电子数 【提问式讲解】 同学们,你们知道氢、碳、氧、钠、硫等原子核外各有几个电子吗? (可提示学生参考教材第53页表3-1。) 原子核对这些电子的吸引力是否相同?这些电子的排布有没有规律可循呢? 【板书】二、核外电子的排布 指导学生阅读教材第54页相关内容后,提问:核外电子是怎样排布的? 用两个字概括。 【过渡】那么,电子究竟是怎样分层排布的呢? 1.原子核外第一层最多有几个电子? 2.原子核外第二层最多有几个电子? 3.原子核外第三层最多有几个电子? 介绍:相对稳定结构的概念。 请同学们利用教材第53页表3-1数据,实行创意绘画:(1)氢原子结构图。(2)氧原子结构图。 请同学们打开书本,看教材第54页图3-10,介绍电子层概念。 阅读课本; 讨论、交流;寻找最佳词语。 思考、猜想;查书。 答:2个。 答:8个。 答:8个。 自由创意画图:各种氢原子结构创意图很快画好;画氧原子结构创意图时遇到问题:含有8个电子的氧原子中,这8个电子究竟怎样绕核高速运动呢? 知道电子是分层运动的。 学习使用文字、图表或化学语言表达相关信息。
充分利用教材资源,激发学生的好奇心。 导入课题。 培养学生的阅读、总结、概括水平。
自然过渡;层层深入。
让学生在讨论与交流中再次体会化学学习的特点,理解原子核外电子排布的一般规律。
画画是学生感兴趣的活动,再加上又是抽象画,学生非常兴奋;培养学生的创造性思维水平。
从问题着手,引出新知。
续表 教师活动 学生活动 设计意图 【投影】 氢原子结构示意图和氧原子结构示意图。介绍原子结构示意图及各部分表示的意义。 【投影】 仔细观察:不同原子的核外电子排布有无一定规律? 【过渡】 因为金属、非金属的原子核外最外层没有达到稳定结构,在化学反应中容易失、得电子,从而达到稳定结构。那么,得失电子的结果是怎样呢? 【动画片演示】 离子的形成。 介绍:阴离子、阳离子的概念。 (看教材插图:第55页图3-13“钠与氯气反应形成氯化钠”。) 【板书】三、离子的形成 请同学们通过观看动画片及看教材第55页插图,说说书写离子符号应注意的事项。 强调离子的表示方法。 【投影】 原子、离子的比较。 原子 离子 不同点 结构的稳定性 所显的电性 相同点 联系 构成物质的粒子有哪几种?举例说明。 【投影】附表1: 因为原子的质量数值太小,书写、使用都不方便,故采用相对原子质量。 原子种类 原子质量 氢 1.67×10-27kg 氧 2.657×10-26kg 碳 1.993×10-26kg 铁 9.288×10-26kg 那什么叫相对原子质量呢? 回忆原子结构,初步了解原子结构的表示方法及各部分表示的意义。 分组讨论后交流。 思考。 观看动画片,体会离子的形成过程。看插图,体会化合物的形成过程。 记录。 自己归纳离子符号的书写特点。 练习书写一些离子的符号。 分组讨论;代表发言。 师生共同填表:氧气由______构成;水由______构成;二氧化碳由______构成;铁由______构成;硅由______构成;氢气由______构成;氯化钠由______构成。 注意知识的前后连贯。 进一步激发求知欲。
在有趣、轻松、又十分形象的氛围中接受抽象、难懂的知识,增强了学生的学习兴趣,提升了学习的效果。
培养学生的思维水平及表达的水平。 以小组竞赛的形式,比准确率、比速度,提升学生的参与意识,从而增强学习的积极性。 在讨论中培养学生的合作意识、训练分析、归纳、表达的水平。 进一步确立物质的微观概念。
“让事实说话”,通过列举数字,让学生真切体会到原子质量书写、使用时的不便,从而更能理解原子质量的表示方法——相对原子质量。
续表 教师活动 学生活动 设计意图 【板书】四、相对原子质量 让学生阅读教材第56页的相关内容。 1.定义(略)。 【提问】哪位同学能用一个简洁的式子表示原子的实际质量与相对质量的关系? 从中我们能够知道:相对原子质量是一个比值。使用这个式子,我们不妨来算一下附表1中四种原子的相对原子质量。 【投影】 附表2: 原子 种类 质子数 中子数 核外电子数 相对原子质量 氢 1 0 1 2 碳 6 6 6 12 氧 8 8 8 16 钠 11 12 11 23 氯 17 18 17 35 铁 26 30 26 56 你们有没有发现:各原子相对原子质量的近似值,与该原子的质子数、中子数有何关系? 集体朗读。 相对原子质量=原子的实际质量
一个碳12原子的质量×112
学生练习计算。 观察后找出规律。 相对原子质量≈质子数+中子数
学以致用,加深对概念的理解。
通过对数据的观察与分析,找出规律,拓展思维,便于使用。
三、课堂小结 【小结】本节课你有哪些收获? 学生归纳总结。 在交流中进一步巩固。
四、巩固拓展 (1)请学生以图表的形式归纳出:原子、分子、离子之间的关系。 (2)今后学习中,我们可直接查阅书后附录中的相对原子质量表(师生一起查阅),同时,我们也应该记住那些为相对原子质量的测定做出卓越贡献的科学家,如我国的张青莲教授。 尝试用图表表示。 练习查找。 学习用图表、化学用语归纳知识,培养学生的分析推理水平。 对学生实行爱国主义教育。
板书设计