性激素结合球蛋白(SHBG)测定试剂盒(电化学发光免疫分析法)产品技术要求北京联众泰克
- 格式:docx
- 大小:30.39 KB
- 文档页数:2


S100-β蛋白测定试剂盒(荧光免疫层析法)组成:卡型产品包含1/10/20/50人份S100-β蛋白检测卡、1/10/20/50支样品缓冲液(100uL/支)、1份二维码(内含校准信息)。
每人份试剂独立铝箔袋包装内含1支检测卡和1包干燥剂。
卡盒型产品包含1卡盒(内含20/24/48人份S100-β蛋白检测卡及干燥剂、附有标曲信息)、1瓶样品缓冲液(15mL/瓶)。
检测卡由荧光垫(喷涂有荧光微球标记的鼠抗人S100-β蛋白单克隆抗体)、样品垫、硝酸纤维素膜(T线包被鼠抗人S100-β蛋白单克隆抗体;C线包被羊抗鼠抗体)、吸水纸、塑料载板组成。
样品缓冲液由0.1%的表面活性剂和0.1mol/L的Tris溶液(pH7.0)组成。
预期用途:用于体外定量检测人全血、血清、血浆中S100-β蛋白的含量。
2.1物理性状2.1.1外观检测卡应整洁完整、无毛刺、无破损、无污染;材料附着牢固;标签字迹清晰,无破损。
样品缓冲液应清澈透明、无杂质、无絮状物。
2.1.2液体移行速度液体移行速度应不低于10 mm/min。
2.1.3 膜条宽度检测卡的膜条宽度≥2.5mm。
2.1.4样品缓冲液装量卡型:样品缓冲液体积应在标识体积的±5%以内。
卡盒型:样品缓冲液体积不少于标示值。
2.2空白限空白限应不高于0.05ng/mL。
2.3重复性分别检测高、中、低3个浓度的样本,CV(%)应不高于10.0%。
2.4批间差用3个批号的试剂卡,分别检测2个浓度的样本,相对极差(R)应不高于15.0%。
2.5线性在[0.05,30]ng/mL的范围内,线性相关系数应不低于0.990。
2.6准确度样本回收率应在85%~115%范围内。
2.7 校准信息溯源性应根据GB/T21415-2008提供校准信息的来源、赋值过程,溯源至公司内部工作校准品,并与已上市产品比对赋值。
2.8稳定性将试剂盒在4℃~30℃环境中放置至有效期18个月后,过有效期后3个月内检测,结果应符合2.1、2.2、2.3、2.5、2.6项目的要求。
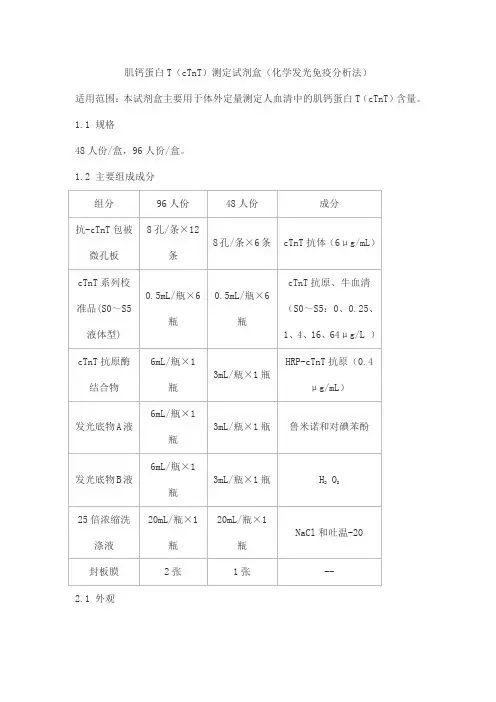
肌钙蛋白T(cTnT)测定试剂盒(化学发光免疫分析法)
适用范围:本试剂盒主要用于体外定量测定人血清中的肌钙蛋白T(cTnT)含量。
1.1 规格
48人份/盒,96人份/盒。
1.2 主要组成成分
2.1 外观
液体组分澄清,无沉淀或絮状物;其它组分无包装破损,标签外观完整、无脱落、标签标识清晰。
2.2 装量
装量不少于标示值。
2.3 准确性
回收率应在90.0%~110%范围内。
2.4 剂量-反应曲线线性相关系数
在[0.25,64]μg/L范围内,用log-logit数学模式拟合,剂量-反应曲线相关系数(r)的绝对值应不小于0.9900。
2.5 精密度
2.5.1 重复性(C.V%)应不高于15.0%;
2.5.2 批间差(C.V%)应不高于20.0%。
2.6 最低检出量
应不高于0.250μg/L。
2.7 质控血清测定值
应在允许的范围之内。
2.8 特异性
cTnT与肌红蛋白、cTnI、肌酸激酶同工酶的交叉反应如下:
2.9 稳定性
2.9.1 37℃放置3天,测定结果应符合上述2.1~2.7项要求。
2.9.2 成品试剂盒2~8℃存放6个月后,测定结果应符合上述2.1~2.7项要求。
2.10 校准品溯源性
按照GB/T 21415-2008《体外诊断医疗器械生物样品中量的测量校准品和控制物质赋值的计量学溯源性》要求,该校准品溯源至本公司内部工作校准品,通过与湖南隆润达生物技术有限公司的cTnT试剂盒比对赋值。
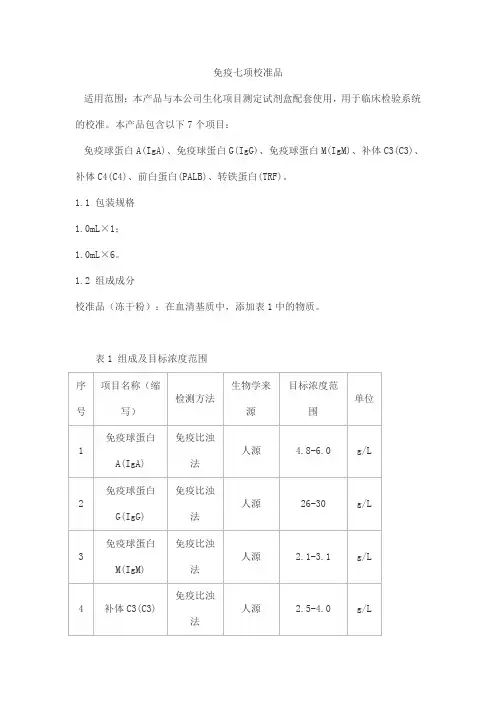
免疫七项校准品适用范围:本产品与本公司生化项目测定试剂盒配套使用,用于临床检验系统的校准。
本产品包含以下7个项目:免疫球蛋白A(IgA)、免疫球蛋白G(IgG)、免疫球蛋白M(IgM)、补体C3(C3)、补体C4(C4)、前白蛋白(PALB)、转铁蛋白(TRF)。
1.1 包装规格1.0mL×1;1.0mL×6。
1.2 组成成分校准品(冻干粉):在血清基质中,添加表1中的物质。
表1 组成及目标浓度范围批特异,具体浓度见值单。
2.1 外观冻干粉,复溶后为浅黄色或黄色液体。
2.2 水分含量水分含量应≤5%。
2.3 量值溯源按照GB/T 21415-2008《体外诊断医疗器械生物样品中量的测量校准品和控制物质赋值的计量学溯源性》要求,提供校准品的来源、赋值过程及测量不确定度。
本校准品中免疫球蛋白A(IgA)、免疫球蛋白G(IgG)、免疫球蛋白M(IgM)、补体C3(C3)、补体C4(C4)、转铁蛋白(TRF)溯源至ERM-DA470k,前白蛋白(PALB)溯源至GBW(E) 090619。
2.4 赋值结果及其不确定度的表示方式赋值结果及其不确定度的表示方式应符合(赋值结果±扩展不确定度)。
2.5 正确度检测相应项目的参考物质,量值传递的正确度应符合≤1。
2.6 均匀性2.6.1 瓶内均匀性瓶内均匀性(变异系数)应≤10%。
2.6.2 瓶间均匀性瓶间均匀性(变异系数)应≤15%。
2.7 稳定性2.7.1 效期稳定性原包装校准品在2℃~8℃密闭避光保存,有效期为24个月,稳定期内赋值结果的变化趋势应不显著。
2.7.2 复溶稳定性2.7.2.1校准品复溶后,在15℃~25℃条件下密闭避光保存,可至少稳定3天,稳定期内赋值结果的变化趋势应不显著(P≥0.05)。
2.7.2.2 校准品复溶后,在2℃~8℃条件下密闭避光保存,可以稳定7天,稳定期内赋值结果的变化趋势应不显著(P≥0.05)。

抑制素B(INH B)测定试剂盒(磁微粒化学发光法)适应范围:本试剂盒用于体外定量测定人血清、血浆中抑制素B(INH B)的含量。
1.1规格100人份/盒、100人份×5/盒。
1.2主要组成成分表1主要组成成分注:校准品靶值、质控品质控范围批特异,具体浓度详见靶值单。
2.性能指标2.1物理性能2.1.1 外观试剂盒各组分应齐全、完整,液体无渗漏;各液体组分应澄明,无沉淀或絮状物;中文包装标签应清晰,无磨损。
2.1.2 样本稀释液装量样本稀释液装量应不小于标示量。
2.1.3 样本稀释液pH值样本稀释液pH值应在7.1~7.6范围内。
2.2 溯源性根据GB/T 21415-2008的有关规定,提供所用校准品的来源、赋值过程及测量不确定度等内容,溯源至企业工作校准品,并与已上市产品比对赋值。
2.3 准确度回收率应在90%~110%之间。
2.4 线性在线性范围[15,1500]pg/mL内,相关系数(r)应不低于0.9900。
2.5 重复性分别检测高值和低值两个样本,重复性(CV%)应不高于10.0%。
2.6 批间差在三个不同批次产品之间,样本测定结果的变异系数(CV%)应不高于15.0%。
2.7 空白限空白限应不高于12pg/mL。
2.8 特异性表2 与INH B、ACV B的交叉反应2.9 质控品赋值有效性测定高值、低值浓度质控品,其结果均应在质控范围内。
2.10 稳定性2℃~8℃储存,有效期12个月,效期后分别检测2.3、2.4、2.5、2.7、2.8、2.9项,其结果应符合各项要求。

2性能指标
2.1外观
试剂盒各组分应齐全、完整、液体无渗漏;包装标签应清晰,准确、牢固;Ra 组分应为棕色含固体微粒的液体,无板结、无絮状物。
Rb 组分应为清澈透明的液体,无沉淀、无悬浮物、无絮状物。
2.2装量
应不少于试剂瓶的标示装量值。
2.3准确度
对具有溯源性的两个浓度水平的正确度控制品进行检测,检测结果与标定浓度的相对偏差在±10% 范围内。
2.4最低检测限
应不大于1 pg/mL。
2.5线性
试剂盒在1 pg/mL~2000 pg/mL 区间内,其相关系数(r)应不低于0.9900。
2.6重复性
变异系数CV 应≤ 6%。
2.7批间差
变异系数CV 应≤ 10%。

促黄体生成素(LH)测定试剂盒(电化学发光法)2.性能要求2.1外观和性状2.1.1试剂盒各组份应齐全、完整,液体无渗漏,标签应清晰、牢固;2.1.2磁珠组份为棕色含固体微粒液体,静置后底部有棕色沉淀,无板结、无絮状物;2.1.3试剂组份应为清亮液体,无沉淀、无悬浮物;2.1.4校准品、质控品组份为冻干品,加入去离子水等复溶剂后在20 分钟内完全溶解。
2.2净含量净含量应符合表 2 的要求。
净含量要求表2应不大于0.10 mIU/mL。
2.4准确度测定国家标准品,其实测值与理论值之比应在0.900~1.100 之间。
2.5线性试剂盒在0.10 mIU/mL~120.0 mIU/mL 区间内,其相关系数(r)应不低于0.9900。
2.6批内精密度变异系数CV 应≤ 6%。
2.7批间精密度变异系数CV 应≤ 10%。
2.8特异性2.8.1与促卵泡生成素(FSH)浓度不低于200 mIU/mL 的FSH,其测定结果应不高于0.10 mIU/mL。
2.8.2与促甲状腺素(TSH)浓度不低于200mIU/L 的TSH,其测定结果应不高于0.10 mIU/mL。
2.8.3与人绒毛膜促性腺激素(HCG)浓度不低于1000 mIU/mL 的HCG,其测定结果应不高于0.10 mIU/mL。
2.8.4与人生长激素(hGH)浓度不低于350mIU/L 的hGH,其测定结果应不高于0.10 mIU/mL。
2.8.5与人胎盘催乳素(hPL)浓度不低于12.5mg/L 的hPL,其测定结果应不高于0.10 mIU/mL。
2.9质控品测定值试剂盒配套的定值质控品,其测定结果应在试剂盒规定的范围内。
2.10生物安全性试剂盒内校准品、质控品的HBsAg、HIV 抗体、HCV 抗体检测结果均应为阴性。
2.10 校准品、质控品均一性瓶内均一性:变异系数CV≤ 10%;瓶间均一性:变异系数CV≤ 10%。
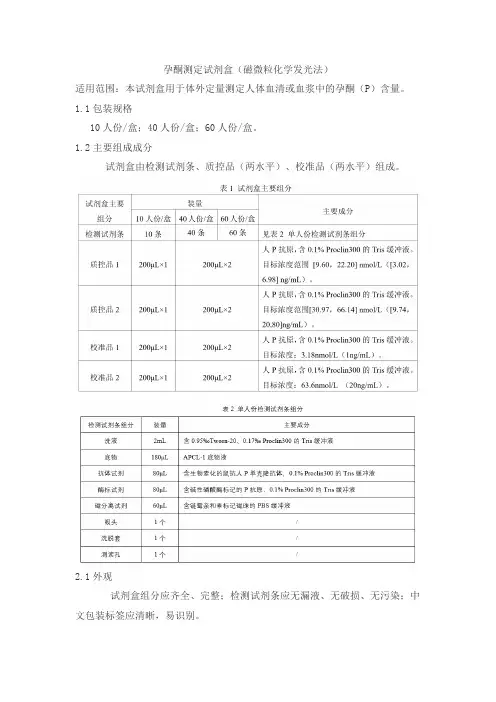
孕酮测定试剂盒(磁微粒化学发光法)适用范围:本试剂盒用于体外定量测定人体血清或血浆中的孕酮(P)含量。
1.1包装规格10人份/盒;40人份/盒;60人份/盒。
1.2主要组成成分试剂盒由检测试剂条、质控品(两水平)、校准品(两水平)组成。
2.1外观试剂盒组分应齐全、完整;检测试剂条应无漏液、无破损、无污染;中文包装标签应清晰,易识别。
2.2 校准品溯源性根据GB/T 21415-2008《体外诊断医疗器械生物样品中量的测量校准品和控制物质赋值的计量学溯源性》及有关规定提供校准品的来源、赋值过程及测量不确定度等内容,该校准品溯源至本公司的工作校准品。
2.3准确度将已知浓度的孕酮(P)加入到低值样品中,其回收率应在85%~115%范围内。
2.4检出限应≤0.64nmol/L (0.2ng/mL)。
2.5线性范围在[0.64-127.20]nmol/L([0.2,40]ng/mL)的线性范围内,相关系数r 应≥0.9900。
2.6重复性CV≤10%。
2.7批间差CV≤15%。
2.8质控品赋值有效性测定值在质控品质控范围内。
2.9 特异性分别添加潜在干扰物于含有孕酮的样本中,获得待测样本中孕酮目标浓度为64nmol/L (20.1ng/mL)(允许相对偏差为±15%),潜在干扰物浓度分别为10ng/mL的皮质酮和10ng/mL的17α-羟孕酮。
各个样本测量结果的均值应在目标浓度平均值(M)±2标准差(SD)范围内。
2.10校准品和质控品瓶间差校准品瓶间差CV≤10%。
质控品瓶间差CV≤10%。
2.11稳定性2.11.1效期稳定性取效期后的试剂盒检测外观、准确度、检出限、线性范围、重复性、质控品赋值有效性和特异性,应符合2.1、2.3、2.4、2.5、2.6、2.8和2.9的要求。
2.11.2 质控品开瓶稳定性质控品开瓶后,在2℃~8℃密封避光保存,在7天后检测质控品重复性和质控品赋值有效性,应符合2.6和2.8的要求。
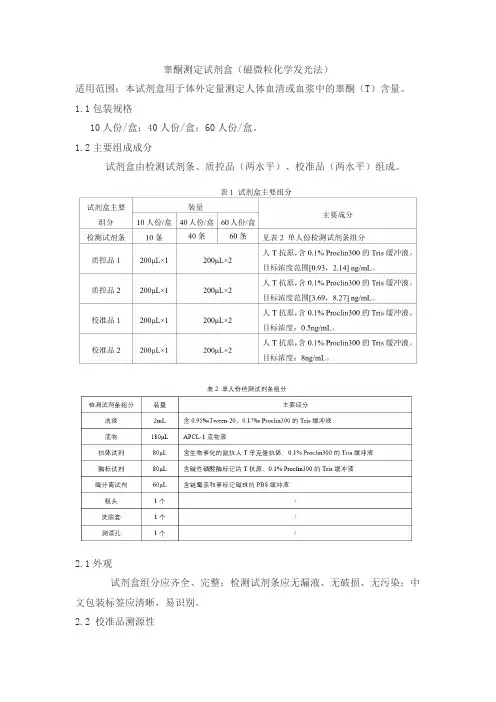
睾酮测定试剂盒(磁微粒化学发光法)适用范围:本试剂盒用于体外定量测定人体血清或血浆中的睾酮(T)含量。
1.1包装规格10人份/盒;40人份/盒;60人份/盒。
1.2主要组成成分试剂盒由检测试剂条、质控品(两水平)、校准品(两水平)组成。
2.1外观试剂盒组分应齐全、完整;检测试剂条应无漏液、无破损、无污染;中文包装标签应清晰,易识别。
2.2 校准品溯源性根据GB/T 21415-2008《体外诊断医疗器械生物样品中量的测量校准品和控制物质赋值的计量学溯源性》及有关规定提供校准品的来源、赋值过程及测量不确定度等内容,该校准品溯源至出厂商的工作校准品。
2.3准确度对睾酮冰冻人血清国家标准品360034进行检测,其测量结果的相对偏差应不高于±15.0%。
2.4空白限应不高于0.1ng/mL。
2.5线性在[0.2,16] ng/mL的线性范围内,相关系数r应≥0.9900。
2.6重复性对质控品1、质控品2各测试10次,CV≤10%。
2.7批间差用三个批号的试剂盒对质控品1、质控品2各测试10次,其测量结果的变异系数CV≤15%。
2.8质控品赋值有效性测定值在质控品质控范围内。
2.9 特异性测定浓度为100ng/mL的孕酮、10ng/mL的双氢睾酮、10ng/mL的雌二醇样本,其测定结果应不高于0.2ng/mL。
2.10校准品和质控品瓶间差校准品瓶间差CV≤10%。
质控品瓶间差CV≤10%。
2.11稳定性2.11.1效期稳定性取效期后的试剂盒检测外观、准确度、空白限、线性、重复性和质控品赋值有效性,应符合2.1、2.3、2.4、2.5、2.6和2.8的要求。
2.11.2 质控品开瓶稳定性质控品开瓶后,在2℃~8℃密封避光保存,在7天后检测质控品重复性和质控品赋值有效性,应符合2.6和2.8的要求。
2.11.3 校准品开瓶稳定性校准品开瓶后,在2℃~8℃密封避光保存,在7天后检测准确度和线性,应符合2.3和2.5的要求。

可溶性生长刺激表达基因2蛋白测定试剂盒(荧光免疫层析法)适用范围:用于体外定量测定人全血、血浆、血清中可溶性生长刺激表达基因2蛋白(ST2)的含量。
1.1包装规格1人份/盒、5人份/盒、20人份/盒、25人份/盒、50人份/盒、100人份/盒。
1.2主要组成成分每种包装规格含相应人份数的检测卡、加样枪头、干燥剂、样本缓冲液及1个校准信息卡。
不同批号试剂盒中各组分不可互换。
2.1外观1)检测卡使用铝塑单个密封包装,标签应完整清晰,内容物齐全,卡壳应整洁、无破损,扣合紧密;2)缓冲液为无色或淡黄色透明液体,不得有任何沉淀及絮状悬浮物。
2.2装量样本缓冲液装量偏差应不大于±10%。
2.3宽度试纸条宽度为4.0±0.2mm。
2.4移行速度液体移行速度不低于10mm/min。
2.5空白限试剂盒的空白限不大于1.0ng/ml。
2.6线性在[5,200]ng/ml 范围内,线性相关系数应满足r≥0.990。
2.7重复性用高浓度[100,200]ng/ml、低浓度[10,50]ng/ml两水平样本重复测定10次,其测定值的变异系数(CV)应不大于15%。
2.8准确度用本试剂盒做回收试验,其回收率应在85%~115%范围内。
2.9特异性取不含可溶性生长刺激表达基因2蛋白的样本,加入以下物质平行检测3次,结果均应不大于1.0 ng/ml。
表1特异性2.10溯源性根据GB/T 21415-2008及有关规定,提供校准曲线的赋值过程及不确定度等内容,溯源至企业工作校准品并与已上市产品比对赋值。
2.11批间差用3个不同批号的试剂盒分别测试样本,所得结果的相对极差(R)应不大于15%。
2.12稳定性原包装的试剂盒在2℃~30℃贮存,有效期为12个月。
在有效期满后六个月以内的试剂盒,分别检测2.1,2.2,2.3,2.4,2.5,2.6,2.7,2.8,2.9项,结果应符合各项目的要求。
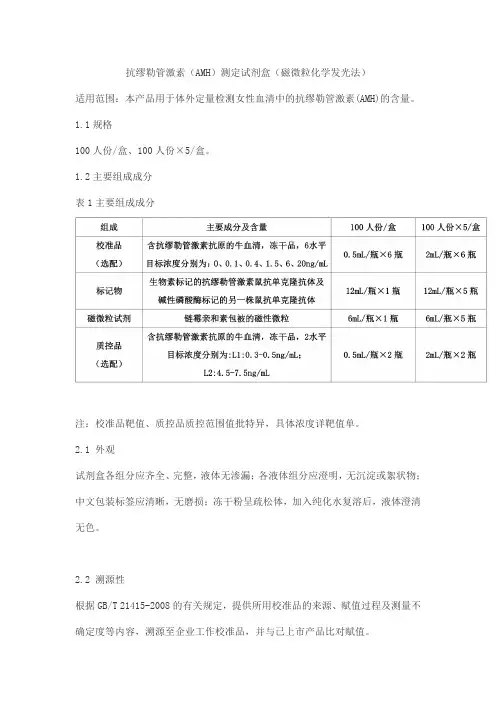
抗缪勒管激素(AMH)测定试剂盒(磁微粒化学发光法)适用范围:本产品用于体外定量检测女性血清中的抗缪勒管激素(AMH)的含量。
1.1规格100人份/盒、100人份×5/盒。
1.2主要组成成分表1主要组成成分注:校准品靶值、质控品质控范围值批特异,具体浓度详靶值单。
2.1 外观试剂盒各组分应齐全、完整,液体无渗漏;各液体组分应澄明,无沉淀或絮状物;中文包装标签应清晰,无磨损;冻干粉呈疏松体,加入纯化水复溶后,液体澄清无色。
2.2 溯源性根据GB/T 21415-2008的有关规定,提供所用校准品的来源、赋值过程及测量不确定度等内容,溯源至企业工作校准品,并与已上市产品比对赋值。
2.3 准确度回收率应在90%~110%之间。
2.4 线性在线性范围内[0.1,20]ng/mL,相关系数(r)应不低于0.99。
2.5 重复性分别检测高值和低值两个样本,重复性(CV%)应不高于10.0%。
2.6 批间差在三个不同批次产品之间,样本测定结果的变异系数(CV%)应不高于15.0%。
2.7 空白限空白限应不高于0.05ng/mL。
2.8 特异性表2与FSH、LH的交叉反应2.9 质控品赋值有效性测定高值、低值浓度质控品,其结果均应在质控范围内。
2.10 稳定性2.10.1 效期稳定性2℃~8℃储存,有效期12个月,效期后分别检测2.3、2.4、2.5、2.7、2.8、2.9项,其结果应符合各项要求。
2.10.2 复溶稳定性2.10.2.1 校准品开瓶后(复溶后),-20℃以下储存,有效期1个月,效期后分别检测2.3、2.4、2.5、2.7、2.8、2.9项,其结果应符合各项要求。
2.10.2.2 质控品开瓶后(复溶后),-20℃以下储存,有效期1个月,效期后分别检测2.5、2.9项,其结果应符合各项要求。
促甲状腺激素(TSH)校准品
适用范围:促甲状腺激素(TSH)校准品与本公司促甲状腺激素(TSH)测定试剂盒(磁微粒化学发光法)配套使用,用于人血清中促甲状腺激素(TSH)测定系统的校准。
1.1规格
0.5mL/瓶×6瓶;2mL/瓶×6瓶。
1.2主要组成成分
促甲状腺激素(TSH)校准品S0-S5,校准品S0为含添加0.1%生物防腐剂的P.B 缓冲液,校准品S1-S5为在含0.1%生物防腐剂的P.B缓冲液中添加促甲状腺激素(TSH)抗原。
表1
注:校准品靶值批特异、具体浓度详见标签。
2.1 外观
校准品包装标签应清晰,无磨损;呈澄清透明的液体,无沉淀或絮状物,液体无渗漏。
2.2 装量
装量应不少于标示值。
2.3 溯源性
根据GB/T 21415-2008的有关规定,提供所用校准品的来源、赋值过程及测量不确定度等内容,溯源至中国食品药品检定研究院提供的标准品(编号:150530)。
2.4 准确度
检测中国食品药品检定研究院所提供的TSH标准品(编号:150530),其测量结果的相对偏差应在±10%范围内。
2.5 均匀性
2.5.1 瓶内均匀性
各浓度点(除零外),变异系数(CV)应不高于10.0%。
2.5.2 瓶间均匀性
各浓度点(除零外),变异系数(CV)应不高于15.0%。
2.6 稳定性
2.6.1 首次开封后稳定性
校准品开瓶后,2℃~8℃储存,有效期15天,在效期内赋值结果的变化趋势不显著。
2.6.2 效期稳定性
校准品原包装2℃~8℃储存,有效期12个月,在效期内赋值结果的变化趋势不显著。
1性能指标
1.1外观
外观应符合如下要求:
a)磁珠包被物R1摇匀后应为棕褐色悬浊液;静止久后,棕褐色磁珠沉降于底部,上清液应为无色液体;酶标记物R2应为无色液体,无沉淀或絮状物;校准品和质控品应为外观均匀,成形完整,呈乳白色的冻干品,复溶后较清亮,无浑浊及沉淀;
b)试剂盒各组分应齐全、完整,液体无渗漏;
c)中文包装标签清晰,无磨损。
1.2准确度
将具有溯源性的两个浓度准确度参考品进行检测,检测结果与标定浓度的相对偏差在±10%范围内。
1.3空白限
不大于0.007ng/mL。
1.4线性
试剂盒在0.01ng/mL~23ng/mL 区间内,其相关系数(r)的绝对值不低于0.9900。
1.5重复性
变异系数CV≤8%。
1.6批间差
变异系数CV≤10%。
1.7校准品
1.7.1校准品准确度
测定校准品,C1,C2 测定结果的相对偏差在±10%范围内。
1.7.2校准品瓶内均一性
校准品C1,C2 瓶内均一性≤8%。
1.7.3校准品瓶间均一性
校准品C1,C2 瓶间均一性≤5%。
1.8质控品
1.8.1瓶内均一性
变异系数CV≤8.0%。
1.8.2瓶间均一性
变异系数CV≤5.0%。
1.8.3靶值及靶值范围
每批质控品均应提供本批产品的靶值单,并应提供赋值方法程序文件。
质控品的测试值应在靶值范围内。
产品名称β—人绒毛膜促性腺激素(β—HCG)测定试剂(荧光免疫层析法)型号、规格5人份/袋、25人份/盒、40人份/盒、50人份/盒、100人份/盒结构及组成试剂由测试卡、缓冲液和ID芯片组成。
其中:(1)测试卡由测试条、塑料盒组成。
测试条由硝酸纤维素膜、吸水纸、PVC板等其他支持物。
其中,硝酸纤维素膜包被有抗β-HCG单克隆抗体、兔IgG、荧光标记的抗β-HCG单克隆抗体和荧光标记的抗兔IgG。
(2)缓冲液主要为磷酸盐缓冲液(PBS)。
产品适用范围/预期用途适用于体外定量检测人全血、血清或血浆中的β-人绒毛膜促性腺激素(β-HCG)的浓度,不得用于肿瘤的辅助诊断。
2. 性能指标2.1 外观检查外观应平整,材料附着应牢固,各组份应齐全,卡固定紧密。
2.2 物理检查膜条宽应不小于2.0mm;液体移行速度应不低于10mm/min。
2.3 线性范围取同一批号的试剂分别对五个浓度的β-HCG参考品进行检测,其检测范围为5mIU/mL~200000mIU/mL,每份参考品重复检测3次,计算相关系数r,其中r值≥0.99。
2.4 精密度2.4.1 批内精密度随机抽取同一批号的试剂分别对两个浓度的β-HCG参考品进行检测,每份参考品重复检测10次,其变异系数CV(%)值≤15%。
2.4.2 批间精密度随机抽取连续三个批号的试剂,每批试剂分别对两个浓度的β-HCG参考品进行检测,每份参考品重复检测3次,其变异系数CV(%)值≤15%。
2.5 准确度取同一批号的试剂分别对三个水平浓度的β-HCG参考品进行检测,每份参考品重复检测3次,计算样本测定结果均值和相对偏差,其中相对偏差(Bias%)在±15%内。
2.6 最低检出限取同一批号的试剂分别对配制参考品基质进行检测,重复检测20次,计算出反应量的均值和标准偏差SD,将(+2SD)的反应量代入剂量-反应曲线,使最终浓度值应不大于2mIU/mL。
2.7 分析特异性1选择同一浓度的β-HCG参考品分别加入1000mIU/mL促卵泡生成素(FSH)、500mIU/mL促黄体生成素(LH)、1000μIU/mL促甲状腺激素(TSH)进行检测,各干扰样本重复检测3次,计算样本检测结果的均值和相对偏差,其中相对偏差(Bias%)在±15%内。
性激素结合球蛋白(SHBG)测定试剂盒(电化学发光免疫分析法)
适用范围:本试剂盒用于体外定量测定人体血清样本中性激素结合球蛋白(SHBG)
的含量。
1.1包装规格:50人份/盒、100人份/盒。
1.2主要组成成分
试剂盒由磁分离试剂(M)、试剂a(Ra)、试剂b(Rb)和定标品(SHBG-Cal)
(选配)组成。组成及含量见下表:
注:1、定标品靶值批特异,详见靶值单。
2、试剂盒条码卡内含主校准曲线。
2.1 外观
2.1.1 试剂盒各组分应齐全、完整、液体无渗漏;
2.1.2 磁分离试剂摇匀后应为棕色含固体微粒的均匀悬浊液,无明显凝集、无絮
状物;
2.1.3 其它液体组分应澄清,无异物,沉淀物或絮状物;
2.1.4 包装标签应清晰、无磨损、易识别。
2.2 空白限
应不大于0.35nmol/L。
2.3 准确度
用SHBG国际标准品(08/266)进行检测,其测量结果的相对偏差应在±10%范围
内。
2.4 线性
在[1.0,200.0] nmol/L范围内,线性相关系数(r)应不小于0.9900。
2.5 精密度
2.5.1 重复性
在试剂盒的线性范围内,检测高、低两个水平的样品,检测结果的变异系数(CV)
应不大于8%。
2.5.2 批间差
在试剂盒的线性范围内,用3个批号试剂盒分别检测高、低两个水平的样品,检
测结果的变异系数(CV)应不大于15%。
2.6 效期末稳定性
本产品效期为15个月,试剂盒在2~8℃下保存至有效期末进行检测,检测结果
应符合2.1、2.2、2.3、2.4、2.5.1的要求。
2.7 溯源性
依据GB/T 21415-2008《体外诊断医疗器械 生物样品中量的测量 校准品和控
制物质赋值的计量学溯源性》的要求提供性激素结合球蛋白(SHBG)定标品的来
源、赋值过程以及测量不确定度等内容,定标品溯源至国际标准品(08/266)。