溶液pH计算方法
- 格式:docx
- 大小:10.73 KB
- 文档页数:1

高中化学ph值计算公式
高中化学中计算pH值的公式为:pH=-lgc(H+),其中c(H+)为氢离子浓度。
另外,还有pOH=-lgc(OH-)和c(H+)=10-pH等公式,可以用于计算溶液
的pH值。
在计算过程中,需要注意温度和溶液体积的影响。
对于同一种电解质溶液,在室温条件下,pH+pOH=-lgKW=14。
当强酸和强碱溶液等体积混合时,若强酸和强碱溶液的pH之和等于14,则混合后的溶液呈现中性;若强酸
和强碱溶液的pH之和大于14,则混合后的溶液呈现碱性;若强酸和强碱
溶液的pH之和小于14,则混合后的溶液呈现酸性。
以上内容仅供参考,建议查阅高中化学教材或咨询化学老师获取更准确的信息。

ph计检测公式
pH计检测公式是用于测量溶液酸碱性的数学公式。
pH是指测量溶液酸碱程度
的指标,它是以负对数形式表示的,用于表示溶液中氢离子的浓度。
根据国际公认的pH计检测公式,pH值可以通过测量溶液中的氢离子浓度得出。
pH计检测公式可以表示为:
pH = -log[H+]
其中,H+表示溶液中氢离子的浓度。
在纯水中,H+的浓度为10^-7 mol/L,因此,pH值为7。
如果溶液中的H+浓度增加,pH值会降低,表示溶液更加酸性;
反之,如果H+浓度减少,pH值会增加,表示溶液更加碱性。
pH计检测公式的意义在于通过测量溶液中的氢离子浓度来确定溶液的酸碱性。
pH值的测量通常通过酸碱指示剂或pH计进行。
酸碱指示剂是根据溶液pH值的不
同而发生颜色变化的物质,通过比较颜色变化可以推测溶液的酸碱性;而pH计则
是一种电子仪器,能够通过测量溶液中的电势来计算出溶液的pH值。
pH计检测公式的应用非常广泛。
在生活中,我们可以利用pH计来测量饮用水、游泳池水、土壤酸碱性等。
在实验室中,pH计也是一种常用的工具,用于测量化
学试剂的酸碱性以及溶液的酸碱滴定等实验。
总之,pH计检测公式为我们提供了一种方便快捷的方法来测量溶液的酸碱性。
它的应用帮助我们了解和控制溶液的性质,对于许多领域的研究和应用都具有重要意义。
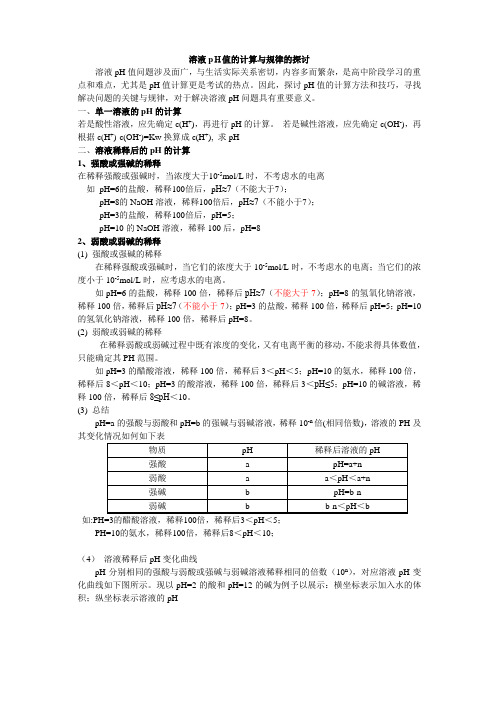
溶液pH值的计算与规律的探讨溶液pH值问题涉及面广,与生活实际关系密切,内容多而繁杂,是高中阶段学习的重点和难点,尤其是pH值计算更是考试的热点。
因此,探讨pH值的计算方法和技巧,寻找解决问题的关键与规律,对于解决溶液pH问题具有重要意义。
一、单一溶液的pH的计算若是酸性溶液,应先确定c(H+),再进行pH的计算。
若是碱性溶液,应先确定c(OH-),再根据c(H+)·c(OH-)=Kw换算成c(H+), 求pH二、溶液稀释后的pH的计算1、强酸或强碱的稀释在稀释强酸或强碱时,当浓度大于10-5mol/L时,不考虑水的电离如pH=6的盐酸,稀释100倍后,p H≈7(不能大于7);pH=8的NaOH溶液,稀释100倍后,p H≈7(不能小于7);pH=3的盐酸,稀释100倍后,pH=5;pH=10的NaOH溶液,稀释100后,pH=82、弱酸或弱碱的稀释(1) 强酸或强碱的稀释在稀释强酸或强碱时,当它们的浓度大于10-5mol/L时,不考虑水的电离;当它们的浓度小于10-5mol/L时,应考虑水的电离。
如pH=6的盐酸,稀释100倍,稀释后pH≈7(不能大于7);pH=8的氢氧化钠溶液,稀释100倍,稀释后pH≈7(不能小于7);pH=3的盐酸,稀释100倍,稀释后pH=5;pH=10的氢氧化钠溶液,稀释100倍,稀释后pH=8。
(2) 弱酸或弱碱的稀释在稀释弱酸或弱碱过程中既有浓度的变化,又有电离平衡的移动,不能求得具体数值,只能确定其PH范围。
如pH=3的醋酸溶液,稀释100倍,稀释后3<pH<5;pH=10的氨水,稀释100倍,稀释后8<pH<10;pH=3的酸溶液,稀释100倍,稀释后3<pH≤5;pH=10的碱溶液,稀释100倍,稀释后8≤pH<10。
(3) 总结pH=a的强酸与弱酸和pH=b的强碱与弱碱溶液,稀释10-n倍(相同倍数),溶液的PH及其变化情况如何如下表物质pH 稀释后溶液的pH强酸 a pH=a+n弱酸 a a<pH<a+n强碱 b pH=b-n弱碱 b b-n<pH<b如:PH=3的醋酸溶液,稀释100倍,稀释后3<pH<5;PH=10的氨水,稀释100倍,稀释后8<pH<10;(4)溶液稀释后pH变化曲线pH分别相同的强酸与弱酸或强碱与弱碱溶液稀释相同的倍数(10n),对应溶液pH变化曲线如下图所示。

混合溶液ph值的计算
混合溶液的pH值可以通过以下公式进行计算:
pH = pKa1 * lg([A-]/[A+]) + pKa2 * lg([B-]/[B+]) + pKa3 * lg([C-]/[C+]) + ...
其中,[A-]、[B-]、[C-]等为溶液中对应离子的浓度,[A+]、[B+]、[C+]为对应离子的共轭酸浓度,pKa1、pKa2、pKa3等为对应离子的酸解离常数的负对数值。
如果只有两种溶液混合,则公式简化为:
pH = pKa1 * lg([A-]/[A+]) + pKa2 * lg([B-]/[B+])
如果只有一种溶液稀释,则公式为:
pH = pKa * lg([A-]/[A+])
其中,pKa为溶液的酸解离常数。
需要注意的是,上述公式中的离子浓度和共轭酸浓度都是指在溶液中的总浓度,包括了离子和水分子之间的相互作用。
此外,公式中的lg表示以10为底的对数。

计算ph的公式计算pH的公式是用来计算溶液酸碱性强弱的一种方法。
pH的全称是“potential of hydrogen”,表示溶液中氢离子的浓度。
pH值是一个无量纲的指标,通常在0到14之间取值,数值越小表示酸性越强,数值越大表示碱性越强,7表示中性。
pH的计算公式是通过溶液中的氢离子浓度来计算的。
氢离子浓度可以通过酸碱指示剂、酸度计等实验手段测量得到。
根据定义,pH值等于负以10为底的氢离子浓度的对数。
即pH = -log[H+],其中[H+]表示氢离子的浓度。
在实际应用中,pH的计算可以通过以下步骤进行:1. 测量氢离子浓度:首先需要测量溶液中的氢离子浓度,可以使用酸碱指示剂、酸度计或PH计等仪器进行测量。
2. 计算pH值:根据测量得到的氢离子浓度,可以使用pH的计算公式进行计算。
将测得的氢离子浓度代入公式中,利用对数运算计算出pH值。
3. 解读结果:根据计算得到的pH值,可以判断溶液的酸碱性质。
如果pH值小于7,表示溶液为酸性;如果pH值大于7,表示溶液为碱性;如果pH值等于7,表示溶液为中性。
需要注意的是,pH值的计算公式只适用于稀溶液和水溶液。
对于浓溶液或非水溶液,由于其中存在其他离子的相互影响,pH值的计算会更加复杂。
pH值在生活和科学研究中有着广泛的应用。
在生活中,我们经常用pH试纸来测试水质的酸碱性,以确定是否适合饮用或其他用途。
在农业领域,pH值可以影响土壤的肥力和植物的生长,因此合理调节土壤的pH值对于农作物的种植非常重要。
在医学和生物学研究中,pH值的变化可以影响生物体内的酶活性、细胞功能和代谢过程,因此对于疾病的诊断和治疗具有重要意义。
pH值的计算公式是一种用来评估溶液酸碱性的方法。
通过测量溶液中的氢离子浓度,利用pH的计算公式可以快速准确地得到溶液的酸碱性质。
pH值的应用广泛,涉及生活、农业、医学等多个领域。
了解和掌握pH值的计算方法对于我们理解和应用酸碱性是非常重要的。

ph和h离子浓度计算公式在化学中,pH是用来表示溶液酸碱性强弱的指标,它是负对数函数。
而H离子浓度也是衡量溶液中酸碱性的重要参数。
本文将介绍pH和H离子浓度的计算公式,以及它们在化学实验和工业生产中的应用。
pH的计算公式为:pH = -log[H+]其中,[H+]表示溶液中的H离子浓度。
当[H+]的值越大,溶液的酸性就越强;反之,当[H+]的值越小,溶液的碱性就越强。
pH值的范围通常在0到14之间,其中7表示中性溶液,小于7表示酸性溶液,大于7表示碱性溶液。
H离子浓度的计算公式为:[H+] = 10^(-pH)。
这个公式是pH计算公式的反推公式,通过pH值可以计算出溶液中H离子的浓度。
例如,如果一个溶液的pH值为3,那么它的H离子浓度就是10^(-3) =0.001M。
pH和H离子浓度的计算公式在化学实验和工业生产中有着广泛的应用。
在实验室中,科学家们可以通过测定溶液的pH值来判断其酸碱性,从而确定适合的实验条件。
在工业生产中,控制溶液的pH值可以影响反应的进行速率和产物的选择,因此pH和H离子浓度的计算公式对于工艺优化和产品质量的控制起着重要作用。
除了上述的计算公式,还有一些与pH和H离子浓度相关的概念需要了解。
例如,pOH是表示溶液中碱性强弱的指标,它的计算公式为:pOH = -log[OH-]其中,[OH-]表示溶液中的OH离子浓度。
与pH类似,pOH值越大表示溶液越碱性,而pOH值越小表示溶液越酸性。
pH和pOH之间有着互补关系,它们的和始终等于14。
这意味着,如果我们知道了溶液的pH值,就可以通过14减去pH值得到pOH值;反之,如果我们知道了溶液的pOH值,就可以通过14减去pOH 值得到pH值。
除了pH和pOH,还有一个与H离子浓度相关的概念叫做酸碱度。
酸碱度是用来表示溶液中酸碱性强弱的指标,它的计算公式为:酸碱度 = -log[H+] 。
酸碱度与pH有着直接的关系,它们的数值是相等的。
缓冲溶液通常由共轭的酸碱对组成,如醋酸和醋酸钠,草酸氢钠和草酸钠,邻苯二甲酸氢钾和邻苯二甲酸钾等,能有效抵御酸碱的少量加入,保持pH的基本稳定。
下面以1mol/L 醋酸和1mol/L醋酸钠的缓冲对为例,介绍缓冲溶液pH值的计算方法:
- 公式:pH=pKa+lg(c(醋酸根)/c(醋酸))。
- 计算过程:
- Ka=c(氢离子)·c(醋酸根)/c(醋酸)。
- 两边取负对数,得:-lg Ka=-lg(c(氢离子)·c(醋酸根)/c(醋酸))。
- pKa=-lg(c(氢离子)·c(醋酸根)/c(醋酸)),即为该缓冲溶液的pKa值。
- pH=pKa+lg(c(醋酸根)/c(醋酸)),即可计算出该缓冲溶液的pH值。
一般来说,缓冲溶液的浓度越大,酸碱浓度的比例越接近1:1,缓冲效果越好。
但缓冲溶液的作用是有限的,超过一定限度,上述两个有利因素就会被破坏,缓冲范围一般在上下1个pH单位左右。
酸碱度计算公式小结pH是一个表示溶液酸碱度的指标,它是通过测量溶液中氢离子(H+)浓度的负对数来计算的。
pH计算公式如下:pH = -log[H+]其中[H+]表示溶液中的氢离子浓度。
pH的取值范围是0到14,小于7的溶液被认为是酸性的,大于7的溶液被认为是碱性的,而等于7的溶液被认为是中性的。
在溶液中,酸和碱都会产生离子,酸会产生氢离子(H+),碱会产生氢氧根离子(OH-)。
pH的计算方法可以根据酸碱溶液中的氢离子和氢氧根离子的浓度来进行计算。
对于酸性溶液,pH值可以通过以下方法计算:1.测量氢离子浓度[H+]。
2. 将[H+]的数值取负对数,即-log[H+],得到pH值。
对于碱性溶液,pOH值可以通过以下方法计算:1.测量氢氧根离子浓度[OH-]。
2. 将[OH-]的数值取负对数,即-log[OH-],得到pOH值。
由于pH和pOH之间有一个简单的数学关系,可以通过以下公式相互转换:pH+pOH=14这意味着,如果我们知道一个溶液的pH值,我们可以通过用14减去pH值来计算该溶液的pOH值。
在实际应用中,可以使用各种方法来测量溶液的pH值。
常见的方法有pH电极、指示剂和酸碱滴定等。
pH电极是一种特殊的电极,它可以测量溶液中的氢离子浓度。
通过将pH电极浸入溶液中,电极内部的玻璃膜会与溶液中的氢离子反应,产生电势差。
通过测量这个电势差,可以计算出溶液的pH值。
指示剂是一种可以改变颜色的化合物,它可以根据溶液的pH值发生颜色变化。
通过将一定量的指示剂加入溶液中,观察颜色的变化可以推断出溶液的酸碱性质。
常见的指示剂有酚酞、溴蓝、天青等。
酸碱滴定是一种通过加入酸或碱溶液来确定溶液酸碱度的方法。
在滴定过程中,使用酸碱指示剂来指示溶液的酸碱改变,当颜色发生变化时,可以确定溶液的终点,从而得到溶液的pH值。
总结起来,pH值是表示溶液酸碱度的指标,可以通过测量溶液中氢离子(H+)或氢氧根离子(OH-)的浓度来计算。
缓冲溶液ph计算公式缓冲溶液PH计算公式是用于求解缓冲溶液PH值的有效量化方法,决定一种物质在溶液中的PH值,从而确定它的水溶性和溶解度。
它最常见的运用是用于有关分析化学的场合,所以熟悉和掌握它的技巧很重要。
下面给出缓冲溶液PH计算公式:一、基础PH值1、通用表达式PH=[H+]/[H+]其中,[H+]是一种酸性离子,它是由其酸性性质给出的。
2、基础pH 是指:pH = -log( [H+] )其中,- log( [H+] ) 是由它的特定A( H+ )的值计算出的。
二、可逆反应的PH值1、表达式pH = pKa + log( [A-]/[HA] )其中, [A-] 是一种弱酸的离子,它是由它的单质A的盐酸释放出来的,而[HA] 为这个弱酸的酸性盐,pKa 是它的分解常数,是由它的特定A( H+ )的值计算出的。
2、离子伴随反应它涉及到两个离子,即可逆反应中质子H+ 和离子A-,在缓冲溶液中,它们形成H2AM+ 和A2M- 这两个微量离子,表达式为:pH = pKa + log( [A2M-]/[H2AM+] )三、加入其它离子1、界面反应法它涉及到三个离子,即质子 H+ 和离子 A-和 M+,当三者相遇时,在反应中会产生一个新的离子M2A+,表达式为:pH = pKa + log( [M2A+]/[H2AM+] )2、加入其它电离常数的方法这是通过加入其它的电离常数(如氢离子常数、硝酸根离子常数和游离碱离子常数),来计算缓冲溶液的PH值,表达式为:pH = pKa + log( [H+]/[A-] ) + log( [HA]/[OH-] ) + log( [NO3-]/[OH-] ) + log( [NH4+]/[OH-] )以上就是缓冲溶液PH计算公式和它们的表达式,它们在分析化学中有很多运用,所以要好好掌握这些技巧,来更好地解决缓冲溶液中的PH 值问题。
溶液pH计算方法
溶液的pH是描述溶液酸碱性强弱的指标。
pH值是用于表示溶液酸碱程度的指标,它是以酸性和碱性溶液的氢离子(H+)浓度来衡量的。
pH值一般介于0到14之间,其中pH=7表示中性溶液,pH<7表示酸性溶液,pH>7表示碱性溶液。
要计算溶液的pH值,可以使用以下方法:
1. 离子浓度法:根据离子浓度计算溶液的pH值。
对于强酸和强碱溶液,可以直接使用浓度计算pH。
而对于弱酸和弱碱溶液,需要使用酸碱离解常数来计算。
pH = -log[H+]
2. 指示剂法:使用指示剂来测定溶液的酸碱性。
指示剂是一种能够在溶液中改变颜色的物质,其颜色的变化与溶液的pH值相关。
通过观察指示剂颜色的变化,可以确定溶液的酸碱性。
3. pH电极法:使用pH电极来测量溶液的pH值。
pH电极是一种能够测量溶液中氢离子浓度的仪器。
通过将pH电极浸入溶液中,根据电极的电势变化来测量pH值。
4. 酸碱滴定法:使用酸碱滴定法来确定溶液的酸碱性。
酸碱滴定法是通过向溶液中滴加一定浓度的酸或碱溶液,观察pH值的变化来确定溶液的酸碱性。
在实际应用中,根据不同的情况选择适合的方法来计算溶液的pH值。
无论是离子浓度法、指示剂法、pH电极法还是酸碱滴定法,都需要根据具体的实验条件来确定溶液的pH 值。