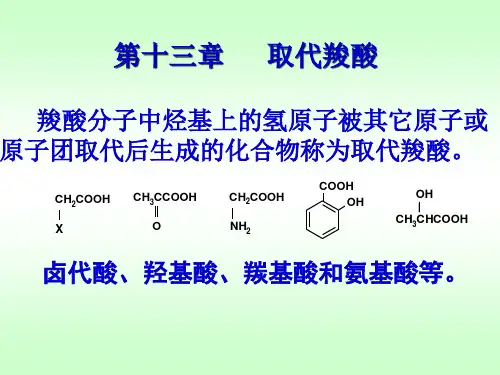
第12章羧酸和取代羧酸
- 格式:ppt
- 大小:9.02 MB
- 文档页数:63




第十二章 羧酸及其衍生物定义:分子中含有羧基的有机化合物称为羧酸(Carboxylic Acid),其通式为RCOOH ,其中R-可以是烷基或芳基。
羧酸的羟基被其它基团取代的化合物称为羧酸衍生物(boxylic acid derivatives)。
第一节 羧酸的结构、分类和命名 一、 结构1. 羰基C 原子以sp2杂化轨道成键:三个sp2杂化轨道形成的三个σ键在同一平面上,键角大约为120度。
2. 键长:C=O 双键键长为123pm ,C —O 单键键长为136pm 。
3. p –π共轭:碳原子的P 轨道和羧基氧的一个P 轨道相互交叠形成π键。
4. —COO-结构:羧基离解为负离子后,负电荷就完全均等地分布在O —C —O 链上,即两个C —O 键键长完全平均化。
0.127nmCHOO0.127n m二、 分类1、根据羧基羧连接烃基不同,将羧酸分为脂肪、脂环和芳香羧酸。
2、根据羧酸分子中所含的羧基数目不同,可分为一元酸、二元酸和多元酸。
三、 命名1、 羧酸常用俗名:通常根据天然来源命名。
如:HCOOH 蚁酸,HOOC —COOH 草酸。
2、 IUPAC 命名法:与醛的命名相同,即选择含有羧基的最长碳链为主链,靠近羧基一端开始编号;对于脂环酸和芳香酸,则把脂环或芳环看作取代基来命名;多元羧酸,选择含两个羧基的碳链为主链,按C 原子数目称为某二酸;如有不饱和键角要标明烯(或炔)键的位次,并使主链包括双键和叁键。
例如:COOHCH 2CH 2CH 2COOH环已基甲酸4—环已基丁酸CH 3(CH 2)7CH=CH (CH 2)7COOH 9—十八碳烯—酸(俗称油酸)第二节 羧酸的物理性质 一、 溶解性羧酸分子可与水形成氢键,所以低级羧酸能与水混溶,随着分子量的增加,非极性的烃基愈来愈大,使羧酸的溶解度逐渐减小,6个碳原子以上的羧酸则难溶于水而易溶于有机溶剂。
二、 熔沸点1、 熔点:随着C 原子的增加呈锯齿状的变化。





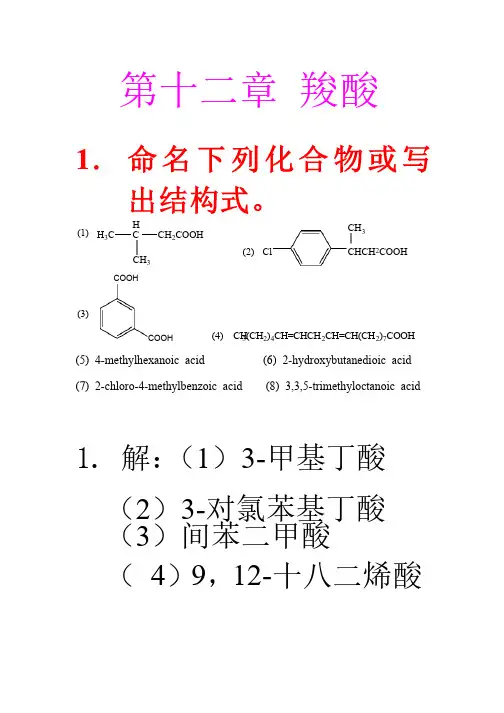
第十二章 羧酸1. 命名下列化合物或写出结构式。
H CCH 2COOHCH 3H 3C(1)ClCHCH 2COOHCH 3(2)COOHCOOH (3)(4) CH3(CH 2)4CH=CHCH 2CH=CH(CH 2)7COOH (5) 4-methylhexanoic acid (6) 2-hydroxybutanedioic acid (7) 2-chloro-4-methylbenzoic acid (8) 3,3,5-trimethyloctanoic acid1. 1. 解:解:(1)3-甲基丁酸 (2)3-对氯苯基丁酸 (3)间苯二甲酸 ( 4)9,12-十八二烯酸十八二烯酸CHCH CHCOOH COOHCl CHCH CCH CHCHOH HCOOH + PClCOOH + PClΔ碱石灰NaCO3Tollens试剂(+)银镜 NaCO3I2 + NaOH(+)△(-)KMnO 4/H (△(丁二酸 二酸己二酸(△() 正丙醇 HBr1) Mg , Et 2O2) CO ; 3) H +O CH HBrNaCNCNH 3OOH H2SO4△H HBr(CHMg Et O1) CO22) H OCl2POH COOH SOCl2COCl CH3CH2COONa THF1) CO222) H+OEtOHH+甲为CH3CH 2COOH , 乙为HCOOC 2H 5 , 丙为CH 3COOCH 3 . 7. 指出下列反应中的酸和碱. (1) 二甲醚和无水三氯化铝二甲醚和无水三氯化铝; (2) (2) 氨和三氟化硼; (3) 乙炔钠和水乙炔钠和水 7.解:按Lewis 酸碱理论:凡可接受电子对的分子、离子或基团称为酸,凡可给予电子对的分子、离子或基团成为碱。
Lewis 碱: 二甲醚二甲醚,, , 氨氨, , 乙炔钠乙炔钠乙炔钠. . Lewis 酸: 三氯化铝三氯化铝 , , , 三氟化硼三氟化硼三氟化硼 , , 水.8. (1) 按照酸性降低的次序排列下列化合物:①乙炔、氨、水; ②乙醇、乙酸、环戊二烯、乙炔(2) 按照碱性降低的次序排列下列离子:①C H3- , CH3O-, HC≡C- ; ②C H3O- , (CH3)3CO-, (CH3)2CHO-8.解:(1)酸性: ①水>乙炔>氨;②乙酸>环戊二烯>乙醇>乙炔(2)碱性:①CH3->HC≡C- >CH3O-; ②(CH3)3CO->(CH3)2CHO->依分OHCOOHCOOHC CHCH3綜上所述,马尿酸的结构为:C NHCHO。
第十章羧酸和取代羧酸1.苯甲醛、苯甲醇和苯甲酸的分子量较接近,而沸点和熔点却相差很大,此现象如何解释?苯甲醛苯甲醇苯甲酸分子量106 108 122沸点/178 205 249℃熔点/℃-26 -15.3 1222.顺丁烯二酸在100克水中能溶解79克,而反丁烯二酸只能溶解0.7克,试给予解释。
3.试解释邻氯苯丙炔酸的酸性弱于其对位和间位异构体的酸性。
4.试解释为什么2,6-二羟基苯甲酸(pKa=2.32)的酸性强于邻羟基苯甲酸(pKa=2.98)的酸性。
5.在利用氧化法由伯醇制备醛或由烷基苯制备芳酸中,如何能得到纯净的醛或羧酸?6.甲酸为什么具有还原性?7.分子式为C9H8O3的一种化合物,能溶于氢氧化钠和碳酸钠溶液,与三氯化铁溶液有显色反应,能使溴的四氯化碳溶液褪色,用KMnO4氧化得到对羟基苯甲酸,试推断它的结构。
8.分子式为C4H8O3的两种同分异构体A和B,A与稀硫酸共热,得到分子式为C3H6O 的化合物C和另一化合物D,C不能发生碘仿反应,但D能与托伦试剂反应生成银镜。
B 加热脱水生成分子式为C4H6O2的化合物E,E能使溴的四氯化碳溶液褪色,并经催化氢化生成分子式为C4H8O2的直链羧酸F。
试写出A、B、C、D、E、F的结构式。
9.用化学方法区分下列各组化合物:(1)甲酸、乙酸和丙烯酸(2)苯甲醇、苯甲酸、水杨酸和苯甲醛10.阿司匹林水溶液加入FeCl3溶液能否显色?如将其水溶液加热放冷后再加入FeCl3溶液能否显色?11.用反应方程式表示丙酮酸在体内的变化过程。
12.将下列各组化合物按酸性由大到小顺序排列,简述其理由。
(1)(A)丁酸(B)顺丁烯二酸(C)丁二酸(D)丁炔二酸(E)反丁烯二酸(3)(A)α-氯代苯乙酸(B)对氯苯乙酸(C) 苯乙酸(D) β-苯丙酸13.回答下列问题:(1)为什么羧酸的沸点及在水中的溶解度相对分子质量相近的其它有机物高?(2)苯甲酸和邻氯苯甲酸都是不溶于水的固体,能用甲酸钠的水溶液将其混合物分开,为什么?14.排列出下列醇在酸催化下与丁酸发生反应的活性次序:(1)(CH3)3CCH(OH)CH3(2)CH3CH2CH2CH2OH(3)CH3OH (4)CH3CH(OH)CH2CH315.写出草酸、对苯二甲酸在酸催化下,分别与乙二醇反应的产物。