实验九--羧酸和取代羧酸的性质
- 格式:doc
- 大小:14.00 KB
- 文档页数:2

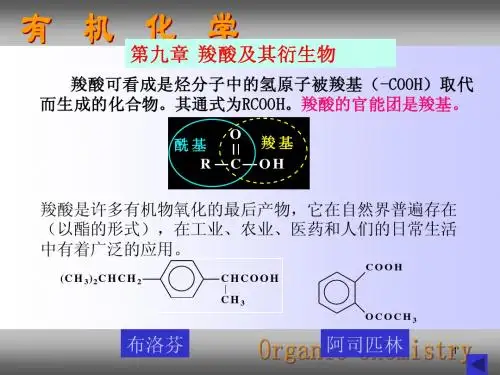
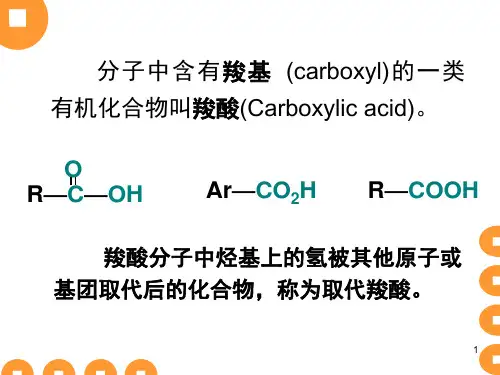
RCOOH..第九章 羧酸及其衍生物和取代酸(一COOH )官能团的化合物,一元饱和脂肪羧酸的通式为C n H 2n O 2 。
羧基中的羟基被其它原子或基团取代的产物称为羧酸衍生物(如酰卤、酸酐、酯、酰胺等),羧酸烃基上的氢原子被其他原子或基团取代的产物称为取代酸(如卤代酸、羟基酸、羰基酸、氨基酸等)。
羧酸是许多有机化合物氧化的最终产物,常以盐和酯的形式广泛存在于自然界,许多羧酸在生物体的代谢过程中起着重要作用。
羧酸对于人们的日常生活非常重要,也是重要的化工原料和有机合成中间体。
§9-1 羧酸一、羧酸的结构、分类和命名 1、羧酸的结构在羧酸分子中,羧基碳原子是sp 2杂化的,其未参与杂化的p 轨道与一个氧原子的p 轨道形成C=O 中的π键,而羧基中羟基氧原子上的未共用电子对与羧基中的C=O 形成p -π共轭体系,从而使羟基氧原子上的电子向C=O 转移,结果使C=O 和C —O 的键长趋于平均化。
X 光衍射测定结果表明:甲酸分子中C=O 的键长(0.123 nm )比醛、酮分子中C=O 的键长(0.120nm )略长,而C —O 的键长(0.136nm )比醇分子中C —O 的键长(0.143nm )稍短。
RCOOH羧基上的p -π共轭示意图2、羧酸的分类和命名 2.1.羧酸的分类根据分子中烃基的结构,可把羧酸分为脂肪羧酸(饱和脂肪羧酸和不饱和脂肪羧酸)、脂环羧酸(饱和脂环羧酸和不饱和脂环羧酸)、芳香羧酸等;根据分子中羧基的数目,又可把羧酸分为一元羧酸、二元羧酸、多元羧酸等。
例如:或OOCOOcCOOHHOOC HOOC CH 2COOHCH 2COOHCH 2HOOC CH 3CH C H C OOHCOOH HOOC脂肪羧酸 一元羧酸 脂环羧酸 芳香羧酸二元羧酸多元羧酸2.2.羧酸的命名羧酸的命名方法有俗名和系统命名两种。
俗名是根据羧酸的最初来源的命名。
在下面的举例中,括号中的名称即为该羧酸的俗名。

一、实验目的1. 学习并掌握取代羧酸的制备方法。
2. 探究取代羧酸的物理性质和化学性质。
3. 理解取代基对羧酸性质的影响。
二、实验原理羧酸分子中羧基上的氢原子被其他原子或原子团取代的产物称为取代羧酸。
取代羧酸的种类繁多,根据取代基的不同,可分为卤代羧酸、烷基羧酸、芳基羧酸等。
本实验以苯甲酸为例,通过卤代反应制备取代羧酸,并研究其性质。
三、实验材料与仪器1. 实验材料:- 苯甲酸- 氯化亚铁- 浓硫酸- 乙醇- 乙醚- 碘化钠- 氢氧化钠- 氢氧化钠溶液- 水浴锅- 烧杯- 滴管- 滤纸- 酒精灯- 冷却水- pH试纸- 721分光光度计2. 实验仪器:- 坩埚- 研钵- 蒸发皿- 漏斗- 烧瓶- 滴定管- 酸式滴定瓶- 铁架台- 移液管四、实验步骤1. 苯甲酸的制备- 将苯甲酸加入烧杯中,加入适量的乙醇,加热溶解。
- 加入氯化亚铁溶液,搅拌均匀。
- 加入浓硫酸,继续搅拌。
- 将反应液倒入蒸发皿中,加热蒸发至干燥。
- 将干燥的固体产物加入研钵中,研细。
- 将研细的固体产物转移至坩埚中,放入马弗炉中加热至熔融。
- 将熔融的固体产物倒入冷却水中,冷却结晶。
- 将结晶产物过滤、洗涤、干燥,得到苯甲酸。
2. 取代羧酸的制备- 将苯甲酸加入烧杯中,加入适量的乙醇,加热溶解。
- 加入碘化钠溶液,搅拌均匀。
- 加入氢氧化钠溶液,调节pH值为8-9。
- 将反应液倒入烧瓶中,加热回流。
- 反应一段时间后,停止加热,冷却至室温。
- 将反应液倒入漏斗中,过滤、洗涤、干燥,得到取代羧酸。
3. 取代羧酸的性质研究- 物理性质:观察取代羧酸的颜色、状态、熔点、沸点等。
- 化学性质:1. 酸性:测定取代羧酸的pKa值。
2. 氧化还原性:用高锰酸钾溶液测定取代羧酸的氧化还原性。
3. 水解性:用氢氧化钠溶液测定取代羧酸的水解性。
五、实验结果与讨论1. 苯甲酸的制备- 成功制备了苯甲酸,产率较高。
2. 取代羧酸的制备- 成功制备了取代羧酸,产率较高。

实验九羧酸和取代羧酸的性质一、实验目的1.验证羧酸和取代羧酸的主要化学性质。
2.掌握羧酸及取代羧酸的鉴别方法。
二、实验原理羧酸均有酸性,与碱作用生成羧酸盐。
羧酸的酸性比盐酸和硫酸弱,但比碳酸强,因此可与碳酸钠或碳酸氢钠成盐而溶解。
饱和一元羧酸中甲酸的酸性最强,二元羧酸中草酸的酸性最强。
羧酸和醇在浓硫酸的催化下发生酯化反应,生成有香味的酯。
在适当的条件下羧酸可发生脱羧反应。
甲酸分子中含有醛基,具有还原性,可被高锰酸钾或托伦试剂氧化。
由于两个相邻羧基的相互影响,草酸易发生脱羧反应和被高锰酸钾氧化。
乙酰乙酸乙酯是由酮式和烯醇式两种互变异构体共同组成的混合物,因此它既有酮的性质,如能与2,4-二硝基苯肼反应生成橙色的2,4-二硝基苯腙沉淀,又有烯醇的性质,如能使溴水褪色,与三氯化铁溶液作用发生显色反应等。
三、仪器和药品试管、烧杯、酒精灯、试管夹、带软木塞的导管等。
冰醋酸、草酸、苯甲酸、乙醇、异戊醇、乙酰乙酸乙酯、水杨酸、乙酰水杨酸、乳酸、酒石酸、2mol∙L-1一氯乙酸、2mol∙L-1三氯乙酸、2,4-二硝基苯肼、10%甲酸、10%乙酸、10%草酸、10%苯酚、托伦试剂、5%氢氧化钠溶液、5%盐酸、0.05%高锰酸钾溶液、0.05mol∙L-1三氯化铁溶液、5%碳酸钠溶液、浓硫酸、溴水、饱和石灰水、甲基紫指示剂、pH试纸。
四、实验步骤1.羧酸的酸性(1)用干净的玻棒分别蘸取10%乙酸、10%甲酸、10%草酸、10%苯酚于pH 试纸上,观察和记录其pH并解释之。
(2)在2支试管中分别加入0.1g苯甲酸、水杨酸和1mL水,边摇边逐滴加入5%氢氧化钠溶液至恰好澄清,再逐滴加入5%盐酸溶液,观察和记录反应现象并解释之。
(3)在2支试管中分别加入0.1g苯甲酸、水杨酸,边摇边逐滴加入5%碳酸钠溶液,观察和记录反应现象并解释之。
2.乙酰乙酸乙酯的互变异构现象(1)在试管中加入10滴2,4-二硝基苯肼试剂和3滴10%乙酰乙酸乙酯,观察和记录反应现象并解释之。






实验二十五(取代)羧酸及其衍生物、胺的性质【实验目的】1.熟悉羧酸、羧酸衍生物和取代羧酸的化学性质;2.掌握胺类化合物的性质及其鉴别方法;3. 了解酰化反应和缩二脲反应的应用。
【实验原理】羧酸一般为弱酸性(但酸性比碳酸强)。
羧酸能发生脱羧反应,而且不同羧酸的脱羧条件各有不同,如草酸、丙二酸经加热即易脱羧,放出CO2;羧酸与醇在酸的催化下,加热可以发生酯化反应。
甲酸含有醛基,故能还原托伦试剂。
羧酸除能生成酯外,也能生成酰卤、酸酐和酰胺(四者统称为羧酸衍生物)。
它们的化学性质相似,能发生水解、醇解和氨解。
活泼顺序为:酰卤>酸酐>酯>酰胺。
取代羧酸中重要的有羟基酸和酮酸。
羟基酸中的羟基比醇分子中的羟基易被氧化,如乳酸能被托伦试剂氧化成丙酮酸;在碱性高锰酸钾溶液中,因高锰酸钾被乳酸还原而使紫色褪去。
乙酰乙酸乙酯是酮型和烯醇型两种互变异构体的平衡混合物,这两种异构体借分子中氢原子的移位而互变转换,所以它既具有酮的性质(如与2,4-二硝基苯肼反应生成2,4-二硝基苯腙),又具有烯醇的性质(如能使溴水褪色并能与FeCl3溶液作用呈现紫色)。
胺可以看做是氨分子中的氢原子被羟基取代的衍生物。
胺类化合物有碱性,能与酸反应生成盐。
芳香胺由于氨基的存在使苯环活化,易发生取代反应。
在酰化反应中,伯胺和仲胺由于氮上有氢原子可被酰基取代,生成相应的酰胺类化合物,叔氨氮上无氢原子则无此反应。
大多数酰胺为结晶固体,故可利用酰化反应鉴别胺类化合物。
胺类容易被氧化,氧化产物往往很复杂。
将尿素缓慢加热至熔点以上,则二分子尿素可脱去一分子氨生成缩二脲。
缩二脲在碱性溶液中与稀的硫酸铜溶液反应能产生紫红色,这种反应叫做缩二脲反应。
【仪器材料】小试管10支,烧杯(100 mL)2个,玻璃棒1根,小橡皮塞1个,酒精灯1个,温度计1个,石棉网1个,铁架台1个,铁圈1个,铁夹1个,大试管1个,带孔橡皮塞1个,导管1个,药匙1个。
【试剂药品】5%甲酸溶液,5%草酸溶液,5%乙酸溶液,广泛pH试纸,固体草酸,异戊醇,澄清石灰水,冰醋酸,浓硫酸,乙酰氯,蒸馏水,乙酐,10%乙酰乙酸乙酯溶液,2,4-二硝基苯肼溶液,1%三氯化铁溶液,饱和溴水,苯胺,苄胺,二乙胺,N-甲基苯胺,N,N-二甲基苯胺,10%氢氧化钠溶液,1%硫酸铜溶液,红色石蕊试纸,尿素。
实验九羧酸和取代羧酸的性质
一、实验目的
1.验证羧酸和取代羧酸的主要化学性质。
2.掌握羧酸及取代羧酸的鉴别方法。
二、实验原理
羧酸均有酸性,与碱作用生成羧酸盐。
羧酸的酸性比盐酸和硫酸弱,但比碳酸强,因此可与碳酸钠或碳酸氢钠成盐而溶解。
饱和一元羧酸中甲酸的酸性最强,二元羧酸中草酸的酸性最强。
羧酸和醇在浓硫酸的催化下发生酯化反应,生成有香味的酯。
在适当的条件下羧酸可发生脱羧反应。
甲酸分子中含有醛基,具有还原性,可被高锰酸钾或托伦试剂氧化。
由于两个相邻羧基的相互影响,草酸易发生脱羧反应和被高锰酸钾氧化。
乙酰乙酸乙酯是由酮式和烯醇式两种互变异构体共同组成的混合物,因此它既有酮的性质,如能与2,4-二硝基苯肼反应生成橙色的2,4-二硝基苯腙沉淀,又有烯醇的性质,如能使溴水褪色,与三氯化铁溶液作用发生显色反应等。
三、仪器和药品
试管、烧杯、酒精灯、试管夹、带软木塞的导管等。
冰醋酸、草酸、苯甲酸、乙醇、异戊醇、乙酰乙酸乙酯、水杨酸、乙酰水杨酸、乳酸、酒石酸、2mol∙L-1一氯乙酸、2mol∙L-1三氯乙酸、2,4-二硝基苯肼、10%甲酸、10%乙酸、10%草酸、10%苯酚、托伦试剂、5%氢氧化钠溶液、5%盐酸、0.05%高锰酸钾溶液、0.05mol∙L-1三氯化铁溶液、5%碳酸钠溶液、浓硫酸、溴水、饱和石灰水、甲基紫指示剂、pH试纸。
四、实验步骤
1.羧酸的酸性
(1)用干净的玻棒分别蘸取10%乙酸、10%甲酸、10%草酸、10%苯酚于pH 试纸上,观察和记录其pH并解释之。
(2)在2支试管中分别加入0.1g苯甲酸、水杨酸和1mL水,边摇边逐滴加入5%氢氧化钠溶液至恰好澄清,再逐滴加入5%盐酸溶液,观察和记录反应现象并解释之。
(3)在2支试管中分别加入0.1g苯甲酸、水杨酸,边摇边逐滴加入5%碳酸
钠溶液,观察和记录反应现象并解释之。
2.乙酰乙酸乙酯的互变异构现象
(1)在试管中加入10滴2,4-二硝基苯肼试剂和3滴10%乙酰乙酸乙酯,观察和记录反应现象并解释之。
(2)在试管中加入乙酰乙酸乙酯2滴,加乙醇2 mL,再加0.05 mol∙L-1三氯化铁溶液1滴,注意颜色变化。
再加溴水到颜色刚好消失。
注意不久颜色又会重现,观察并解释发生的变化。
五、说明
1.酯化反应温度不能过高,若超过乙酸异戊酯和异戊醇的沸点,会引起两者挥发,使现象不明显。
2.羧酸一般无还原性,但由于甲酸与草酸的结构特殊,均能被氧化而具有还原性。
3.水杨酸与甲醇所生成的酯叫水杨酸甲醇,又叫冬青油,有特殊的香味。
六、思考题
1.做脱羧实验时,若将过量的二氧化碳通入石灰水中时,将会出现什么现象?
2.甲酸是一元羧酸,草酸是二元羧酸,它们都有还原性,可以被氧化。
其他的一元羧酸和二元羧酸是否也能被氧化?
3.如何鉴别甲酸、乙酸与草酸?
4.为什么酯化反应要加硫酸?为什么酯的碱性水解比酸性水解效果好?。