第十章 羧酸和取代羧酸
- 格式:pptx
- 大小:2.68 MB
- 文档页数:109



实验九羧酸和取代羧酸的性质一、实验目的1.验证羧酸和取代羧酸的主要化学性质。
2.掌握羧酸及取代羧酸的鉴别方法。
二、实验原理羧酸均有酸性,与碱作用生成羧酸盐。
羧酸的酸性比盐酸和硫酸弱,但比碳酸强,因此可与碳酸钠或碳酸氢钠成盐而溶解。
饱和一元羧酸中甲酸的酸性最强,二元羧酸中草酸的酸性最强。
羧酸和醇在浓硫酸的催化下发生酯化反应,生成有香味的酯。
在适当的条件下羧酸可发生脱羧反应。
甲酸分子中含有醛基,具有还原性,可被高锰酸钾或托伦试剂氧化。
由于两个相邻羧基的相互影响,草酸易发生脱羧反应和被高锰酸钾氧化。
乙酰乙酸乙酯是由酮式和烯醇式两种互变异构体共同组成的混合物,因此它既有酮的性质,如能与2,4-二硝基苯肼反应生成橙色的2,4-二硝基苯腙沉淀,又有烯醇的性质,如能使溴水褪色,与三氯化铁溶液作用发生显色反应等。
三、仪器和药品试管、烧杯、酒精灯、试管夹、带软木塞的导管等。
冰醋酸、草酸、苯甲酸、乙醇、异戊醇、乙酰乙酸乙酯、水杨酸、乙酰水杨酸、乳酸、酒石酸、2mol∙L-1一氯乙酸、2mol∙L-1三氯乙酸、2,4-二硝基苯肼、10%甲酸、10%乙酸、10%草酸、10%苯酚、托伦试剂、5%氢氧化钠溶液、5%盐酸、0.05%高锰酸钾溶液、0.05mol∙L-1三氯化铁溶液、5%碳酸钠溶液、浓硫酸、溴水、饱和石灰水、甲基紫指示剂、pH试纸。
四、实验步骤1.羧酸的酸性(1)用干净的玻棒分别蘸取10%乙酸、10%甲酸、10%草酸、10%苯酚于pH 试纸上,观察和记录其pH并解释之。
(2)在2支试管中分别加入0.1g苯甲酸、水杨酸和1mL水,边摇边逐滴加入5%氢氧化钠溶液至恰好澄清,再逐滴加入5%盐酸溶液,观察和记录反应现象并解释之。
(3)在2支试管中分别加入0.1g苯甲酸、水杨酸,边摇边逐滴加入5%碳酸钠溶液,观察和记录反应现象并解释之。
2.乙酰乙酸乙酯的互变异构现象(1)在试管中加入10滴2,4-二硝基苯肼试剂和3滴10%乙酰乙酸乙酯,观察和记录反应现象并解释之。





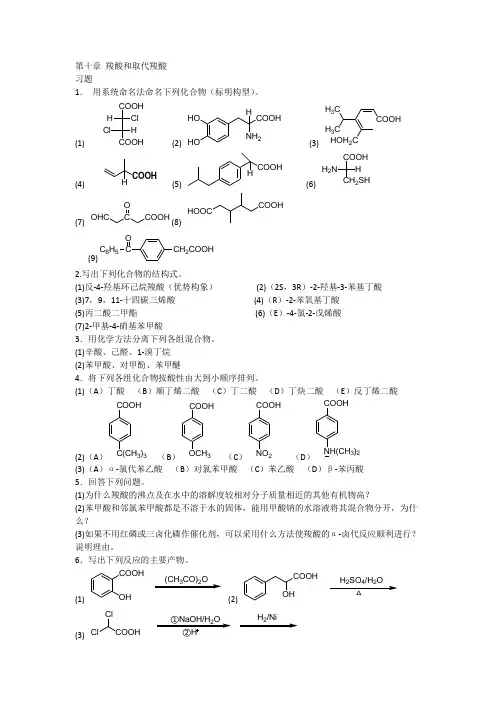
第十章 羧酸和取代羧酸 习题1. 用系统命名法命名下列化合物(标明构型)。
(1)COOHCOOH Cl H HCl (2) HO HO COOHNH 2H(3) COOHHOH 2CH 3CH 3C(4)H(5)COOH H(6)COOHCH 2SH H H 2N (7)OHC C O (8)COOHHOOC(9)CH 2COOHCC 6H 5O2.写出下列化合物的结构式。
(1)反-4-羟基环己烷羧酸(优势构象) (2)(2S ,3R )-2-羟基-3-苯基丁酸 (3)7,9,11-十四碳三烯酸 (4)(R )-2-苯氧基丁酸 (5)丙二酸二甲酯 (6)(E )-4-氯-2-戊烯酸 (7)2-甲基-4-硝基苯甲酸3.用化学方法分离下列各组混合物。
(1)辛酸、己醛、1-溴丁烷 (2)苯甲酸、对甲酚、苯甲醚4.将下列各组化合物按酸性由大到小顺序排列。
(1)(A )丁酸 (B )顺丁烯二酸 (C )丁二酸 (D )丁炔二酸 (E )反丁烯二酸(2)(A )COOH C(CH 3)3 (B )COOHOCH 3 (C )NO 2COOH (D )COOH NH(CH 3)2(3)(A )α-氯代苯乙酸 (B )对氯苯甲酸 (C )苯乙酸 (D )β-苯丙酸 5.回答下列问题。
(1)为什么羧酸的沸点及在水中的溶解度较相对分子质量相近的其他有机物高?(2)苯甲酸和邻氯苯甲酸都是不溶于水的固体,能用甲酸钠的水溶液将其混合物分开,为什么?(3)如果不用红磷或三卤化磷作催化剂,可以采用什么方法使羧酸的α-卤代反应顺利进行?说明理由。
6.写出下列反应的主要产物。
(1)COOHOH(CH 3CO)2O(2)COOHOH△242(3) ClCl2(4)ClC 6H 5NaOH/H 2O△4H(5)COOHOH OH+(6)COOH ONaBH 4(7)COOH①LiAlH 4②H 3O(8)COOH2(9) COOH25H(10) COOHSOCl 27.下列化合物在加热条件下发生什么反应?写出主要产物。

第十章羧酸和取代羧酸1.苯甲醛、苯甲醇和苯甲酸的分子量较接近,而沸点和熔点却相差很大,此现象如何解释?苯甲醛苯甲醇苯甲酸分子量106 108 122沸点/178 205 249℃熔点/℃-26 -15.3 1222.顺丁烯二酸在100克水中能溶解79克,而反丁烯二酸只能溶解0.7克,试给予解释。
3.试解释邻氯苯丙炔酸的酸性弱于其对位和间位异构体的酸性。
4.试解释为什么2,6-二羟基苯甲酸(pKa=2.32)的酸性强于邻羟基苯甲酸(pKa=2.98)的酸性。
5.在利用氧化法由伯醇制备醛或由烷基苯制备芳酸中,如何能得到纯净的醛或羧酸?6.甲酸为什么具有还原性?7.分子式为C9H8O3的一种化合物,能溶于氢氧化钠和碳酸钠溶液,与三氯化铁溶液有显色反应,能使溴的四氯化碳溶液褪色,用KMnO4氧化得到对羟基苯甲酸,试推断它的结构。
8.分子式为C4H8O3的两种同分异构体A和B,A与稀硫酸共热,得到分子式为C3H6O 的化合物C和另一化合物D,C不能发生碘仿反应,但D能与托伦试剂反应生成银镜。
B 加热脱水生成分子式为C4H6O2的化合物E,E能使溴的四氯化碳溶液褪色,并经催化氢化生成分子式为C4H8O2的直链羧酸F。
试写出A、B、C、D、E、F的结构式。
9.用化学方法区分下列各组化合物:(1)甲酸、乙酸和丙烯酸(2)苯甲醇、苯甲酸、水杨酸和苯甲醛10.阿司匹林水溶液加入FeCl3溶液能否显色?如将其水溶液加热放冷后再加入FeCl3溶液能否显色?11.用反应方程式表示丙酮酸在体内的变化过程。
12.将下列各组化合物按酸性由大到小顺序排列,简述其理由。
(1)(A)丁酸(B)顺丁烯二酸(C)丁二酸(D)丁炔二酸(E)反丁烯二酸(3)(A)α-氯代苯乙酸(B)对氯苯乙酸(C) 苯乙酸(D) β-苯丙酸13.回答下列问题:(1)为什么羧酸的沸点及在水中的溶解度相对分子质量相近的其它有机物高?(2)苯甲酸和邻氯苯甲酸都是不溶于水的固体,能用甲酸钠的水溶液将其混合物分开,为什么?14.排列出下列醇在酸催化下与丁酸发生反应的活性次序:(1)(CH3)3CCH(OH)CH3(2)CH3CH2CH2CH2OH(3)CH3OH (4)CH3CH(OH)CH2CH315.写出草酸、对苯二甲酸在酸催化下,分别与乙二醇反应的产物。

第十章 取代羧酸【目的要求】1、掌握取代羧酸的分类和命名(包含俗名);取代羧酸的酸性及其它特性。
2、熟悉乙酰乙酸乙酯、丙二酸二乙酯的结构和性质特点。
3、了解取代羧酸的制备方法;一些重要化合物。
【教学内容】第一节 取代羧酸的结构、分类和命名一、结构和分类卤代酸、羟基酸、羰基酸(氧代酸)和氨基酸等。
二、命名第二节 卤代酸一、卤代酸的制备 (一)、α-卤代酸的制备脂肪族羧酸在少量红磷(或卤代磷)存在下可以直接溴化或氯化,生成α-卤代酸(Hell-Volhard-Zelinsky 反应)。
RCH 2BrPBr 2Brα-溴代酸 (二)、β-卤代酸的制备β-卤代酸可用α,β-不饱和酸和卤化氢发生加成作用而制得。
加成时,卤原子总是加β-碳原子上。
(三)、 洪赛迪克尔(Hunsdiecker )反应 二、性质 (一)、酸性卤原子的存在使卤代酸的酸性比相应的羧酸强。
酸性的强弱与卤原子取代的位置、卤原子的种类和数目有关。
(二)、与碱的反应1、α-卤代酸:与水或稀碱溶液共煮,水解成羟基酸。
Cl OHH ClCH 3CHCOOHCH 32、β-卤代酸:与氢氧化钠水溶液反应,失去一分子卤化氢,而产生α,β-不饱和羧酸。
H2ClHCH 2CHCOOH 23、γ-与δ-卤代酸 (三)、达则斯(Darzens )反应 (四)、雷福尔马斯基(Reformatsky )反应α-卤代酸酯在锌粉作用下与羰基化合物(醛、酮、酯)发生反应,产物经水解后生成β-羟基酸酯的反应称雷福尔马斯基反应。
反应是通过有机锌化合物进行的。
例如:BrCH 2COOC 2H 5ZnBrZnCH 2COOC 2H5Zn BrZnCH2COOC 2HC 6H 5CHOC 6H 5CHCH 2COOC 2H 5OZnBrC 6H 5CHCH 2COOC 2H 5OZnBrOHC 6H 5CHCH 2COOC 2H OHBr OH261%~64% 三、个别化合物第三节 羟基酸一、醇酸 (一)、醇酸的制备1、卤代酸水解2、羟基腈水解3、雷福尔马斯基反应(二)、性质1、酸性。