HV-4离体组织器官恒温灌流系统说明书
- 格式:pdf
- 大小:1.89 MB
- 文档页数:15

济南离体灌流操作流程离体灌流是一种广泛应用于生物医学研究的实验技术,它可以通过灌注特定溶液到离体组织或器官中,使其保持生理活性,从而研究其功能及药物的作用机制。
下面是济南离体灌流操作的一般流程,供参考:1.实验前的准备工作:在进行离体灌流实验前,需要准备好实验所需的材料和设备,包括离体灌流装置(包括离体灌流槽、灌流泵等)、组织切割工具(如手术刀、剪刀等)、灌流溶液、药物等。
2.组织切割:使用清洁的手术刀和剪刀,将动物或人体器官取出,并迅速进行组织切割。
根据实验需要,可以选择切割出不同的组织或器官,如心脏、肝脏、肺等。
切割时要尽量保持组织的完整性和生理活性,避免对组织产生损伤。
3.灌流装置的组装:将离体灌流装置按照说明书上的指导进行组装,确保装置的稳定性和安全性。
通常,将组织放置在灌流槽中,通过灌流泵和导管将灌流溶液灌注到组织中。
4.灌流溶液的准备:灌流溶液是将药物或生理盐水等溶解在适当的缓冲液中得到的。
根据实验需要,可以选择不同的灌流溶液配方。
溶液的调配必须严格按照说明书上的指导进行,确保配制好的溶液符合实验所需的浓度和pH值。
5.灌流操作:将准备好的灌流溶液通过导管连接到组织中,开始进行灌流操作。
其中,需要控制灌流溶液的流速、温度和压力等参数,以维持组织的生理状态。
通常,灌流操作时间较长,可持续数小时以上。
6.添加药物:根据实验需要,可以在灌流溶液中添加特定的药物,以研究其对组织的作用机制。
在添加药物时,需要按照指定的剂量和时间进行,避免过量或过长时间的暴露。
7.检测和记录:在灌流操作期间,需要对组织的生理参数、功能状态以及药物的作用等进行监测和记录。
通常,可以使用生理记录仪、激光显微镜等设备进行实时监测,并通过数据采集系统将数据记录下来。
8.分析和结果:根据实验的目的和研究问题,对灌流实验所得到的数据进行分析和结果的总结。
可以使用统计学方法对数据进行处理,并进行图表的绘制和实验结果的解释。
总结:济南离体灌流操作的流程分为实验前准备、组织切割、灌流装置的组装、灌流溶液的准备、灌流操作、添加药物、检测和记录以及分析和结果等步骤。

GDF11改善老龄鼠内皮依赖性血管舒张功能的实验研究刘婷;张承英;苏静克;韩宁;朱彪【摘要】目的探讨生长分化因子11(growth differentiation factor 11,GDF11)对老龄小鼠内皮依赖性血管舒张功能的影响.方法选择20只18个月龄C57小鼠随机分为实验组(GDF11组,n=10)和对照组(Vehi组,n=10),GDF11组按0.3mg/(kg·d)的剂量腹腔注射重组GDF11,Vehi组注射等量生理盐水.4周后取材,检测脂代谢相关的血液学指标,分离小鼠的胸主动脉,测定血管舒张功能和主动脉Samd2/3的磷酸化水平.结果与Vehi组比较,GDF11干预显著增强乙酰胆碱(Ach)诱导的内皮依赖性血管舒张功能[10-6 mol/L Ach:(37.1±5.2)%vs(59.7±4.3)%;10-5 mol/L Ach:(48.2±4.0)%vs (78.4±5.6)%;10-4 mol/L Ach.(61.1±4.7)%vs (90.2±7.4)%],降低血清中三酰甘油的水平[(76.6±11.2) vs (64.5±10.4) mg/dl],升高脂联素的浓度[(11.9±1.1)vs(14.2±1.7) μg/ml],并能提高主动脉Samd2/3的磷酸化水平[Smad2:(1.00±0.05) vs (1.78±0.10)]、Smad3 [(1.00±0.09) vs (1.57±0.12)].结论 GDF11对血管内皮细胞有保护作用.【期刊名称】《武警医学》【年(卷),期】2018(029)007【总页数】4页(P702-705)【关键词】GDF11;内皮依赖性血管舒张功能;老龄鼠【作者】刘婷;张承英;苏静克;韩宁;朱彪【作者单位】102413,北京核工业医院心电图室;100039 北京,武警总医院肾内科;100039 北京,武警总医院肾内科;100039 北京,武警总医院肾内科;071000 保定,河北大学附属医院口腔科【正文语种】中文【中图分类】R543.1动脉硬化是一类以血管管壁增厚变硬、弹性减弱和管腔缩小为特征的疾病,它严重威胁着人类的健康。



硫化氢对大鼠肠缺血再灌注后回肠收缩活性的保护作用张观坡;高峻;李桂香;李兆申;邹多武【摘要】肠缺血再灌注(I/R)在临床中较为常见,并可引起严重的并发症,目前仍缺乏有效的治疗药物.目的:研究硫化氢(H2S)对大鼠肠I/R后离体回肠收缩活性的影响及其机制.方法:24只Sprague-Dawley大鼠随机分为正常组、假手术组、I/R组(I1h/R4h)、H2S组(再灌注前20 min腹腔内注射硫氢化钠10 μmol/kg).记录离体回肠自发收缩频率和曲线下面积(AUC),观察离体回肠对KCl(30 mmol/L)、乙酰胆碱(Ach)( 10-5 mol/L)、电场刺激(EFS)(30 V,10 Hz,1.00 ms,10 s)的反应.以免疫荧光染色检测肠肌间神经丛中Hu、胆碱乙酰转移酶(ChAT)阳性神经元表达.结果:与假手术组相比,I/R组和H2S组大鼠离体回肠自发收缩频率、对KCl和Ach的反应无明显改变.I/R组自发收缩AUC和对EFS的反应明显下降(P<0.05),Hu、ChAT阳性神经元表达均明显降低(P<0.05);给予H2S干预后,上述指标均明显升高(P<0.05).结论:H2S对大鼠肠I/R后回肠收缩活性可产生保护作用,其机制可能是减轻了肠神经元尤其是兴奋性神经元的损伤.%Ischemia-reperfusion (I/R) injury is common and can cause severe complications, but there are only a few drugs showing promising effects. Aims: To investigate the protective effect and mechanism of hydrogen sulfide (H2S) on the contractile activity of isolated ileum induced by I/R in rats. Methods: Twenty-four SpragueDawley rats were randomly divided into normal control group, sham-operated group, I/R (I1h/R4h) group, H2S group (NaHS 10 μmol/kg injected intraperitoneally 20 minutes before reperfusion). Functional studies were carried out by recording the frequency and area under curve (AUC) of spontaneous contraction of isolated ileum, and responses to KC1(30 mmol/L), acetylcholine (Ach) (10-5 mol/L) and electrical field stimulation (EFS) (30 V, 10 Hz, 1.00 ms, 10 s). Immunofluorescenee staining was used to detect the expressions of Hu-positive and choline acetyl transferase (ChAT)-positive enteric neurons in myenteric plexus. Results: Compared with sham-operated group, no significant differences in frequency of spontaneous contraction, responses to KC1 and Ach were found in I/R group and H2S group. AUC of spontaneous contraction and the response to EFS, and expressions of Hu-positive and ChAT-positive enteric neurons were significantly decreased (P<0.05). After intervention with H2S, all the above-mentioned indices significantly increased (P<0.05). Conclusions: H2S shows protective effect on contractile activity of rat ileum induced by I/R. The mechanism is probably related to the alleviation of enteric neurons injury by H2S, especially the excitatory neurons.【期刊名称】《胃肠病学》【年(卷),期】2012(017)002【总页数】5页(P119-123)【关键词】再灌注损伤;硫化氢;回肠;收缩活性;神经元【作者】张观坡;高峻;李桂香;李兆申;邹多武【作者单位】第二军医大学长海医院消化内科,200433;第二军医大学长海医院消化内科,200433;第二军医大学长海医院消化内科,200433;第二军医大学长海医院消化内科,200433;第二军医大学长海医院消化内科,200433【正文语种】中文肠缺血再灌注(ischemia-reperfusion,I/R)损伤是临床上较为常见的基本病理生理过程,可在出血性休克、小肠移植、机械性肠梗阻和严重外伤等过程中发生[1],会引起严重的并发症甚至死亡,但目前仍缺乏有效的治疗药物。

环维黄杨星D对大鼠胸主动脉环的双向作用研究作者:刘妍妍等来源:《中国保健营养·中旬刊》2013年第07期【摘要】目的:探讨环维黄杨星 D(CVB-D)对大鼠离体胸主动脉环的作用。
方法:采用大鼠离体胸主动脉环灌流模型,观察累积浓度CVB-D对盐酸去氧肾上腺素(PE)或氯化钾(KCl)预处理的内皮完整及去内皮主动脉环的作用。
结果:累积加入CVB-D 4~64g/ml,对PE或KCl预处理的主动脉环均能产生明显的舒张作用(P【关键词】环维黄杨星D;大鼠;离体胸主动脉环;双向作用环维黄杨星D(CVB-D)是从黄杨科植物小叶黄杨及其同属植物中提取分离得到的一种生物碱,商品名为黄杨宁,亦称环常绿黄杨碱D、黄杨碱等,它对心血管系统有重要的作用,具有强心、抗心绞痛、扩张血管、抗心律失常等作用[1]。
目前对CVB-D的药理作用已进行了广泛的研究,而CVB-D对大鼠离体胸主动脉环的双向作用国内未见报道。
本文旨在观察CVB-D对大鼠离体胸主动脉环的药理作用,以期为该药物的进一步临床应用提供理论依据。
1材料与方法1.1 材料1.1.1 药品与试剂盐酸去氧肾上腺素注射液:上海禾丰制药有限公司,批号20060908;环维黄杨星D:河南开封开抗药业有限公司,批号200501018;其它试剂均为国产分析纯。
1.1.2 实验仪器HV-4离体组织器官恒温灌流系统、HW-1000超级恒温水浴及BL-410生物机能实验系统:成都泰盟科技有限公司;JH-2张力换能器:北京航天医学工程研究所。
1.1.3 实验动物健康雄性Wistar大鼠,150~180g。
由中国医学科学院放射医学研究所动物中心提供,动物合格证号:SCXK(京)2005-001。
1.2 方法1.2.1 大鼠离体胸主动脉环制备取健康雄性Wistar大鼠,脱颈椎处死后,立即打开胸腔,迅速取出胸主动脉,小心分离附着的脂肪及结缔组织后,用剪刀剪成宽3mm的主动脉环。
去内皮主动脉环的制备采用机械法。

离体心脏灌流系统技术参数1、具备有温度控制系统的浴槽,可产生不同的控制环境(如一定的灌流压力、温度、酸碱度等)及各种因素(如营养物质、缺血、缺氧及药物等)。
2、离体心脏活动的各种信号(如心室压、心电图等)可用MP150多道生理信号分析系统或心功能分析系统自动采集、处理、分析。
3、该系统可进行离体心脏的正逆向灌流,可调恒流、恒压(恒压循环式和非循环式,恒流循环式和非循环式,Langendorff,工作心脏)等多种实验模式。
含所需支架、管路系统及开关、蠕动泵、控温水浴槽。
1).温度范围:+12oC~+200 oC2).温度稳定度:±0.01 oC3).加热功率:1600 Watts4).LED显示5).用户选择显示精度范围0.01 oC~0.1 oC6).用户可调节高低温度报警装置(可视的温度安全报警)7).自动充液孔8).泵流速:15L/min(最大)9).泵压 0.5 bar(16'head)(最大)10).泵流量范围:6~600ml/min4、乳胶球囊0.03ML、0.05ML、0.10ML、0.20ML、0.27ML、0.35ML、0.49ML、0.70、ML、1.30ML各一包,每包十只。
5、柔性球囊导管两根。
6、配置模块能与MP150主机相连接,记录和分析的参数指标有:心电、心室内压、肌张力、温度、冠脉流量、刺激、呼吸频率和幅度。
7、有创血压换能器:测量范围:-50mmHg到+300mmHg过压:-400mmHg到+4000mmHg动态响应:100HZ8小时漂移:1mmHg8、肌张力换能器:量程:50克,噪声小于1mg磁滞:小于0.05%FSR非线性:小于0.025%FSR温度零点漂移:小于+/-0.03%FSR/˚C9、刺激输出模块:刺激输出电压:20V输出驱动电流:+/-100mA(50Ω)极性控制:手动或数控衰减控制范围:126dB最小单相脉宽:10μs最小双相脉宽:20μs任意波形分辨率:10μs10、刺激隔离适配器(电流和电压):最大输出电压:200伏恒流电流:0.01, 0.02, 0.05, 0.1, 0.2, 0.5, 1.0, 2.0, 5.0,10.0, 20.0, 50.0 毫安脉冲宽度范围:50 µsec - 2 msec11、防水温度探头最大测量温度:60°C精度:0.2°C长度:3米12、呼吸放大器放大倍数:10, 20, 50, 100低通滤波:1 Hz, 10 Hz高通滤波:DC, 0.05 Hz, 0.5 Hz输出范围:±10 V噪音电压:0.2 µV (RMS)13、呼吸绑带可变电阻输出范围:50-125 Kohm电缆长度:3米离体心脏灌流系统配置明细表。

一、实验目的1. 理解灌流实验的基本原理和方法;2. 掌握离体器官灌流技术;3. 观察理化因素对离体器官生理功能的影响。
二、实验原理灌流实验是一种常用的生物学实验方法,通过将离体器官(如心脏、肾脏等)置于适宜的灌流液中,维持器官的生理功能,并观察和分析灌流液中理化因素对器官生理功能的影响。
离体器官灌流实验中,灌流液的成分、温度、流速等都会对器官的生理功能产生影响。
三、实验材料与仪器1. 实验材料:青蛙心脏、任氏液、0.65%NaCl溶液、2%CaCl2溶液、1%KCl溶液、1:10000肾上腺素、1:10000乙酰胆碱、3%乳酸;2. 实验仪器:手术器械、蛙板(或蜡盘)、蛙心夹、计算机采集系统、张力传感器、支架、双凹夹、双针形露丝刺激电极、滴管、培养皿(或小烧杯)、棉线、套管夹。
四、实验方法与步骤1. 将青蛙麻醉,暴露心脏,用手术刀小心地分离心脏周围的组织,暴露心脏;2. 将心脏用任氏液清洗干净,并用棉线固定在支架上;3. 将心脏动脉插管,插入心脏主动脉,用蛙心夹夹住;4. 将心脏与张力传感器连接,启动计算机采集系统,记录心脏收缩活动;5. 以任氏液作为对照,观察心脏的收缩活动;6. 分别用0.65%NaCl溶液、2%CaCl2溶液、1%KCl溶液、1:10000肾上腺素、1:10000乙酰胆碱、3%乳酸替换任氏液,观察心脏的收缩活动变化;7. 分析实验结果,探讨不同理化因素对心脏生理功能的影响。
五、实验结果与分析1. 对照组:心脏在任氏液中以正常节律收缩和舒张;2. 0.65%NaCl溶液组:心脏收缩幅度和节律稍微减小和减弱,相当于细胞外环境中缺乏Ca2+,动作电位2期Ca2+内流减少,胞浆中Ca2+减少,心肌收缩力降低;3. 2%CaCl2溶液组:心脏收缩幅度和节律稍微加大和加快,细胞外液浓度升高,动作电位2期Ca2+内流增更多,心肌收缩力增强;慢反应细胞4期去极速度加快、心率增快;4. 1%KCl溶液组:心脏收缩幅度和节律稍微加大和加快,K+与Ca2+在细胞膜上有竞争性抑制;细胞外液中K+浓度升高,Ca2+内流减少,心肌的兴奋性降低;5. 1:10000肾上腺素组:心脏收缩幅度和节律明显加大和加快,肾上腺素可以产生类似心交感神经兴奋时对心脏的作用;6. 1:10000乙酰胆碱组:心脏收缩幅度和节律明显减小和减弱,乙酰胆碱可以产生类似心迷走神经兴奋时对心脏的作用;7. 3%乳酸组:心脏收缩幅度和节律明显减小和减弱,乳酸可以导致心肌细胞能量代谢障碍,心肌收缩力降低。

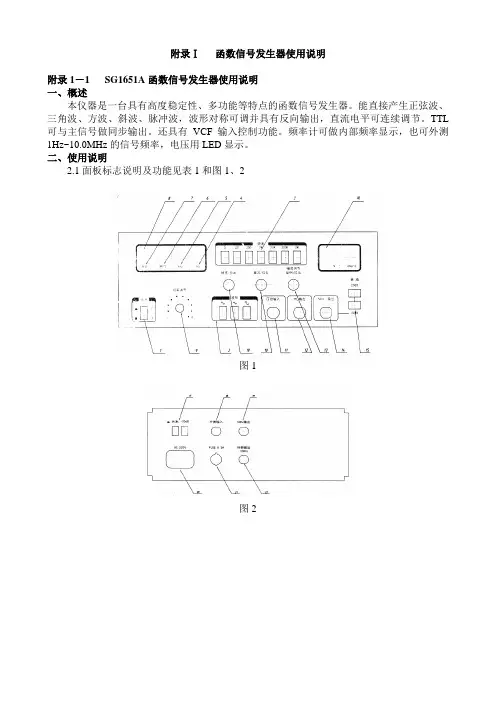
附录Ⅰ函数信号发生器使用说明附录1-1 SG1651A函数信号发生器使用说明一、概述本仪器是一台具有高度稳定性、多功能等特点的函数信号发生器。
能直接产生正弦波、三角波、方波、斜波、脉冲波,波形对称可调并具有反向输出,直流电平可连续调节。
TTL 可与主信号做同步输出。
还具有VCF输入控制功能。
频率计可做内部频率显示,也可外测1Hz~10.0MHz的信号频率,电压用LED显示。
二、使用说明2.1面板标志说明及功能见表1和图1、2图1图2附录1-2 DC1641数字函数信号发生器使用说明一、概述DC1641使用LCD显示、微处理器(CPU)控制的函数信号发生器,是一种小型的、由集成电路、单片机与半导体管构成的便携式通用函数信号发生器,其函数信号有正弦波、三角波、方波、锯齿波、脉冲五种不同的波形。
信号频率可调范围从0.1Hz~2MHz,分七个档级,频率段、频率值、波形选择均由LCD显示。
信号的最大幅度可达20Vp-p。
脉冲的占空比系数由10%~90%连续可调,五种信号均可加±10V的直流偏置电压。
并具有TTL电平的同步信号输出,脉冲信号反向及输出幅度衰减等多种功能。
除此以外,能外接计数输入,作频率计数器使用,其频率范围从10Hz~10MHz(50、100MHz[根据用户需要])。
计数频率等功能信息均由LCD显示,发光二极管指示计数闸门、占空比、直流偏置、电源。
读数直观、方便、准确。
二、技术要求2.1函数发生器产生正弦波、三角波、方波、锯齿波和脉冲波。
2.1.1函数信号频率范围和精度a、频率范围由0.1Hz~2MHz分七个频率档级LCD显示,各档级之间有很宽的覆盖度,如下所示:频率档级频率范围(Hz)1 0.1~210 1~20100 10~2001K 100~2K10K 1K ~20K100K 10K ~200K1M 100K ~2M频率显示方式:LCD显示,发光二极管指示闸门、占空比、直流偏置、电源。

em⼤⿏离体胸主动脉⾎管环实验⽅法介绍离体⼤⿏胸主动脉环实验⽬的:观察药物对⼤⿏离体胸主动脉⾎管环收缩活动的影响;动物:健康的SD⼤⿏,雄性,体重250~280克药品与试剂:20%氨基甲酸⼄酯,3mo1氯化钾,10-5mo1/L维拉帕⽶,0.1%苯肾上腺素,1%酚妥拉明,Krebs液,95%O2+5%CO2混合⽓体器材:HV-4/SV-4离体组织器官恒温灌流装置,超级恒温⽔浴,温度计,5g张⼒换能器,BL-420⽣物信号采集系统,⼿术剪⼑,眼科剪,眼科镊,培养⽫,烧杯,100µl、1m1移液器,棉线;⽅法:1.BL-420⽣物信号采集系统参数设置:T:DC , F:10Hz ,采样率:100Hz, 扫描速度:25s/div,放⼤倍数200~500。
2.标本制备(1)⼤⿏⽤20%氨基甲酸⼄酯按1g/kg体重腹腔注射⿇醉,剪开胸腔,迅速取出⼼脏及胸主动脉放⼊盛有4℃的混合⽓体饱和的Krebs营养液的培养⽫中,连续⽤混合⽓体充⽓。
分离出主动脉,将⾎管内的残存⾎液冲洗⼲净,⼩⼼剥去外围的结缔组织,将主动脉⼸以下的胸主动脉剪成4mm长的动脉环数段备⽤。
(2)需要保存内⽪的⾎管,动作应轻柔。
如需⽆内⽪的⾎管环,可⽤棉签或⽛签将⾎管内⽪轻轻檫去。
(3)将不锈钢三⾓钩轻轻穿⼊⾎管环,并将另⼀的三⾓形不锈钢挂钩也轻轻穿⼊,通过挂钩悬挂于浴管内,下⽅固定于固定钩上,上⽅以⼀细钢丝挂钩连于张⼒换能器,通⼊混合⽓体,调节通⽓量⾄⼀个⼀个⼩⽓泡逸出为(如下图⽰)。
浴槽内温度应保持37±0.5℃。
图1 离体主动脉⾎管环孵育测量⽅式图⽰4)⾎管环的初始张⼒前15分钟调为1g,15分钟后调⾄2g,并以此张⼒平衡60分钟。
每隔15分钟换液⼀次。
5)⽤终浓度60mmol KCL收缩⾎管环,作⽤15 min诱导⾎管环收缩,激发舒缩活性,待收缩稳定后⽤预热的Krebs洗脱,反复冲洗直⾄张⼒恢复到初始值为⽌;重复加⼊同⼀浓度KCL,连续3次,⽤Krebs液反复脱洗标本观察收缩曲线波形使其张⼒信号回复初始值。
上海离体灌流操作说明以上是关于上海离体灌流操作的详细说明。
离体灌流是一种常见的实验方法,用于研究生物体内的某种物质的作用机制。
本文将为您介绍离体灌流操作的流程和注意事项。
一、准备工作在进行离体灌流操作之前,首先需要准备以下材料和设备:1. 离体器官:可以是小鼠、大鼠、猪等动物的器官,如心脏、肾脏等。
2. 灌流液:根据实验需要选择适当的灌流液,常用的有生理盐水、Krebs液等。
3. 灌流装置:包括温控装置、泵、气体供应装置等。
二、操作流程1. 准备灌流液:按照实验需要,配制适当的灌流液。
在配制过程中要注意消毒和无菌操作,以防止污染。
2. 准备离体器官:将动物的器官取出,并迅速放入含有灌流液的容器中。
在这个过程中,要注意保持器官的完整性和无菌性。
3. 连接离体器官和灌流装置:将灌流装置的出口和入口分别连接到离体器官的动脉和静脉上。
在连接过程中,要确保连接紧密,避免泄漏。
4. 开始灌流:打开灌流装置的泵,使灌流液从入口进入离体器官,然后从出口流出。
同时,通过调节泵的流速和压力,控制灌流液的流量和压力。
5. 温控:使用温控装置,将离体器官保持在恒定的温度。
一般来说,37摄氏度是常用的温度。
6. 气体供应:根据需要,向灌流液中通入适量的氧气和二氧化碳,以保证器官的正常代谢。
三、注意事项1. 操作过程中要注意无菌操作,以防止细菌和其他微生物的污染。
2. 灌流液的配制要准确,以保证实验的可靠性和重复性。
3. 灌流液的流速和压力要适当,过高或过低都会对实验结果产生影响。
4. 离体器官的完整性和无菌性是实验成功的关键,所以在取出器官和连接器官时要小心谨慎。
5. 温度的控制要准确,过高或过低都会对实验结果产生干扰。
6. 气体供应要稳定,以保证器官的正常代谢。
7. 在实验过程中要及时观察离体器官的变化,并记录相关数据。
四、实验应用离体灌流操作广泛应用于生物医学研究领域,主要用于研究生物体内某种物质的作用机制。
通过灌流液中添加不同的药物或化学物质,观察其对离体器官的影响,可以揭示该物质对器官功能的影响机制。
北京离体灌流操作说明
离体灌流操作,有以下几步:
1.确定灌流浓度等处理条件:选择灌流溶液浓度合适;
2.准备灌流液:打开灌流液,灌入溶液,加上必要的药物;
3.安装灌流器:将灌流器的接口连接到容器,将灌流液的输出口接口连接到容器,最好把容器放入水中;
4.灌流:根据灌流液的特性,调整流量,灌流时应稳定,以免细胞受损;
5.终止灌流:当灌流结束时,关闭灌流器,拆开输出口,彻底清洗灌流器;
6.更换培养液:更换培养液,充分混匀后倒入容器;
7.处理结束:拆开所有接口,清洗容器和灌流器,最后将细胞放入饲料培养箱中。
广州离体灌流操作说明
广州离体灌流操作说明
离体灌流是一种在实验室环境下,利用设备将液体从输入部分引导到输出部分的操作过程。
它广泛应用于药物、生物学研究和化学反应等领域,帮助研究者有效地获得有用的数据。
广州离体灌流操作说明由以下几个部分组成:
1. 使用离体灌流仪器之前,必须仔细阅读操作手册,理解各个部件的功能和使用方法,并熟练掌握灌流仪器的操作方法和原理,保证安全操作。
2. 连接气源:将气源连接到离体灌流仪器卡口上,打开气源,调节气流量到正确的大小,以确保装置的正常运行。
3. 使用蠕动泵或压力控制系统:根据实验情况的不同,选择蠕动泵或压力控制系统来控制流量和压力,确保液体在设定的浓度和流量范围内循环往复。
4. 操作步骤:按照操作手册的要求,将液体加入容器,按下灌流仪器的开始键;然后在屏幕上查看浓度和流量,按需调节参数;当流量和压力达到设置值时,按下“结束”键,即可完成离体灌流操作。
5. 重复操作:离体灌流操作可以重复多次,以达到实验的目的。
6. 关闭离体灌流仪器:完成离体灌流操作后,按下“关闭”键,将气源断开,取出管道,清洗设备后,及时归位,以便下次使用。
以上就是有关广州离体灌流操作说明的介绍,本操作说明可以帮助实
验者在灌流操作中明确步骤,操作安全有序,有效获取灌流实验数据。
离体灌流操作流程
一、离体灌流操作前准备:
1、准备原料:用于离体灌流的原料要求具有良好的生物安全性,应为无菌或洗涤后的材料,如注射器、袋子、管道以及充入原料。
2、准备技术工具:操作前需要准备适当的技术工具,如手术刀、剪刀、针筒、压瘤钳等。
3、准备必要的试剂:如离体灌流所需的支架试剂、血清和独特的化学抑制剂。
4、准备观察用器械:如显微镜和光学显微镜。
5、准备记录纸:可以根据实验要求准备记录纸,并记录实验过程中的重要信息。
二、离体灌流操作流程:
1、将原料装入袋子:将所需的原料加入袋子中,如支架试剂、血清和独特的化学抑制剂等。
2、将袋子连接到注射器:将袋子通过注射器连接,使其与注射器之间形成密封连接,以便在进行离体灌流时不会漏出任何原料。
3、接通离体灌流设备:将注射器的管道连接到离体灌流设备,并调节设备的工作参数,如压力、流量等,使其符合所需的要求。
4、开始离体灌流:打开离体灌流设备的开关,根据预先设定的参数,通过离体灌流设备将原料灌入支架组织中。
5、观察实验结果:在离体灌流完成后,可以使用显微镜和光学显微镜观察实验结果,记录相关信息。
6、清理设备:清理并调整设备,以备下次使用。
三、离体灌流操作后注意事项:
1、离体灌流操作过程中,应严格按照实验要求,确保实验数据的准确性和可靠性。
2、离体灌流操作后,应及时记录相关实验数据,以便以后使用。
3、在离体灌流操作完成后,应及时清洗和消毒实验用具,以免细菌污染。
4、离体灌流操作过程中,应严格控制实验环境,确保实验数据的准确性和可靠性。