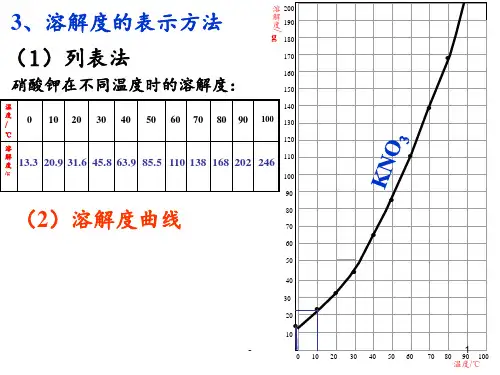
硝酸钾的溶解度曲线
- 格式:ppt
- 大小:2.31 MB
- 文档页数:18


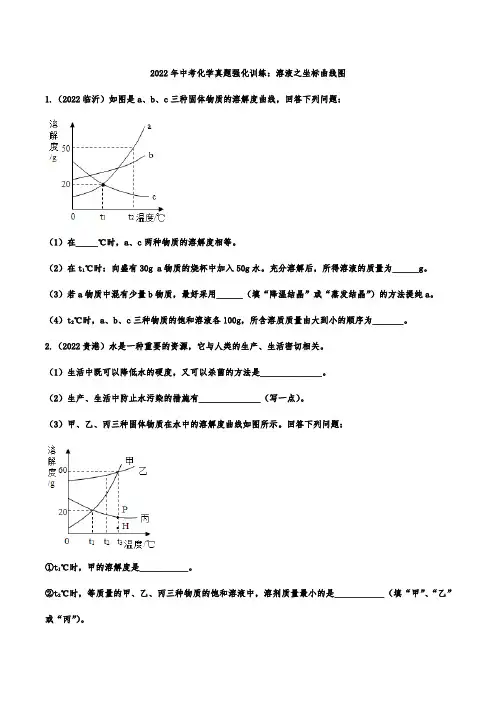
2022年中考化学真题强化训练:溶液之坐标曲线图1.(2022临沂)如图是a、b、c三种固体物质的溶解度曲线,回答下列问题:(1)在_____℃时,a、c两种物质的溶解度相等。
(2)在t1℃时:向盛有30g a物质的烧杯中加入50g水。
充分溶解后,所得溶液的质量为______g。
(3)若a物质中混有少量b物质,最好采用______(填“降温结晶”或“蒸发结晶”)的方法提纯a。
(4)t2℃时,a、b、c三种物质的饱和溶液各100g,所含溶质质量由大到小的顺序为_______。
2.(2022贵港)水是一种重要的资源,它与人类的生产、生活密切相关。
(1)生活中既可以降低水的硬度,又可以杀菌的方法是______________。
(2)生产、生活中防止水污染的措施有______________(写一点)。
(3)甲、乙、丙三种固体物质在水中的溶解度曲线如图所示。
回答下列问题:①t1℃时,甲的溶解度是___________。
②t2℃时,等质量的甲、乙、丙三种物质的饱和溶液中,溶剂质量最小的是___________(填“甲”、“乙”或“丙”)。
③乙中混有少量的甲,可用___________的方法提纯乙。
④将丙溶液由P点转化到H点的方法是____________。
3.(2022黑龙江龙东地区)水和溶液与人类的生活息息相关。
(1)①生活中常用活性炭净化水,主要利用活性炭的_____性。
②日常生活中硬水软化的方法是____。
(2)甲、乙、丙三种物质的溶解度曲线如图。
回答下列问题:①在____℃时,乙和丙的溶解度相等。
②t3℃,将35g甲加入到50g水中,所得溶液中溶质与溶剂的质量比为_____。
③t1℃,将乙溶液的状态由M点变为N点,方法是_____。
④t3℃时,甲、乙、丙三种物质的饱和溶液同时降温至t2℃时,所得溶液中溶质质量分数由大到小的顺序为_____。
4.(2022铁岭葫芦岛)如图是A、B、C三种固体物质的溶解度曲线,请回答下列问题。
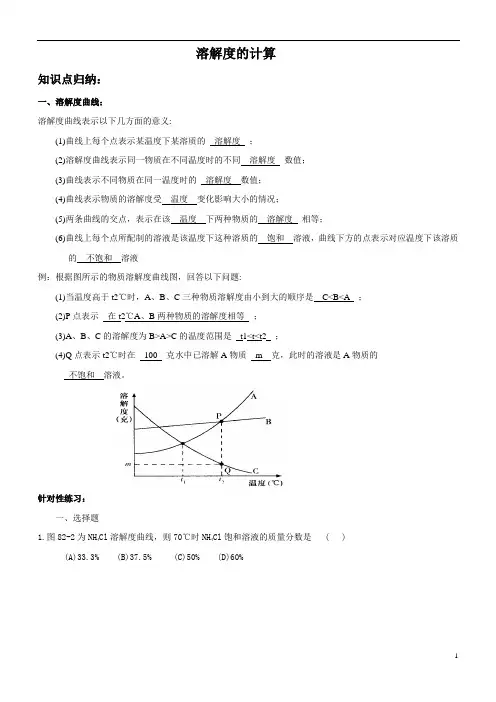
溶解度的计算知识点归纳:一、溶解度曲线:溶解度曲线表示以下几方面的意义:(1)曲线上每个点表示某温度下某溶质的溶解度;(2)溶解度曲线表示同一物质在不同温度时的不同溶解度数值;(3)曲线表示不同物质在同一温度时的溶解度数值;(4)曲线表示物质的溶解度受温度变化影响大小的情况;(5)两条曲线的交点,表示在该温度下两种物质的溶解度相等;(6)曲线上每个点所配制的溶液是该温度下这种溶质的饱和溶液,曲线下方的点表示对应温度下该溶质的不饱和溶液例:根据图所示的物质溶解度曲线图,回答以下问题:(1)当温度高于t2℃时,A、B、C三种物质溶解度由小到大的顺序是C<B<A ;(2)P点表示在t2℃A、B两种物质的溶解度相等;(3)A、B、C的溶解度为B>A>C的温度范围是t1<t<t2 ;(4)Q点表示t2℃时在100 克水中已溶解A物质m 克,此时的溶液是A物质的不饱和溶液。
针对性练习:一、选择题1.图82-2为NH4Cl溶解度曲线,则70℃时NH4Cl饱和溶液的质量分数是 ( )(A)33.3% (B)37.5% (C)50% (D)60%2.某固体物质的溶解度曲线如图82-3所示,在40℃时将75克物质放入150克水中,则溶液的质量分数是( )(A)28.6% (B)33.3% (C)40.0% (D)50.0%3.如图82-4所示,配制33.33%的NH4Cl饱和溶液的最低温度是( )(A)0℃(B)30℃(C)50℃(D)70℃4.如图82-5所示,m克KNO3的不饱和溶液,恒温蒸发水份,直到有少量晶体析出,则在此变化过程中,纵坐标溶液的质量分数(a%)与横坐标时间(t)的变化关系是 ( )5.图82-6为X和Y两种物质的溶解度曲线。
X、Y的混合溶液在100℃时都达到饱和,高温时降低到70℃时,得到的固体成分是 ( )(A)纯净的X(B)纯净的Y(C)等量的X和Y(D)大量的X和少量的Y二、填空题1.如图82-7所示:(1)在时,A和B的溶解度相等。

溶解度曲线图表题1.(2020湘潭)甲、乙、丙三种固体物质的溶解度曲线如图1所示,请回答下列问题:(1)t1℃时,甲、乙、丙三种物质中溶解度最大的是____。
(2)t2℃时,甲物质的溶解度为____g。
(3)将t2℃时的甲、乙、丙三种物质的饱和溶液降温至t1℃,所得溶液溶质质量分数由大到小的顺序为_______。
(4)如图2,t1℃时,若向烧杯中加入足量的_____(填字母序号)并使之充分溶解,在试管中可观察到有晶体析出。
A 氯化钠B 氢氧化钠C 硝酸铵【答案】丙60乙>甲>丙C【解析】(1)根据甲、乙、丙三种固体物质的溶解度曲线图,t1℃时,甲、乙、丙三种物质中溶解度最大的是丙。
(2)根据甲物质的溶解度曲线图,t2℃时,甲物质的溶解度为60g。
(3)甲、乙溶解度随温度降低而减小,丙溶解度随温度降低而增大,t2℃时溶解度关系为:甲>乙>丙,t1℃时,溶解度关系为:丙>乙>甲,将t2℃时的甲、乙、丙三种物质的饱和溶液降温至t1℃,甲、乙析出晶体得到的是饱和溶液,此温度下甲的溶解度小于乙,故乙的溶质质量分数大于甲,而丙的溶解度随温度的降低而增大,溶液组成不变,所得溶液溶质质量分数由大到小的顺序为乙>甲>丙。
(4)丙的溶解度随温度的升高而减小,则t1℃时,若向烧杯中加入足量的硝酸铵并使之充分溶解,在试管中可观察到有晶体析出,因为硝酸铵溶于水吸热使温度降低;而氯化钠溶于水温度几乎不变,氢氧化钠溶于水放热使温度升高,均不符合题意;故填:C。
2.(2020长沙)数据处理是对数据进行加工的过程,列表法和作图法是常用的数据处理方法。
请你根据图表分析:表:两种物质在不同温度时的溶解度(1)KNO3对应的是图中的_____物质。
(2)25℃时,向100g水中加入45.8g KNO3,充分搅拌后,所得的溶液是_____溶液(填“饱和”或“不饱和”)。
(3)当甲中含有少量乙时,应采用_____结晶法提纯甲。
【答案】甲饱和降温【解析】(1)由表中数据可知,硝酸钾的溶解度随温度的升高而增大,硝酸钾的溶解度受温度变化影响较大,氯化钠溶解度受温度变化影响较小,故KNO3对应的是图中的甲物质。

第2课时溶解度与溶解度曲线知能演练提升能力提升1.下列关于溶液的说法中,不正确的是()A.溶液是一种混合物,各部分性质相同B.氢氧化钠溶液能导电,是因为溶液中含有自由移动的离子C.接近饱和的硝酸钾溶液,通过蒸发溶剂或加溶质的方法都可以达到饱和状态D.20 ℃,氯化钠的溶解度为36 g,则20 ℃时100 g氯化钠饱和溶液中含有氯化钠36 g2.小龙同学在工具书中查到NaOH在水和酒精中的溶解度(见表)。
通过分析她得出以下结论,其中不正确的是()A.温度和溶剂种类对NaOH的溶解度都有影响B.NaOH易溶于水,也易溶于酒精C.40 ℃,40 g NaOH溶解在100 g酒精中达到饱和D.将等质量40 ℃的饱和NaOH水溶液和饱和NaOH酒精溶液降温至20 ℃,析出的晶体前者比后者多3.甲、乙两种物质的溶解度曲线如右图所示。
下列叙述正确的是()A.依据溶解度曲线可判断,甲的溶解度比乙的大B.将甲、乙的饱和溶液从t2℃降到t1℃,析出甲的质量大C.将t2℃时甲的饱和溶液变为不饱和溶液,可采取降温的方法D.t1℃时,甲和乙的饱和溶液各100 g,其溶质的质量一定相等4.在20 ℃时,氯化铵的溶解度为35.5 g,碳酸氢钠的溶解度为9.8 g,现将30 g氯化铵和30 g碳酸氢钠同时加入20 ℃时的100 g水中,充分搅拌,则下列有关说法错误的是()A.在20 ℃时,两种物质相比,碳酸氢钠的溶解能力较小B.未溶解的固体一定是碳酸氢钠C.形成的溶液是20 ℃时氯化铵的饱和溶液D.溶液中的溶质有两种5.右图是KNO3和NH4Cl的溶解度曲线。
下列说法正确的是()A.t1℃时,KNO3的溶解度大于NH4ClB.t2℃时,KNO3和NH4Cl的溶解度相等C.t3℃时,可采用冷却热饱和溶液的方法除去NH4Cl溶液中混有的少量KNO3D.NH4Cl的溶解度受温度的影响大于KNO36.根据下列溶解度表和溶解度曲线图回答问题。



一、饱和溶液与不饱和溶液1.饱和溶液与不饱和溶液的定义在一定温度下,向一定量溶剂里加入某液;当溶质还能继续溶解时,所得到的溶液2.对饱和溶液与不饱和溶液的理解(1)首先,要明确“一定温度”和“一定相转化的。
(2)其次,要明确“某一溶质的”饱和还能溶解KNO 3,此时的溶液是NaCl 的饱的饱和或不饱和溶液。
(3)有些物质能与水以任意比互溶3.饱和溶液与不饱和溶液的转化条件(1)一般规律:此转化条件适合大多数固体物质的溶液(2)特殊情况(如氢氧化钙):极少数物质在一定量水中溶解的最大溶液时,要升高温度;若把饱和溶液转化4.判断溶液是否饱和的方法一般地,可以向原溶液中再加入少量原继续溶解,则说明原溶液是该溶质的不饱和如果有且溶质的量不再减少,未溶解的溶质二、固体的溶解度1.定义在一定温度下,某固态物质在100 g 溶剂里度。
如果不说明溶剂,通常所说的溶解度是2.正确理解溶解度概念需要抓住的四个要(1)条件:一定温度。
因为物质的溶解度溶解度溶液加入某种溶质,当溶质不能继续溶解时,所得到的溶的溶液叫做这种溶质的不饱和溶液。
理解一定量的溶剂”。
因为改变溶剂量或温度时,饱和溶饱和溶液或不饱和溶液。
例如,在一定温度下不能再的饱和溶液,对KNO 3来说就不一定是饱和溶液了互溶,不能形成饱和溶液,如酒精没有饱和溶液。
化条件 的溶液,因为大多数固体物质在一定量水中溶解的最的最大量随温度的升高而降低(如熟石灰),此类物质转化成不饱和溶液,要降低温度。
少量原溶质,如果不能继续溶解,说明原溶液是该溶不饱和溶液。
或者在一定温度下,看该溶液中有没有不的溶质与溶液共存,那么这种溶液就是这种溶质的饱溶剂里达到饱和状态时所溶解的质量,叫做这种固态度是指物质在水里的溶解度。
四个要点溶解度随温度的变化而变化,所以不指明温度时,溶解到的溶液叫做这种溶质的饱和溶饱和溶液与不饱和溶液是可以互不能再溶解NaCl 的溶液,可能液了。
因此必须指明是哪种溶质解的最大量随温度升高而增大。

溶解度曲线知识归纳
一、点的意义
1.溶解度曲线上的点表示某物质在该点所对应温度下的溶解度,溶液所处的状态是饱和状态。
2.溶解度曲线以下区域内的任一点,表示溶液所处的状态是不饱
和状态,依其数据配制的溶液为对应温度时的不饱和溶液。
3.溶解度曲线以上区域内的任一点,表示溶液所处的状态是饱和
状态,依其数据配制的溶液为对应温度时的饱和溶液,且该溶质有
剩余。
4.两条溶解度曲线的交点,表示在该点所对应温度下两种物质的
溶解度相等。
二、变化规律
1.大多数固体物质的溶解度随温度的升高而增大,曲线为“陡升
型”,如硝酸钾。
2.少数固体物质的溶解度受温度的影响很小,曲线为“缓升型”,如氯化钠。
3.极少数固体物质的溶解度随温度的升高而减小,曲线为“下降
型”,如氢氧化钙。
4.气体物质的溶解度均随温度的升高而减小(横坐标表示温度,纵坐标表示体积),曲线为“下降型”如氧气;气体物质的溶解
度均随压强的增大而增大,如二氧化碳,曲线为“上升型”。
三、应用
1.查找指定温度时物质的溶解度,并根据溶解度判断溶解性。
2.比较相同温度时(或一定温度范围内)不同物质溶解度的大小。
3.比较和确定物质的溶解度受温度影响的程度,并据此确定物质
结晶或混合物分离提纯的方法。
4.确定溶液的状态(饱和与不饱和)。
1∕1。
质壁分离曲线和硝酸钾溶液曲线概述说明以及解释1. 引言1.1 概述质壁分离曲线和硝酸钾溶液曲线是化学实验中常用的重要工具,在不同领域具有广泛的应用。
质壁分离曲线是一种用于分析物质特性和测定其含量的方法,通过观察物质在不同条件下与另一物质之间的相互作用,可以得到一条特定形状的曲线。
而硝酸钾溶液曲线则是一种浓度与反应速率之间关系的图形表示,通过改变硝酸钾溶液的浓度,我们可以获得不同浓度下反应速率的数据点。
1.2 文章结构本文将首先介绍质壁分离曲线及其基本原理、测定方法和应用领域。
接着将详细讨论硝酸钾溶液曲线以及硝酸钾的特性和用途,并解释其构建过程以及相应的解释与分析。
然后,我们将比较和对比这两种曲线之间的相似之处和差异之处,并探讨它们在实际应用中选择依据的问题。
最后,我们将总结质壁分离曲线和硝酸钾溶液曲线的重要性及应用价值,并给出对未来相关研究的展望和建议。
1.3 目的本文的目的是深入探讨质壁分离曲线和硝酸钾溶液曲线的概念、原理、方法和应用,帮助读者更好地理解和使用这两种工具。
同时,通过比较与对比这两种曲线之间的异同,我们将为读者提供在实际应用中选择合适方法的依据。
最后,本文还将展望未来相关研究领域,为科学家们提供进一步研究质壁分离曲线和硝酸钾溶液曲线的方向和建议。
2. 质壁分离曲线:2.1 定义和原理:质壁分离曲线是一种用于描述溶液中可溶物质与不可溶固体之间分离行为的曲线。
在溶液中,当饱和度达到一定程度时,可溶物质会逐渐从溶液中析出形成不可溶固体,称为沉淀。
质壁分离即指沉淀物与容器壁之间的分离过程。
该曲线可以用来研究和掌握溶解度、沉淀速率以及影响这些因素的各种因素。
在实验室和工业生产中,通过构建质壁分离曲线可以确定最佳操作条件以提高沉淀效率。
2.2 测定方法:测定质壁分离曲线需要进行以下步骤:1)准备一系列浓度已知的试剂液;2)将试剂液缓慢添加到容器中;3)记录每次添加后的时间以及对应的沉淀量或浊度;4)根据记录的数据绘制图表,得到质壁分离曲线。
备战2020中考化学知识点归类训练——溶解度知识点一:溶解度1.增加二氧化碳在水中的溶解度,可行的操作是( )A.升温B.加压C.增加水量D.不断通入二氧化碳2.生活中的下列现象,能说明气体的溶解度随压强变化而变化的是( )A.夏天,鱼塘中的鱼常常会浮在水面呼吸B.烧开水时,沸腾前水中有气泡产生C.打开饮料瓶盖会有大量气泡冒出D.喝了汽水以后,常常会打嗝3.打开汽水瓶盖,有大量气体逸出,下列说法不正确的是( )A.溶质减少B.溶解度减小C.浓度减小D.饱和溶液变成不饱和溶液4.判断下列说法中正确的是( )A.20℃时,100 g水里最多溶解36 g氯化钠,所以20℃时氯化钠的溶解度为36 gB.硝酸钾的溶解度为31.6 gC.20℃时,在100 g水中加入35 g氯化钠完全溶解,则20℃时氯化钠的溶解度为35 gD.20℃时,100 g氯化钠的饱和溶液中有27 g氯化钠,则20℃时氯化钠的溶解度为27 g5.将2.5 g硼酸在20℃时溶于50 g水中即达到饱和,则一般把这种物质的溶解性划分为( )A.易溶物质B.可溶物质C.微溶物质D.难溶物质6. 25℃时,50 g水中最多可溶10 g A,30℃时,50 g水中最多可溶15 g B,则A、B溶解度比较为( )A.无法比较B.A大于BC.A小于BD.A等于B7.20℃时,氯化钠的溶解度为36 g。
将40 g氯化钠放入100 g水中,所得氯化钠溶液的质量是多少( )A.40 gB.140 gC.136 gD.100 g8.下列加速物质溶解措施中,能改变固体溶解度的是( )A.加热B.搅拌C.振荡D.把固体研细9.某温度时,将10 g饱和氯化钾溶液蒸干,得氯化钾晶体2 g,则氯化钾在此温度下的溶解度为( )A.10 gB.2 gC.20 gD.25 g10.控制变量法是科学探究中常用的方法之一。
(1)在探究固体物质的溶解度时,需要考虑的因素有①溶质的种类;②溶剂的种类;③溶质最多被溶解的质量;④溶剂的质量;⑤温度。
巧用溶解度曲线在九年级化学第九单元第 2 课题中溶解度曲线是反应溶解度与温度数学表示法,是溶解度曲线概念直观形象的表达方式。
利用溶解度曲线可以解决很多的问题技巧一:溶解度曲线是一条饱和线。
通过点与曲线的位置关系,判断溶液的的状态。
1、线上方的点表示该温度下该溶液为饱和溶液且有固体存在。
2、线下方的点表示该温度下该溶液为不饱和溶液。
3、线上的点表示该游弋上该溶液恰好为饱和溶液。
技巧二:将溶液升温或降温,可在图上将点平移。
通过点与线的位置判断溶液的状态变化,质量分数的变化以及是否有晶体析出。
(归纳为5个字,就低不就高)1、某温度下将溶升温。
在图象上把表示该溶液的点向右平移。
2、某温度下将溶降温。
在图象上把表示该溶液的点向左平移。
技巧三:通过曲线趋势,选择饱和溶液和不饱和溶液的相互转化措施(特别是升温或降温),以及混合物分离的方法(蒸发结晶或降温结晶)技巧四:通过点的位置(高低),比较不同温度,不同状态下溶液的质量分数的大小。
1、同一温度下,某物质的饱和溶液的质量分数比其不饱和溶液的质量分数要大。
(同温下饱和溶液的质量分数最大)。
×100%,溶解度S越大质量分数越大。
(质量分数最大的2、某温度下某饱和溶液的质量分数=S100g+S是该温度下的饱和溶液)特殊点的处理方法:溶解度曲线是一笨拙饱和线,线上方的点表示的溶液的质量分数与该温度下的饱和溶液的质量分数相等。
(等效法)×100%3、线上的点及线下的点表示的溶液的质量分数=S纵S纵+100g技巧引入:例:已知:40℃时氯化钾的溶解度为40g,其含义为。
(1)在40℃时,向100g水中加入20gKCl,搅拌至完全溶解,形成溶液A,此时,溶液A中KCl的质量分数为,溶液为(填“饱和”或“不饱和”)。
(2)在40℃时氯化钾的饱和溶液B的质量分数为。
(3)在40℃时,向100g水中加入50g氯化钾,充分搅拌形成溶液C。
此时溶液C中氯化钾的质量分数为。
人教版九年级化学全一册第九单元溶液1.(2021湖南邵阳中考)下列有关溶液的说法错误的是()A.溶液是均一、稳定的混合物B.溶液中的溶质可以是固体、液体或气体C.饱和溶液一定是浓溶液,不饱和溶液一定是稀溶液D.洗涤剂能洗去衣服上的油污,原因是洗涤剂具有乳化作用答案:C2.(2021江苏连云港中考)向盛有等质量水的甲、乙、丙三个烧杯中分别加入15 g、30 g、30 g蔗糖固体,充分搅拌后静置,现象如图所示。
下列说法正确的是()A.可采用升温的方法使乙烧杯中剩余的固体溶解B.甲、丙烧杯中的溶液一定属于不饱和溶液C.乙、丙烧杯中溶质的质量分数相等D.蔗糖的溶解度随温度的升高而减小答案:A3.(2020贵州毕节中考)下列关于如图所示实验的相关判断错误的是()A.固体X可能是NaOHB.固体X可能是NH4NO3C.Ca(OH)2的溶解度:①>②D.Ca(OH)2的质量分数:①=③答案:B4.(2019四川自贡中考)实验室用氯化钠固体配制100 g溶质质量分数为8%的氯化钠溶液,下列说法中错误的是()A.实验的步骤为计算、称量、量取、溶解B.量取水时,用规格为100 mL的量筒C.若用量筒量取水时俯视凹液面的最低处,则配制溶液的质量分数小于8%D.溶解过程中玻璃棒搅拌的作用是加快氯化钠的溶解答案:C5.(2020山东威海中考)氢氧化钠和碳酸钠的溶解度如表所示。
下列有关分析和推理不正确的是()A.氢氧化钠易溶于水和酒精B.温度相同,同种物质在不同溶剂中溶解度不同C.40 ℃碳酸钠饱和水溶液中溶质质量分数为49%D.20 ℃时,将足量二氧化碳通入饱和氢氧化钠酒精溶液中,溶液变浑浊答案:C6.(2019浙江金华中考)甲是60 ℃的蔗糖溶液,按如图所示进行操作。
以下分析错误的是()A.甲一定是不饱和溶液B.丙和丁一定是饱和溶液C.乙的溶质质量分数一定比甲大D.甲和丙的溶质质量分数一定不相等答案:D7.(2021青海中考)硝酸钾的溶解度曲线如图所示,将100 g 60 ℃的硝酸钾饱和溶液分别进行如下操作,所得溶液与原溶液相比,变化结果全部正确的是()答案:C8.(2019天津中考)溶液与人类生产、生活密切相关。