相平衡与相图原理
- 格式:pptx
- 大小:1.40 MB
- 文档页数:55



第六章相平衡§6-1 相律1.基本概念(1)相和相数相:系统中物理性质和化学性质完全相同的均匀部分称为相,系统中相数目为相数。
相数用“P”表示。
相的确定:气体:无论有多少种物质都为一相液体:根据相互的溶解性可为一相、二相、三相固体:由固体的种类及晶型决定(固熔体除外)(2)自由度和自由度数自由度:能够维系系统原有相数,而可以独立改变的变量叫自由度,这种变量的数目叫做自由度数,用“F”表示。
说明:a)在一定范围内,任意改变F不会使相数改变。
b)自由度数和系统内的物种数和相数有关。
2.相律物种数:系统中所含独立物质的数目,用“S”表示。
依据:自由度数=总变量数-非独立变量数=总变量数-方程式数相律表达式:F = C – P + 2式中C = S –R- R’称组分数R 独立反应的方程式数R’独立限制条件3.几点说明(1) 每一相中均含有S种物质的假设,不论是否符合实际,都不影响相律的形式。
(2) 相律中的2表示整体温度、压强都相同。
(3) F = C – P + 2是通常的形式。
(4) 凝聚相系统的相律是F = C – P + 1§6.2单组分系统相图相图:表示相平衡系统的组成与温度、压力之间的图形。
单组分系统一相:P=1 则F=1-1+2=2(T,P)双变量系统二相:P=2 则F=1-2+2=1(T或P)单变量系统三相:P=3 则F=1-3+2=0 无变量系统1.水的相平衡实验数据由数据可得:(1)水与水蒸气平衡,蒸气压随温度的升高而增大;(2)冰与水蒸气平衡,蒸气压随温度的升高而增大;(3)冰与水平衡,压力增大,冰的熔点降低;(4)在0.01℃和610Pa下,冰、水和水蒸气共存,三相平衡。
2. 水的相图单相区:液态水,水蒸气,冰双相线:OA —液固共存线,冰的熔点曲线OB —气固共存线,冰的饱和蒸气压曲线OC —气液共存线,水的饱和蒸气压曲线三相点:冰、水和水蒸气共存相图的说明(1) 冰在熔化过程中体积缩小,故水的相图中熔点曲线的斜率为负,但大多数物质熔点曲线的斜率为正。

第五章相律与相图5.1 相平衡相平衡是热力学在化学领域中的重要应用,也是化学热力学的主要内容之一。
在第三章中已经应用热力学原理研究了纯物质系统的两相平衡;在第四章中研究了多组分系统的两相平衡,其结果是用热力学公式表达相平衡的规律。
而本章则是应用热力学原理采用图解的方法来表达相平衡规律,特别是对多相系统的相平衡规律的研究,用图解的方法更显得方便和实用。
研究多相系统的相平衡状态随组成、温度、压力等变量的改变而发生变化,并用图形来表示系统相平衡状态的变化,这种图称为相图,相图形象而直观地表达出相平衡时系统的状态与温度、压力、组成的关系。
相律为多相平衡系统的研究建立了热力学基础,是物理化学中最具有普遍性的规律之一,它讨论平衡系统中相数、独立组分数与描述该平衡系统的变数之间的关系,并揭示了多相平衡系统中外界条件(温度、压力、组成等)对相变的影响。
虽然相律不能直接给出相平衡的具体数据,但它能帮助我们从实验数据正确地画出相图,可以帮助我们正确地阅读和应用相图。
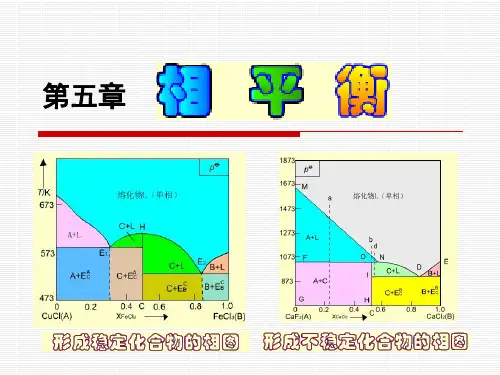
本章首先介绍相律,然后介绍单组分、二组分和三组分系统的最基本的几种相图,其中着重介绍二组分气-液相图和液-固相图,介绍相图的制法和各种相图的意义以及它们和分离提纯方法之间的关系。
应用:a、水泥熟料的烧成过程,系统中有C3S(硅酸三钙)、C2S(硅酸二钙)、C3A(铝酸三钙)、C4AF(铁铝酸四钙)————固相,还有一定的液相,是一个多相的系统。
随着温度升高,这个多相系统中那些相能继续存在?那些相会消失?有没有新的相生成?各相组成如何?各相含量为多少?b、在化工生产中对原料和产品都要求有一定的纯度,因此常常对原料和产品进行分离和提纯。
常用的分离提纯的方法是结晶、蒸馏、萃取和吸收等等,这些过程的理论基础就是相平衡。
相图:根据多相平衡的实验结果,可以绘制成几何图形用来描述这些在平衡状态下的变化关系,这种图相成为相图。
现实意义:水泥、玻璃、陶瓷等形成过程均在多相系统中实现,都是将一定配比的原料经过锻烧而形成的,并且要经历多次相变过程。




第六章相平衡内容提要:本章系统阐述相图的基本原理并结合实际介绍了相图在无机非金属的研究和生产实践中的具体应用。
硅酸盐系统中的组分、相及相律:相——体系中具有相同物理与化学性质的均匀部分的总和称为相。
组元——系统中每一个能单独分离出来并独立存在的化学均匀物质称为物种或组元。
独立组元数——决定一个相平衡系统的成分所必需的最少物种(组元)数成为独立组元数。
独立组元数=物种数-独立化学平衡关系式数自由度——在一定范围内可以任意改变而不引起旧相消失或新相产生的独立变数称为自由度。
相律数学式为:-F+=PnC式中P——系统平衡时的相数;F——独立可变数的数目即自由度;C——独立组元数即组分数;n——外界因素的独立变量。
如果外界因素只有温度和压力影响时,相律关系式为2F,对于凝聚体C+-=P系(不考虑压力)相律为:1+FC=P-凝聚系统相图测定方法:1、淬冷法(静态法)在高温充分保温的试样迅速掉入淬冷容器,然后用X射线、电子显微镜等对试样进行物相鉴定。
当试验点足够多,温度与组成间隔小时能获得准确的结果。
这是凝聚系统相图测定的主要方法,缺点是工作量相当大。
2、热分析法(动态法)冷却曲线法系通过测定系统冷却过程中的温度-时间曲线、并通过曲线的连续、转折或水平段出现的温度来确定相变化。
差热曲线法试用于相变热效应小的试样,其原理是将被测试样及惰性参比物放在相同热环境中,以相同速率升温,当试样有相变而产生热效应时与参比物之间产生的温差用差热电偶检测,根据差热曲线峰或谷的位置判断试样发生的相变温度。
三元系统相平衡基本原理:组成表示法:用等边三角形表示三元系统中各组成相对含量,此三角形称为组成三角形或浓度三角形。
等含量规则:平行于浓度三角形某一边的直线上的各点,都含有等量的对面顶点组元。
等比例规则:浓度三角形一顶点和对边上任一点的连线上各点的体系中其它两个组元的含量比值不变。
背向规则:如果从三个组元的混合物中不断取走C组元,那么这个系统的组成点将沿通过C的射线并朝着背离C的方向而变化。

