2017士兵军校考试之军考化学:物质的量的定义
- 格式:docx
- 大小:16.38 KB
- 文档页数:2

高一化学物质的量知识点一、化学物质的量的概念化学物质的量是用来表示物质数量的物理量,通常用摩尔(mol)来表示。
化学物质的量与物质的质量之间存在着一定的关系,化学物质的量的单位摩尔是国际通用的。
二、摩尔质量摩尔质量是指一个物质中含有的质量与该物质的摩尔数之间的比值。
摩尔质量的单位为克/摩尔(g/mol)。
计算摩尔质量的方法是将该物质的相对原子质量(或相对分子质量)的数值与单位g/mol相乘。
三、摩尔体积摩尔体积是指在一定条件下(通常是常温常压下),一个物质的摩尔数所占据的体积。
摩尔体积的单位为升/摩尔(L/mol)。
四、摩尔浓度摩尔浓度是指溶液中溶质的摩尔数与溶液体积的比值。
摩尔浓度的单位为摩尔/升(mol/L)。
计算摩尔浓度的方法是将溶质的摩尔数除以溶液的体积。
五、摩尔分数摩尔分数是指在混合物中,某一组分的摩尔数与所有组分的摩尔数之比。
摩尔分数没有单位,通常用小数表示。
计算摩尔分数的方法是将某一组分的摩尔数除以所有组分的摩尔数之和。
六、化学方程式中的物质的量关系在化学方程式中,各个物质之间的摩尔比可以根据化学方程式的系数得到。
化学方程式中的系数表示各个物质的物质的量比例。
七、气体的物质的量与体积的关系根据理想气体状态方程PV=nRT(P为压强,V为体积,n为物质的量,R为气体常数,T为温度),在一定条件下,气体的物质的量与体积成正比。
当温度和压强一定时,气体的物质的量增加,体积也会增加。
八、物质的量在化学反应中的应用化学反应中,反应物与生成物之间的物质的量是按照化学方程式的摩尔比关系进行反应的。
根据化学方程式中的系数,可以计算出反应物与生成物的物质的量之间的关系,从而进行计量。
九、摩尔计算在化学实验和计算中,常常需要根据物质的质量、体积或摩尔浓度等信息计算出物质的物质的量。
根据摩尔质量、摩尔体积、摩尔浓度等的定义和计算方法,可以进行摩尔计算。
总结:化学物质的量是用来表示物质数量的物理量,摩尔是化学物质的量的单位。

物质的量所有公式
1物质的量
物质的量是指物质的定义特性之一,可以衡量物质的总量,以及量的大小。
物质的量用数学和物理学的术语来表示,这是物质的基本性质和特性。
使用“量”一词,这一概念有一些不同的含义:它可以是物质的总量,物质相对于某一参照物的量,物质总量比以及物质总量的变化。
2常见公式
1.物质的总量公式:物质总量=比例(物质单位)×数量(物质单位)
2.比例公式:物质的比例=物质总量÷物质数量
3.物质总量比公式:物质总量比=比较物质总量÷参照物质总量4.物质总量变化公式:物质总量变化=(末总量-初总量)÷初总量
3工程应用
物质的量在学术领域中有重要的工程应用,如在化学、气体动力学、水资源管理、能源管理、材料数据处理等领域。
物质总量的计算可以用来比较不同时间或不同环境的物质量。
它也可以用于推算物质的密度和浓度。
此外,可以使用物质总量公式来确定物质的比例关系,从而正确设计工程和实验,改善工程和实验的可重复性。
4结论
物质的量是物质的基本性质和特性,使用相关公式可以计算出物质总量、比例、总量比和总量变化,并且推算物质的密度和浓度,物质总量的计算可以用来比较不同时间和环境的状态,有重要的工程应用。

物质的量换算公式一、引言物质的量是化学中的重要概念,它是描述物质数量大小的物理量。
在化学反应中,我们经常需要进行物质的量换算。
本文将介绍物质的量的换算公式及其应用。
二、物质的量的定义物质的量是指物质中含有的粒子数目。
在化学中,常用的物质的量单位是摩尔(mol)。
1摩尔(mol)定义为包含6.022×10^23个粒子的物质的量,这个数目也被称为阿伏伽德罗常数(Avogadro's constant)。
三、物质的量和质量的换算物质的量和质量是两个不同的物理量,但它们之间存在一定的关系。
根据物质的量与质量之间的关系,我们可以通过下面的公式进行换算:物质的量(mol)= 质量(g)/ 相对分子质量(g/mol)其中,相对分子质量是指一个分子的质量相对于碳-12同位素的质量的比值。
通过相对分子质量,我们可以计算出一摩尔物质的质量。
四、物质的量和体积的换算在化学实验中,我们经常需要将物质的量换算为体积。
这个换算涉及到气体的状态方程。
根据理想气体状态方程,我们可以得到以下公式:物质的量(mol)= 气体体积(L)/ 气体的摩尔体积(L/mol)其中,气体的摩尔体积是指在标准温度和压力下,1摩尔气体所占据的体积,近似为22.4升。
通过这个公式,我们可以将气体的体积转换为物质的量。
五、物质的量和溶质的换算在溶液中,我们常常需要将溶质的质量换算为物质的量。
这个换算涉及到溶液的浓度。
根据溶液的质量浓度公式,我们可以得到以下公式:物质的量(mol)= 溶质的质量(g)/ 溶液的质量浓度(g/L)通过这个公式,我们可以计算出溶液中溶质的物质的量。
六、物质的量和反应的换算在化学反应中,我们常常需要根据反应物的物质的量计算生成物的物质的量。
这个换算涉及到化学方程式中的化学计量比。
根据化学方程式中的化学计量比,我们可以得到以下公式:物质的量(mol)= 反应物的物质的量(mol)× 反应物的化学计量比 / 生成物的化学计量比通过这个公式,我们可以根据反应物的物质的量计算生成物的物质的量。

一. For personal use only in study and research; not for commercial use二.三. 知识梳理1.物质的量概念:物质的量是一个物理量,表示含有 的集合体。
符号为n 。
2.单位: 。
3. 阿伏加德罗常数概念:国际上规定,1mol 粒子集体所含有的粒子数与0.012kg 12C 中所含有的碳原子数相同,约为6.02×1023,所以6.02×1023mol-1叫做阿伏加德罗常数。
4.注:(1)我们把含有 个粒子数的任何粒子集合体都称为1mol 。
物质的量(n ),阿伏加德罗常数与粒子数(N )之间的关系为:n=N NA5.摩尔质量的概念:单位物质的量的物质所具有的质量叫摩尔质量。
6.定义式:摩尔质量(M )=物质的质量(m )物质的量(n ),即M=m n 7.气体的摩尔体积: 叫做气体摩尔体积。
符号Vm 单位为L/mol8.定义式:Vm=V n9.物质的量浓度的概念:单位体积溶液里所含溶质B 的物质的量,也称为 。
9.定义式:CB=nB V 单位为mol/L10.阿伏加德罗定律:同温同压下,相同体积的任何气体都含有相同数目的分子。
注:(1)阿伏加德罗定律仅适用于气体,可以是单一的气体,也可以为混合气体。
(2)阿伏加德罗定律的条件是三个“同”,只有在同温、同压、同体积的条件下,才有分子数目相等这一结论。
11. 阿伏加德罗定律推论(1)同温同压下,气体的体积之比等于其物质的量之比。
(2)同温同体积下,气体的压强之比等于其物质的量之比。
(3)同温同压下,相同体积的任何气体的质量之比,等于其摩尔质量之比。
(4)同温同压下,任何气体的密度之比等于其摩尔质量之比。
(5)同温同物质的量的气体,压强之比等于体积的反比。
11.物质的量浓度和溶质的质量分数的换算:设溶液体积为1L,溶液的密度为pg/ml ,溶质的质量分数为w(1) 溶质的质量m=1L ×1000ml/L ×pg/ml=1000pw g(2) 溶质的物质的量n=m M =1000PW M mol(3) 溶质的物质的量浓度:C= n V =1000pw M 1L =1000pw M mol/L12.标准状况下气体摩尔体积的计算(1)摩尔质量与气体摩尔体积的关系:M=Vm ·p g/L=22.4P g/mol(2)物质的量与气体摩尔体积的关系:n=V L 22.4L/mol =V 22.4mol(3)气体质量与气体摩尔体积的关系:m=n ·M=V Vm ·M(4)气体分子数与气体摩尔体积的关系:N=n ·NA=V Vm ·NA二.课前热身1.(08四川卷)下列说法中不正确的是( )。

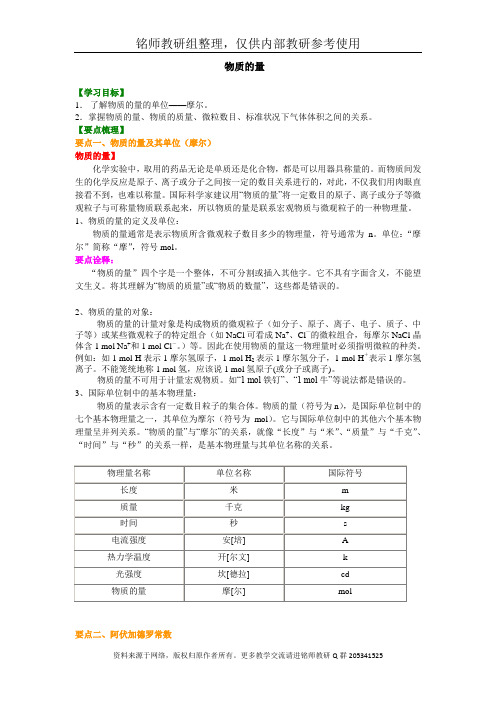
物质的量【学习目标】1.了解物质的量的单位——摩尔。
2.掌握物质的量、物质的质量、微粒数目、标准状况下气体体积之间的关系。
【要点梳理】要点一、物质的量及其单位(摩尔)物质的量】化学实验中,取用的药品无论是单质还是化合物,都是可以用器具称量的。
而物质间发生的化学反应是原子、离子或分子之间按一定的数目关系进行的,对此,不仅我们用肉眼直接看不到,也难以称量。
国际科学家建议用“物质的量”将一定数目的原子、离子或分子等微观粒子与可称量物质联系起来,所以物质的量是联系宏观物质与微观粒子的一种物理量。
1、物质的量的定义及单位:物质的量通常是表示物质所含微观粒子数目多少的物理量,符号通常为n。
单位:“摩尔”简称“摩”,符号mol。
要点诠释:“物质的量”四个字是一个整体,不可分割或插入其他字。
它不具有字面含义,不能望文生义。
将其理解为“物质的质量”或“物质的数量”,这些都是错误的。
2、物质的量的对象:物质的量的计量对象是构成物质的微观粒子(如分子、原子、离子、电子、质子、中子等)或某些微观粒子的特定组合(如NaCl可看成Na+、Cl—的微粒组合,每摩尔NaCl晶体含1 mol Na+和1 mol Cl-。
)等。
因此在使用物质的量这一物理量时必须指明微粒的种类。
例如:如1 mol H表示1摩尔氢原子,1 mol H2表示1摩尔氢分子,1 mol H+表示1摩尔氢离子。
不能笼统地称1 mol氢,应该说1 mol氢原子(或分子或离子)。
物质的量不可用于计量宏观物质。
如“1 mol铁钉”、“1 mol牛”等说法都是错误的。
3、国际单位制中的基本物理量:物质的量表示含有一定数目粒子的集合体。
物质的量(符号为n),是国际单位制中的七个基本物理量之一,其单位为摩尔(符号为mol)。
它与国际单位制中的其他六个基本物理量呈并列关系。
“物质的量”与“摩尔”的关系,就像“长度”与“米”、“质量”与“千克”、“时间”与“秒”的关系一样,是基本物理量与其单位名称的关系。
《化学中常用的物理量》物质的量定义解析《化学中常用的物理量——物质的量定义解析》在化学的世界里,物质的量是一个极其重要的概念,它就像是一座桥梁,连接着微观粒子的世界和宏观可测量的世界。
要真正理解化学这门学科,搞清楚物质的量的定义是关键的一步。
那到底什么是物质的量呢?简单来说,物质的量是表示含有一定数目粒子的集合体的物理量。
这听起来可能有点抽象,让我们来把它拆解一下。
想象一下,我们面前有一堆沙子。
如果我们一粒一粒地去数沙子,那几乎是不可能完成的任务,而且也没有太大的实际意义。
但是,如果我们把一定数量的沙子看作一个整体,比如一千粒沙子算作一堆,那么我们就可以通过数“堆”的数量,来更方便地描述沙子的多少。
在化学中,物质的量就起到了类似“堆”的作用。
我们用“摩尔”这个单位来衡量物质的量。
一摩尔任何粒子所含的粒子数都约等于 602×10²³个,这个数值被称为阿伏伽德罗常数。
为什么会有这样一个特定的数值呢?这是经过科学家们的大量实验和研究得出的结论。
比如说,我们拿氧气分子(O₂)来说。
如果我们说有 1 摩尔的氧气分子,那就意味着我们拥有约 602×10²³个氧气分子。
同样,如果是2 摩尔的氧气分子,那就是约2×602×10²³个氧气分子。
通过物质的量,我们可以在宏观可测量的质量、体积等与微观的粒子数目之间建立起联系。
再举个例子,水(H₂O)。
我们知道一个水分子由两个氢原子和一个氧原子组成。
当我们说有 05 摩尔的水时,就知道其中含有的氢原子的物质的量是 1 摩尔,氧原子的物质的量是 05 摩尔。
这样,通过物质的量,我们就能很清晰地了解不同原子在一定量的物质中所占的比例和数量。
物质的量的定义对于化学反应的研究也具有重要意义。
在化学反应中,各种粒子按照一定的比例相互作用。
通过物质的量,我们可以准确地表示出反应中各物质的比例关系,从而进行定量的计算和分析。
《物质的量》讲义一、什么是物质的量在化学的世界里,我们经常需要处理各种各样的物质以及它们之间的反应。
为了更方便、更准确地描述和研究物质之间的数量关系,科学家们引入了一个非常重要的概念——物质的量。
物质的量就像是一个特殊的“尺子”,用来衡量微观粒子的集合体。
微观粒子包括分子、原子、离子、电子等等。
这些粒子非常小,我们很难一个一个去数清楚,而物质的量就是帮助我们解决这个难题的工具。
它的单位是摩尔(mol)。
一摩尔任何物质所含的粒子数都等于阿伏伽德罗常数,约为 602×10²³个。
这就好比我们说一打鸡蛋是 12 个,一摩尔粒子就是约 602×10²³个。
举个例子,1mol 氧气,就意味着含有约 602×10²³个氧分子。
二、物质的量与粒子数的关系物质的量(n)、粒子数(N)和阿伏伽德罗常数(NA)之间存在着一个简单而重要的关系:N = n × NA。
这就像是一个数学公式,通过它,我们可以在已知其中两个量的情况下,求出第三个量。
比如说,如果我们知道某种物质的粒子数是 1204×10²⁴个,那么它的物质的量就是:n = N/NA = 1204×10²⁴ ÷ 602×10²³ mol⁻¹= 2 mol反过来,如果我们知道某种物质的物质的量是 05 mol,那么它所含的粒子数就是:N = n × NA = 05 mol × 602×10²³ mol⁻¹= 301×10²³个三、物质的量与质量的关系物质的量不仅与粒子数有关,还与物质的质量有着密切的联系。
对于任何一种物质,其物质的量(n)、质量(m)和摩尔质量(M)之间的关系可以用公式表示为:n = m/M 。
2017士兵军校考试之军考化学:物质的量的定义
化学基本概念是军考化学中的知识基础,学好化学需要大家打牢基础,记熟记忆。张为
臻老师说对于这一基础的学习要做到:一、了解分子、原子、离子、原子团等概念的含义;
二、理解物理变化与化学变化的区别与联系;三、理解混合物和纯净物、单质和化合物、金
属和非金属的概念;四、理解酸、碱、盐、氧化物的概念及其相互联系。物质的量是国际单
位制中7个基本物理量之一,记熟并应用它是化学中考试解题时用到的重要数据。
物质的量是国际单位制中7个基本物理量之一(7个基本的物理量分别为:长度(单位:
m)、质量(单位:kg)、时间(单位:s)、电流强度(单位:A)、发光强度(单位:cd)、温度(单
位:K)、物质的量(单位:mol),它和“长度”,“质量”,“时间”等概念一样,是一个
物理量的整体名词。其符号为n,单位为摩尔(mol),简称摩。物质的量是表示物质所含微
粒数(N)(如:分子,原子等)与阿伏加德罗常数(NA)之比,即n=N/NA。阿伏伽德罗常数的数
值为0.012kg12C所含碳原子的个数,约为6.02×1023。它是把微观粒子与宏观可称量物质
联系起来的一种物理量。其表示物质所含粒子数目的多少。物质的量是一个物理量,它表示
含有一定数目粒子的集合体,符号为n。物质的量的单位为摩尔,简称摩,符号为mol。国
际上规定,1mol粒子集体所含的粒子数与0.012kg碳12中含有的碳原子数相同。
基本符号
物质的量——n 物质的质量——m
摩尔质量——M 粒子数(微粒的个数)——N
阿伏伽德罗常数——NA 相对原子质量——Ar
相对分子质量——Mr 质量分数——w
气体摩尔体积——Vm——L/mol——22.4L/mol(在标准状况下,即在0℃101千帕的条件
下)
物质的量浓度——CB(B在C的右下角)——mol/L
物质的量(mol)=物质的质量(g)/物质的摩尔质量(g/mol)
以单位体积溶液里所含溶质B(B表示各种溶质)的物质的量来表示溶液组成的物理量,
叫做溶质B的物质的量浓度。
常用单位:mol/L或mol/m3。
气体的体积V=物质的量(mol)x气体摩尔体积(Vm)