高中化学有机化学基础同步练习19醇的性质和应用
- 格式:doc
- 大小:54.00 KB
- 文档页数:3

1. 酒后驾车是引发交通事故的重要原因。
交警对驾驶员进行呼气酒精检测的原理是:橙色的K2Cr2C7酸性水溶液乙醇迅速生成蓝绿色Cr3+。
下列对乙醇的描述与此测定原理有关的是()①乙醇沸点低②乙醇密度比水小③乙醇有还原性④乙醇是烃的含氧化合物A.②④B.②③C.①③D.①④答案:C解析:①③符合题意题干评注:醇的化学性质及用途问题评注:醇的化学反应主要是由官能团羟基(—OH)决定。
醇的大部分反应都涉及O—H 键和C—O键的断裂,还有C—O键和βC—H键同时断裂的脱水反应、氧化还原反应等。
2. 向盛有无水乙醇的烧杯中投入一小块金属钠,可以观察到的现象是()A.钠块在乙醇液面上四处快速游动钠块B.开始时钠块沉在乙醇液面下C.熔成小球D.钠块表面有大量气泡迅速产生,比水反应剧烈答案:B解析:ACD现象错误题干评注:醇的化学性质及用途问题评注:醇的化学反应主要是由官能团羟基(—OH)决定。
醇的大部分反应都涉及O—H 键和C—O键的断裂,还有C—O键和βC—H键同时断裂的脱水反应、氧化还原反应等。
3. 据报道,近来发现了一种新的星际分子氰基辛炔,其结构式为:HC≡C—C≡C-C≡C-C≡C -C≡N 对该物质判断正确的是()A.晶体的硬度与金刚石相当 B.能使酸性高锰酸钾溶液褪色C.不能发生加成反应 D.可由乙炔和含氮化合物加聚制得答案:B解析:ACD说法错误题干评注:醇的化学性质及用途问题评注:醇的化学反应主要是由官能团羟基(—OH)决定。
醇的大部分反应都涉及O—H 键和C—O键的断裂,还有C—O键和βC—H键同时断裂的脱水反应、氧化还原反应等。
4. 茶多酚是目前尚不能人工合成的纯天然、多功能、高效能的抗氧化剂和自由基净化剂。
其中没食子儿茶素(EGC)的结构如右图所示。
关于EGC的下列叙述中不正确的是()A.分子中所有的原子共面B.遇FeCl3溶液发生显色反应C.1molEGC能与3molNaOH完全反应D.易发生氧化反应和取代反应,难发生加成反应答案:A解析:BCD说法正确题干评注:醇的化学性质及用途问题评注:醇的化学反应主要是由官能团羟基(—OH)决定。

高中化学学习材料金戈铁骑整理制作高二化学选修(有机化学基础)单元练习之十九醇的性质和应用班级 学号 姓名一.选择题1.在下列物质中,分别加入金属钠,不能产生氢气的是A .蒸馏水B .煤油C .无水乙醇D . 75%的酒精2.将质量为a 克的铜丝在酒精灯上加热灼烧后,分别插入到下列溶液中,放置片刻,铜丝质量不变的是A .硝酸B .氢氧化钠C .无水乙醇D .石灰水3.比较乙烷和乙醇的结构,下列说法错误的是A .两个碳原子以单键相连B .分子里都含有6个相同的氢原子C .乙基与一个氢原子相连就是乙烷分子D .乙基与一个羟基相连就是乙醇分子4.验证某有机物属于烃的含氧衍生物,应完成的实验内容是A .只有验证它完全燃烧后产物只有H 2O 和CO 2B .只有测定其燃烧产物中H 2O 和CO 2物质的量的比值C .测定完全燃烧时消耗有机物与生成的CO 2、H 2O 的物质的量之比D .测定该试样的质量及其试样完全燃烧后生成CO 2和H 2O 的质量5.下列有机化合物,既可作防冻剂又可用于制炸药的是A .三硝基甲苯B .甲苯C .乙二醇D .丙三醇6.在甲醇和乙醇的混和物中加浓硫酸,在一定条件下使其反应,生成的醚中不可能含有A .甲醚B .乙醚C .丙醚D .甲乙醚7.下列反应后只可能生成一种有机物的是A .CH 3-CH =CH 2与HCl 加成B .CH 3-CH 2-CHOH -CH 3在浓硫酸存在下,发生分子内脱水C .C 6H 5-CH 3在铁粉存在下与氯气反应D .CH 3-CHOH -CH 3在浓硫酸存在下,发生分子内脱水8.乙醇分子中各化学键如图所示,对乙醇在各种反应中应断裂的键说明不正确的是A .和金属钠作用时,键①断裂H —C —C —O —H H HH H ① ② ③ ④ ⑤B.和浓硫酸共热至170 ℃时,键②和⑤断裂C.和浓硫酸共热至140 ℃时,键②和③断裂D.在铜催化下和氧气反应时,键①和③断裂9.已知质量分数为0.95的乙醇溶液物质的量浓度为16.52mol·L-1,将这种乙醇溶液稀释为质量分数0.475的乙醇溶液,则稀释后溶液的物质的量浓度A.等于8.26mol·L-1B.小于8.26mol·L-1C.大于8.26mol·L-1D.无法判断10.用硫酸酸化的CrO3遇酒精后,其颜色会从红色变为蓝绿色,用这个现象可以测得汽车司机是否酒后开车。

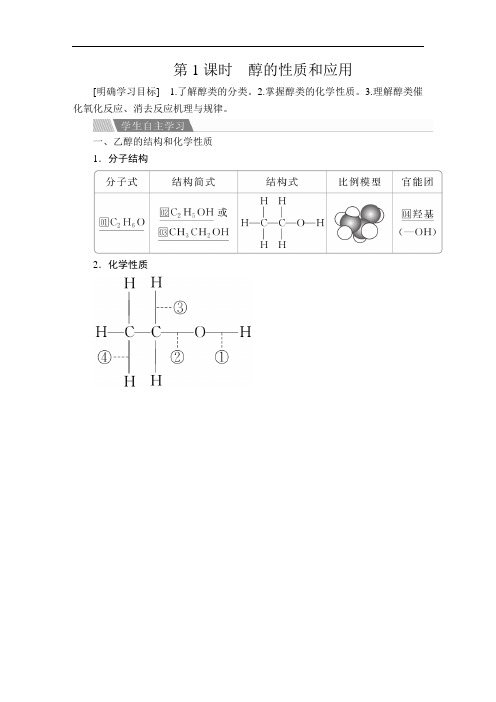
第1课时醇的性质和应用[明确学习目标] 1.了解醇类的分类。
2.掌握醇类的化学性质。
3.理解醇类催化氧化反应、消去反应机理与规律。
一、乙醇的结构和化学性质1.分子结构2.化学性质续表二、醇的概述与分类1.概念烃分子中饱和碳原子上的氢原子被羟基取代形成的化合物。
2.分类根据醇分子中□01醇羟基的数目,可分为一元醇、二元醇和多元醇。
3.组成一元醇的分子通式为R—OH,饱和一元醇的分子通式为□02C n H2n+1OH。
4.化学性质与乙醇相似(1)与活泼金属发生□03置换反应。
(2)氧化反应(燃烧、催化氧化、被酸性KMnO4溶液氧化等)。
(3)消去反应。
(4)与HX、羧酸等的□04取代反应等。
5.几种典型醇的结构、性质与用途(1)甲醇(CH3OH)俗称□05木精或□06木醇:无色透明的液体;甲醇有□07剧毒,饮用后会使人眼睛失明,量多时使人致死,是一种重要的□08有机化工原料。
(2)乙二醇结构简式:□09CH2OHCH2OH,为无色黏稠有□10甜味的液体,易溶于水和乙醇,它的水溶液凝固点□11低,可作内燃机的□12抗冻剂、制造涤纶。
(3)丙三醇(甘油)结构简式:□13CH2OHCHOHCH2OH,无色黏稠有□14甜味的液体,吸湿性强,它跟水、乙醇以任意比例互溶,甘油水溶液的凝固点很低,用于制造硝化甘油。
1.醇和卤代烃发生消去反应时有什么异同?提示:相同点:①醇和卤代烃发生消去反应的规律类似,对有机物结构的要求均为:醇(或卤代烃)分子所含碳原子数必须大于1;与—OH(或—X)相连的碳原子的邻位碳原子上有氢原子。
②醇和卤代烃的消去反应均有烯烃生成。
不同点:二者发生消去反应的条件不同,醇的消去反应需在浓硫酸作催化剂并加热的条件下进行;卤代烃的消去反应需在强碱的醇溶液中并加热的条件下进行。
2.乙醇能使酸性高锰酸钾溶液和重铬酸钾溶液褪色吗?提示:乙醇具有还原性,强氧化剂如酸性高锰酸钾溶液、酸性重铬酸钾溶液均能首先将乙醇氧化为乙醛,然后进一步将乙醛氧化为乙酸。

醇的化学性质与应用在化学领域中,醇是一类重要的有机化合物,其化学性质独特且多样。
醇分子中含有一个或多个羟基(OH基团),这使得醇具有一系列物理和化学性质,以及广泛的应用领域。
本文将探讨醇的化学性质以及其在医药、工业和实验室等领域中的应用。
一、醇的化学性质醇是通过醇类化合物中碳原子上的氢被羟基(OH基团)取代而形成的,其结构通用式为:R-OH。
根据羟基取代的位置和数量,醇可以分为一元醇、二元醇、多元醇等不同类型。
醇的化学性质主要涉及酸碱性、氧化还原性和水解性等方面。
1. 酸碱性:醇具有一定的酸碱性,能够与碱反应形成盐和水。
例如,乙醇(C2H5OH)与氢氧化钠(NaOH)反应,生成乙醇钠(C2H5ONa)和水(H2O),显示出酸碱中和的特性。
2. 氧化还原性:醇具有氧化还原反应的能力。
醇可以被氧化剂氧化为相应的醛或酮。
醇的氧化反应常常伴随着羟基氧化为醛或酮基团的生成,如乙醇可以被氧气氧化为乙醛。
3. 水解性:醇可发生水解反应,将醇分子中的羟基断裂,生成相应的酸。
例如,乙醇可以在酸性条件下水解为乙酸。
二、醇的应用领域由于其独特的化学性质,醇在众多领域发挥着重要作用。
下面将介绍醇在医药、工业和实验室等领域中的应用。
1. 医药领域:醇广泛应用于药物的合成和制备过程中。
醇可以作为药物活性部分的前体合成,同时也是一些药物的主要溶剂。
例如,乙二醇作为一种醇类物质,常用于制造药用注射剂。
2. 工业领域:醇在工业中具有多种应用。
一方面,醇可以用作溶剂,广泛应用于涂料、油墨、胶粘剂等领域。
另一方面,醇也可以用作合成化工产品的重要原料,例如乙二醇是合成聚酯纤维原料的关键物质。
3. 实验室应用:醇是实验室中常用的重要试剂和溶剂,用于溶解和稀释各种化合物。
醇的溶解能力较强,使其成为溶解固体样品或稀释液态试剂的理想选择。
总结起来,醇作为一类重要的有机化合物,具有独特的化学性质和广泛的应用领域。
从医药到工业,从实验室到生产现场,醇的应用与化学性质密不可分。

醇的性质及应用学案醇,又称为醇类化合物,是一类含有羟基(-OH)官能团的有机化合物。
它们由一个或多个羟基取代了碳链或环状结构中的一个或多个氢原子。
醇是重要的有机化学物质,它们在生活和工业中有广泛的应用。
一、醇的性质:1. 反应活性:醇有较高的反应活性,可以发生酯化、醚化、醇醚互变、氧化还原等多种反应。
这使得醇可用于合成各种有机化合物。
2. 溶解性:由于醇分子中含有羟基,具有亲水性。
醇可溶于水和其他极性溶剂,如乙醚、醚、酮等。
但随着碳链的增长,醇的溶解度下降。
3. 氢键作用:醇分子中的氢与羟基的氧原子形成氢键,使得醇分子之间的相互作用增强,导致醇的沸点和熔点较高。
二、醇的应用:1. 溶剂:由于醇具有良好的溶解性,因此常用作溶剂。
例如:乙醇是常用的溶剂,广泛用于画家颜料中,充当溶解和稀释颜料的作用。
2. 反应中间体:醇具有活泼的羟醇基,可以发生酯化、醚化、氧化还原等反应,因此常用作有机合成中的反应中间体。
3. 药物:许多药物中含有醇基团,以增加药物的溶解度和稳定性。
例如:乙醇作为抗生素和止痛药的溶剂,剃须液中的甘油等。
4. 化妆品:醇可以增加化妆品的粘度、润滑性和稳定性。
醇类物质也可用作头发定型剂和护肤品中的保湿剂。
例如:乙醇可用作香水中的溶剂,甘油可用作面膜和护肤品中的保湿剂。
5. 燃料:醇类物质可以作为燃料,如乙醇作为生物燃料,在某些地区用于汽车燃料。
6. 酒精饮料制造:醇是酒精饮料的重要成分之一,如啤酒、红酒、白酒等。
7. 食品添加剂:醇可以作为食品的增稠剂、抗氧化剂和甜味剂,如甘油即用于食品制作,又用作食品保鲜剂。
8. 工业应用:醇可以用于制备塑料、纤维、化肥和涂料等化工产品。
总结起来,醇是一类重要的有机化合物,具有较高的反应活性和溶解性。
由于醇分子中的羟基能够发生多种反应,使得醇具有广泛的应用领域,如溶剂、反应中间体、药物、化妆品、燃料、酒精饮料制造、食品添加剂和工业应用等。
4.2.1《醇的性质和应用》导学案(一)【学习目标】1.掌握乙醇的主要化学性质;2.了解醇类的结构特点、一般通性和几种典型醇的用途。
【预习作业】1.现在有下面几个原子团,将它们组合成含有—OH的有机物CH3——CH2——OH【基础知识梳理】一、认识醇和酚羟基与烃基或苯环侧链上的碳原子相连的化合物叫做醇;羟基与苯环直接相连形成的化合物叫做酚。
二、醇的性质和应用1.醇的命名(系统命名法)命名原则:一元醇的命名:选择含有羟基的最长碳链作为主链,把支链看作取代基,从离羟基最近的一端开始编号,按照主链所含的碳原子数目称为“某醇”,羟基在1位的醇,可省去羟基的位次。
多元醇的命名:要选取含有尽可能多的带羟基的碳链作为主链,羟基的数目写在醇字的前面。
用二、三、四等数字表明2.醇的分类(1)根据醇分子中羟基的多少,可以将醇分为一元醇、二元醇和多元醇饱和一元醇的分子通式:C n H2n+2O饱和二元醇的分子通式:C n H2n+2O2(2)根据醇分子中羟基所连碳原子上氢原子数目的不同,可以分为伯醇、仲醇和叔醇伯醇:-CH2-OH 有两个α-H仲醇:-CH-OH 有一个α-H叔醇:-C-OH 没有α-H3.醇的物理性质(1)状态:C1-C4是低级一元醇,是无色流动液体,比水轻。
C5-C11为油状液体,C12以上高级一元醇是无色的蜡状固体。
甲醇、乙醇、丙醇都带有酒味,丁醇开始到十一醇有不愉快的气味,二元醇和多元醇都具有甜味,故乙二醇有时称为甘醇(Glycol)。
甲醇有毒,饮用10毫升就能使眼睛失明,再多用就有使人死亡的危险,故需注意。
(2)沸点:醇的沸点比含同数碳原子的烷烃、卤代烷高。
且随着碳原子数的增多而升高。
(3)溶解度:低级的醇能溶于水,分子量增加溶解度就降低。
含有三个以下碳原子的一元醇,可以和水混溶。
4.乙醇的结构分子式:C2H6O结构式:结构简式:CH3CH2OH5.乙醇的性质(1)取代反应A.与金属钠反应化学方程式:2CH3CH2OH +2Na → 2CH3CH2ONa +H2↑化学键断裂位置:①对比实验:乙醇和Na反应:金属钠表面有气泡生成,反应较慢水和钠反应:反应剧烈乙醚和钠反应:无明显现象结论:①金属钠可以取代羟基中的H,而不能和烃基中的H反应。
醇的结构性质及应用醇是一类含有羟基(-OH)官能团的有机化合物,也是一类重要的有机溶剂。
醇的结构、性质及应用都十分广泛。
下面将从不同的角度详细介绍。
一、醇的结构:醇的分子结构通常可以表示为R-OH,其中R代表醇分子的碳链,可以是脂肪烃或芳香烃。
醇分子中的羟基与碳链上的一个碳原子通过共价键连接,形成醇的结构。
醇分子中的羟基具有亲电性,容易参与化学反应。
二、醇的性质:1. 水溶性:醇分子中的羟基具有明显的极性,可以与水分子形成氢键,因此大多数低碳醇具有较好的水溶性。
随着碳链的增加,醇的溶解度逐渐下降。
2. 沸点和熔点:醇的沸点和熔点通常比相应的烷烃高,这是因为醇分子中的羟基可以与其他醇分子形成氢键,增加分子间吸引力,导致升高沸点和熔点。
3. 酸碱性:醇分子中的羟基可以与强碱反应产生盐,因此醇具有一定的酸性。
同时,羟基也可以与强酸反应形成酯,具有一定的碱性。
三、醇的应用:1. 溶剂:由于醇的极性和溶解性,多数醇可以作为良好的溶剂使用。
例如,乙醇被广泛用作溶解有机化合物、制备药物、化妆品和清洗剂等。
苯酚可作为用于清洗玻璃器皿的溶剂,甘油可用作润滑剂以及制备涂料和染料等。
2. 酒精饮料:乙醇是一种常见的醇类,广泛应用于制备酒类饮料。
乙醇通过发酵作用产生,是各种酒类的主要成分,如啤酒、葡萄酒、白酒等。
3. 化学反应中的反应物和中间体:醇在化学反应中常作为反应物或中间体。
例如,醇可以通过脱水反应形成烯烃或醚,可以与醛、酮反应形成醛酮,还可以被氧化为醛、酮或羧酸等。
此外,醇还参与酯化、醚化、胺化等重要的有机化学反应。
4. 醇的抗冻性能:一些醇具有较低的冰点,可以作为防冻剂使用。
例如,甲醇作为汽车防冻液中的主要成分之一,具有较低的冰点,防止汽车冷却液在寒冷的冬季结冰。
5. 生物医学应用:醇有广泛的生物医学应用。
例如,乙醇可用于消毒和消毒剂;苯酚可以用于制备抗菌洗剂;甘油可用于制备药物、护肤品和口腔护理产品等。
总结:醇是一类含有羟基(-OH)的有机化合物,具有较好的溶解性和极性。
课时追踪检测(十二)醇的性质和应用一、单项选择题1.以下物质中,不属于醇类的是()A. CH 3CH 2OH B.C.D. HOCH 2CH 2OH分析:选 C C 项分子中羟基直接连在苯环上,不属于醇类。
2.能证明乙醇分子中有一个羟基的事实是()A.乙醇完整焚烧生成 CO 2和 H 2OB. 0.1 mol 乙醇与足量钠反响生成0.05 mol H 2C.乙醇能溶于水D.乙醇能脱水分析:选 B 乙醇与生成的氢气的物质的量之比为0.1∶ 0.05= 2∶ 1,说明乙醇分子中有一个开朗的氢原子可被金属钠置换,即乙醇分子中有一个羟基。
3.已知在浓 H 2 SO4存在并加热至140 ℃时, 2 个醇分子在羟基上发生疏子间脱水反响生成醚,如浓 H 2SO4CH 3CH 2— OH + HO —CH 2CH 3――――→140 ℃CH 3CH 2— O— CH 2CH 3+H 2O,用浓 H 2SO4跟分子式分别为 C 2H 6O 和 C3H 8O 的醇的混淆液反响,可获得醚的种类有()A.1种B.3 种C.5种D.6 种分析:选 D C2H 6O的醇只有CH 3CH 2OH一种,而分子式为C3H 8O 的醇有CH 3— CH 2— CH 2OH 和 CH 3CHOHCH 3两种。
同种分子间可形成 3 种醚,不一样种分子间可形成 3 种醚,共 6 种。
4.同样质量的以下醇,分别和过度的金属钠作用,放出H2最多的是 ()A.甲醇B.乙醇C.乙二醇D.丙三醇分析:选D醇与钠反响时每个羟基与一个钠原子反响,生成 1 mol H 2需要 2 mol 羟基,所以生成 1 mol H2,需要各醇的质量分别为32×2 g、 46×2 g、 62 g、61.3 g,明显等质量的醇生成H 2最多的是丙三醇。
5.以下图表示4-溴 -1-环己醇所发生的 4 个不一样反响。
此中产物只含有一种官能团的反响是 ()A.②③C.①②④分析:选AB.①④D.①②③④反响② 溴原子水解生成羟基;反响③ 羟基与溴原子发生代替反响生成卤代烃。
醇的性质与应用醇是一类含有羟基(-OH)官能团的有机化合物,它们在化学和生物学领域中具有广泛的应用。
本文将探讨醇的性质以及它们在不同领域中的应用。
一、醇的性质醇的性质主要取决于它们的碳链长度、取代基及氢键能力。
下面将介绍醇的一些主要性质。
1. 溶解性:由于醇分子中含有亲水性的羟基,较低碳链的醇具有良好的溶解性,尤其是可溶于水。
而随着碳链的增长,醇的溶解性会逐渐降低。
2. 沸点和熔点:由于醇分子之间可形成氢键作用力,使得醇的沸点和熔点相对较高。
一般而言,分子量较大的长链醇具有较高的沸点和熔点。
3. 酸碱性:醇可被质子化,形成醇碱。
较长链的醇的酸性较弱,而较短链的醇则具有明显的酸性。
4. 反应活性:醇可以发生多种有机反应,例如酯化、醚化、氧化等。
其羟基为一种重要的官能团,常作为化学反应的活性中心。
二、醇的应用由于醇具有独特的性质,它们在多个领域中被广泛应用。
以下是几个典型的应用领域:1. 药物与化妆品:醇可以作为药物的载体或溶剂,帮助药物的输送和吸收。
同时,醇也在化妆品中作为保湿剂和溶剂被广泛使用。
2. 化学合成:醇在有机合成中扮演着重要的角色。
例如,它们可以用作还原剂、催化剂或试剂,参与有机反应中的加成、酯化和醚化等反应。
3. 能源产业:醇是生物质能源的重要组成部分。
生物质醇如乙醇可以被用作可再生能源,用于汽油的替代品或掺和剂。
4. 表面活性剂:醇是许多表面活性剂如洗涤剂、乳化剂和润滑剂的重要成分。
醇的亲水性和亲油性使其可以在水和油之间有效地分散和乳化。
5. 食品工业:醇在食品工业中被广泛使用,如醇类甜味剂常用于饮料、甜食和糖果中。
总结:醇作为一类含有羟基官能团的有机化合物,在化学与生物学中扮演着重要的角色。
它们的性质如溶解性、沸点熔点、酸碱性以及反应活性,决定了它们的应用领域和特点。
醇在药物与化妆品、化学合成、能源产业、表面活性剂以及食品工业中都发挥着不可替代的作用。
鉴于醇的广泛应用和重要性,进一步的研究和应用开发将有助于推动相关领域的进步和创新。
高二化学选修(有机化学基础)单元练习之十九
醇的性质和应用
班级 学号 姓名
一.选择题
1.在下列物质中,分别加入金属钠,不能产生氢气的是
A .蒸馏水
B .煤油
C .无水乙醇
D . 75%的酒精
2.将质量为a 克的铜丝在酒精灯上加热灼烧后,分别插入到下列溶液中,放置片刻,铜丝质量不变的是
A .硝酸
B .氢氧化钠
C .无水乙醇
D .石灰水
3.比较乙烷和乙醇的结构,下列说法错误的是
A .两个碳原子以单键相连
B .分子里都含有6个相同的氢原子
C .乙基与一个氢原子相连就是乙烷分子
D .乙基与一个羟基相连就是乙醇分子
4.验证某有机物属于烃的含氧衍生物,应完成的实验内容是
A .只有验证它完全燃烧后产物只有H 2O 和CO 2
B .只有测定其燃烧产物中H 2O 和CO 2物质的量的比值
C .测定完全燃烧时消耗有机物与生成的CO 2、H 2O 的物质的量之比
D .测定该试样的质量及其试样完全燃烧后生成CO 2和H 2O 的质量
5.下列有机化合物,既可作防冻剂又可用于制炸药的是
A .三硝基甲苯
B .甲苯
C .乙二醇
D .丙三醇
6.在甲醇和乙醇的混和物中加浓硫酸,在一定条件下使其反应,生成的醚中不可能含有 A .甲醚 B .乙醚 C .丙醚 D .甲乙醚
7.下列反应后只可能生成一种有机物的是
A .CH 3-CH =CH 2与HCl 加成
B .CH 3-CH 2-CHOH -CH 3在浓硫酸存在下,发生分子内脱水
C .C 6H 5-CH 3在铁粉存在下与氯气反应
D .CH 3-CHOH -CH 3在浓硫酸存在下,发生分子内脱水
8.乙醇分子中各化学键如图所示,对乙醇在各种反应中应断裂的键说明不正确的是
A .和金属钠作用时,键①断裂
B .和浓硫酸共热至170 ℃时,键②和⑤断裂
C .和浓硫酸共热至140 ℃时,键②和③断裂
D .在铜催化下和氧气反应时,键①和③断裂 9.已知质量分数为0.95的乙醇溶液物质的量浓度为16.52mol·L -1,将这种乙醇溶液稀释为质量分数0.475的乙醇溶液,则稀释后溶液的物质的量浓度
A .等于8.26mol·L -1
B .小于8.26mol·L -1
C .大于8.26mol·L -1
D .无法判断
H —C —C —O —H H H H ① ② ③ ④ ⑤
10.用硫酸酸化的CrO3遇酒精后,其颜色会从红色变为蓝绿色,用这个现象可以测得汽车司机是否酒后开车。
反应的方程式为2CrO3+ 3C2H5OH + 3H2SO4== Cr2(SO4)3+ 3CH3CHO + 6H2O,此反应的氧化剂是
二.填空题
11.(1)写出下列微粒的电子式:氢氧根离子,羟基。
(2)4.6g某有机物完全燃烧,得到8.8g二氧化碳和5.4g水。
此有机物的蒸气对氢气的相对密度为23,该有机物与金属钠反应放出氢气。
其分子式为________________,结构简式________________。
12.在焊接铜漆包线的线头时,常先把线头放在火上烧一下,以除去漆层,并立即在酒精中蘸一下,再焊接。
为什么要用酒精处理后再焊接?试用化学方程式来说明。
13.相同质量的①乙醇、②乙二醇、③丙三醇。
依照下列要求进行排序(填序号)
(1)燃烧后生成二氧化碳的量由多到少______________________ ;
(2)燃烧时耗用氧气量由多到少____________________ ;
(3)与足量金属钠反应放出氢气量由多到少________________________ 。
14.1 mol有机物,充分燃烧后生成2mol CO2和3 mol H2O。
此有机物可能是(用结构简式表示)、、。
三.计算题
15.某有机物由C、H、O三种元素组成,将该有机物3g充分燃烧生成0.15mol二氧化碳和3.6g水,已知该有机物的蒸汽密度2.68 g/L(折算成标准状况)。
该有机物能与金属钠反应。
则:(1)通过计算求出该有机物的分子式。
(2)写出该有机物可能的结构简式。
16.0.2mol有机物和0.4molO2在密闭容器中燃烧后的产物为CO2、CO和H2O(气),产物经过浓硫酸后,质量增加10.8g;再通过灼热的CuO,充分反应后,质量减轻3.2g;
最后气体再通过碱石灰被完全吸收,质量增加17.6g。
(1)试推断该有机物的分子式。
(2)0.2mol该有机物恰好与9.2g金属钠完全反应,试确定该有机物的结构简式。
3.醇的性质和应用
1B,2C,3B,4D,5D,6C,7D,8C,9C,10B二.填空题:11略,12略,13:①③②、①②③、③②①;14:CH3CH3、CH3CH2OH、CH3OCH3。
15:C3H8O,CH3CH2CH2OH,CH3CH(OH)CH3。
16: C2H6O2,CH2 OHCH2OH。