高中化学解题方法归纳难点16水的电离
- 格式:doc
- 大小:158.00 KB
- 文档页数:5

专题16 水溶液中的离子平衡一、单选题1.在25 ℃时,某稀溶液中由水电离产生的H +浓度为1.0×10-13 mol/L ,下列有关该溶液的叙述,正确的是( )A .该溶液可能呈酸性B .该溶液一定呈碱性C .该溶液的pH 一定是1D .该溶液的pH 不可能为132.常温下,下列各组离子在指定溶液中一定能大量共存的是( ) A .遇苯酚显紫色的溶液:I -、K +、SCN -、2Mg +B .pH 12=的溶液:K +、Na +、ClO -、23SO -C .水电离的()--13-1c OH =110mol L ⨯⋅的溶液中:K +、Cl -、3CH COO -、2Cu +D .10.1mol L -⋅的24K SO 溶液:Na +、3Al +、-Cl 、3NO -3.某溶液仅有+3+2++4432K Al Mg NH Cl S C O H O ---、、、、、、中的几种.为确定其成分,做如下实验:①取部分溶液.加入适量Na 2O 2固体,产生无色无味的气体和白色沉淀,再加入足量的 NaOH 溶液后白色沉淀全部溶解;②另取部分溶液,加入HNO 3酸化的()32BaNO 溶液,无沉淀产生.下列推断正确的是( ) A .肯定有3Al Cl +-、,一定没有 3HCO -和 24SO -B .肯定有32Al Mg Cl ++-、、,可能有 4NH K ++、 C .肯定有34Al NH Cl ++-、、,肯定没有3HCO -D .该溶液可能显弱酸性,也可能显中性4.已知室温时,0.1-1mol L ⋅某一元酸HA 在水中有0.1%发生电离,下列叙述正确的是( ) A .该溶液的pH=3B .升高温度,溶液的 pH 增大C .此酸的电离平衡常数约为1×10-7D .由 HA 电离出的()+Hc 约为水电离出的 ()+H c 的105倍5.室温时,向20 mL 0.1 mol/L 的一元弱酸HA 溶液中滴加同浓度的NaOH 溶液,溶液中-(A )lg (HA)c c 与pH的关系如图所示。

课时38水的电离和溶液的酸碱性知识点一水的电离(一)水的电离平衡【考必备·清单】1.水的电离(1)水是极弱的电解质,其电离方程式为H2O+H2O⇌H3O++OH-,可简写为H2O⇌H++OH-。
(2)25 ℃时,纯水中c(H+)=c(OH-)=1×10-7 mol·L-1。
[名师点拨]任何情况下,水电离产生的c(H+)、c(OH-)总是相等的。
2.水的离子积常数[名师点拨]K W=c(H+)·c(OH-)中的H+和OH-不一定都是由水电离出来的,而是指溶液中的c(H+)和c(OH-)。
3.水电离平衡的影响因素(1)温度:温度升高,促进水的电离;温度降低,抑制水的电离。
(2)酸、碱:抑制水的电离。
(3)能水解的盐:促进水的电离。
(4)实例(填写下表):体系变化条件移动方向K W电离程度c(OH-)c(H+)加酸逆不变减小减小增大加碱逆不变减小增大减小[名师点拨] ①给水加热,水的电离程度增大,c (H +)>10-7 mol ·L -1,pH<7,但水仍显中性。
②酸、碱能抑制水的电离,故室温下,酸、碱溶液中水电离产生c (H +)<1×10-7 mol ·L -1而能水解的盐溶液中,水电离产生的c (H +)[或c (OH -)]>1×10-7 mol ·L -1。
(二)水电离出的c 水(H +)或c 水(OH -)的计算 【考必备·清单】1.当抑制水的电离时(如酸或碱溶液)在溶液中c (H +)、c (OH -)较小的数值是水电离出来的。
如下表:2.当促进水的电离时(如盐的水解)在溶液中c (H +)、c (OH -)较大的数值是水电离出来的。
如下表:【探题源·规律】[示例] 25 ℃时,在等体积的①pH =0的H 2SO 4溶液、②0.05 mol ·L-1的Ba(OH)2溶液、③pH =10的Na 2S 溶液、④pH =5的NH 4NO 3溶液中,发生电离的水的物质的量之比是( ) A .1∶10∶1010∶109 B .1∶5∶(5×109)∶(5×108) C .1∶20∶1010∶109 D .1∶10∶104∶109[解析] H 2SO 4与Ba(OH)2抑制水的电离,Na 2S 与NH 4NO 3促进水的电离。

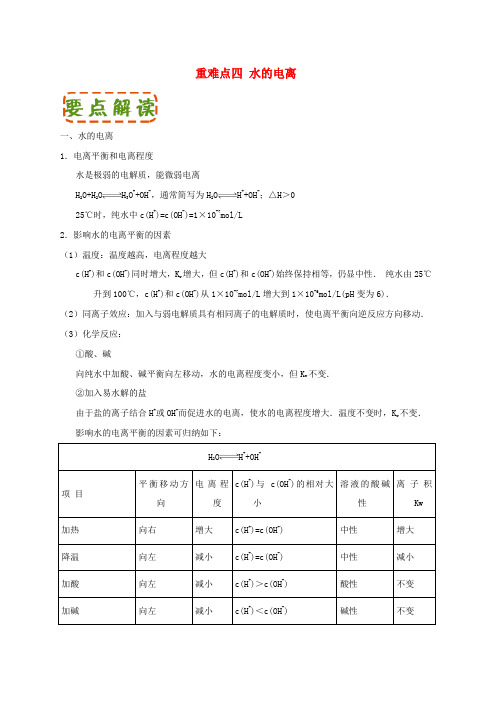
重难点四水的电离一、水的电离1.电离平衡和电离程度水是极弱的电解质,能微弱电离H2O+H2O H3O++OH-,通常简写为H2O H++OH-;△H>025℃时,纯水中c(H+)=c(OH-)=1×10-7mol/L2.影响水的电离平衡的因素(1)温度:温度越高,电离程度越大c(H+)和c(OH-)同时增大,K w增大,但c(H+)和c(OH-)始终保持相等,仍显中性.纯水由25℃升到100℃,c(H+)和c(OH-)从1×10-7mol/L增大到1×10-6mol/L(pH变为6).(2)同离子效应:加入与弱电解质具有相同离子的电解质时,使电离平衡向逆反应方向移动.(3)化学反应:①酸、碱向纯水中加酸、碱平衡向左移动,水的电离程度变小,但K w不变.②加入易水解的盐由于盐的离子结合H+或OH-而促进水的电离,使水的电离程度增大.温度不变时,K w不变.影响水的电离平衡的因素可归纳如下:H【重难点点睛】酸式盐对水的电离平衡的影响:(1)水溶液呈酸性的酸式盐(如NaHSO4,NaH2PO4,NaHSO3,NH4HSO4等),会抑制水的电离.①强碱强酸的酸式盐:如NaHSO4,在其水溶液中发生完全电离,因此溶液呈酸性,会抑制水的电离;②强酸弱碱的酸式盐:强酸和弱碱生成的盐:如 NH4HSO4,溶液呈酸性.(溶液显酸性是由于HSO4-的电离,HSO4-电离程度远远大于NH4+水解,并一定程度上抑制NH4+水解;(2)水溶液呈碱性的酸式盐(如NaHCO3,NaHPO4,NaHS等),因电离趋势小于水解趋势,溶液呈碱性,会促进水的电离。
二、水的离子积常数1.定义:在一定温度时,c(H+)与c(OH-)的乘积是一个常数,称为水的离子积常数,简称水的离子积.K w=c(H+)•c(OH-),25℃时,K w=1×10-142.离子积常数的影响因素①K w只受温度影响,水的电离吸热过程,温度升高,水的电离程度增大,K w增大;25℃时K w=1×10-14,100℃时K w约为1×10-12;②水的离子积不仅适用于纯水,也适用于其他稀溶液.不论是纯水还是稀酸、碱、盐溶液,只要温度不变,K w就不变;特别提醒]水的离子积不仅适用于纯水,还适用于稀的电解质溶液。

【高中化学】高中化学知识点总结:水的电离1、电解质水是一种两性物质,可以释放和接收质子。
水在一定程度上也会弱解离,质子从一个水分子转移到另一个水分子,形成H3O+和oh-。
通常,水合氢离子H3O+缩写为H+,其电离方程式为:H2O+H2O?H3O++OH-,缩写为H2O?H++OH-是一个吸热过程。
水的电离是一个吸热过程,因此水的电离平衡随着温度的升高而向前移动。
水的电离是水分子与水分子之间的相互作用而引起的,因此极难发生。
实验测得,25℃时1l纯水中只有1×10(-7)mol的水分子发生电离,100℃时1l纯水中有55×10(-7)mol的水分子发生电离。
由水分子电离出的h+和oh-数目在任何情况下总相等,电离前后h2o的物质的量几乎不变,c(h+)×c(oh-)=k(电离)×c(h2o),既然k(电离)是常数c(h2o)也可以看作是常数,那么常数的乘积可以看作一个新的常数,我们把它写作kw(kw=c(h+)×c(oh-)),我们把kw简称为水的离子积,25摄氏度时kw约1×10-14。
点击查看:高中化学知识点2、水电离平衡:水的离子积:kW=C[H+]?c[oh-]25℃时,[h+]=[oh-]=10-7mol/l;kw=[h+]?[oh-]=1*10-14注:千瓦仅与温度有关。
如果温度恒定,则功率值恒定kw不仅适用于纯水,适用于任何溶液(酸、碱、盐)水电离特性:(1)可逆(2)吸热(3)非常弱3、影响水电离的因素1)温度。
加热总是促进水的离子化2)酸,碱。
强酸强碱(强电解质)总是抑制水的电离,弱酸弱碱(弱电解质)也抑制水的电离。
3)可水解盐,盐(酸盐除外)总是促进水的离子化,4)活泼金属。
因为活泼金属总是与水电离出的氢离子反应,使氢离子浓度减小,所以总是促进水的电离。
高中化学水的电离知识点总结,供大家参考和学习,希望对大家的化学学习和化学成绩的提高有所帮助。

水的电离和溶液的酸碱性【八大题型】【新高考通用】【知识点1水的电离与水的离子积常数】【知识点2溶液的酸碱性与pH 】【知识点3酸碱中和滴定】【题型1水的电离及影响因素】【题型2水的电离的相关计算】【题型3水的电离有关图像】【题型4溶液酸碱性的判断】【题型5有关pH 的简单计算】【题型6中和滴定的操作与指示剂选择】【题型7中和滴定的误差分析】【题型8滴定曲线的分析与应用】【过关测试】考点要求真题统计考情分析1.了解水的电离、离子积常数。
2.了解溶液pH 的含义及其测定方法,能进行pH 的简单计算。
3.能选择实例说明溶液pH 的调控在工农业生产和科学研究中的重要作用。
4.理解酸碱中和滴定,能根据实验试题要求分析或处理实验数据,得出合理结论;能够分析以图像形式考查滴定曲线。
2024·安徽卷7题,3分;2024·安徽卷7题,3分;2024·山东卷10题,2分;2023湖南卷12题,4分;2022辽宁卷15题,3分;2022·浙江卷1题,2分;2022·浙江卷17题,2分2021湖北卷14题,3分;2021海南卷14题,4分;本专题试题主要结合图像考查溶液的酸碱性判断、pH 的计算,以及离子浓度的大小比较等;以酸碱中和滴定为载体,考查微粒浓度的变化。
预测2025年结合图像,考查水的电离平衡与溶液酸碱性的关系,以及pH 的相关计算等;考查氧化还原滴定、沉淀滴定等有关计算,注意滴定现象、操作、误差分析。
【思维导图】【知识点1水的电离与水的离子积常数】1.水的电离(1)水是极弱的电解质,其电离过程吸热(填“吸热”或“放热”)。
水的电离平衡常数的表达式为K=c(H+)·c(OH-)c(H2O)。
(2)影响水的电离平衡的因素①温度:温度升高,水的电离平衡向正方向移动,c(H+)和c(OH-)均增大(填“增大”“减小”或“不变”)。
②加酸或碱会抑制(填“促进”或“抑制”)水的电离。
《水的电离和溶液的pH》教学设计方案(第一课时)一、教学目标1. 理解水的电离过程以及影响水电离的因素。
2. 掌握溶液pH值的定义和计算方法。
3. 了解溶液酸碱性的影响因素。
二、教学重难点1. 教学重点:水的电离过程及影响水电离的因素,pH值的定义和计算方法。
2. 教学难点:如何将理论知识与实际应用相结合,理解溶液酸碱性的影响因素。
三、教学准备1. 准备教学PPT和相关视频素材。
2. 准备实验器材,进行水的电离实验。
3. 准备一些常见溶液,让学生进行pH值测量和记录。
4. 准备一些与溶液酸碱性相关的案例,用于课堂讨论。
四、教学过程:本节课为高中化学课程《水的电离和溶液的pH》的第一课时,教学目标包括理解水的电离和溶液的pH概念,掌握测定溶液pH 的方法,以及学会运用pH值判断溶液酸碱性。
教学过程如下:1. 导入新课:通过展示水和酸碱性不同的溶液,引导学生思考水的性质和溶液酸碱性的关系,从而引出本节课的主题。
2. 讲授新课:(1)水的电离:通过实验展示水电离过程,引导学生观察实验现象,理解水的离子性质和水电离产生的氢离子、氢氧根离子对溶液酸碱性的影响。
(2)溶液的pH:通过讲解pH值的概念、计算方法和表示方法,让学生了解如何用pH值判断溶液酸碱性,并掌握测定溶液pH的方法。
可以通过演示实验和学生实验相结合的方式,让学生亲手操作测定溶液pH的仪器,学会如何准确测量溶液pH。
(3)应用举例:通过实例讲解如何根据溶液的pH值判断溶液的酸碱性,让学生学会将所学知识应用于实际生活。
3. 课堂互动:鼓励学生提出疑问,分享自己的想法和见解,通过讨论交流,加深学生对知识的理解和掌握。
4. 作业布置:布置与本节课内容相关的作业,包括理论题和实验题,要求学生运用所学知识解决实际问题。
5. 课堂小结:回顾本节课的重点内容,强调知识要点,帮助学生梳理所学知识,加深印象。
6. 拓展延伸:介绍一些与本节课内容相关的拓展知识,引导学生继续探究和学习。
高中化学解题方法归纳难点16 水的电离如何判断(或计算)溶液中c水(H+)或c水(OH-)的大小,如何找出c水(H+)与c水(OH-)的物料守恒关系,是本篇解决的问题。
●难点磁场请试做下列题目,然后自我界定学习本篇是否需要。
Na2S(aq)中,下列说法正确的是________。
A.2c(Na+)+c(H+)====c(S2-)+c(HS-)+c(OH-)B.c(Na+)+c(H+)====2c(S2-)+c(HS-)+c(OH-)C.c(H+)+c(HS-)+2(H2S)====c(OH-)D.c(Na+)====2c(S2-)+2(HS-)+2c(H2S)●案例探究[例1]室温下,在pH=12的某溶液中,由水电离生成的c(OH-)为A.1.0×10-7 mol·L-1B.1.0×10-6 mol·L-1C.1.0×10-2 mol·L-1D.1.0×10-12 mol·L-1命题意图:考查学生对不同条件下水电离程度的认识,同时考查学生思维的严密性。
知识依托:水的离子积。
错解分析:pH=12的溶液,可能是碱溶液,也可能是盐溶液。
忽略了强碱弱酸盐的水解,就会漏选D。
解题思路:先分析pH=12的溶液中c(H+)、c(OH-)的大小。
由c(H+)=10-pH得:c(H+)=1.0×10-12 mol·L-1c(OH-)=1.0×10-2 mol·L-1再考虑溶液中的溶质:可能是碱,也可能是强碱弱酸盐。
最后进行讨论:(1)若溶质为碱,则溶液中的H+都是水电离生成的:c水(OH-)=c水(H+)=1.0×10-12 mol·L-1(2)若溶质为强碱弱酸盐,则溶液中的OH-都是水电离生成的:c水(OH-)=1.0×10-2 mol·L-1答案:CD[例2](NH4)2CO3(aq)中存在________种粒子。
试完成下列问题:(1)根据电荷守恒,写出一个用离子浓度表示的等式:;(2)根据水的电离,写出一个含有c(H+)和c(OH-)的等式:;(3)根据(NH4)2CO3中,C、N原子个数关系,写出一个含有c(NH+4)和c(CO-23)的等式:。
命题意图:考查学生对电荷守恒和物料守恒的认识;考查学生分析、解决、归纳水解问题的能力。
知识依托:盐类的水解。
错解分析:不清楚CO-23与其所带电荷的关系而错解(1);不清楚H2CO3、HCO-3中氢的来源及他们与水电离的OH-的关系而错解(2);不清楚(NH4)2CO3中C、N原子个数比为1∶2,及碳、氮的具体存在形式而错解(3)。
解题思路:(NH 4)2CO 3(aq)中存在以下几种水解和电离方程式:(NH 4)2CO 3====2NH +4+CO -23H 2O H ++OH -NH +4+H 2ONH 3·H 2O +H +CO -23+H 2O HCO -3+OH -HCO -3+H 2OH 2CO 3+OH -以上所列粒子,除(NH 4)2CO 3外都存在,共有8种。
虽然NH +4与CO -23的水解能够相互促进,但不够剧烈,故水解反应不能进行到底。
(1)由于1个CO -23带2个负电荷,即c (CO -23)所带负电荷可表示为:2c (CO -23),根据正负电荷总数相等可得答案。
(2)水电离出的H +与OH -是相等的,但水电离出的H +不全部独立的存在于溶液中,有的存在于HCO -3中,有的存在于H 2CO 3,故由水电离出的H +总数可以浓度形式表示为:c (H +)+c (HCO -3)+2c (H 2CO 3)。
同样,水电离出的OH -也不全部独立存在于溶液中,有的被NH +4俘获存在于NH 3·H 2O 中,被NH +4俘获的OH -数与它们结合生成的NH 3·H 2O 数是相等的,故由水电离出的OH -总数可以用浓度形式表示为:c (OH -)+c (NH 3·H 2O)。
(3)(NH 4)2CO 3中,N (N)∶N (C)=2∶1。
(NH 4)2CO 3中的N 原子,有的存在于NH +4中,有的存在于NH 3·H 2O 中,其总数以浓度形式可表示为:c (NH +4)+c (NH 3·H 2O)。
(NH 4)2CO 3中的C 原子,有的存在于CO -23中,有的存在于HCO -3中,还有的存在于H 2CO 3中,其总数以浓度形式可表示为:c (CO -23)+c (HCO -3)+c (H 2CO 3)。
依据N 、C 原子个数比答案可得。
答案:8(1)c (NH +4)+c (H +)====c (OH -)+c (HCO -3)+2c (CO -23)(2)c (H +)+c (HCO -3)+2c (H 2CO 3)====c (OH -)+c (NH 3·H 2O)(3)c (NH +4)+c (NH 3·H 2O)====2c (CO -23)+2c (HCO -3)+2c (H 2CO 3)●锦囊妙计 一、c 水(H +)[或c 水(OH -)]的求解规律 1.强酸溶液:c 水(H +)×c 酸(H +)=K w [或c 水(H +)=)(H W+酸c K ] 弱酸溶液中:c 水(H +)=酸酸α⋅c K W2.碱溶液中:c 水(OH -)·c 碱(OH -)=K w [或c 水(OH -)=)(OH W-碱c K ] 对于弱碱中的氨水溶液:c 水(OH -)=)O H NH ()O H NH (2323W⋅⋅⋅αc K3.盐溶液中,c 水(H +)、c 水(OH -)的求解规律:(1)常温下,强碱弱酸盐溶液中,c 水(H +)或c 水(OH -)的求解规律分别是c 水(OH -)=10pH -14c 水(H +)=c 溶液(H +)+∑=ni ic 1[H iA(n -i )-]=10-pH+∑=ni ic 1[H iA(n -i )-](A n -代表弱酸根离子)(2)常温下,强酸弱碱盐溶液中,c 水(H +)、c 水(OH -)的求解规律分别是c 水(H +)=10-pHc 水(OH -)=c 溶液(OH -)+c [M(OH)n -1](M n +代表弱碱阳离子)二、有关溶液的物料守恒 1.强酸弱碱盐溶液中:c (H +)=c (OH -)+c (被弱碱阳离子结合的OH -) 2.强碱弱酸盐溶液中:c (OH -)=c (H +)+c (被弱酸根结合的H +)3.对所有盐溶液而言都可根据溶质的分子组成列出一个阴、阳离子浓度的关系式。
●歼灭难点训练1.(★★★)水是一种极弱的电解质,在室温下平均每n 个水分子中只有1个分子发生电离,则n 值是( )A.107B.5.56×108C.1.0×10-14D.55.62.(★★★★)常温下,在pH 都等于9的NaOH 和CH 3COONa 两种溶液中,设由水电离产生的OH -浓度分别为A mol ·L -1与B mol ·L -1,则A 与B 的关系为( )A.A >BB.A=10-4BC.B=10-4A D.A=B3.(★★★★)在室温下,某溶液中由水电离出的H +浓度为1.0×10-13 mol ·L -1,则此溶液中一定不可能.....大量存在的离子组是( ) A.Fe 3+、NO -3、Cl -、Na+B.Ca 2+、HCO -3、Cl -、K +C.NH +4、Fe 2+、SO -24、NO -3D.Cl -、SO -24、K +、Na +4.(★★★★★)Na 3PO 4(aq)中有多种分子和离子,其总数为 种。
试完成下列问题。
(1)写出一个以离子浓度表示的电荷守恒等式: 。
(2)写出一个含有c (OH -)和c (H +)的等式: 。
(3)根据Na 3PO 4中Na 、P 原子个数关系,写出一个含有c (Na +)和c (PO -34)的等式: 。
附:参考答案 难点磁场提示:根据电荷守恒,可知A 错B 对。
根据由水电离产生的H +和OH -个数相等,可知C对。
根据Na 2S 中,Na +个数是S 2-的两倍,可知D 对。
答案:BCD 歼灭难点训练1.提示:常温下,c (H +)=1.0×10-7 mol ·L -1,即每升水中已电离的水的物质的量是1.0×10-7mol ,而每升水的物质的量是1-molg 18g1000⋅,则: n =181000mol ∶10-7 mol=5.56×108答案:B2.提示:本题有两种解法。
方法1(常规解法):NaOH(aq)中:c 水(OH -)=c 水(H +)=91410100.1--⨯mol ·L -1=1.0×10-5 mol ·L -1CH 3COONa(aq)中:c ′水(OH -)=c ′总(OH -)=10-9 mol ·L -1则A ∶B=10-4方法2(巧解法):NaOH(aq)中,水的电离被抑制;CH 3COONa(aq)中,水的电离被促进;故A <B 。
答案:B3.提示:c 水(H +)=1.0×10-13 mol ·L -1,则该溶液可能是强碱性溶液,也可能是强酸性溶液,总之,水的电离被抑制。
因而“一定不可能大量存在”是指酸性和碱性条件下都不能大量存在。
答案:BC评注:若去掉题干中的“不可”,则选D 。
若去掉题干中的“一定不”,则选AD 。
4.提示:Na 3PO 4完全电离,水部分电离:Na 3PO 4====3Na ++PO -34 H 2OH ++OH -PO -34发生系列水解: PO -34+H 2O HPO -24+OH -HPO -24+H 2OH 2PO -4+OH -H 2PO-4+H2O H3PO4+OH-答案:8(1)c(Na+)+c(H+)==c(OH-)+3c(PO-34)+2c(HPO-24)+c(H2PO-4)(2)c(H+)+c(HPO-24)+2c(H2PO-4)+3c(H3PO4)==c(OH-)(3)c(Na+)==3c(PO-34)+3c(HPO-24)+3c(H2PO-4)+3c(H3PO4)。