南开大学有机化学课件(王积涛版) 26
- 格式:pdf
- 大小:581.94 KB
- 文档页数:91

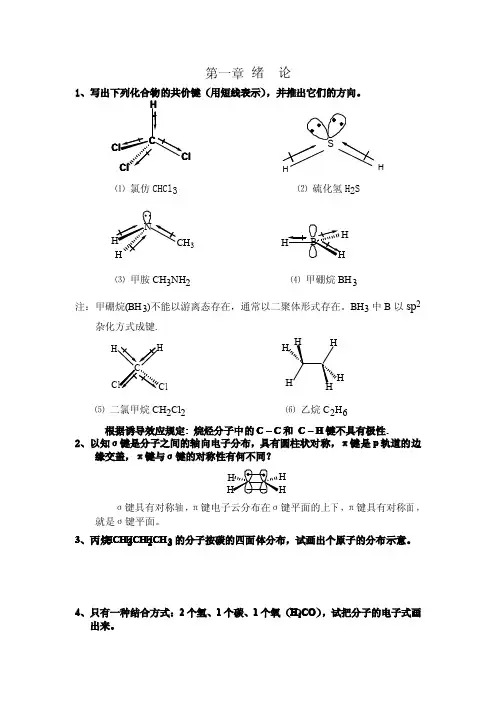
第一章绪论1、写出下列化合物的共价键(用短线表示),并推出它们的方向。
lCH⑴氯仿CHCl 3⑵硫化氢H 2S3H⑶甲胺CH 3NH 2⑷甲硼烷BH 3注:甲硼烷(BH 3)不能以游离态存在,通常以二聚体形式存在。
BH 3中B 以sp2杂化方式成键.l⑸二氯甲烷CH 2Cl 2⑹乙烷C 2H 6根据诱导效应规定:烷烃分子中的C–C 和C –H 键不具有极性.2、以知σ键是分子之间的轴向电子分布,具有圆柱状对称,π键是p 轨道的边缘交盖,π键与σ键的对称性有何不同?σ键具有对称轴,π键电子云分布在σ键平面的上下,π键具有对称面,就是σ键平面。
3、丙烷CH C H 3CH C H 2CHC H 3的分子按碳的四面体分布,试画出个原子的分布示意。
4、只有一种结合方式:2个氢、1个碳、1个氧(H 2CO C O ),试把分子的电子式画出来。
5、丙烯CH 3CH =CH 2中的碳,哪个是sp 3杂化,哪个是sp 2杂H OH 化?33226、试写试写出丁二烯分子中的键型:CH 2 = CH __ CH = CH 2σ-σ- σ- π-π- 7、试写出丙炔CH 3C≡CH中碳的杂化方式。
你能想象出sp 杂化的方式吗?332根据杂化后形成的杂化轨道有着最佳的空间取向,彼此做到了最大程度的远离,可想像2个sp 杂化轨道之间的夹角应互为1800,sp 杂化的碳原子应为直线型构型。
8、二氧化碳的偶极矩为零,这是为什麽?如果CO 2遇水后形成HCO 3-或H 2CO 3,这时它们的偶极矩还能保持为零吗?碳酸分子为什麽是酸性的?化合物分子的偶极矩是分子中所有键偶极矩的矢量和,二氧化碳分O = C = O 子中两个碳氧键的偶极矩大小相等、方向相反,故二氧化碳分子的偶极矩为零。
C -O O O -C HO O O H-2H+-O H 碳酸和碳酸氢根的偶极矩不为零。
碳酸根中的氧电负性比较大,具有容纳负电荷的能力。
换言之:碳酸失去H +后形成的共轭碱碳酸根负离子比较稳定,所以碳酸分子显示酸性。

Concerted Reactions1协同反应-反应中旧键的断裂与新键 的形成协同进行的反应 特点-不受溶剂,催化剂等的影响 经历环状过渡态,没有中间体产生 电环化反应, 环加成反应,σ迁移反应2§1 电环化反应Electrocyclic Reactions一、定义及反应特点电环化反应-开链共轭多烯在一定条件下(热或光) 环合及其逆反应hνhν特点-具有高度的立体专一性3CH3CH3 CH3hνH CH3 HCH3 CH3CH3CH3 CH3 hνH CH3 HCH3 CH3立体专一性决定于:多烯中双键的数目;反应的条件 是加热或光照4二、立体选择性的解释1、前沿轨道CH2=CH-CH=CH2LUMO-Lowest Unoccupied Molecular OrbitalHOMO-Highest Occupied Molecular Orbital前沿轨道-HOMO, LUMO 1,3-丁二烯π分子轨道 基态5CH2=CH-CH=CH-CH=CH2π6π5LUMOπ4LUMOHOMOπ3HOMOπ2π11,3,5-己三烯π分子轨道基态激发态62、立体选择性解释电环化反应立体选择性由前沿轨道的对称性决定 1,3-丁二烯型化合物 CH2=CH-CH=CH2 A 热电环化反应HOMO π2顺旋H3C HH3CCH3HCH3H3CH H3CH7B 光照下的电环化反应hνHOMO π3对旋H3C Hhν H3C HCH3 CH3H3CH H3CH81,3,5-己三烯型化合物 A 热电环化反应CH2=CH-CH=CH-CH=CH2HOMOπ3对旋CH3H H3C H3CCH3H3CH H3 CHH9B 光照下的电环化反应HOMOπ4顺旋hν H H3C H3C HCH3CH3H3C H H3C H10电开环反应的立体选择性开环反应的立体选择性与环合时相同 如1,3-丁二烯环合时有四个电子参与反应,那么涉及四个电子的开 环反应的立体选择性与它环合时相同,即加热为同旋,光照为对旋CH3CH3H3 C HH3CHCH3CH3hν H3CH H3C Hhν 1,3-丁二烯1,3,5-己三烯4个π电子6个π电子顺旋(同旋)对旋对旋顺旋(同旋)11Woodward-Hoffmann Roleshν 4n个π电子 (4n+2)个π电子hνH H顺旋(同旋) 对旋对旋 顺旋(同旋)HH12HOMO π3HH HHH4个π电子的开环H6个π电子的关环HHH H H HH H H HH H H HH4个π电子的 顺旋开环6个π电子的对旋关环13§2 环加成反应 Cycloaddition Reactions+ hν[2+2]环加成+[4+2]环加成14一、[4+2]环加成CO2Et + CO2EtCO2Et + EtO2C CO2Et CO2EtCO2Et CO2Et特点:高度的立体专一性15HOMO π2LUMO π2轨道同面/同面 加成-新形成 的两个键在同 一面上LUMO π3HOMO π116一般情况下,只要参与反应的π电子数符合(4n+2), 在加热条件下均可进行同面/同面环加成O + O[4 + 6]NN+ CH3O2C CO2CH3CH3O2C CO2CH3[8 + 2]17区域选择性G +LG LG 给电子取代基L 拉电子取代基G + LG L18N(C2H5)2 +C2H5O +CO2CH3N(C2H5)2 CO2CH3C2 H5O CO2CH3 CO2CH3CO2CH3 + CO2CH3CO2C2 H5 N N CO2C2 H5CO2CH3 CO2CH3+N CO2C2H5 N CO2C2H519RCN2 RN3R2C N N RN N NR2C N N RN N NN NH2C N N + H3C EtO2CO2NH2C H3CCO2EtCO2Et CH3CH3 CO2EtN N N+NN NNO220二、[2+2]环加成HOMO π1 异面x+No ReactionLUMO π2同面热禁阻hνHOMO π2+光允许LUMO π2同面同面21+ Ohν O H3C CH3CO2Et hνCO2Et一般情况下,只要参与反应的π电子数符合4n,在 光照条件下也可进行同面/同面环加成hν [10 + 2] + CH3O2C CO2CH3 CH3O2C CO2CH322§3 σ迁移-Sigmatropic ReactionsZ C C C1 2 3Z CZ CZ C C C1 2 3[1,3]-σ迁移Z C C C C C1 2 3 4 5Z C C C C C1 2 3 4 5[1,5]-σ迁移Z C C C nC C1 2 3Z C C C C nC1 2 3[1,j]-σ迁移 [3,3]-σ迁移 Cope重排23C C C C C C1 2 3C CC C C C C C1 2 3[1,j]- σ迁移同面异面2425具有奇数个轨道的自由基基态时HOMO轨道节点通过该碳,它的p轨 道对形MO轨道没有贡献C C C CCCC C C C CCCCCCCCC C C C C C CC C C C C C C C=C特点:在这些具有奇数个轨道的自由基基态 的HOMO轨道中,节点正好通过偶数碳原子26H [1,3]-H迁移 C C CHH C C C ??几何角度考虑,在加热 条件下[1,3]-H迁移困 难,张力太大H异面H hν C C CHH C C CH光照下[1,3]-H 迁移是允许的同面27[1,5]-H迁移H C C C C C1 2 3 4 5H C C C C C1 2 3 4 5HH同面加热条件下[1,5]H迁移易发生28H3C5 4 3H1 2CH3 [1,5]-H迁移 R.T H HCH3 [1,5]-H迁移 R.T H H 3-甲基环戊二烯CH35-甲基环戊二烯1-甲基环戊二烯NaH CH3CH3I+ H3C CH3 CH3CH3 + CH329CH3hν H HOHO7−脱氢胆固醇hν维生素D3[1,7]-sigmatic antarafacial reactionCH3HO30[3,3]-σ迁移-Cope重排2 1 1' 2'CH33 3'[3,3]-σ迁移CH3CH3 H CH3 H HCH3 H CH3CH3 H CH3 H31[3,3]-σ迁移热允 许,光禁阻的32OOOHOOHHOO33Claisen重排H2C H2C C CH2 H [3,3]-σ迁移 H O O C CH2 CH2 CHO C CH2 H H C CH2OCH=CH2OH CH-CH=CH2 CH3OH CH3OO-CH2-CH=CHCH3OCH3 CH-CH=CH2 HO-CH2-CH=CHCH3 CH3O OCH3OCH334CH2-CH=CHCH3ProblemExplain whether this reaction is allowed or forbidden and predict whether the reactant or product is favored at equilibrium.Solution: It’s a [3,3]-sigmatropic rearrangement and is thermally allowed. The reactant is favored at equibrium because it has less angle strain.35。


第六章旋光异构旋光性与分子手性1808年,马露(Malus)发现了偏光,1811年法物理学家阿瑞洛(Arago)在研究石英的光学性质时发现:天然的石英有两种晶体,一种使偏光左旋,称“左旋石英”;另一种使偏光右旋,称“右旋石英”。
这两种石英不具有任何对称性,两者互为实物与镜像的关系,互相不能重叠,正如人的左、右手。
1815年,法物理学家拜奥特(Biot)观察到蔗糖水溶液、酒石酸水溶液、松节油的酒精溶液、樟脑的酒精溶液等都具有旋光能力。
1863年,德有机化学家韦斯立森努斯(Wislicenus)对乳酸进行了一系列研究发现:肌肉乳酸(+)和发酵乳酸(—)具有相同的组成,但旋光方向相反。
因此,他断言:如果分子在结构上是相同的,然而性质不同的话,这种差别,只能认识为原子在空间的不同排布。
1874年,Von’t Hoff和LeBel分别提出了碳四面体学说:如果碳原子位于一个正四面体中心,那么与碳相连的四个原子或基团将占据四面体的四个顶点,它们若有旋光性应归结于不对称取代的碳原子。
二、手性(一)对称因素:1. 对称面(二)判别手性分子的依据有对称面、对称中心的分子均可与其镜象重叠,是非手性分子;反之,为手性分子。
至于对称轴并不能作为分子是否具有手性的判据。
既无对称面也没有对称中心的,一般判定为是手性分子。
分子的手性是对映体存在的必要和充分条件。
对映异构体的性质1 结构:镜影与实物关系。
2 内能:内能相同。
3 物理性质和化学性质在非手性环境中相同,在手性环境中有区别。
4 旋光能力相同,旋光方向相反。
费歇尔(Fischer)投影式投影方法是:把含手性碳原子的主链直立,编号最小的基团放在上端;用十字交叉点代表手性碳原子;手性碳原子的2个横向键所连的原子或基团,表示伸向纸平面的前方;2个竖立键所连的原子或基因,伸向纸平面的后方。
乳酸对映体的费歇尔投影式费歇尔投影式是用平面式代表三维空间的立体结构。
所以在书写投影式时,必须严格地按照其规定表示分子构型的立体概念。

Alkane烃:由碳氢两种元素组成的化合物烷烃 烯烃 脂肪烃 炔烃 烃 芳香烃 脂环烃§1 烷烃的结构及表示式碳的核外电子排布C 1S2杂化轨道理论C 1S2 2S1 2P32S22P23SP3杂化轨道4甲烷结构H H C H H 构造式CH4 简式5乙烷结构H H H C C H H H 构造式CH3CH3 简式C2H6 分子式6乙烷透视式H H H H乙烷纽曼式H H架锯式H H H H H H7构象异构体H H H H交叉式σ键的自由旋转所产生的不同空间形象H H稳定性:交叉式>重叠式后碳绕C-C键旋转180oH HH H HH重叠式8丁烷的构象分析H2 H2 CH3 C C CH31 2 3 44CH3 H H H14 C3 绕C2 -C 3 键旋转60oHHCH3 HH H H4H CH360o160oH HH H CH3 CH31 4H CH3H CH31CH3反式交叉反错重叠邻位交叉顺式重叠稳定性:反式交叉>邻位交叉>反错重叠>顺式重叠91021§4烷烃的物理性质Phsical Properties of Some Unbranched Alkanes22Physical Properties of the Isomeric Alkanes of Molecular Formula C 6H 14色散力-范德华力瞬间偶极相互作用瞬间偶极228326. 反应活性与自由基稳定性的关系自由基的结构氢的反应活性:3o H >2o H > 1o H > CH 4自由基稳定性:3o > 2o > 1o > CH 3.33自由基的结构哈蒙特(Hammond)假说早期过渡态后期过渡态3536poor antiknock good antiknockC37。



第十一章含氮化合物在有机化学中,分子中含氮的有机物称为含氮有机化合物,含氮有机物中有硝基化合物、胺、腈、重氮盐以及氨基酸和蛋白质等。
11.2 胺的分类和命名11.2.1 胺的分类氨分子中的一个或几个氢原子被烃基取代形成的化合物称为胺,据被取代的氢的数目可将胺分为:•伯胺:一级胺一个氢原子被取代如:甲胺•仲胺:二级胺二个氢原子被取代如:二甲胺•叔胺:三级胺三个氢原子被取代如:三甲胺此分类中伯、仲、叔胺与醇中不同,需要特别注意。
据取代的烃基类型的不同,可分为:•脂肪胺:全部是烷基的胺如:甲胺、二甲胺•芳香胺:至少有一个是芳基的胺如:N-甲基苯胺胺还可根据分子中氨基的数目可分为:•一元胺分子中有一个氨基如:乙胺•二元胺分子中有二个氨基如:乙二胺•多元胺分子中有多个氨基氨接受一个质子后形成铵离子,同样与之类似,胺再接受一个质子得到的产物,亦可称为铵离子。
三级胺也可与一个烃基结合在一起,提到的相应结构的铵称为季铵盐或季铵碱。
如:(CH3)3N (CH3)4N+I-叔胺季铵盐•伯胺、仲胺中的N与其他胺中的N上的H原子可形成分子间氢键,使伯胺、仲胺的沸点较分子量相近的醚的沸点高。
由于N-H键极性比O-H键弱,所以胺中形成的N-H氢键比醇和酸中O-H氢键弱,故沸点较相应的醇和酸低。
•叔胺中N原子上无活泼氢,不能形成分子间氢键,所以其沸点较低。
•伯、仲、胺胺都可与水形成氢键,因此低级胺可溶于水,也能溶于醚、醇和苯。
芳胺的碱性在苯胺中,氨基与苯环形成p-π共轭体系,-NH2使苯环活化,即苯环上电子云密度增加,则N上的电子云密度下降,所以氨的碱性大于苯胺的碱性。
芳环上连有取代基时,对芳胺的碱性也有影响。
•供电子基有利于提高N原子上的电子云密度,使芳胺碱性增强,但仍小于氨。
•供电子基所在位置不同,对碱性增加的贡献也不同,处于氨基邻、对位的供电子基可通过共轭效应,增强芳胺的碱性。
•供电子基在间位时,共轭效应的影响较小,碱性增强的也少。

第五章脂环烃第一节脂环烃的分类和命名第二节脂环烃的化学性质第三节脂环烃的结构
第一节脂环烃的分类和命名
一、单环烃
1、母体(环某烷、环某烯、环某炔)
2、编号
1)按“次序规则”,较优基团所在的碳后编号。
2)有双键,则从双键碳开始,经过双键,使取代基位次尽可能小。
小环不稳定,C-C键易断;环增大,加成活性降低;
第三节环烷烃的结构与稳定性
实验事实:
环的稳定性:三元环<四元环<五元、六元环why?结构所致!环张力所致!
•环烷烃的环张力越大,表明分子的能量越高,稳定性越差,越容易开环加成。
环丙烷的结构
物理方法测得,环丙烷分子中三个碳原子共平面。
显然,环丙烷中没有正常的C-C键,而是形成“弯曲键”:
由于环丙烷分子中的C-C键不是沿轨道对称轴实现头对头的最大重叠,而重叠较少,张力较大,具有较高的能量。
根据结构与性能的关系,环丙烷的化学性质应该活泼,容易开环加成。
脂环烃的主要来源和制法主要来源:石油。
制法:
(1) 芳香族化合物催化氢化
(2) 分子内关环
(3) 其它方法
本章重点:
①环的大小与其稳定性(三元、四元环不稳定,易开环加成;五元、六元环稳定,不易开环加成);
②环丙烷的结构、弯曲键的不稳定性;
③环己烷的构象:
a. 通过C-C键的自由旋转形成椅式构象,消
除张力;
b. 椅式构象中的a键、e键,a、e键的相互转
换,e键取代稳定。
环己烷的椅式构象
芳香烃
芳香族碳氢化合物简称芳香烃或芳烃。
一般在分子中都有一个苯环的结构。
它具有与烷、烯、炔不同的典型性质。
芳烃名称的由来及分类
•芳香烃是指含有苯环的烃类有机物。
“芳香”一词是历史习惯造成的,当时人们得到的含苯环的化合物大多是从天然植物中提取的具有香味的物质,
•如从茴香中提取的茴香醚、从肉桂中提取的肉桂酸等有一种浓郁的香味,这一类有机物就以“芳香”一词来命名。
•现代“芳香”则不再是指其味道,相反,苯、甲苯、萘等大多数的芳烃的气味十分难闻。
•“芳香”是指芳烃具有的不同于脂肪烃的独特的性质——芳香性。
芳香性
•从苯的分子式(C6H6)来看,它应与乙炔(C2H2)一样是高度不饱和的烃类化合物,应该与乙炔类似,容易进行加成和氧化反应,较难发生取代反应,但实际正与此相反。
•苯的性质非常稳定,不易加成和氧化反应,相对容易发生取代反应。
•芳烃具有的这种难加成、难氧化、易取代的不同于脂肪烃的化学性质称为芳香性。
•芳烃按分子内环的多少、结合方式可分为以下几类:
苯的结构
•苯最初是由法拉第于1825年发现的,他发现在使用过的煤气桶底部总是残留着一些液体,并对这些液体进行了研究,从中提取出一种碳氢比较高的液体,测定了其C:H=1:1,法拉第把它叫碳化氢。
•到1833年,人们才测出其分子式为C
6H
6
,但对其
分子结构不太清楚,当时人们已经知道高度不饱和化合物多为炔烃。
但却可确定该化合物结构肯
定不是CH
3-C≡C-C≡C-CH
3
及CH≡C-C≡C-CH
2
-
CH
3等与此类似的结构。
因为苯不易发生与它们
性质相似的加成和氧化反应,而与它们的性质区别很大。
苯结构的现代理论
价键理论
•该理论认为苯中的6个碳原子和6个氢原子都在一个平面内,碳原子采用sp2杂化方式,碳碳间形成闭合环,6个碳构成平面正六边形。
•碳-碳键键长为0.1396nm,比C-C单键键长0.154nm短,比C-C双键键长0.134nm长,各键角都是120°。
•每个碳原子以sp2杂化轨道与相邻碳原子的sp2杂化轨道相互交盖,构成6个等同的碳碳σ键,同时每个碳原子以sp2杂化轨道与氢的1s轨道重叠成6个等同的碳-氢σ键。
单环芳烃的物理性质
1. 状态芳烃大多是有特殊气味的油状液体,苯及苯蒸气有毒,可影响人的呼吸道和造血器官。
长期接触容易导致白血病,在苯的同系物中,二甲苯的毒性相对较小。
2. 沸点比相应的烷、烯烃要高,随分子量增加而有规律地变化,每增加一个系差,则沸点增加30℃左右。
苯的沸点为80℃。
3. 密度d<1,大约在0.86~0.9之间。
但比分子量相近的烷烃、烯烃的相对密度大。
4. 溶解度苯及同系物难溶于水,易溶于有机溶剂,苯本身就是极好的有机溶剂。
如:苯和乙酸异戊酯的混合液,俗称“香蕉水”,是油漆的良好溶剂。
5. 危险性苯爆炸极限1.5~8.0%(V),燃烧时火焰明亮,若空气不足,则有大量黑烟(C:H高,燃烧不完全,有碳生成)。
苯蒸气密度大于空气,易聚于地面附近,难扩散,燃烧危险性大。
单环芳烃的化学性质
苯的化学性质稳定,是常用的有机溶剂,它不易发生加成反应和氧化反应,但相对容易发生取代反应。
常见反应有以下反应:•取代反应
•加成反应
•氧化反应
•其取代反应机理与烷烃的自由基取代反应机理不同,属于亲电取代反应机理。
取代反应
•苯环上的氢可被亲电试剂取代,是典型的亲电取代反应。
常用的亲电试剂有-X 、-NO 2、-SO 3H 、-R 等,可发生以下几种反应。
•
卤代反应•
硝化反应•
磺化反应•
傅瑞德尔-克拉夫茨烷基化反应•
傅瑞德尔-克拉夫茨酰基化反应•亲电取代反应机理(加成消除机理)。