高三一轮复习-------钠镁铝及其化合物学案
- 格式:doc
- 大小:137.00 KB
- 文档页数:3
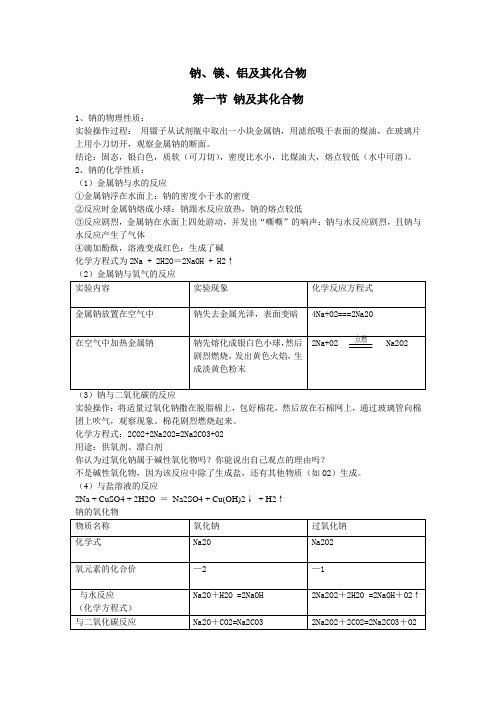
钠、镁、铝及其化合物第一节钠及其化合物1、钠的物理性质:实验操作过程:用镊子从试剂瓶中取出一小块金属钠,用滤纸吸干表面的煤油,在玻璃片上用小刀切开,观察金属钠的断面。
结论:固态,银白色,质软(可刀切),密度比水小,比煤油大,熔点较低(水中可溶)。
2、钠的化学性质:(1)金属钠与水的反应①金属钠浮在水面上:钠的密度小于水的密度②反应时金属钠熔成小球:钠跟水反应放热,钠的熔点较低③反应剧烈,金属钠在水面上四处游动,并发出“嘶嘶”的响声:钠与水反应剧烈,且钠与水反应产生了气体④滴加酚酞,溶液变成红色:生成了碱化学方程式为2Na + 2H2O=2NaOH + H2↑(2)金属钠与氧气的反应实验内容实验现象化学反应方程式金属钠放置在空气中钠失去金属光泽,表面变暗4Na+O2===2Na2O点燃在空气中加热金属钠钠先熔化成银白色小球,然后2Na+O2 Na2O2剧烈燃烧,发出黄色火焰,生成淡黄色粉末(3)钠与二氧化碳的反应实验操作:将适量过氧化钠撒在脱脂棉上,包好棉花,然后放在石棉网上,通过玻璃管向棉团上吹气,观察现象。
棉花剧烈燃烧起来。
化学方程式:2CO2+2Na2O2=2Na2CO3+O2用途:供氧剂、漂白剂你认为过氧化钠属于碱性氧化物吗?你能说出自己观点的理由吗?不是碱性氧化物,因为该反应中除了生成盐,还有其他物质(如O2)生成。
(4)与盐溶液的反应2Na + CuSO4 + 2H2O =Na2SO4 + Cu(OH)2↓+ H2↑钠的氧化物物质名称氧化钠过氧化钠化学式Na2O Na2O2氧元素的化合价—2 —1Na2O+H2O =2NaOH 2Na2O2+2H2O =2NaOH+O2↑与水反应(化学方程式)与二氧化碳反应Na2O+CO2=Na2CO3 2Na2O2+2CO2=2Na2CO3+O2(5)苏打与小苏打性质苏打Na2CO3小苏打NaHCO3比较及应用主要物性易溶,白固易溶,白固相同温度下苏打比小苏打易溶溶液酸碱性碱性碱性稳定性受热不易分解受热分解与CO2不反应 1.鉴别固体Na2CO3和NaHCO32. NaHCO3转化为Na2CO3与盐酸反应反应Na2CO3转化为NaHCO3与烧碱溶液不反应反应盐酸浓度相同时小苏打快与氯化钙溶液反应不反应鉴别NaHCO3和Na2CO3与Ca(OH)2溶液反应反应均产生白色沉淀(6)氢氧化钠1、氢氧化钠的物理性质氢氧化钠,化学式为NaOH,俗称烧碱、火碱、苛性钠(香港亦称“哥士的”),为一种具有高腐蚀性的强碱,一般为片状或颗粒形态,易溶于水并形成碱性溶液,另有潮解性,易吸取空气中的水蒸气。

第三章金属及其化合物一、钠及其化合物(一)钠单质1、物理性质:金属钠银白色,硬度:软,密度比水小,熔沸点低,导电性、导热性优秀钠露置与空气中的过程变化:化学钠保留在白腊油或煤油中,由于钠易与水或许空气中的氧气反响,而钠不与煤油反响,且钠的密度大于煤油的密度,所以保留在煤油中。
2、化学性质①与氧气反响4Na+O2=2NaO(常温 )2Na+O2Na2 O2 ( 过氧化钠 )2NaO+O22NaO2②与非金属反响2Na + Cl22NaCl2Na + S=Na S2③与水反响: 2Na + 2H 2 O = 2NaOH + H2↑钠与水反响的实验现象:浮、熔、游、响、红。
钠焚烧惹起火灾,一般用砂土盖灭。
④钠与酸的反响2HCl + 2Na = 2NaCl + H 2↑⑤将钠与盐的反响a.若将钠放入CuSO4溶液中,发生以下反响:2Na+2HO= 2NaOH+H↑CuSO4+2NaOH= Cu(OH)2↓+Na2SO4b.钠可与某些熔盐作用,置换出相应金属。
如: 4Na + TiCl 4 ( 熔) =4NaCl + Ti(二)钠的化合物1、 Na2O和 Na2 O2名称氧化钠 (Na O)过氧化钠 (Na O)222电子式分类碱性氧化物过氧化物阴阳离子个数比1:21:2色态白色固体淡黄色固体化与水反响Na2 O +H2O=2NaOH2Na2 O2+2HO=4NaOH+O2↑学与 CO2反响Na2 O +CO2=Na2CO32Na2 O2+2CO==2NaCO3+O2性与酸反响Na2O +2HCl= 2NaCl + H 2O2NaO2 +4HCl=4NaCl+O2↑ +2HO 质特征__________________Na2O2有强氧化性,能够使品红溶液退色,有漂白作用、杀菌消毒。
Na2O2与 CO2、 H2O反响的各样关系Na2O2的强氧化性Na2O2可与 SO2、 H2S、 FeCl2等复原性物质反响。


第7讲 镁、铝及其重要化合物考点一 镁单质及其重要化合物的性质及海水提镁ZHI SHI SHU LI 知识梳理 1.镁的原子结构和存在镁位于元素周期表__第3周期第ⅡA 族___,原子结构示意图为_____,镁性质活泼,在自然界中的镁全部以__化合___态存在。
2.镁的性质 (1)物理性质①镁:镁是__银白___色有金属光泽的固体,密度__较小___,硬度__较低___。
有良好的导电、传热和延展性。
②镁合金:密度__较小___,硬度和强度都__较大___。
(2)化学性质①与非金属单质的反应A .镁条在O 2中燃烧,发出耀眼的强光,生成白色固体物质,反应的化学方程式为__2Mg +O 2=====点燃2MgO___。
B .镁条在点燃的条件下能与N 2反应,化学方程式为 __3Mg +N 2=====点燃Mg 3N 2___。
②与水或酸的反应A .镁与水反应:镁不易与冷水反应,能与沸水反应 Mg +2H 2O=====△Mg(OH)2+H 2↑。
B .镁与酸的反应:镁是活泼金属,能与盐酸、稀硫酸反应放出H 2,反应的离子方程式为__Mg +2H +===Mg 2++H 2↑___。
③与某些氧化物的反应镁能在CO 2中燃烧,反应的化学方程式为 __2Mg +CO 2=====点燃2MgO +C___。
3.镁的提取和用途 (1)从海水中提取镁 ①工艺流程②基本步骤及主要反应(1)由MgCl 2·6H 2O 到无水MgCl 2,必须在HCl 气流中加热,以防MgCl 2水解。
(2)因镁在高温下能与O 2、N 2、CO 2等气体发生反应,故工业电解MgCl 2得到的镁,应在H 2氛围中冷却。
4.镁的重要化合物XIAO TI SU CE 小题速测1.判断正误,正确的画“√”,错误的画“×”。
(1)点燃的镁条能够在空气中剧烈燃烧,将点燃的镁条插入CO 2气体中,镁条停止燃烧( × )(2)镁条在空气中燃烧得到的灰白色物质为纯净物( × ) (3)在镁条参加的化学反应中,镁均作还原剂( √ )(4)从海水中提取镁所涉及的化学反应全都是氧化还原反应( × ) (5)将氯化镁晶体(MgCl 2·6H 2O)直接加热可制得无水氯化镁( × ) (6)镁着火时可用泡沫灭火器灭火( × )(7)可以直接将MgCl 2溶液蒸干获得无水MgCl 2( × ) (8)可以通过电解MgCl 2溶液的方法制取Mg( × )(9)下列转化关系均可通过一步反应实现:Mg ―→MgO ―→Mg(OH)2―→MgCl 2( × ) (10)1 mol Mg 与足量盐酸反应时,转移2N A 个电子( √ )2.“绿色化学”要求从经济、环保和技术上设计可行的化学反应。

镁、铝及其化合物第二节 镁、铝及其化合物1.了解铝、镁及其重要化合物的制备方法。
2.掌握铝、镁及其重要化合物的主要性质及其应用。
考点(一) 镁、铝 【点多面广精细研】1.铝的性质和用途 (1)物理性质 色、态 密度质地导电、导热、延展性存在 银白色,有金属光泽的固体较小柔软良好自然界中以化合态存在[注意] 铝是地壳中含量最高的金属元素,仅次于硅元素。
(2)化学性质写出图中标号反应的化学方程式或离子方程式:④2Al +2OH -+2H 2O===2AlO -2+3H 2↑。
⑤2Al +Fe 2O 3=====高温2Fe +Al 2O 3(铝热反应)。
(3)制备及用途2.(1)物理性质①镁:镁是银白色有金属光泽的固体,密度较小,硬度较低。
②镁合金:密度较小,硬度和强度都较大。
(2)对比记忆镁的化学性质①镁合金——用于制造火箭、导弹和飞机的部件。
②镁——制造信号弹和焰火。
[小题练微点]判断下列说法的正误(正确的打“√”,错误的打“×”)。
(1)(2017·全国卷Ⅱ)2.4 g Mg与H2SO4完全反应,转移的电子数为0.1N A( )(2)(2016·天津高考)用NaOH溶液除去镁粉中的杂质铝:2Al+2OH-+2H2O===2AlO-2+3H2↑()(3)(2015·全国卷Ⅰ)用坩埚钳夹住一小块用砂纸仔细打磨过的铝箔在酒精灯上加热,熔化后的液态铝滴落下来,说明铝的熔点较低( )(4)(2015·全国卷Ⅱ)浓硝酸滴入用砂纸打磨过的铝条中,产生红棕色气体( )(5)(2014·全国卷Ⅱ)铝与Fe2O3发生铝热反应,反应后固体物质增重( )(6)Mg粉与浓NH4Cl溶液反应放出H2和NH3( )(7)冶炼铝时常用焦炭作还原剂( )(8)1 mol Al与足量的硫酸或足量的氢氧化钠溶液反应转移电子数相同( )(9)铝与少量NaOH溶液反应得到铝盐,与足量NaOH溶液反应生成偏铝酸盐( )(10)相同质量的镁条分别在足量的CO2和O2中完全燃烧,所得固体的质量相同( )(11)工业上制造镁粉时,可将镁蒸气在N2中冷却( )答案:(1)×(2)√(3)×(4)×(5)×(6)√(7)×(8)√(9)×(10)×(11)×镁、铝的性质1.铝制品具有较强的抗腐蚀性,主要是因为( )A.铝的化学性质稳定B.铝在常温时与氧气不反应C.铝具有金属性,也具有非金属性D.铝与氧气反应生成一层致密的氧化物薄膜解析:选D 铝是活泼金属,化学性质活泼,故A错误;铝被氧气氧化生成氧化铝,而不是不反应,故B错误;铝具有金属性,不具有非金属性,故C错误;铝被氧气氧化生成氧化铝,氧化铝是致密的氧化物,能阻止铝进一步被氧化,故D正确。

第一单元 钠、镁及其化合物[考试标准]知识条目必考要求加试要求1.钠、镁的物理性质及用途a a 2.钠、镁的化学性质(跟非金属、酸、某些氧化物的反应)bc 3.钠、镁的生产原理a b 4.碳酸钠、碳酸氢钠的性质及检验方法 b c 5.碳酸钠、碳酸氢钠的用途 a a 6.过氧化钠的性质c考点一 钠的性质、制备与用途 焰色反应1.钠的物理性质颜色:银白色,有金属光泽; 密度:ρ(H 2O)>ρ(Na)>ρ(煤油); 熔点:低于100 ℃;硬度:质地柔软,可以用小刀切割。
2.从钠原子的原子结构认识钠的化学性质——还原性(1)与非金属单质(如O 2、Cl 2)的反应O 2⎩⎨⎧常温:4Na +O 2===2Na 2O 点燃:2Na +O 2=====点燃Na 2O 2Cl 2:2Na +Cl 2=====点燃2NaCl 。
(2)与水反应①离子方程式:2Na +2H 2O===2Na ++2OH -+H 2↑。
②与滴加酚酞的水反应的现象及解释(3)与盐酸反应离子方程式:2Na +2H +===2Na ++H 2↑。
(4)Na 与盐溶液反应 ①钠投入到NaCl 溶液中离子方程式:2Na +2H 2O===2Na ++2OH -+H 2↑。
②钠投入到CuSO 4溶液中离子方程式:2Na +2H 2O +Cu 2+===Cu(OH)2↓+2Na ++H 2↑。
3.钠的制取及保存(1)制取:化学方程式为2NaCl(熔融)=====通电2Na +Cl 2↑。
(2)保存:密封保存,通常保存在石蜡油或煤油中。
(3)露置于空气中钠的变化过程Na 2CO 3(溶液)―→Na 2CO 3·10H 2O(结晶)――→风化Na 2CO 3(粉末)4.钠的用途(1)制取Na 2O 2等化合物。
(2)钠、钾合金(液态)可用于原子反应堆的导热剂。
(3)用作电光源,制作高压钠灯。
(4)冶炼某些金属金属钠具有强还原性,熔融状态下可以用于制取金属,如4Na +TiCl 4(熔融)===4NaCl +Ti 。
专题3.2 镁铝及其重要化合物[考试说明]1.掌握铝及其重要化合物的主要性质及其应用。
2.掌握镁及其重要化合物的主要性质及其应用。
3.了解铝、镁及其重要化合物的制备方法。
[命题规律]有关Al及其化合物知识在高考中出现频率较高,“铝三角〞是命题的出发点。
高考中常以选择题型结合离子方程式的书写正误判断、离子共存问题考查Al及其化合物的转化;以化工流程图中铝土矿的开发为载体以填空题型考查镁、铝及其化合物的性质、制备等。
一、铝、镁的性质及应用1.铝的结构和存在铝位于元素周期表第三周期ⅢA族,原子结构示意图为。
铝是地壳中含量最多的金属元素。
自然界中的铝全部以化合态的形式存在。
2.金属铝的物理性质银白色有金属光泽的固体,有良好的延展性、导电性和传热性等,密度较小,质地柔软。
3.金属铝的化学性质写出图中有关反应的化学方程式或离子方程式:①AlO 2――→常温形成致密的氧化膜――→点燃4Al +3O 2=====点燃2Al 2O 3②2Al+3Cl 2=====点燃2AlCl 3③Al酸―――→氧化性酸遇冷的浓硫酸或浓硝酸钝化―――→非氧化性酸2Al +6HCl===2AlCl 3+3H 2↑④2Al+2NaOH +2H 2O===2NaAlO 2+3H 2↑ ⑤2Al+Fe 2O 3=====高温Al 2O 3+2Fe(铝热反应) 4.对比记忆镁的化学性质5.铝的用途纯铝用作导线,铝合金用于制造汽车、飞机、生活用品等。
二、铝的重要化合物 1.氧化铝(1)物理性质:白色固体,难溶于水,有很高的熔点。
(2)化学性质两性氧化物—――――→与HCl 反应Al 2O 3+6HCl===2AlCl 3+3H 2O――――→与NaOH 反应Al 2O 3+2NaOH===2NaAlO 2+H 2O2.氢氧化铝 (1)物理性质白色胶状不溶于水的固体,有较强的吸附性。
(2)化学性质(用化学方程式表示) Al(OH)3的电离方程式为①两性氢氧化物—――――――→与HCl 反应Al OH3+3HCl===AlCl 3+3H 2O――――――→与NaOH 反应AlOH 3+NaOH===NaAlO 2+2H 2O②受热分解:2Al(OH)3=====△Al 2O 3+3H 2O 。
高考化学一轮复习专题04 钠及其化合物学案苏教版1、理解钠的物理性质,掌握钠的化学性质。
2、以氢氧化钠为例,了解重要的碱的性质用用途。
3、了解钠的重要化合物。
☆考点透视☆一、钠的化学性质⑴与非金属反应①与氧气反应常温下能与空气中的氧气化合使其表面变暗。
4Na + O2 ====2Na2O (不稳定)在空气或氧气中燃烧,生成淡黄色固体。
2Na + O2 Na2O2(有黄色火焰)(稳定)②与硫反应:2Na + S ==== Na2S(研磨易爆炸)③与卤素反应:2Na + Cl22NaCl⑵与水反应:钠与水激烈反应,放出氢气并生成氢氧化钠,水中加酚酞,溶液呈红色。
2Na +2H2O ===2NaOH + H2↑注意a:钠与水(加酚酞)反应有四个现象:①水面上(比水轻);②熔化成闪亮的小球(反应放热点低);③迅速游动(产生氢气);④溶液呈红色(NaOH遇酚酞变红)。
b:反应实质:与水电离出的H+反应。
⑶与酸反应:钠与酸的反应比水反应更激烈爆炸,要特别小心。
2Na +2HCl =2NaCl + H2↑①钠不足,直接与酸反应;钠过量,先与酸反应再钠反应。
2Na +2H2O =2NaOH + H2↑②投入饱和NaCl溶液中,有H2放出,还有NaCl晶体析出(温度不变)。
③投入饱和NH4Cl溶液中,有H2和NH3逸出。
④投入CuSO4溶液中,有气体放出和蓝色沉淀生成。
2Na +2H2O + CuSO4 = Cu(OH)2↓+ Na2SO4 + H2↑二、金属钠露置在空气中的变化过程(Na)银白色金属钠表面变暗出现白色固体表面变成溶液(NaOH潮解)出现白色固体(生成Na2CO310H2O)生成白色粉末 (生成Na2CO3)有关反应如下:4Na + O2 ===2Na2O,Na2O + H2O===2NaOH2NaOH + CO2 === Na2CO3 + H2O三、氧化钠和过氧化钠的异同点比较名称氧化钠过氧化钠化学式Na2ONa2O2氧元素化合价-2-1电子式化合物类型离子化合物离子化合物颜色状态白色,固体淡黄色,固体某些化学性质与水反应Na2O + H2O =2NaOH2Na2O2 +2H2O =4NaOH + O2↑与CO2反应Na2O + CO2 = Na2CO32Na2O2 +2CO2 =2Na2CO3 + O2 与盐酸反应Na2O +2HCl =2NaCl + H2O2Na2O2 +4HCl =4NaCl +2H2O + O2↑用途氧化剂、供氧剂、源白剂、杀菌剂保存隔绝空气,密封保存隔绝空气,远离易燃物,密封保存四、过氧化钠的强氧化性⑴Na2O2与SO2反应:Na2O2 + SO2 = Na2SO4。
第10讲镁、铝及其重要化合物鸟故知重温一、镁及其重要化合物的主要性质和应用1.镁的性质(1)物理性质:具有軽色金屈光泽的固体,密度、硬度均较小,熔点较低,有良好的导电性、导热性和延展性C(2)化学性质MgO、Mg3N2. MgCl2<①与非金属林2+ u④与M 3-1②与C6 . c CMg、也------------- M g --------------- ► Mg()、C③与热水Mg(OH)2、H2①与非金属反应( 占燃与()2反应:2Mg+()2 二2Mg()(产生强烈白光)占燃V 与Cl2反应:Mg+Cl? iMgCb点燃与N2反应:3Mg+\2…\匹3 N?X.点燃②与C02 反应:2Mg+C02^=2Mg0+C煮沸③与出0反应:艙+ 2出0^=虺(0小2+出f④与『反应:血+ 2H+=M『++H2 f2.海水提镁沉淀Mg 2'4— —Mg2++2()H ———Mg(OH)2 I制 MgCl 2->Mg(C)H)?+2HCl ——MgCl ?+2H 9O电解得Mg 电解->MgCl ?(熔融)Mg+Clo t3. 用途生产合金,冶金工业上用作还原剂和脱氧剂。
4. 镁的重要化合物物质主要性质氧化镁 碱性氧化物 MgO+2H + — Mg 2* -H 9() 氢氧 中强碱 Mg(OH)9+2H^- ——Mg-+2H,) 化镁难溶于水Mg 2++2()H~- —Mg(()H)9 |二、铝的性质及应用1.铝的物理性质[密度较尘,质地柔软a...................[在第二周期第川A 族 1 ------ 原子结构I1I•注意铝是地壳中含塑最高的金属元素。
2.掌握铝的化学性质及用途 (1) 铝的化学性质银口色有金属光泽 的固体存在在地壳||啲含量排廿盍 在第三位ryi④ 2A1 + 2()H _+2H 2O —2Al()r+3H 2 A髙温⑤ 2A1-Fe2()3 HAbd+ZFe (钳热反应)(2) 铝的制备及用途制备电解rH 鈕『片 Wrfr Al 。
A .Na 2CO 3
B .Na 2O 2 Na 2CO 3
C .NaOH Na 2CO 3
D .Na 2O 2 NaOH Na 2CO 3
练习6. 等物质的量的CO 2、N 2、O 2混合气体通过Na 2O 2后,体积变为原体积的8/9(同温同压),这时混
合气体中CO 2、N 2、O 2物质的量之比为( )
A .1∶3∶4
B .2∶3∶3
C . 3∶6∶7
D .1∶6∶9
练习7.关于氢氧化钠的说法错误的...
是 ( ) A.纯净的NaOH 为白色固体,易潮解,易溶于水,溶于水放出大量的热 B.称量NaOH 固体可直接放在托盘天平的托盘上称量 C.NaOH 溶液存放于带橡胶塞玻璃瓶中
D.NaOH 浓溶液不慎洒在皮肤上,应先用较多的水冲洗,再涂上硼酸溶液 练习8、(14课标2)下列反应中,反应后固体物质增重的是 ( )
A 、氢气通过灼热的CuO 粉末
B 、二氧化碳通过Na 2O 2粉末
C 、铝与Fe 2O 3发生铝热反应
D 、将锌粒投入Cu(NO 3)2溶液
练习9.2.1g CO 和H 2组成混合气体与足量O 2充分反应后,立即通入足量Na 2O 2固体中,固体质量增加A .2.1g
B .3.6 g
C .7.2 g
D .不可确定 ( )
【规律总结】:2Na 2O 2+2CO 2==2Na 2CO 3+O 2 ① 2Na 2O 2+2H 2O (g )==4NaOH+O 2 ②
对Na 2O 2固体而言,反应①中,Na 2O 2增重的质量相当于CO 2中的“CO ”的质量,反应②中,Na 2O 2增重的质量相当于H 2O 中的“H 2”的质量。
由此可推得,通式符合(CO )m (H 2)n 的物质完全燃烧产物通入足量的Na 2O 2固体完全反应后,固体质量的增加量等于原物质的质量。
四、钠元素的存及制备 :
1、钠元素在自然界中以 存在,钠单质的制备方程式 五、钠及其化合物的用途
钠单质的主要用途 ,过氧化钠的主要用途 碳酸钠的主要用途 ,碳酸氢钠的主要用途
元素化合物——金属元素钠、镁、铝及其化合物学案(二)
出右图中对应的化学方程式
① ② ③ ④
⑤ ⑥
⑦ ⑧
五、镁和铝
1.工业制取Al 采用电解熔融的氧化铝的方法,写出反应的化学方程式____________________________
2.海水提镁的过程:写出①、②的离子方程式
贝壳(CaCO 3)
△
生石灰 石灰乳
Mg(OH)2
MgCl 2溶液 MgCl 2固体
Mg+Cl 2↑ _______________________________________,__________________________________________ 2、化学性质(1)与非金属反应:常温下与空气中的O 2反应生成一层致密的氧化物薄膜,所以镁、铝都有抗腐蚀的性能。
镁、铝都能在氧气中燃烧。
Al+ Cl 2
Al+ S
注意:镁还能与N2反应,方程式
(2)与酸反应:Mg 、A1与盐酸、稀硫酸反应置换出H 2,铝在冷浓 H 2SO 4,冷浓硝酸中发生钝化。
(3)与某些氧化物反应
a .镁与二氧化碳反应: __________
b .铝热反应: Fe 2O 3+ Al — ,V 2O 5 + Al — 应用
Na[Al(OH)4]
加盐酸
加水
受热熔化 ②通电 加海水 ①
结晶 过滤
干燥
(4)与碱反应:镁不与碱反应,铝与碱液反应:
铝与NaOH溶液反应的化学方程式 ______ _________
离子方程式 _______________
练习10、铝分别与足量的稀盐酸和氢氧化钠溶液反应,当两个反应放出的气体在相同状况下体积相等时,
反应中消耗的HCl和NaOH物质的量之比为,反应的铝的质量之比为。
练习11、等量镁铝合金粉末分别与下列4种过量的溶液充分反应,放出氢气最多的是 ( )。
A.2 mol·L-1 H2SO4溶液 B.18 mol·L-1 H2SO4溶液
C.6 mol·L-1 KOH溶液 D.3 mol·L-1 HNO3溶液
练习12、镁和铝分别与等浓度、等体积的过量稀硫酸反应,产生气体的体积(V) 与
时间(t)关系如右图。
反应中镁和铝的( )
A.物质的量之比为3∶2
B.质量之比为3∶2
C.摩尔质量之比为2∶3
D.反应速率之比为2∶3
六、铝的化合物
1、Al2O3是性氧化物,Al2O3与盐酸反应的离子方程式:______________ _______。
Al2O3与NaOH溶液反应的化学方程式:__ _。
练习9.如何除去铝土矿(Al2O3)中含有的杂质Fe2O3、SiO2?(写出流程图)
2、A l(O H)3:a.吸附性:氢氧化铝是不溶于水的白色胶状物质、它能凝聚水中悬浮物,又有吸附色素
的性质,所以常用作。
b.A l(O H)3是性氢氧化物,与盐酸反应的离子方程式 _____
与N a O H溶液反应离子方程式
c.不稳定性:加热易分解,方程式为
d.Al(OH)3制备:
①用铝盐和氨水反应,其离子方程式为
②用向Na[Al(OH)4]溶液中通入CO2,其离子方程式为 ______
③ AlCl3溶液与Na[Al(OH)4]溶液混合其离子方程式 ____ 练习13、在30mL 1 mol·L-1氯化铝溶液中加入4 mol·L-1的烧碱溶液,若能生成0.01mol的沉淀,则加入的烧碱溶液的体积是()
A.3mL B.7.5mL C.27.5mL D.以上都不对
练习14、在硝酸铝和硝酸镁的混合溶液中,逐滴加入稀氢氧化钠溶液,直至过量。
下列表示氢氧化加入量(X)与溶液中沉淀物的量(Y)的关系示意图中正确的是()
六、重要的铝盐:
十二水合硫酸铝钾,俗称,化学式为
水溶液呈酸性原因: _______ 用途: ____________ 练习15、某化工厂生产中,要用到一种无色、可溶于水的晶体铝铵矾。
该晶体是一种复盐,其主要化学成分为十二水合硫酸铝铵。
向该复盐的浓溶液中逐滴加入浓氢氧化钠溶液。
将发生一系列变化。
已知,NH4+与[Al(OH)4]--在水溶液中不能大量共存,会发生如下反应:
NH4+ + [Al(OH)4]- = Al(OH)3↓ + NH3↑ + H2O
试回答:(1)硫酸铝铵在水溶液中的电离方程式为
(2)在逐滴加入浓氢氧化钠溶液的过程中,产生的现象有:
①溶液中出现白色沉淀;②有刺激性气体逸出;③白色沉淀量逐渐增多;
④白色沉淀完全消失;⑤白色沉淀逐渐减少。
请回答各种现象由先到后出现的顺序是(用序号回答):;
(3)写出滴入氢氧化钠溶液的过程中,有关反应的离子方程式:
①
②
③。