价类二维图复习元素化合物 金属钠及其化合物
- 格式:doc
- 大小:189.00 KB
- 文档页数:5

元素化合物及其价类二维图引子:元素化合物的知识给人的感觉就是“繁、乱、杂、难”,我们认为以物质的类别为横坐标,以某元素的化合价为纵坐标,在二维平面内,绘制含有某元素的物质的转化图像,既能体现“元素观”也能体现“分类观”和转化观,进而实现对元素化合物知识的系统化,有助于建立系统的知识体系,明确学习要点,形成化学基本观念。
思路点拨分析物质的通性分析氧化性和还原性元素的最高价态只有氧化性,元素的中间价态既有氧化性又有还原性,元素的最低价态只有还原性。
分析离子反应离子反应发生的条件包括生成沉淀、弱电解质或气体的复分解反应,也包括因氧化还原反应的导致的离子反应,还包括相互促进的彻底水解、沉淀的转化、络合反应等。
一、钠元素及其化合物1.价类二维图2.核心物质的性质3.重要化学方程式的书写0101钠和氧气在加热条件下的反应(化) 2Na +O 2=====△Na 2O 20102钠和氯气在加热条件下的反应(化) 2Na+Cl 2=====△2NaCl0103过氧化钠和水反应(化)2Na2O2+2H2O===4NaOH+O2↑0104过氧化钠和二氧化碳反应(化)2Na2O2+2CO2===2Na2CO3+O20105钠和水反应(离)2Na+2H2O===2Na++2OH-+H2↑0106氢氧化钠与过量二氧化碳反应(离)OH-+CO2===HCO3-0107钠和乙醇反应(化)2CH3CH2OH+2Na→2CH3CH2ONa+H2↑0108过量钠与氯化铝溶液反应,先后可能发生的三个反应(化)2Na+2H2O===2NaOH+H2↑AlCl3+3NaOH===Al(OH)3↓+3NaCl Al(OH)3+NaOH===Na[Al(OH)4]二、氯元素及其化合物1.价类二维图2.核心物质的性质3.重要化学方程式的书写0201向氯化亚铁溶液中滴加氯水(化) 2FeCl 2+Cl 2=2FeCl 30202铁在氯气中燃烧(化)2Fe+3Cl 22FeCl 30203氯气的尾气吸收(离) Cl 2+2OH -===ClO -+Cl -+H 2O 0204漂白粉的制备(化)2Ca(OH)2+2Cl 2===CaCl 2+Ca(ClO)2+2H 2O 0205漂白粉的失效(2 化)Ca(ClO)2+CO 2+H 2O===CaCO 3↓+2HClO 2HClO2HCl+O 2↑0206氯气的实验室制备(离)4H ++2Cl -+MnO 2=====△Mn 2++Cl 2↑+2H 2O0207将等物质的量的二氧化硫和氯气通入水中(离) SO 2+Cl 2+2H 2O===SO 2-4+2Cl -+4H +0208工业上盐酸的制备(化)Cl2+H22HCl0209氯离子检验(证明存在)过程中一定会发生的离子方程式(离)Cl-+Ag+===AgCl↓三、铁元素及其化合物1.价类二维图2.核心物质的性质3.重要化学方程式的书写0301铁在高温条件下与水蒸气反应(化)3Fe+4H 2O Fe 3O 4+H 2↑0302铁与硫化合(化) Fe+S =====△FeS0303铁与非氧化性强酸反应(离) Fe+2H +=== Fe 2++H 2↑0304铁和硫酸铜溶液反应(离) Fe+ Cu 2+=== Fe 2++ Cu0305铁和氯化铁溶液反应(离) Fe +2Fe 3+===3Fe 2+0306向氯化亚铁溶液中通入氯气(离) 2Fe 2++Cl 2===2Fe 3++2Cl -0307向硝酸亚铁溶液中滴加稀硫酸(离) 3Fe 2++NO 3-+4H +===3Fe 3++NO ↑+2H 2O0308向硫酸亚铁溶液(酸性)中滴加过氧化氢溶液(离)2Fe2++H2O2+2H+===2Fe3++2H2O0309向硫酸铁溶液中通入二氧化硫气体(离)2Fe2++SO2+2H2O===2Fe3++SO42-+4H+0310氢氧化亚铁露置在空气中(化)4Fe(OH)2+O2+2H2O===4Fe(OH)3四、碳元素及其化合物1.价类二维图2.核心物质的性质3.重要化学方程式的书写0401碳和浓硫酸在加热条件下反应(化)C+2H2SO4(浓)CO2↑+2SO2↑+2H2O0402碳和水在高温条件下反应(化)C+H2O CO+H20403向次氯酸钠溶液中通入过量二氧化碳(离)ClO-+CO2+ H2O=HCO3-+HClO0404实验室制备二氧化碳(离)CaCO3 + 2H+ = Ca2++CO2↑+ H2O0405可溶性碳酸盐与强酸反应(离)CO32- + 2H+=CO2↑+ H2O0406碳酸氢钠溶液与氢氧化钠溶液反应(离)HCO3-+OH-=CO32- + H2O0407向碳酸氢钠溶液中滴加盐酸(离)HCO3-+H+=CO2↑+ H2O0408向可溶性碳酸盐溶液中加入氯化钡溶液(离)CO32- +Ba2+=BaCO3↓0409向氢氧化钡溶液中通入少量二氧化碳气体(离)Ba2++2OH-+CO2 =BaCO3↓+H2O0410加热碳酸氢钠固体(化)2NaHCO3Na2CO3+CO2↑+ H2O五、氮元素及其化合物1.价类二维图2.核心物质的性质3.重要化学方程式的书写 0501工业制氨气(化)N 2+3H 22NH 30502实验室制氨气(化)2NH 4Cl +Ca(OH)2=====△CaCl 2+2NH 3↑+2H 2O 0503铜与稀硝酸反应(离)3Cu +2NO -3+8H +===3Cu 2++2NO ↑+4H 2O 0504碳与浓硝酸的反应(化)C +4HNO 3(浓) =====△CO 2↑+4NO 2↑+2H 2O 0505氨的催化氧化(化) 4NH 3+5O 2=====催化剂△4NO +6H 2O 0506氯化铝溶液与氨水的反应(离)Al 3++3NH 3·H 20=A1(OH)3↓+3NH 4+0507氯化铵和氢氧化钠溶液在加热条件下反应(离) NH 4++OH -=====△NH 3↑+H 20 0508碳酸铵的受热分解(化)(NH 4)2CO 3=====△2NH 3↑+CO 2↑+H 20六、硫元素及其化合物 1.价类二维图2.核心物质的性质3.重要化学方程式的书写 0601铜与硫的化合(化) 2Cu+S =====△Cu 2S0602硫与浓硫酸的反应(化) S+2H 2SO 4(浓)=====△3SO 2↑+2H 2O 0603硫化氢和二氧化硫的反应(化) 2H 2S +SO 2===3S ↓+2H 2O 0604二氧化硫尾气的吸收(化) 2NaOH+SO 2=Na 2SO 3+H 2O0605二氧化硫的催化氧化(工业制备硫酸)(化) 2SO 2↑+O 2=====催化剂△2SO 3 0606将二氧化硫通入到溴水中(化) SO 2+Br 2+2H 2O===H 2SO 4+2HBr 0607浓硫酸和碳反应(化)C +2H 2SO 4(浓)=====△CO 2↑+2SO 2↑+2H 2O 0608浓硫酸和铜反应(化)Cu +2H 2SO 4(浓)=====△CuSO 4+SO 2↑+2H 2O七、镁元素及其化合物 1.价类二维图2.核心物质的性质3.重要化学方程式的书写0701镁与空气中燃烧时可能发生的反应(3 化)2Mg+ O22MgO 3Mg+N2Mg3N22Mg+ CO22MgO+C 0702工业上镁的炼制(化)MgCl2Mg+Cl2↑0703氢氧化镁与盐酸反应(离)Mg(OH)2+2H+===Mg2++2H2O0704氯碱工业(化)2NaCl+2H2O2NaOH+Cl2↑+H2↑0705向溴化钠溶液中滴加氯水(离)2Br-+Cl2===2Cl-+Br20706向碘化钾溶液中滴加溴水(离)2I-+Br2===2Br-+I2八、硅元素及其化合物1.价类二维图2.核心物质的性质3.重要化学方程式的书写0801硅与氧气在加热条件下的反应(化) Si+O 2=====△SiO 20802不能用带玻璃塞的试剂瓶保存碱性溶液的原因(化) SiO 2+2NaOH===Na 2SiO 3+H 2O 0803玻璃刻蚀过程中发生的反应(化) SiO 2+4HF===SiF 4↑+2H 2O 0804工业上硅的制备(化)SiO 2+2C Si+2CO0805玻璃制备过程发生的反应(2 化)Na 2CO 3+SiO 2Na 2SiO 3+CO 2↑ CaCO 3+SiO 2CaSiO 3+CO 2↑0806能证明碳酸酸性比硅酸酸性强的反应(化) Na 2CO 3+CO 2+H 2O===H 2SiO 3↓+Na 2CO 3 0807硅酸的受热分解(化) H 2SiO 3=====△SiO 2+H 2O 九、铝元素及其化合物 1.价类二维图2.核心物质的性质3.重要化学方程式的书写0901铝与氢氧化钠溶液反应(离)2Al+2OH-+2H2O===2AlO-2+3H2↑0902铝与四氧化三铁在高温条件下的反应(化)8Al+3Fe3O44Al2O3+9Fe0903氧化铝与氢氧化钠溶液反应(离)Al 2O 3+2OH -===2AlO -2+H 2O 或Al 2O 3+2OH -+3H 2O===2[Al(OH)4]- 0904实验室中氢氧化铝的制备(离) Al 3++3NH 3·H 2O===Al(OH)3↓+3NH +40905氯化铝溶液与过量氢氧化钠溶液反应(离) Al 3++4OH -===[Al(OH)4]-0906向四羟基合铝酸钠溶液中通入过量二氧化碳气体(离) [Al(OH)4]-+CO 2===Al(OH)3↓+HCO 3- 0907氢氧化铝的受热分解(化) 2Al(OH)3=====△Al 2O 3+3H 2O 0908工业上铝的冶炼(化)2Al 2O 34Al+3O 2↑十、铜元素及其化合物 1.价类二维图2.核心物质的性质3.重要化学方程式的书写 1001铜与浓硫酸的反应(化)Cu +2H 2SO 4(浓)=====△CuSO 4+SO 2↑+2H 2O 1002铜与稀硝酸的反应(化)3Cu +8HNO 3===3Cu(NO 3)2+2NO ↑+4H 2O 1003氧化铜溶于盐酸中(离) CuO+2H +===Cu 2++H 2O1004铜与氯化铁溶液反应(离) Cu+2Fe 3+===Cu 2++2Fe 2+1005氧化铜高温条件下分解(化)4CuO2Cu 2O+O 2↑1006气体中少量水的检验过程中发生反应(化) CuSO 4+5H 2O ===CuSO 4?5H 2O1007铜在潮湿空气中被腐蚀生成铜绿(化) 2Cu+O 2+CO 2+H 2O ===Cu 2(OH)2CO 3。

金属元素及其化合物-------钠及其化合物碱金属
【知识网络】
【基础知识】
1、钠的结构、性质、保存
(1)钠原子的结构特点
钠原子最外层只有电子,在化学反应中易失去最外层的一个电子,因此。
(2)性质
1钠与非金属反应:O2(缓慢氧化生成Na2O,燃烧生成的Na2O2)、S等。
2钠与水的反应:(现象:熔、浮、游、红)3钠与酸的反应: (先与酸反应,过量的钠再与水反应) 4钠与盐溶液的反应:先与水反应生成碱,再考虑碱与盐的反应。
5钠与有机物的反应:与醇、酚、羧酸能发生反应置换出H2。
(3)钠的保存:钠应密封保存,少量的钠可保存在中。
2、氧化钠、过氧化钠的结构和性质(注意两者的比较)。
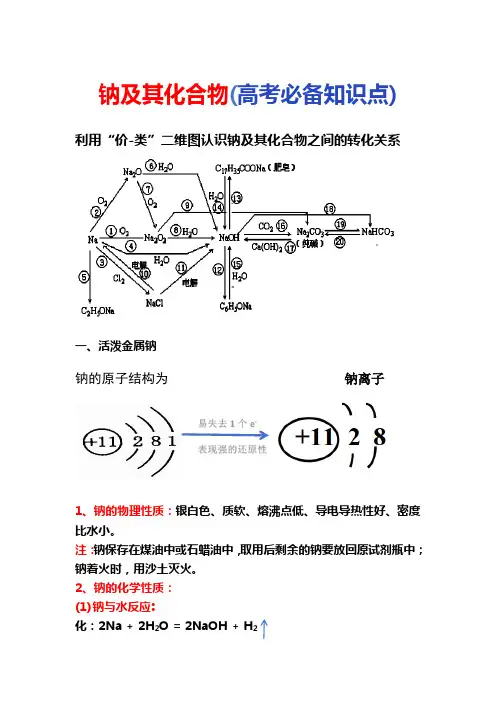
钠及其化合物(高考必备知识点)利用“价-类”二维图认识钠及其化合物之间的转化关系一、活泼金属钠钠的原子结构为钠离子1、钠的物理性质:银白色、质软、熔沸点低、导电导热性好、密度比水小。
注:钠保存在煤油中或石蜡油中,取用后剩余的钠要放回原试剂瓶中;钠着火时,用沙土灭火。
2、钠的化学性质:(1)钠与水反应:化:2Na + 2H2O = 2NaOH + H22Na + 2H2O = 2Na+ + 2OH- + H2(2)钠与氧气反应:4Na + O2 = 2Na2O (常温)4Na + O2 = 2Na2O2(发出黄色火焰,生成淡黄色固体)(3)钠与卤素反应:2Na + Cl2 = 2NaCl(I2、Br2类似,生成卤化钠)(4)钠与硫、氢气等非金属单质反应:2Na + S = Na2S 2Na + H2 = 2NaH(5)钠与酸溶液反应:2Na + 2HCl = 2NaCl + H2(如果钠少量,只能与酸反应;若钠过量,先与酸反应,再与酸溶液中的水反应) (6)钠与盐溶液反应:将钠投入盐溶液中,钠先会和溶液中的水反应,生成的氢氧化钠如果能与盐反应则继续反应.如将钠投入硫酸铜溶液中:2Na+2H2O=2NaOH+H2↑2NaOH+CuSO4=Na2SO4+ Cu ( OH )2↓(7)钠与熔融盐反应:这类反应多数为置换反应,常见于金属冶炼工业中,如:4Na+TiCI4(熔融)=4NaCl+ Ti (条件为高温)Na + KCl = K + NaCl (条件为高温)★钠与熔融盐反应不能证明金属活动性的强弱(8)钠与有机物反应:钠还能与某些有机物反应,如钠与乙醇反应:2Na+2C2H5OH→2CH3CH2ONa+H2↑(生成物为氢气和乙醇钠)(钠还能与苯酚反应生成苯酚钠和氢气;与乙酸反应生成乙酸钠和氢气)(9)钠露置在空气中的变化二、氧化钠与过氧化钠三、碳酸钠与碳酸氢钠四、侯氏制碱法化学反应原理:NH3+CO2+ H2O = NH4HCO3NaCl(饱和)+ NH4HCO3=NaHCO3↓+ NH4CI总反应:NaCl(饱和)+NH3+CO2+H2O= NaHCO3↓+ NH4CI 将经过滤、洗涤得到的NaHCO3微小晶体再加热,制得纯碱产品:2NaHCO3 = Na2CO3+CO2↑+H20注:1、将氟化钠溶于水制成饱和氯化钠溶液,2、先通入NH3达饱和,3、再通入CO2至饱和,4、过滤,得到碳酸氢钠固体,5、加热固体、得纯碱.6、滤液,主要是氧化铵。

元素化合物及其价类二维图引子:元素化合物的知识给人的感觉就是“繁、乱、杂、难”,我们认为以物质的类别为横坐标,以某元素的化合价为纵坐标,在二维平面内,绘制含有某元素的物质的转化图像,既能体现“元素观”也能体现“分类观”和转化观,进而实现对元素化合物知识的系统化,有助于建立系统的知识体系,明确学习要点,形成化学基本观念。
思路点拨分析物质的通性分析氧化性和还原性元素的最高价态只有氧化性,元素的中间价态既有氧化性又有还原性,元素的最低价态只有还原性。
分析离子反应离子反应发生的条件包括生成沉淀、弱电解质或气体的复分解反应,也包括因氧化还原反应的导致的离子反应,还包括相互促进的彻底水解、沉淀的转化、络合反应等。
一、钠元素及其化合物1.价类二维图2.3.重要化学方程式的书写0101钠和氧气在加热条件下的反应(化) 2Na +O 2=====△Na 2O 20102钠和氯气在加热条件下的反应(化) 2Na+Cl 2=====△2NaCl0103过氧化钠和水反应(化) 2Na 2O 2+2H 2O===4NaOH +O 2↑0104过氧化钠和二氧化碳反应(化) 2Na 2O 2+2CO 2===2Na 2CO 3+O 2 0105钠和水反应(离)2Na +2H 2O===2Na ++2OH -+H 2↑0106氢氧化钠与过量二氧化碳反应(离) OH -+CO 2===HCO 3-0107钠和乙醇反应(化)2CH 3CH 2OH+2Na →2CH 3CH 2ONa+H 2↑0108过量钠与氯化铝溶液反应,先后可能发生的三个反应(化) 2Na +2H 2O===2NaOH +H 2↑ AlCl 3+3NaOH===Al(OH)3↓+3NaCl Al(OH)3+NaOH===Na[Al(OH)4]二、氯元素及其化合物 1.价类二维图2.3.重要化学方程式的书写0201向氯化亚铁溶液中滴加氯水(化)2FeCl2+Cl2=2FeCl30202铁在氯气中燃烧(化)2Fe+3Cl22FeCl30203氯气的尾气吸收(离)Cl2+2OH-===ClO-+Cl-+H2O0204漂白粉的制备(化)2Ca(OH)2+2Cl2===CaCl2+Ca(ClO)2+2H2O 0205漂白粉的失效(2 化)Ca(ClO)2+CO2+H2O===CaCO3↓+2HClO 2HClO2HCl+O2↑0206氯气的实验室制备(离)4H++2Cl -+MnO2=====△Mn2++Cl2↑+2H2O0207将等物质的量的二氧化硫和氯气通入水中(离)SO2+Cl2+2H2O===SO2-4+2Cl-+4H+0208工业上盐酸的制备(化)Cl2+H22HCl0209氯离子检验(证明存在)过程中一定会发生的离子方程式(离)Cl-+Ag+===AgCl↓三、铁元素及其化合物1.价类二维图2.3.重要化学方程式的书写0301铁在高温条件下与水蒸气反应(化) 3Fe+4H 2OFe 3O 4+H 2↑0302铁与硫化合(化) Fe+S =====△FeS0303铁与非氧化性强酸反应(离) Fe+2H +=== Fe 2++H 2↑0304铁和硫酸铜溶液反应(离) Fe+ Cu 2+=== Fe 2++ Cu0305铁和氯化铁溶液反应(离)Fe +2Fe 3+===3Fe 2+0306向氯化亚铁溶液中通入氯气(离) 2Fe 2++Cl 2===2Fe 3++2Cl -0307向硝酸亚铁溶液中滴加稀硫酸(离)3Fe 2++NO 3-+4H +===3Fe 3++NO ↑+2H 2O0308向硫酸亚铁溶液(酸性)中滴加过氧化氢溶液(离)2Fe 2++H 2O 2+2H +===2Fe 3++2H 2O0309向硫酸铁溶液中通入二氧化硫气体(离)2Fe 2++SO 2+2H 2O ===2Fe 3++SO 42-+4H + 0310氢氧化亚铁露置在空气中(化)4Fe(OH)2+O2+2H2O===4Fe(OH)3四、碳元素及其化合物1.价类二维图2.3.重要化学方程式的书写0401碳和浓硫酸在加热条件下反应(化)C+2H2SO4(浓)CO2↑+2SO2↑+2H2O0402碳和水在高温条件下反应(化)C+H2O CO+H20403向次氯酸钠溶液中通入过量二氧化碳(离)ClO-+CO2+ H2O=HCO3-+HClO0404实验室制备二氧化碳(离)CaCO3 + 2H+ = Ca2++CO2↑+ H2O0405可溶性碳酸盐与强酸反应(离)CO32- + 2H+=CO2↑+ H2O0406碳酸氢钠溶液与氢氧化钠溶液反应(离)HCO3-+OH-=CO32- + H2O0407向碳酸氢钠溶液中滴加盐酸(离)HCO3-+H+=CO2↑+ H2O0408向可溶性碳酸盐溶液中加入氯化钡溶液(离)CO32- +Ba2+=BaCO3↓0409向氢氧化钡溶液中通入少量二氧化碳气体(离)Ba2++2OH-+CO2 =BaCO3↓+H2O0410加热碳酸氢钠固体(化)2NaHCO3Na2CO3+CO2↑+ H2O五、氮元素及其化合物1.价类二维图2.3.重要化学方程式的书写 0501工业制氨气(化) N 2+3H 22NH 30502实验室制氨气(化)2NH 4Cl +Ca(OH)2=====△CaCl 2+2NH 3↑+2H 2O 0503铜与稀硝酸反应(离)3Cu +2NO -3+8H +===3Cu 2++2NO ↑+4H 2O 0504碳与浓硝酸的反应(化)C +4HNO 3(浓) =====△CO 2↑+4NO 2↑+2H 2O 0505氨的催化氧化(化) 4NH 3+5O 2=====催化剂△4NO +6H 2O 0506氯化铝溶液与氨水的反应(离) Al 3++3NH 3·H 20=A1(OH)3↓+3NH 4+0507氯化铵和氢氧化钠溶液在加热条件下反应(离) NH 4++OH -=====△NH 3↑+H 20 0508碳酸铵的受热分解(化) (NH 4)2CO 3=====△2NH 3↑+CO 2↑+H 20六、硫元素及其化合物 1.价类二维图2.3.重要化学方程式的书写 0601铜与硫的化合(化) 2Cu+S =====△Cu 2S0602硫与浓硫酸的反应(化) S+2H 2SO 4(浓)=====△3SO 2↑+2H 2O0603硫化氢和二氧化硫的反应(化) 2H 2S +SO 2===3S ↓+2H 2O0604二氧化硫尾气的吸收(化) 2NaOH+SO 2=Na 2SO 3+H 2O0605二氧化硫的催化氧化(工业制备硫酸)(化) 2SO 2↑+O 2=====催化剂△2SO 3 0606将二氧化硫通入到溴水中(化) SO 2+Br 2+2H 2O===H 2SO 4+2HBr 0607浓硫酸和碳反应(化)C +2H 2SO 4(浓)=====△CO 2↑+2SO 2↑+2H 2O 0608浓硫酸和铜反应(化)Cu +2H 2SO 4(浓)=====△CuSO 4+SO 2↑+2H 2O七、镁元素及其化合物1.价类二维图2.3.重要化学方程式的书写0701镁与空气中燃烧时可能发生的反应(3 化)2Mg+ O22MgO 3Mg+N2Mg3N22Mg+ CO22MgO+C 0702工业上镁的炼制(化)MgCl2Mg+Cl2↑0703氢氧化镁与盐酸反应(离)Mg(OH)2+2H+===Mg2++2H2O0704氯碱工业(化)2NaCl+2H2O2NaOH+Cl2↑+H2↑0705向溴化钠溶液中滴加氯水(离)2Br-+Cl2===2Cl-+Br20706向碘化钾溶液中滴加溴水(离)2I-+Br2===2Br-+I2八、硅元素及其化合物1.价类二维图2.3.重要化学方程式的书写0801硅与氧气在加热条件下的反应(化) Si+O 2=====△SiO 20802不能用带玻璃塞的试剂瓶保存碱性溶液的原因(化) SiO 2+2NaOH===Na 2SiO 3+H 2O0803玻璃刻蚀过程中发生的反应(化) SiO 2+4HF===SiF 4↑+2H 2O 0804工业上硅的制备(化) SiO 2+2CSi+2CO0805玻璃制备过程发生的反应(2 化) Na 2CO 3+SiO 2Na 2SiO 3+CO 2↑ CaCO 3+SiO 2CaSiO 3+CO 2↑0806能证明碳酸酸性比硅酸酸性强的反应(化) Na 2CO 3+CO 2+H 2O===H 2SiO 3↓+Na 2CO 3 0807硅酸的受热分解(化) H 2SiO 3=====△SiO 2+H 2O 九、铝元素及其化合物1.价类二维图2.3.重要化学方程式的书写0901铝与氢氧化钠溶液反应(离)2Al +2OH -+2H 2O===2AlO -2+3H 2↑0902铝与四氧化三铁在高温条件下的反应(化) 8Al +3Fe 3O 44Al 2O 3+9Fe0903氧化铝与氢氧化钠溶液反应(离)Al 2O 3+2OH -===2AlO -2+H 2O 或Al 2O 3+2OH -+3H 2O===2[Al(OH)4]- 0904实验室中氢氧化铝的制备(离) Al 3++3NH 3·H 2O===Al(OH)3↓+3NH +40905氯化铝溶液与过量氢氧化钠溶液反应(离) Al 3++4OH -===[Al(OH)4]-0906向四羟基合铝酸钠溶液中通入过量二氧化碳气体(离) [Al(OH)4]-+CO 2===Al(OH)3↓+HCO 3- 0907氢氧化铝的受热分解(化) 2Al(OH)3=====△Al 2O 3+3H 2O 0908工业上铝的冶炼(化) 2Al 2O 34Al+3O 2↑十、铜元素及其化合物 1.价类二维图2.3.重要化学方程式的书写1001铜与浓硫酸的反应(化)Cu +2H 2SO 4(浓)=====△CuSO 4+SO 2↑+2H 2O 1002铜与稀硝酸的反应(化)3Cu +8HNO 3===3Cu(NO 3)2+2NO ↑+4H 2O 1003氧化铜溶于盐酸中(离) CuO+2H +===Cu 2++H 2O1004铜与氯化铁溶液反应(离) Cu+2Fe 3+===Cu 2++2Fe 2+1005氧化铜高温条件下分解(化) 4CuO2Cu 2O+O 2↑1006气体中少量水的检验过程中发生反应(化) CuSO 4+5H 2O ===CuSO 4▪5H 2O1007铜在潮湿空气中被腐蚀生成铜绿(化) 2Cu+O 2+CO 2+H 2O ===Cu 2(OH)2CO 3。

第二章典型元素及其化合物第1讲钠及其化合物【课标要求】1.能列举、描述、辨识钠及其化合物重要的物理和化学性质及实验现象。
2.能根据钠及其化合物的性质分析实验室、生产、生活及环境中的某些常见问题,说明妥善保存、合理使用化学品的常见方法。
3.能说明钠及其化合物的应用对社会发展的价值、对环境的影响。
【学科素养】1.宏观辨识与微观探析:认识物质的多样性,能从钠元素的原子结构认识钠的性质,理解“结构决定性质”的内涵。
2.变化观念与平衡思想:认识钠的活泼性的本质是容易失去最外层一个电子,钠发生化学变化需要一定的条件,并遵循一定规律。
考点考题考点一:钠及其氧化物2020浙江7月选考第9、12题2020山东等级考第1题2019全国Ⅱ卷第11题2019江苏高考第6题考点二:碳酸钠碳酸氢2020山东等级考第2题钠2018江苏高考第3、9题2018全国Ⅱ卷第7题分析近几年高考试题,高考命题在本讲有以下规律:1.从考查题型和内容上看,高考命题以选择题和非选择题呈现,主要选择一些重要的金属、非金属化合物或新型化合物结合氧化还原反应、盐类水解、难溶物的溶解平衡等核心考点进行考查。
2.从命题思路上看,高考试题中元素化合物不单独出现,而是分散到不同题型和题目中。
选择题一般直接考查元素化合物的性质和应用,填空题一般有两种形式,一是直接考查元素及其化合物的性质,通常以物质的判断、化学式的书写、微粒的检验和鉴定等形式;二是与基本概念和基本理论的知识相结合,如氧化还原反应、电化学、实验、计算等。
3.从考查学科素养的角度看注重考查变化观念与平衡思想、科学探究与创新意识、科学态度与社会责任的学科素养。
根据高考命题的特点和规律,复习时要注意以下几点:1.注重常见金属和非金属元素及其化合物性质,构建知识网络化、系统化的模型。
2.元素化合物是考查基本概念、基本理论、化学实验、化学计算等的载体。
考点一:钠及其氧化物(基础性考点)一、钠的性质与应用1.物理性质颜色状态密度硬度熔点银白色固体比水小,比煤油大较小较低,低于100 ℃2.钠在化学反应中易失去最外层的一个电子,表现还原性。

氢及其化合物的“价—类二维图”①H 2+2Na 2NaH(拓展反应) ②NaH+H 2O NaOH+H 2↑(拓展反应)③2H 2O 2H 2↑+O 2↑ ④2H 2+O 22H 2O⑤2H 2O 22H 2O+O 2↑氧及其化合物的“价—类二维图”①3O 2 2O 3②2O 3 3O 2 ③2H 2O 2 2H 2O+O 2↑ ④2H 2O 22H 2O+O 2↑⑤Na 2O 2+2H 2O 2NaOH+H 2O 2(拓展反应)⑥2Na+O 2 Na 2O 2 ⑦4Na+O 22Na 2O⑧2Na 2O 2+2CO 2 2Na 2CO 3+O 2(或2Na 2O 2+2H 2O4NaOH+O 2↑)钠及其化合物的“价—类二维图”①4Na+O 2 2Na 2O ②2Na+O 2Na 2O 2③2Na+2H 2O2NaOH+H 2↑ ④Na 2O+H 2O2NaOH⑤2Na 2O 2+2H 2O 4NaOH+O 2↑ ⑥NaOH+HCl NaCl+H 2O⑦Na 2O+2HCl 2NaCl+H 2O ⑧2Na+Cl 2 2NaCl⑨2NaCl(熔融) 2Na+Cl 2↑铝及其化合物的“价—类二维图”①4Al+3O 2 2Al 2O 3 ②2Al+6HCl 2AlCl 3+3H 2↑③2Al+2NaOH+2H 2O 2NaAlO 2+3H 2↑④Al 2O 3+6HCl 2AlCl 3+3H 2O⑤AlCl 3+4NaOH NaAlO 2+3NaCl+2H 2O ⑥NaAlO 2+4HClAlCl 3+NaCl+2H 2O⑦NaAlO 2+2H 2O+CO 2 Al(OH)3↓+NaHCO 3(拓展反应)⑧Al(OH)3+NaOH NaAlO 2+2H 2O⑨2Al(OH)3Al 2O 3+3H 2O⑩AlCl 3+3NH 3·H 2O Al(OH)3↓+3NH 4Cl氯及其化合物的“价—类二维图”①H 2+Cl 2 2HCl ②Cl 2+H 2OHCl+HClO③Cl 2+2NaOH NaCl+NaClO+H 2O ④2HCl H 2↑+Cl 2↑ ⑤HCl+KOHKCl+H 2O ⑥NaClO+CO 2+H 2OHClO+NaHCO 3 ⑦NaClO+2HClNaCl+Cl 2↑+H 2O ⑧2KClO 3+SO 22ClO 2+K 2SO 4(拓展反应) ⑨Cl 2O 7+H 2O2HClO 4 ⑩NaOH+HClO 4NaClO 4+H 2O2ClO 2+H 2O 2+2NaOH 2NaClO 2+2H 2O+O 2↑溴及其化合物的“价—类二维图”①H 2+Br 22HBr ②Br 2+H 2OHBr+HBrO③HBrO+NaOH NaBrO+H 2O ④NaBrO+CO 2+H 2OHBrO+NaHCO 3 ⑤HBr+NaOH NaBr+H 2O ⑥2NaBr+Cl 2Br 2+2NaCl⑦Br 2+2NaOH NaBr+NaBrO+H 2O ⑧Br 2+2NaI2NaBr+I 2碘及其化合物的“价—类二维图”①H 2+I 22HI ②2HI+Cl 2I 2+2HCl③HI+NaOH NaI+H 2O ④2NaI+Br 22NaBr+I 2⑤3I 2+6NaOH 5NaI+NaIO 3+3H 2O ⑥KIO 3+5KI+3H 2SO 43K 2SO 4+3I 2+3H 2O⑦3I 2+6KOH 5KI+KIO 3+3H 2O ⑧HIO 3+KOHKIO 3+H 2O铁及其化合物的“价—类二维图”①Fe 2O 3+3CO 2Fe+3CO 2 ②3Fe+4H 2O(g)Fe 3O 4+4H 2(或3Fe+2O 2 Fe 3O 4)③Fe+2HCl FeCl 2+H 2↑ ④Fe 2O 3+6HCl2FeCl 3+3H 2O⑤FeO+2HClFeCl 2+H 2O ⑥FeCl 3+3NaOHFe(OH)3↓+3NaCl ⑦FeCl 2+2NaOH Fe(OH)2↓+2NaCl ⑧Fe(OH)3+3HClFeCl 3+3H 2O ⑨Fe(OH)2+2HCl FeCl 2+2H 2O ⑩4Fe(OH)2+O 2+2H 2O4Fe(OH)3 2FeCl 2+Cl 22FeCl 32FeCl 3+Fe3FeCl 22Fe(OH)3+3NaClO+4NaOH 2Na 2FeO 4+3NaCl+5H 2O(拓展反应)。


课程篇一、认识“类价二维图”“类价二维图”是以元素为核心,从类别和价态两个角度来认识物质性质和转化的一种二维坐标图。
它能够引导学生从分类的角度分析元素及化合物,把物质分为氢化物、单质、氧化物、酸、碱、盐等,能帮助学生根据物质的类别,推测物质可能具有的性质;还可以引导学生从氧化还原的角度,分析物质的氧化性和还原性,进而分析物质所发生的氧化还原反应,最终形成多角度认识物质转化的思维模型。
例如铁元素的“类价二维图”如下所示。
+3+20单质氧化物氢氧化物盐Fe FeO Fe (OH )2Fe (OH )3Fe 2O 3Fe 3O 4(+2,+3)Fe 3+Fe 2+二、“类价二维图”的应用在教学中如何深入挖掘“类价二维图”的功能价值,引导学生通过“类价二维图”来认识元素化合物,下面跟大家分享一下北京工业大学附属中学的马炜老师运用“类价二维图”所设计的硫元素的复习课,本节课的课题为《NaHSO 3的性质探究》。
1.课题设计背景这节课设计的背景是学生在课前已经对硫单质、二氧化硫、硫酸、硫酸根等相关知识做了比较系统的梳理,这节课实际上是对以上知识的一个总结和提升。
对于学生来说,NaHSO 3相对于SO 2和Na 2SO 3更为陌生一些,从物质类别上说属于多元弱酸的酸式盐,既能与酸反应又能与碱反应,能够了解学生对离子反应的掌握情况,同时NaHSO 3在水溶液中既有电离又有水解,能够帮助学生回顾电离平衡和水解平衡的相关知识;从化合价角度来说,它既有氧化性又有还原性,能够引导学生去深入理解氧化还原反应的相关知识,因此,这个素材的选取有利于培养学生多角度分析问题的能力。
2.课堂设计思路环节一:给学生3分钟在学案上画出硫元素的“类价二维图”,并找学生代表展示二维图,介绍二维图中各物质之间的相互转化关系。
环节二:小组内展开讨论,依据硫元素的“类价二维图”预测NaHSO 3的化学性质,小组代表进行陈述,教师进行点评,学生自我整理。

2.1钠及其化合物 复习与巩固学校:___________姓名:___________班级:___________考号:___________ 一、单选题1.生产、生活离不开化学。
下列说法错误的是 A .碘酒可用于杀菌消毒 B .Na 2O 2可作呼吸面具的供氧剂 C .NaOH 可用作食品干燥剂 D .镁合金可用于制造飞机零部件2.下列物质的俗称与化学式一致的是 A .胆矾——4CuSO B .苏打——23Na CO C .漂白粉——NaClO D .明矾——()42KAl SO3.下列说法正确的是A .相同条件下,3NaHCO 与稀盐酸反应速率比23Na CO 快B .22Na O 能和水反应生成碱,所以是碱性氧化物C .2Na O 和22Na O 组成元素相同,与2CO 反应产物也相同D .22Na O 具有强氧化性,可用作自来水的消毒剂4.依据下列实验装置或操作,结合实验目的,判断所得现象或结论正确的是 选项实验装置或操作实验目的 实验现象或结论A测试干燥NaCl 固体的导电性 干燥的NaCl 固体不导电,因为Na +和Cl -按照一定规则紧密地排列着,不能自由移动,所以NaCl 固体不是电解质B用焰色试验检验某溶液中是否含有Na +、K +火焰呈黄色,证明原溶液中一定含有Na +,一定没有K +A .AB .BC .CD .D5.下列关于钠及其化合物之间转化反应的离子方程式书写正确的是A .碱转化为酸式盐:23OH CO HCO --+=B .钠单质转化为碱:22Na H O Na OH H +-+=++↑C .过氧化物转化为碱:22222O 2H O 4OH O --+=+↑D .盐转化为另一种盐:2322Na CO 2H 2Na CO H O +++=+↑+ 6.下列叙述正确的是①2Na O 与22Na O 都能和水反应生成碱,它们都是碱性氧化物①2Na O 与2CO 发生化合反应生成2322Na CO ,Na O 与2CO 发生置换反应生成2O ①2Na O 是淡黄色物质,22Na O 是白色物质 ①22Na O 可作供氧剂,而2Na O 不可 ①22Na O 和2Na O 焰色反应均为黄色 A .都正确B .①①①C .①①①D .①①7.下列方程式与所给事实不相符的是A .向小苏打溶液中滴加稀盐酸,产生气泡:2322=2H CO H O CO +-++↑B .22Na O 溶于水,反应剧烈并产生气体:22222Na O 2H O=4Na 4OH O +-+++↑C .在2FeCl 溶液中加入锌片,溶液由浅绿色变为无色:22=Zn Fe Zn Fe ++++D .汽车尾气中的NO 与CO 催化转化为无毒气体:222NO 2CN 2CO ++催化剂8.以不同类别物质间的转化为线索,认识钠及其化合物。


高考新题型 价-类 二维图的考查朱沈燕(如皋市搬经中学ꎬ江苏如皋226500)摘㊀要: 价-类 二维图是一种以化合价为纵坐标ꎬ以物质类别为横坐标ꎬ在二维平面内绘制含有某元素的物质的转化的图像ꎬ高考新题型 价-类 二维图的考查有助于考生形成 分类观 元素观 转化观 等化学基本观念ꎬ有助于实现对元素化合物知识的系统化而全面的考查.关键词:高考新题型ꎻ价-类二维图ꎻ高中化学中图分类号:G632㊀㊀㊀文献标识码:A㊀㊀㊀文章编号:1008-0333(2024)01-0136-03收稿日期:2023-10-05作者简介:朱沈燕(1983.10-)ꎬ女ꎬ江苏省如皋人ꎬ本科ꎬ中学一级教师ꎬ从事高中化学教学研究.㊀㊀常见的 价-类 二维图是以物质的类别为横坐标ꎬ以某种元素的化合价为纵坐标ꎬ在二维平面内绘制的含有该元素物质的图像.以 价-类 二维图为素材考查基础知识的同时体现元素观㊁分类观㊁转化观等化学观念的落实与培养ꎬ因此备受高考命题者的青睐ꎬ2021㊁2023年的广东卷连续两年出现对 价-类 二维图的考查ꎬ应引起重视.1基于 价-类 二维图的元素化合物性质与转化的考查㊀㊀例1㊀(2023年广东卷改编)部分含Na或含Cu物质的分类与相应化合价关系如图1所示.下列推断不合理的是(㊀㊀).图1㊀物质与化合价的关系A.可通过观察单质a㊁氧化物b的颜色ꎬ判断其为何种物质B.可存在cңdңe的转化C.新制的d悬浊液可用于检验葡萄糖中的醛基D.能与H2O反应生成c的物质只有b解析㊀单质a可能为金属铜或钠ꎬ两种物质颜色不同ꎬ可以区分ꎻ氧化物b可能是Na2O为白色ꎬNa2O2为淡黄色㊁Cu2O为砖红色ꎬ三种物质颜色均不同ꎬ可以区分ꎬ合理ꎬA不符合题意ꎻ由图可知a㊁b㊁c对应物质分别为:钠㊁氧化钠(过氧化钠)㊁氢氧化钠或a㊁b㊁e㊁d对应物质分别为:铜㊁氧化亚铜㊁氧化铜㊁氢氧化铜ꎬ氢氧化钠和硫酸铜反应生成氢氧化铜ꎬ氢氧化铜受热分解生成氧化铜ꎬ所以存在cңdңe的转化ꎬ合理ꎬB不符合题意ꎻ醛基具有还原性ꎬ新制的Cu(OH)2悬浊液可用于检验葡萄糖中的醛基ꎬ合理ꎬC不符合题意ꎻNa2O2㊁Na与H2O反应也可以生成NaOHꎬ不合理ꎬD符合题意.故选D.考点分析㊀基于 价-类 二维图的元素化合物性质与转化的考查是将物质分类排列ꎬ同价态的物质排成一行ꎬ让考生判断分析哪些物质可能发生631歧化反应ꎬ哪些物质可能发生归中反应ꎬ依据氧化还原反应的价态规律可得含有元素价态相对高的微粒一般具有氧化性ꎬ价态相对低的微粒一般具有还原性ꎬ中间价态的一般可发生歧化反应.横向变化体现同价态的氧化物㊁碱㊁盐等不同类别物质间的转化ꎻ纵向变化是同类别ꎬ不同价态物质间的转化ꎬ斜向变化是不同类别㊁不同价态物质间的转化ꎬ不同价态物质转化要体现其还原性和氧化物㊁遵循氧化还原规律. 价-类 二维图可以明确物质之间转化的反应类型ꎬ如横向转化ꎬ化合价不变ꎬ通常是复分解反应.而斜向反应化合价不同ꎬ则反应类型一定是氧化还原反应. 价-类 二维图将试题信息一目了然地呈现出来ꎬ考查考生必备知识体系是否完善ꎬ并要学会迁移应用等关键能力[1].备考启示㊀ 价-类 二维图很适合在高三的一轮复习元素化合物中使用ꎬ用构建 价-类 二维图的方法复习元素化合物的知识ꎬ可以有效地帮助学生构建知识体系ꎬ将零散的知识点进行系统化ꎬ便于学生站在更高的高度来认识化学㊁学习化学㊁熟练地运用化学.重视学科基础知识ꎬ试题呈现方式多样ꎬ高中化学基础知识包括物质结构理论㊁典型化合物的性质㊁基本化学反应原理㊁基本化学实验操作方法和实验设计思想等ꎬ围绕这些基础内容ꎬ深入考查学生对离子方程式㊁化学实验㊁元素性质与周期率等必备知识点的理解与应用.同时ꎬ要注意试题的综合性ꎬ对有机化学基础㊁物质结构与性质㊁化学反应原理等模块知识点的渗透考查.变式练习1㊀硫元素的价类二维图如图2所示.下列说法错误的是(㊀㊀).A.a与c㊁d㊁e都有可能反应生成bB.d溶液久置于空气中会生成eꎬ溶液的酸性增强C.盐g与盐f之间也可能发生反应D.将铜与e的浓溶液共热产生的气体通入图2㊀硫元素的价类二维图Ba(NO3)2液中ꎬ无明显现象解析㊀由 价 类 二维图可确定a为H2Sꎬb为Sꎬc为SO2ꎬd为H2SO3ꎬe为H2SO4ꎬf为R2SO3或RHSO3ꎬg为R2SO4或RHSO4(假设R显+1价).A项ꎬ由分析可知ꎬa为H2S㊁c为SO2㊁d为H2SO3㊁e为H2SO4ꎬH2S与SO2㊁H2SO3㊁H2SO4(浓)都能发生氧化还原反应ꎬA正确ꎻB项ꎬd为H2SO3ꎬ久置于空气中会被氧气氧化生成H2SO4ꎬ溶液的酸性增强ꎬB正确ꎻC项ꎬ若g为RHSO4ꎬf为R2SO3或RHSO3ꎬ则盐g与盐f之间也可能发生离子交换反应ꎬC正确ꎻD项ꎬ铜与浓硫酸共热产生的气体为SO2ꎬ通入Ba(NO3)2溶液中ꎬ会生成BaSO4ꎬ产生白色沉淀ꎬD错误.故选D.2基于 价-类 二维图的元素化合物性质与应用的考查㊀㊀例2㊀(2021年广东卷改编)部分含Fe物质的分类与相应化合价关系如图3所示.下列说法不正确的是(㊀㊀).图3㊀物质与化合价的关系A.c常用作涂料B.f可与K3[Fe(CN)6]反应制蓝色颜料C.g的溶液可用于检验苯酚D.可将g加入浓碱液中制得e的胶体作净水剂解析㊀由题干价类二维图信息可知ꎬa为Fe㊁b731为FeO㊁c为Fe2O3㊁d为Fe(OH)2ꎬe为Fe(OH)3㊁f为Fe2+㊁g为Fe3+ꎬ据此分析解题.c为Fe2O3ꎬ化学性质稳定且呈红棕色ꎬ故c常用作涂料ꎬA正确ꎻf为Fe2+的盐ꎬ可与K3[Fe(CN)6]反应制蓝色颜料KFe[Fe(CN)6]ꎬB正确ꎻg为Fe3+的盐ꎬFe3+遇到苯酚显紫色ꎬ即g的溶液可用于检验苯酚ꎬC正确ꎻFe3+的盐与浓碱液反应生成Fe(OH)3沉淀ꎬ制备Fe(OH)3胶体操作为:向沸水中滴加饱和FeCl3溶液ꎬ继续煮沸至溶液呈红褐色ꎬ停止加热ꎬD错误.故选D.考点分析㊀以 价-类 二维图为载体ꎬ考查核心元素及其化合物性质与应用ꎬ体现高考化学注重对必备知识的考查ꎬ横坐标表示物质的类别如单质㊁氧化物㊁氢化物㊁酸㊁碱㊁盐ꎬ考查考生从物质类别角度ꎬ结合物质的性质分析判断其在生成生活中的应用[2].备考启示㊀ 价-类 二维图有助于构建不同物质间的转化关系ꎬ将繁多杂乱的物质清晰分类ꎬ有助于构建完善的知识体系ꎬ同时清晰地呈现物质的氧化性㊁还原性㊁同价态的物质性质相近.性质决定用途ꎬ因此基于 价-类 二维图的元素化合物性质与应用其考查的核心是元素ꎬ延伸的是性质应用ꎬ复习的方法是分类ꎬ需要注意的是转化ꎬ尝试构建其他元素的 价-类 二维图ꎬ并熟悉其在生产㊁生活中的应用.变式练习2㊀如图4是某元素的价一类二维图ꎬ其中A为正盐ꎬX是一种强碱ꎬ通常条件下Z是无色液体ꎬE的相对分子质量比D大16ꎬ各物质的转化关系如图4所示.下列说法错误的是(㊀㊀).图4㊀各物质的转化关系A.物质A作肥料时不适合与草木灰混合施用B.物质B是弱电解质ꎬ其水溶液呈弱碱性C.物质C一般用排水法收集D.DңE的反应可用于检验D解析㊀通常条件下ꎬZ是无色液体ꎬ可确定Z为水ꎬA与X反应可以生成BꎬA为正盐ꎬX为强碱ꎬ可确定A为氨盐ꎬB为氨ꎬY为氧气ꎬC为氮气ꎬD为一氧化氮ꎬE为二氧化氮ꎬZ为水ꎬF为硝酸ꎬX为强碱ꎬ所以G为硝酸盐.A项ꎬ氨盐与草木灰混合会释放出氨ꎬ不适合与草木灰混合使用ꎬA正确ꎻB项ꎬ氨属于非电解质ꎬ其水溶液显弱碱性ꎬB错误ꎻC项ꎬ一氧化氮难溶于水且可以与空气中的氧气发生反应ꎬ生成二氧化氮ꎬ一般采用排水法收集ꎬC正确ꎻD项ꎬ一氧化氮被氧气氧化ꎬ生成二氧化氮ꎬ颜色会由无色变为红棕色ꎬ有明显的颜色变化ꎬ可用于检验一氧化氮ꎬD正确.故选B.3结束语价-类 二维图以探究多种变价元素为载体ꎬ以独特的认识视角ꎬ将散落的物质有序地排列ꎬ物质间关系脉络清晰明了ꎬ促进知识结构化.高考中 价-类 二维图考查考生的认识能力和预测能力ꎬ是落实证据推理与模型认知㊁科学态度与社会责任的化学学科核心素养的重要体现[3]ꎬ构建 价-类 二维图认知模型是复习元素化合物重要方式之一ꎬ因此在备考中应加以应用ꎬ从而达到最佳的复习效果.参考文献:[1]任宝华.复习课中使用 元素价-类二维图 的误区及教学改进建议[J].化学教育ꎬ2016(1):7-8.[2]徐凯里ꎬ陈永平.基于模型认知的价-类二维图在元素化合物学习中的应用:以 自然界中硫氮元素的循环 教学为例[J].化学教学ꎬ2020(7):56-57.[3]贾喜珍.如何把价类二维图转化为学生复习元素化合物知识的思路:以硫及化合物知识的复习为例[J].新课程(下旬)ꎬ2014(6):23.[责任编辑:季春阳]831。
高考化学专题复习:钠及其化合物一、单项选择题(共12小题)1.下列有关金属钠及其化合物的性质与用途具有对应关系的是()A.金属钠质地柔软,可用于冶炼金属镁B.碳酸氢钠受热易分解,可用于治疗胃酸过多C.过氧化钠呈淡黄色,可用作供氧剂D.次氯酸钠具有强氧化性,可用作环境消毒剂2.若碳酸钠和碳酸氢钠各1mol,在分别强热后,其产物与足量盐酸反应的结果是()A.放出CO2的量前者为后者的二分之一B.放出的CO2的量前者为后者的二倍C.消耗盐酸一样多D.消耗盐酸后者比前者多3.下列有关Na2O2的叙述正确的是()A.Na2O2属于碱性氧化物B.Na2O2中阴阳离子个数比是1:1C.将Na2O2加入滴有酚酞的水中,溶液最终呈红色D.Na2O2与H2O反应时转移的电子数和参与反应的Na2O2的个数比为1:1 4.Na2O2中阴离子为O22-,下列说法正确的是()A.1molO22-中含有电子数为18N AB.将紫色石蕊试液中加入少量的Na2O2,溶液变为蓝色C.1molNa2O2与过量的H2O充分反应,转移电子数为2N AD.Na2O2不是碱性氧化物,不能与酸反应5.下列各组中的两物质相互反应时,若改变反应条件或反应物用量比,所发生的化学反应并不改变的是()A.Na和O2B.Na2CO3和盐酸C.Fe和Cl2D.NaOH和CO26.下列关于Na2O2的说法错误的是()A.是淡黄色固体B.可作供氧剂C.由Na+和O2-构成D.具有强氧化性7.下列有关金属钠及其化合物的性质与用途具有对应关系的是()A.金属钠质地柔软,可用于冶炼金属钛B.碳酸氢钠受热易分解,用于治疗胃酸过多C.过氧化钠呈淡黄色,可用作供氧剂D.次氯酸钠有强氧化性,可用作环境消毒剂8.下列关于钠的叙述正确的是()A.钠与水反应的现象说明钠的熔点低,且与水反应放出热量B.将4.6g钠投入95.4g水中,所得溶液中溶质的质量分数为8%C.钠放置在空气中表面变暗是由于钠的表面生成了Na2O2D.钠与硫酸铜溶液反应生成硫酸钠和单质铜9.下列叙述正确的是()A.Na2O2投入FeSO4溶液中剧烈反应生成白色沉淀和氢气B.Na投入CuSO4溶液中剧烈反应生成红色固体C.Na2O2可以作漂白剂是因为其有强氧化性D.少量Na投入FeCl3溶液可使溶液质量增大10.少量Na2O2与H2O反应生成H2O2和NaOH。
元素化合物及其价类二维图引子:元素化合物的知识给人的感觉就是“繁、乱、杂、难”,我们认为以物质的类别为横坐标,以某元素的化合价为纵坐标,在二维平面内,绘制含有某元素的物质的转化图像,既能体现“元素观”也能体现“分类观”和转化观,进而实现对元素化合物知识的系统化,有助于建立系统的知识体系,明确学习要点,形成化学基本观念。
思路点拨分析物质的通性分析氧化性和还原性元素的最高价态只有氧化性,元素的中间价态既有氧化性又有还原性,元素的最低价态只有还原性。
分析离子反应离子反应发生的条件包括生成沉淀、弱电解质或气体的复分解反应,也包括因氧化还原反应的导致的离子反应,还包括相互促进的彻底水解、沉淀的转化、络合反应等。
一、钠元素及其化合物1.价类二维图2.核心物质的性质3.重要化学方程式的书写0101钠和氧气在加热条件下的反应(化) 2Na +O 2=====△Na 2O 20102钠和氯气在加热条件下的反应(化) 2Na+Cl 2=====△2NaCl0103过氧化钠和水反应(化)2Na2O2+2H2O===4NaOH+O2↑0104过氧化钠和二氧化碳反应(化)2Na2O2+2CO2===2Na2CO3+O20105钠和水反应(离)2Na+2H2O===2Na++2OH-+H2↑0106氢氧化钠与过量二氧化碳反应(离)OH-+CO2===HCO3-0107钠和乙醇反应(化)2CH3CH2OH+2Na→2CH3CH2ONa+H2↑0108过量钠与氯化铝溶液反应,先后可能发生的三个反应(化)2Na+2H2O===2NaOH+H2↑AlCl3+3NaOH===Al(OH)3↓+3NaCl Al(OH)3+NaOH===Na[Al(OH)4]二、氯元素及其化合物1.价类二维图2.核心物质的性质3.重要化学方程式的书写0201向氯化亚铁溶液中滴加氯水(化) 2FeCl 2+Cl 2=2FeCl 30202铁在氯气中燃烧(化)2Fe+3Cl 22FeCl 30203氯气的尾气吸收(离) Cl 2+2OH -===ClO -+Cl -+H 2O 0204漂白粉的制备(化)2Ca(OH)2+2Cl 2===CaCl 2+Ca(ClO)2+2H 2O 0205漂白粉的失效(2 化)Ca(ClO)2+CO 2+H 2O===CaCO 3↓+2HClO 2HClO2HCl+O 2↑0206氯气的实验室制备(离)4H ++2Cl -+MnO 2=====△Mn 2++Cl 2↑+2H 2O0207将等物质的量的二氧化硫和氯气通入水中(离) SO 2+Cl 2+2H 2O===SO 2-4+2Cl -+4H +0208工业上盐酸的制备(化)Cl2+H22HCl0209氯离子检验(证明存在)过程中一定会发生的离子方程式(离)Cl-+Ag+===AgCl↓三、铁元素及其化合物1.价类二维图2.核心物质的性质3.重要化学方程式的书写0301铁在高温条件下与水蒸气反应(化)3Fe+4H 2O Fe 3O 4+H 2↑0302铁与硫化合(化) Fe+S =====△FeS0303铁与非氧化性强酸反应(离) Fe+2H +=== Fe 2++H 2↑0304铁和硫酸铜溶液反应(离) Fe+ Cu 2+=== Fe 2++ Cu0305铁和氯化铁溶液反应(离) Fe +2Fe 3+===3Fe 2+0306向氯化亚铁溶液中通入氯气(离) 2Fe 2++Cl 2===2Fe 3++2Cl -0307向硝酸亚铁溶液中滴加稀硫酸(离) 3Fe 2++NO 3-+4H +===3Fe 3++NO ↑+2H 2O0308向硫酸亚铁溶液(酸性)中滴加过氧化氢溶液(离)2Fe2++H2O2+2H+===2Fe3++2H2O0309向硫酸铁溶液中通入二氧化硫气体(离)2Fe2++SO2+2H2O===2Fe3++SO42-+4H+0310氢氧化亚铁露置在空气中(化)4Fe(OH)2+O2+2H2O===4Fe(OH)3四、碳元素及其化合物1.价类二维图2.核心物质的性质3.重要化学方程式的书写0401碳和浓硫酸在加热条件下反应(化)C+2H2SO4(浓)CO2↑+2SO2↑+2H2O0402碳和水在高温条件下反应(化)C+H2O CO+H20403向次氯酸钠溶液中通入过量二氧化碳(离)ClO-+CO2+ H2O=HCO3-+HClO0404实验室制备二氧化碳(离)CaCO3 + 2H+ = Ca2++CO2↑+ H2O0405可溶性碳酸盐与强酸反应(离)CO32- + 2H+=CO2↑+ H2O0406碳酸氢钠溶液与氢氧化钠溶液反应(离)HCO3-+OH-=CO32- + H2O0407向碳酸氢钠溶液中滴加盐酸(离)HCO3-+H+=CO2↑+ H2O0408向可溶性碳酸盐溶液中加入氯化钡溶液(离)CO32- +Ba2+=BaCO3↓0409向氢氧化钡溶液中通入少量二氧化碳气体(离)Ba2++2OH-+CO2 =BaCO3↓+H2O0410加热碳酸氢钠固体(化)2NaHCO3Na2CO3+CO2↑+ H2O五、氮元素及其化合物1.价类二维图2.核心物质的性质3.重要化学方程式的书写 0501工业制氨气(化)N 2+3H 22NH 30502实验室制氨气(化)2NH 4Cl +Ca(OH)2=====△CaCl 2+2NH 3↑+2H 2O 0503铜与稀硝酸反应(离)3Cu +2NO -3+8H +===3Cu 2++2NO ↑+4H 2O 0504碳与浓硝酸的反应(化)C +4HNO 3(浓) =====△CO 2↑+4NO 2↑+2H 2O 0505氨的催化氧化(化) 4NH 3+5O 2=====催化剂△4NO +6H 2O 0506氯化铝溶液与氨水的反应(离)Al 3++3NH 3·H 20=A1(OH)3↓+3NH 4+0507氯化铵和氢氧化钠溶液在加热条件下反应(离) NH 4++OH -=====△NH 3↑+H 20 0508碳酸铵的受热分解(化)(NH 4)2CO 3=====△2NH 3↑+CO 2↑+H 20六、硫元素及其化合物 1.价类二维图2.核心物质的性质3.重要化学方程式的书写 0601铜与硫的化合(化) 2Cu+S =====△Cu 2S0602硫与浓硫酸的反应(化) S+2H 2SO 4(浓)=====△3SO 2↑+2H 2O 0603硫化氢和二氧化硫的反应(化) 2H 2S +SO 2===3S ↓+2H 2O 0604二氧化硫尾气的吸收(化) 2NaOH+SO 2=Na 2SO 3+H 2O0605二氧化硫的催化氧化(工业制备硫酸)(化) 2SO 2↑+O 2=====催化剂△2SO 3 0606将二氧化硫通入到溴水中(化) SO 2+Br 2+2H 2O===H 2SO 4+2HBr 0607浓硫酸和碳反应(化)C +2H 2SO 4(浓)=====△CO 2↑+2SO 2↑+2H 2O 0608浓硫酸和铜反应(化)Cu +2H 2SO 4(浓)=====△CuSO 4+SO 2↑+2H 2O七、镁元素及其化合物 1.价类二维图2.核心物质的性质3.重要化学方程式的书写0701镁与空气中燃烧时可能发生的反应(3 化)2Mg+ O22MgO 3Mg+N2Mg3N22Mg+ CO22MgO+C 0702工业上镁的炼制(化)MgCl2Mg+Cl2↑0703氢氧化镁与盐酸反应(离)Mg(OH)2+2H+===Mg2++2H2O0704氯碱工业(化)2NaCl+2H2O2NaOH+Cl2↑+H2↑0705向溴化钠溶液中滴加氯水(离)2Br-+Cl2===2Cl-+Br20706向碘化钾溶液中滴加溴水(离)2I-+Br2===2Br-+I2八、硅元素及其化合物1.价类二维图2.核心物质的性质3.重要化学方程式的书写0801硅与氧气在加热条件下的反应(化) Si+O 2=====△SiO 20802不能用带玻璃塞的试剂瓶保存碱性溶液的原因(化) SiO 2+2NaOH===Na 2SiO 3+H 2O 0803玻璃刻蚀过程中发生的反应(化) SiO 2+4HF===SiF 4↑+2H 2O 0804工业上硅的制备(化)SiO 2+2C Si+2CO0805玻璃制备过程发生的反应(2 化)Na 2CO 3+SiO 2Na 2SiO 3+CO 2↑ CaCO 3+SiO 2CaSiO 3+CO 2↑0806能证明碳酸酸性比硅酸酸性强的反应(化) Na 2CO 3+CO 2+H 2O===H 2SiO 3↓+Na 2CO 3 0807硅酸的受热分解(化) H 2SiO 3=====△SiO 2+H 2O 九、铝元素及其化合物 1.价类二维图2.核心物质的性质3.重要化学方程式的书写0901铝与氢氧化钠溶液反应(离)2Al+2OH-+2H2O===2AlO-2+3H2↑0902铝与四氧化三铁在高温条件下的反应(化)8Al+3Fe3O44Al2O3+9Fe0903氧化铝与氢氧化钠溶液反应(离)Al 2O 3+2OH -===2AlO -2+H 2O 或Al 2O 3+2OH -+3H 2O===2[Al(OH)4]- 0904实验室中氢氧化铝的制备(离) Al 3++3NH 3·H 2O===Al(OH)3↓+3NH +40905氯化铝溶液与过量氢氧化钠溶液反应(离) Al 3++4OH -===[Al(OH)4]-0906向四羟基合铝酸钠溶液中通入过量二氧化碳气体(离) [Al(OH)4]-+CO 2===Al(OH)3↓+HCO 3- 0907氢氧化铝的受热分解(化) 2Al(OH)3=====△Al 2O 3+3H 2O 0908工业上铝的冶炼(化)2Al 2O 34Al+3O 2↑十、铜元素及其化合物 1.价类二维图2.核心物质的性质3.重要化学方程式的书写 1001铜与浓硫酸的反应(化)Cu +2H 2SO 4(浓)=====△CuSO 4+SO 2↑+2H 2O 1002铜与稀硝酸的反应(化)3Cu +8HNO 3===3Cu(NO 3)2+2NO ↑+4H 2O 1003氧化铜溶于盐酸中(离) CuO+2H +===Cu 2++H 2O1004铜与氯化铁溶液反应(离) Cu+2Fe 3+===Cu 2++2Fe 2+1005氧化铜高温条件下分解(化)4CuO2Cu 2O+O 2↑1006气体中少量水的检验过程中发生反应(化) CuSO 4+5H 2O ===CuSO 4?5H 2O1007铜在潮湿空气中被腐蚀生成铜绿(化) 2Cu+O 2+CO 2+H 2O ===Cu 2(OH)2CO 3。
第二节研究物质性质的方法和程序(第1课时)
姓名学号
【学习目标】
1、了解科学探究的基本过程,学习运用以实验和推理为基础的科学探究方法。
2、了解金属钠的性质和应用。
【预习导学】
一、研究物质性质的方法和程序
1.研究物质性质的基本方法有______、_______、______、_____等方法,其中观察法是运用_________有计划有目的的考察研究对象的方法。
在研究物质性质时,通常首先要观察_________,了解物质的存在状态、颜色、气味等,其次通过______来探究物质的性质。
2.研究物质的基本程序是__________ →_________ →_________ →________。
【练习】用如图所示的方法研究某气体的性质,这种方法属于()
A.实验法
B.观察法
C.分类法
D.比较法
二、金属钠及其化合物的性质
一画二写三设计四实验五体验
一、画请按照下图中的物质类别/化合价的二维角度,将钠及其化合物(Na、Na2O2、NaOH、NaHCO3、Na2CO3、NaCl)画到二维图中,体会这样总结的思路。
二、写(按照自己的连线书“写”相关转化的化学方程式及离子方程式,并描述相关物质的特殊颜色(让学生熟悉相关的化学用语和相关物质的颜色,按照物质类别通性、氧化性和还原性、稳定性、特殊性)
1、钠
2、钠的氧化物
3、NaHCO3和Na2CO3
三、“设计”相关的化学实验,以期实现图中的价态变化和物质类别的变化。
(物质制备)
四、提出自己想完成的探究实验(性质预测及验证)
五、体验高考
例(2010上海)将0.4gNaOH和1.06g Na2CO3混合并配成溶液,向溶液中滴加0.1mol·L-1稀盐酸。
下列图像能正确表示加入盐酸的体积和生成CO2的物质的量的关系的是()
变式:2、分别取等物质的量浓度的氢氧化钠溶液各100 mL,再通入一定量的CO2,随后分别各取
20 mL溶液,向其中逐滴滴入0.2 mol/L的盐酸,在标准状况下产生CO2的体积(y轴)与所加入盐酸的体积(x轴)的关系如下图(分A、B两种情况):
(1)在A情况下,溶质是(填化学式),其物质的量之比为。
(2)在B情况下,溶质是(填化学式),其物质的量之比为。
(3)原氢氧化钠溶液的物质的量浓度为。
【三维训练】
1.(2011北京)下列实验方案中,不能
..测定Na2CO3和NaHCO3,混合物中Na2CO3质量分数的是()
A.取a克混合物充分加热,减重b克
B.取a克混合物与足量稀盐酸充分反应,加热、蒸干、灼烧,得b克固体
C.取a克混合物与足量稀硫酸充分反应,逸出气体用碱石灰吸收,增重b克
D.取a克混合物与足量Ba(OH)2溶液充分反应,过滤、洗涤、烘干,得b克固体。
2.在烧杯中加入水和苯(密度:0.88g/cm3)各50mL,将一小粒金属钠(密度:0.97g/cm3)投入烧杯中。
观察到的现象可能是()
A.钠在水层中反应并四处游动
B.钠停留在苯层中并不发生反应
C.钠在苯的液面上反应并四处游动
D.钠在苯和水的界面处反应并可能作上、下跳动
3.1mol过氧化钠与2mol碳酸氢钠固体混合后,在密闭容器中加热充分反应,排出气体物质后冷却,残留的固体物质是()
A. Na2CO3
B. Na2O2Na2CO3
C. NaOH Na2CO3
D. Na2O2NaOH Na2CO3
4.(2012北京)下列用品的有效成分及用途对应错误的是()
5. (2012北京)下列结实实验现象的反应方程式正确的是()
A.切开的金属Na暴露在空气中,光亮表面逐渐变暗2Na+O2=Na2O2
B.向AgC1悬浊液中滴加Na2S溶液,白色沉淀变成黑色2AgC1+S2-=Ag2S↓+2C1-
C.Na2O2在潮湿的空气中放置一段时间,变成白色粘稠物2Na2O2+2CO2=2Na2CO3+O2
D.向NaHCO3溶液中加入过量的澄清石灰水,出现白色沉淀
2HCO3-+Ca2++2OH-=CaCO3↓+CO32-+2H2O
6.在一定温度下向足量的饱和Na2CO3溶液中加入1.06g无水Na2CO3,搅拌后静止,最终析出的晶体的质量
()
A、等于1.06g
B、大于1.06g而小于2 .86g
C、等于2.86g
D、大于2.86g
7.为了使宇航员在飞船中得到一个稳定的、良好的生存环境,一般在飞船内安装盛有Na2O2或K2O2颗粒的
装置,它的用途是产生氧气。
下列关于Na2O2的叙述正确的是( )
A. Na2O2中阴、阳离子的个数比为1∶1
B.Na2O2分别与水及CO2反应产生相同量的O2时,需要水和CO2的质量相等
C.Na2O2分别与水及CO2反应产生相同量的O2时,转移电子的物质的量相等
D.Na2O2的漂白原理与SO2的漂白原理相同
8、下列方法不能用于鉴别Na2CO3和NaHCO3固体的是
A. 分别加热两种固体,将放出的气体通入澄清石灰水
B. 分别取两种固体溶于水,滴加Ba(OH)2溶液,观察是否生成沉淀
C. 分别取两种固体各 1 g,滴入几滴水振荡,用手触摸试管底部
D. 分别取等质量的固体与足量稀盐酸充分反应,加热、蒸干、灼烧称重
9、将钠、镁、铝各0.3mol分别放入100mL1mol·L-1的盐酸中,同温同压下产生的气体体积比是()
A.1︰2︰3 B.6︰3︰2 C.3︰1︰1 D.1︰1︰1
10.现有一定量含有Na2O杂质的Na2O2试样,用下图的实验装置测定Na2O2试样的纯度。
(可供选用的反应物只有CaCO3固体、6 mol/L盐酸、6 mol/L硫酸和蒸馏水)
回答下列问题:
(1)装置A中液体试剂选用________,理由是_______________________________
________________________________________________________________________。
(2)装置B的作用是___________________________________________________,
装置D中碱石灰的作用是_______________________________________________。
(3)装置C中发生反应的化学方程式是______________________________ ______。
(4)若开始时测得样品的质量为2.0 g,反应结束后测得气体体积为224 mL(标准状况),则Na2O2试样的纯度为________。
11.某研究性学习小组,为了探究过氧化钠的强氧化
性,设计了如图的实验装置。
实验步骤及现象如下:
①检查装置气密性后,装入药品并连接仪器:
②缓慢通入一定量的N2后,将装置D连接好(导管
末端未伸人集气瓶中),再向圆底烧瓶中缓慢滴加浓盐
酸,反应剧烈,产生黄绿色气体。
③一段时间后,将导管末端伸入集气瓶中收集气体。
装置D中收集到能使带火星的木条复燃的无色气体。
④反应结束后,关闭分液漏斗的活塞,再通人一定量
的N2至装置中气体无色。
回答下列问题:
(l)装置B中的湿润的红色纸条褪色,证明A中反应有___(填化学式)生成。
若B中改放湿润的淀粉KI试纸,仅凭试纸变蓝的现象不能证明上述结论,请用离子方程式说明原因_______。
(2)装置C的作用是_______________________
(3)甲同学认为O2是Na2O2被盐酸中的HCl还原所得。
乙同学认为此结论不正确,他可能的理由为①_____________;②_____________。
(4)实验证明,Na2O2与干燥的HCl能反应,完成并配平该化学方程式。
该反应___(填“能”或“不能”)用于实验室快速制取纯净的C12,理由是
(要求答出要点)。
第二节研究物质性质的方法和程序(第1课时)答案
例1 C
变式:(1)NaOH、Na2CO31∶1
(2)Na2CO3、NaHCO31∶1
(3)1.5 mol/L
1-5 CDABB 6-9 DCBC
10、(1)6 mol/L盐酸硫酸与CaCO3固体反应生成的CaSO4微溶于水,会覆盖在CaCO3固体表面,使反应不能持续进行
(2)除去气体中的HCl
吸收装置C中反应剩余的CO2及H2O(g)
(3)2Na2O2+2CO2===2Na2CO3+O2、
2Na2O2+2H2O(g)===4NaOH+O2、
Na2O+CO2===Na2CO3、
Na2O+H2O===2NaOH
(4)78%
11、(1)Cl2(1分)4H+ + 4I-+ O2 === 2I2 + 2H2O(2分,写2H2O + 4I-+ O2 === 2I2+4OH-得1分)(2)吸收HCl和过量的Cl2,防止污染空气,使D中能收集到较为纯净的氧气(2分)
(3)①Na2O2被还原时氧元素的化合价应该降低,不可能得到O2(2分)
②O2有可能是Na2O2与盐酸中的H2O反应所得(2分)
(4
Na2
O2
+ + 3分)不能(1分)
①Na2O2与生成的H2O反应有O2生成;HCl混在Cl2中;H2O混在Cl2中(1分)(答出任何一点即可)
②实验室没有可直接使用的干燥HCl气体;固体与气体反应较慢(1分)(答出任何一点即可,其他合理答案均可)。