酶和酶促反应
- 格式:ppt
- 大小:545.00 KB
- 文档页数:30

酶促反应和酶的作用机制酶是一种生物催化剂,也是生命体系中非常重要的一种蛋白质。
酶的作用机制是通过酶促反应来完成的,这种反应是基于酶与底物之间的相互作用。
酶与底物结合形成酶底物复合物,反应后酶与产物解离,使得底物转化为产物。
酶促反应往往速度非常快,特异性较高,因此具有非常广泛的应用前景。
下面将从酶促反应的基本原理和酶的作用机制两方面来详细阐述。
一、酶促反应的基本原理酶促反应是一种基于酶与底物之间的相互作用来进行的化学反应。
这种反应不仅与物质的性质、反应条件有关,而且也与酶的特定性质以及生物环境下的活性相关。
在酶促反应中,酶与底物通过多种非共价键相互作用形成酶底物复合物,复合物中活性中心的化学性质被改变,从而产生反应。
这种反应可以简化为以下四个步骤:1. 亲和力:酶能够与底物结合的过程称为亲和力。
这种相互作用的前提是酶要具有适当的构象,与底物结合必须与一个特定的位点相互作用。
2. 过渡态:酶底物复合物中活性位点经历了一系列形态变化,从而形成一个临时的稳定结构,称为过渡态。
3. 成品生成:过渡态分解后,产生的产物与酶比较弱的相互作用,从而释放酶,进行下一次反应。
4. 酶活性的调节:酶活性的调节是由于底物、产物或其他非底物分子对酶的亲和力和/或立体结构的变化所引起的。
二、酶的作用机制酶的作用机制是基于其分子结构和学问性质的,主要有以下几种:1. 酶催化作用:酶可以促进底物分子之间的反应,降低反应的能垒,从而使化学反应更加容易进行。
2. 特异性:酶的活性中心由一定的氨基酸序列组成,这种序列的三级结构决定了酶的特异性。
在酶底物复合物中,酶能够与特定的底物结合,由于底物在酶的活性中心区域上的结构与底物的大小、形状和化学性质互相适应而产生特异性。
3. 反应速率:酶催化反应的速度比无酶反应快得多,因为酶结构中的活性中心能够提醒底物之间的相互作用。
酶催化反应的速率取决于反应底物的浓度、酶催化的速率常数和反应条件等。

《酶与酶促反应》导学案一、学习目标1、理解酶的概念和本质。
2、掌握酶的特性。
3、了解影响酶促反应的因素。
4、学会探究酶的特性和影响酶促反应的实验设计与分析。
二、学习重点1、酶的作用、本质和特性。
2、影响酶促反应的因素。
三、学习难点1、酶降低化学反应活化能的原理。
2、探究影响酶活性的实验设计与分析。
四、知识梳理(一)酶的发现1、 1773 年,意大利科学家斯帕兰札尼做了一个巧妙的实验:将肉块放入小巧的金属笼内,然后让鹰把小笼子吞下去。
过一段时间后,他把小笼子取出来,发现笼内的肉块消失了。
这个实验说明了胃具有化学性消化的作用。
2、1836 年,德国科学家施旺从胃液中提取出了消化蛋白质的物质,解开了胃的消化之谜。
3、 1926 年,美国科学家萨姆纳从刀豆种子中提取出脲酶的结晶,并通过化学实验证实脲酶是一种蛋白质。
4、 20 世纪 80 年代,美国科学家切赫和奥特曼发现少数 RNA 也具有生物催化功能。
(二)酶的概念酶是活细胞产生的具有催化作用的有机物,其中绝大多数酶是蛋白质,少数酶是 RNA。
(三)酶的作用1、细胞代谢:细胞中每时每刻都进行着许多化学反应,统称为细胞代谢。
2、酶在细胞代谢中的作用:降低化学反应的活化能,使反应能够快速进行。
(四)酶的特性1、高效性:酶的催化效率比无机催化剂高许多倍。
2、专一性:一种酶只能催化一种或一类化学反应。
3、作用条件较温和:酶所催化的化学反应一般是在比较温和的条件下进行的。
(五)影响酶促反应的因素1、温度:在一定温度范围内,随着温度的升高,酶的活性逐渐增强;超过最适温度,酶的活性逐渐降低,甚至失活。
2、pH:在一定pH 范围内,随着pH 的升高,酶的活性逐渐增强;超过最适 pH,酶的活性逐渐降低,甚至失活。
3、底物浓度:在其他条件适宜,酶量一定的条件下,在一定范围内,随着底物浓度的增加,反应速率逐渐加快;当底物浓度达到一定值后,反应速率不再增加。
4、酶浓度:在底物充足,其他条件适宜的条件下,酶促反应速率与酶浓度成正比。

酶的催化作用及酶促反应速率的影响因素酶是一种生物催化剂,是生命体系中重要的组成部分。
酶促反应是生物代谢过程中的基石,涉及能量转化、物质转化等多方面。
酶能够加速化学反应,使反应速率快了几千倍甚至百万倍,由此,酶在生物学、生物化学、医药学等学科中都具有重要的应用价值。
那么,究竟什么是酶的催化作用?酶促反应速率又受哪些影响因素的影响呢?一、酶的催化作用1. 酶的结构与功能酶是一种大分子蛋白质,由一条或多条多肽链组成,具有非常复杂的三维空间结构。
酶的功能依赖于它的三维构象和活性位点,即特定的酶结构和位置,特异性地与底物结合形成酶-底物复合物,使底物转化为产物,同时酶本身在反应中不受消耗。
2. 酶的催化机理酶的催化机理主要有两个方面,一个是使底物形成合适的状态,另一个是促进化学反应发生。
酶的时空特异性是通过酶与底物分子的特定相互作用实现的。
在底物分子与酶分子相互作用的过程中,底物分子进入酶分子的活性位点,只有当底物分子与酶分子的活性位点配对成功时,才能发生化学反应。
二、酶促反应速率的影响因素1. 温度温度是影响酶促反应速率的主要因素之一,酶有一个适宜的温度范围,即最佳反应温度。
在最佳反应温度下,酶分子的结构最稳定,能够实现最好的空间构象,从而最大限度地发挥酶的催化作用。
超过最适温度后,酶分子结构不断变化,活性位点的空间构象被破坏,酶的活性会受到影响甚至失活。
2. pH值pH值是影响酶的催化作用的一个重要因素。
不同的酶对应不同的最适pH值,当pH值偏离酶的最适pH值时,酶分子的活性会受到影响。
3. 底物浓度底物浓度是影响酶催化速率的因素之一。
当底物浓度较低时,酶的环境中底物分子与酶分子的碰撞数目较少,酶的产物生成速率也较慢。
但是当底物浓度逐渐增加时,酶的环境中底物分子与酶分子的碰撞数量增加,产物生成速率也随之增加。
4. 抑制剂抑制剂是一种可以降低酶催化活性的化学物质。
抑制剂分为不可逆性抑制剂和可逆性抑制剂,前者在酶-底物复合物中发挥作用,会永久性地破坏酶的结构,使之失去活性;后者在酶-底物复合物中不影响酶结构,但是会占据酶的活性位点,从而降低酶的活性。

第三章酶与酶的促反应名词解释全酶对于大多数化学本质为蛋白质的酶来说,按照化学组成可分为单纯酶和结合酶两大类。
全酶(又称结合酶)除了蛋白质组分外,还含有对热稳定的小分子物质。
前者称为酶蛋白,后者称为辅因子。
酶蛋白和辅因子单独存在时,均无催化活力。
只有二者结合成完整的分子时,才具有活力。
此完整的酶分子称为全酶。
全酶=酶蛋白+辅因子酶的辅助因子:主要包括金属离子和小分子有机化合物,在酶促反应中主要决定反应的种类和性质,在反应中起到传递电子、原子或某些化学基团的作用。
辅酶和辅基:辅酶是指以非共价键和酶蛋白结合的小分子有机物质,通过透析或超滤等物理方法可以除去。
辅基是指以共价键和酶蛋白结合的小分子有机物质,不能通过透析或超滤的方法除去酶的活性中心是指酶分子能与底物特异性结合并将底物转化为产物,具有特定空间结构的区域。
使酶分子执行其催化功能的部位同工酶催化相同的化学反应,而酶蛋白的分子结构,理化性质及免疫学性质不同的一组酶(5种乳酸脱氢酶同工酶)变构调节变构调节(也叫别构调节)是指一些代谢物与某些酶分子活性中心以外的某一部位可逆的结合(非共价结合),引起酶构象变化、从而改变酶的催化活性,此种调节方式叫做变构调节。
共价修饰调节在其他酶的催化作用下,某些酶蛋白肽链上的一些基因可与某种化学基因发生可逆的共价结合,从而改变酶的活性,此过程成为共价修饰。
抑制剂凡能是酶的催化活性下降而不引起酶蛋白变性的物质称为酶的抑制剂。
Km米氏常数(Km)的含义是酶促反应达最大速度(Vm)一半时的底物(S)的浓度。
竞争性抑制抑制剂的结构与底物结构相似,能与底物竞争结合在酶的活性中心,从而降低或抑制酶活性这种抑制作用称竞争性抑制剂,这种抑制作用称竞争性抑制作用。
底物浓度增大,抑制下降。
Km增大,亲和力下降,Vm不变非竞争性抑制有些抑制剂可与酶活性中心以外的必需基团结合,不影响酶与底物的结合,抑制剂和底物可同时结合在酶分子上,形成酶-底物-抑制剂复合物,不能释放出产物,使酶活性丧失,这种抑制剂称为非竞争性抑制剂,这种抑制作用称为非竞争性作用。

酶促反应与酶动力学的基本原理酶是生物体中一类具有催化作用的蛋白质分子,是维持生命活动正常进行所必需的关键因素。
酶促反应是酶催化下的生化反应,而酶动力学则是研究酶的催化过程的一门学科。
本文将详细介绍酶促反应与酶动力学的基本原理。
一、酶的特性和功能酶是一种具有高度特异性和高催化活性的生物催化剂。
它们能够降低化学反应的活化能,从而加速反应速率。
酶的特性和功能主要体现在以下几个方面:1. 特异性:酶对底物具有高度特异性,只能催化特定的反应物转化为特定的产物。
2. 催化活性:酶能够加速反应速率,使反应在更温和的条件下发生,提高反应效率。
3. 可逆性:酶催化的反应是可逆的,可以使反应达到平衡状态。
4. 可调控性:酶的活性可以通过各种调控机制进行调节,以适应不同的生理需求。
二、酶促反应的基本原理酶催化是通过酶与底物之间的互作用来降低反应的活化能从而加速反应速率的过程。
酶促反应的基本原理包括底物与酶的结合、酶-底物复合物的形成、化学反应的催化以及生成产物等几个关键步骤。
1. 底物与酶的结合:酶通过活性位点与底物发生特异性结合,形成酶-底物复合物。
2. 酶-底物复合物的形成:酶-底物复合物的形成使得底物分子处于更有利的构象状态,有利于反应的进行。
3. 化学反应的催化:酶通过空间位阻、酸碱催化等方式提供合适的反应条件,加速底物的化学转化。
4. 产物的生成:反应完成后,产物与酶-底物复合物解离,释放出产物。
三、酶动力学的基本概念酶动力学是研究酶催化过程中反应速率与底物浓度、酶浓度、温度等因素之间关系的学科。
主要涉及酶催化速率常数(kcat)、酶催化常数(Km)以及酶的催化效率等几个关键概念。
1. 酶催化速率常数(kcat):kcat表示每个酶分子单位时间内可以催化的底物分子数,是反应速率的一个度量。
2. 酶催化常数(Km):Km表示酶与底物之间的亲和力,衡量底物与酶结合的紧密程度。
3. 酶的催化效率:酶的催化效率(kcat/Km)是衡量酶对底物转化的效率和速度的指标,酶的催化效率越高,酶对底物的转化越快速。

酶浓度对酶促反应速度的影响曲线酶是生物体内一类催化剂,能够加速生物体内化学反应的进行,提高反应速度。
酶浓度是指单位体积内酶的数量,一般以酶活性单位(U)表示。
酶浓度的改变会对酶促反应速度产生影响,即酶浓度对反应速率有一定的关系。
本文将通过实验数据和理论分析来探讨酶浓度对酶促反应速度的影响曲线。
一、实验介绍为了研究酶浓度对酶促反应速度的影响,我们选择了一种常用的酶——过氧化氢酶进行实验。
过氧化氢酶是一种催化过氧化氢分解的酶,能够将过氧化氢分解成氧气和水,反应式如下:2H2O2 -> 2H2O + O2实验采用一种比色法来检测反应速度,即通过测量反应过程中产生的氧气量来评价酶促反应速度的变化。
二、实验步骤1.实验所需材料:(1)过氧化氢酶溶液(2)过氧化氢底物溶液(H2O2)(3)缓冲液(4)酶测色液2.制备一系列不同浓度的酶溶液,浓度范围通常选择10U/mL至100U/mL,并用适量的缓冲液稀释。
3.将酶溶液各取一定体积如1mL分别加入试管中,然后加入适量的H2O2底物溶液。
4.在反应开始和结束时,分别加入适量的酶测色液,使反应液显色。
5.根据显色程度可以定量测量出释放的氧气量,从而推测出反应速度。
6.重复实验,取多组数据,得出酶浓度对酶促反应速度的影响曲线。
三、结果与讨论通过实验数据的分析,可以得出如下结论:1.当酶浓度较低时,反应速度较慢,随着酶浓度的增加,反应速度逐渐增加,但增速逐渐趋缓。
2.在一定范围内,酶浓度和反应速度之间存在着正相关关系,即酶浓度越高,反应速度越快。
3.当酶浓度达到一定阈值后,继续增加酶浓度已经不再能够显著提高反应速度,此时酶的量已经足够催化全部反应。
通过以上结果可以得出酶浓度对酶促反应速度的影响曲线,大致呈现一个类似于饱和曲线的形状。
当酶浓度较低时,酶的活性物质较少,反应速度受限于酶活性物质的数量,因此反应速度较慢。
随着酶浓度的增加,酶活性物质的数量增加,反应速度逐渐增加,但增速逐渐减缓。
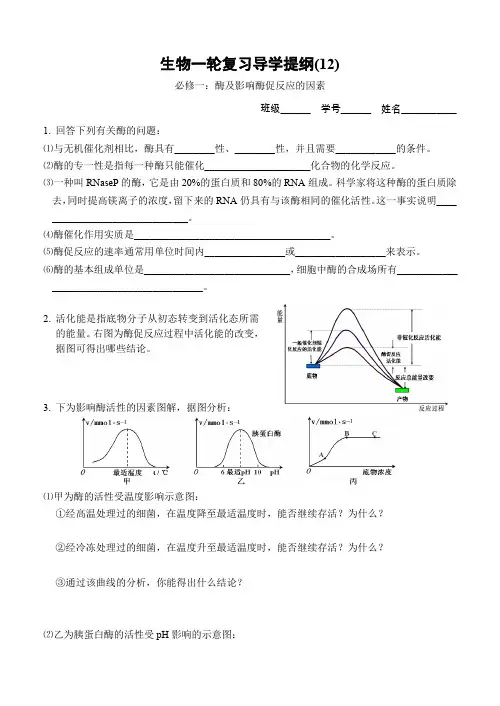
生物一轮复习导学提纲(12)必修一:酶及影响酶促反应的因素班级______ 学号______ 姓名___________1.回答下列有关酶的问题:⑴与无机催化剂相比,酶具有________性、________性,并且需要____________的条件。
⑵酶的专一性是指每一种酶只能催化_____________________化合物的化学反应。
⑶一种叫RNaseP的酶,它是由20%的蛋白质和80%的RNA组成。
科学家将这种酶的蛋白质除去,同时提高镁离子的浓度,留下来的RNA仍具有与该酶相同的催化活性。
这一事实说明____ ___________________________。
⑷酶催化作用实质是_______________________________________。
⑸酶促反应的速率通常用单位时间内________________或__________________来表示。
⑹酶的基本组成单位是_____________________________,细胞中酶的合成场所有____________ ______________________________。
2.活化能是指底物分子从初态转变到活化态所需的能量。
右图为酶促反应过程中活化能的改变,据图可得出哪些结论。
3.下为影响酶活性的因素图解,据图分析:⑴甲为酶的活性受温度影响示意图:①经高温处理过的细菌,在温度降至最适温度时,能否继续存活?为什么?②经冷冻处理过的细菌,在温度升至最适温度时,能否继续存活?为什么?③通过该曲线的分析,你能得出什么结论?⑵乙为胰蛋白酶的活性受pH影响的示意图:反应温度(℃)反应温度(℃)反应温度(℃)反应温度(℃)①当将胰液的pH 从9调至2的过程中,胰蛋白酶的活性将怎样变化?②当将胰液的pH 从2调至8的过程中,胰蛋白酶的活性将怎样变化?③通过上述分析,你能得出什么结论?④下图中能正确表示胰蛋白酶对底物的分解速度和温度关系的是______。


酶的结构与酶促反应酶是一类生物催化剂,能够在生物体内加速化学反应的进行。
酶可以通过特定的结构来催化特定的反应,这种结构与功能的关系被称为“锁与钥”模型。
本文将探讨酶的结构特点以及酶促反应的机制。
一、酶的结构酶的结构通常由蛋白质组成。
蛋白质由氨基酸经过肽键连接而成,形成了多肽链。
在多肽链的折叠过程中,酶蛋白质链会形成不同的二级、三级和四级结构。
1. 二级结构二级结构是指蛋白质链在空间上的折叠形态,其中最常见的二级结构是α螺旋和β折叠。
α螺旋是由多个氨基酸残基以螺旋形式排列而成,而β折叠则是由多个氨基酸残基以折叠形式排列而成。
这些二级结构的存在以及相对稳定的形态为酶的整体结构提供了基础。
2. 三级结构三级结构是指蛋白质链在空间上的整体折叠形态。
酶的三级结构是由不同的二级结构单元按照一定的方式排列组成的。
这些二级结构单元之间可以通过氢键、离子键、范德华力等相互作用力相连。
这些相互作用力的存在使得酶的结构相对稳定,并且能够保持特定的构象。
3. 四级结构四级结构是指由多个多肽链相互组装而成的酶的整体结构。
多肽链之间可以通过非共价键相互作用,如氢键、离子键、疏水作用力等。
这些多肽链的组装可以使得酶的结构更加复杂,形成活性中心。
二、酶促反应的机制酶促反应是指酶催化下的生物化学反应。
酶在反应中的作用是提供一个活性中心,使得底物能够与酶结合并发生特定的化学反应。
在酶促反应中,通常存在以下几个步骤:1. 亲合作用酶与底物之间通过非共价键的相互作用力来形成酶底物复合物。
这种亲合作用可以使酶底物复合物更加稳定,并增加反应速率。
2. 反应酶底物复合物在活性中心的催化下发生化学反应。
催化作用通常包括底物的分解、合成、重排等过程。
3. 产物释放反应完成后,酶释放产物,并回归到初始状态,以便继续进行下一轮反应。
产物的释放可以通过多种方式实现,如酶与产物的亲和力下降、反应条件的变化等。
三、酶的调控与应用酶的活性可以通过多种方式进行调控,如温度、pH值、底物浓度等。

关于酶的所有名词解释酶,作为生物体内一类特殊的蛋白质,对于生命活动中的化学反应具有至关重要的作用。
本文将对相关的名词进行解释,以帮助读者更好地理解和认识酶的作用机制。
1. 酶的定义酶是一种生物催化剂,能够加速化学反应的进行。
它不改变化学反应的平衡,也不参与其反应的最终结果,但可以降低反应所需的能量,从而增加反应速率。
2. 酶促反应酶促反应是在酶参与下进行的化学反应。
酶通过与底物形成酶-底物复合物,以催化反应的进行。
当底物与酶结合时,酶通过调整底物的空间构象,或者提供特定的反应环境,在不同的活性位点上发挥作用。
这种相互作用可以使底物之间的键易于形成、断裂或重排,从而加速反应速度。
3. 底物底物是指参与化学反应的物质。
酶具有高度的底物特异性,即特定的酶只能催化特定底物的反应。
这种特异性受到酶与底物之间的独特空间结构以及相互作用的影响。
4. 反应速率反应速率是指化学反应在特定条件下的变化率。
酶的存在可以显著提高反应速率,使它们在有限的时间内完成更多的化学反应。
5. 酶活性酶活性是评估酶催化效果的指标。
酶活性通常表示为单位时间内酶催化产物的形成量。
酶的活性受到许多因素的影响,如温度、pH值和底物浓度等。
6. 酶底物复合物酶底物复合物是在酶与底物结合形成的临时结构。
在酶底物复合物中,酶与底物之间的键合和作用力可以改变底物的构象,从而使酶催化的反应更具可能性。
7. 活性位点酶分子上的活性位点是酶催化反应发生的具体位置。
活性位点通常由一些特定的氨基酸残基组成,这些残基通过亲和力、电荷等相互作用与底物结合,并促使反应的进行。
8. 辅因子辅因子是酶催化活性所必需的非蛋白质辅助因子。
常见的辅因子包括金属离子(如锌、铜、铁等)和辅酶(如辅酶A、NAD+等)。
这些辅助因子可以协助酶的催化过程,改变底物的性质并提供必要的反应环境。
9. 酶动力学酶动力学是研究酶催化动力学行为的科学。
它涉及到酶催化反应速率的测定、酶的动力学参数(如最大反应速率、底物浓度等)的求解,以及对酶的活性调节机制的分析。

酶促反应实验报告酶促反应是一种在生物体内常见的化学反应过程,其重要性不言而喻。
在生命过程中,我们的身体内有很多种酶,在不同的反应中发挥着不同的作用。
本次实验是通过酶促反应的方式来研究不同条件下对酶作用的影响。
通过实验的结果,加深我们对于酶和酶促反应的了解。
实验方法:材料:过氧化氢、酶、试管、酶标板、醋酸、磷酸盐缓冲液、双氧水。
操作步骤:1.将3倍分贝的过氧化氢与不同浓度的酶混合,分别装在试管中。
2.将不同浓度的醋酸和磷酸盐缓冲液分别混合,用于调节酸碱度。
3.将混合后的试管放入恒温水浴中,每5秒钟记录一次反应的进展情况。
实验结果:实验数据记录表:| 酸碱度 | 酿酒酵母酶 | 酶标板 || ------ | --------- | ------- || 2 | 快 | 快 || 3 | 适中 | 适中 || 4 | 缓慢 | 缓慢 |根据实验结果可以看出,酿酒酵母酶在不同酸碱度的环境下,反应的速度存在较大的差异。
在酸碱度为2的情况下,酶的反应速度最快,其次是酸碱度为3的情况,而酸碱度为4时酶的反应速度最慢。
这也从侧面证明了酶是一种对于环境条件比较敏感的物质,在不同的环境下会有差异表现。
通过本次实验,我们可以得出以下结论:1.不同的酸碱度对于酶活性存在影响。
2.在酸碱度为2的情况下酶反应的速度最快。
4.不同酸碱度下的酶反应速度趋向一致,说明酶的反应受到环境条件的影响较大。
参考文献:1. 王嘉亮, 张小强, 林文豪. 酶结构与功能的研究进展[J]. 化学通报, 2016(04):31-37.2. 刘洋, 朱佳佳, 赵芳芳. 酶影响因素及应用综述[J]. 技术创新与应用, 2018(26):142-143.3. 赵亚非, 宋茂静, 杨月华. 酶活性与温度、温敏性酶[J]. 湖南农业科学, 2015(10):23-25.。
酶促反应的四个特点酶促反应是指在生物体内,由酶催化而发生的化学反应。
酶是一类特殊的蛋白质,能够降低反应的活化能,并加速反应速率。
酶促反应有以下四个特点:1. 酶促反应具有高效性:酶能够提高反应速率,使得反应在生物体内能够在适当的时间内进行。
酶能够加速化学反应的速率,使得生物体内的代谢过程能够迅速进行,维持生命活动的正常进行。
2. 酶促反应具有高度专一性:酶能够选择性地催化特定的反应。
每种酶只能催化特定的底物转化为特定的产物,具有高度的专一性。
这是因为酶的结构决定了其特异性,酶的活性中心与底物之间形成特异性的亲和力,从而实现特定底物的催化。
3. 酶促反应受环境影响较大:酶的活性受到环境条件的影响较大。
酶的活性受到温度、pH值和离子浓度等环境因素的影响。
适宜的温度和pH值能够使酶的活性达到最佳状态,从而提高酶促反应的效率。
4. 酶促反应受底物浓度影响:底物浓度对酶促反应速率有直接影响。
在酶的催化下,底物与酶结合形成底物-酶复合体,然后通过化学反应生成产物。
底物浓度的增加会提高底物与酶结合的机会,从而增加反应速率。
但当底物浓度过高时,酶的活性可能会受到抑制。
在扩展解释酶促反应的过程中,还可以从以下几个方面展开描述:1. 酶的结构与功能:酶是一种具有特殊的三维结构的蛋白质,其结构决定了其功能。
酶分为两种基本类型:单酶和复酶。
单酶是指能够催化一个底物的酶,而复酶是指需要辅助因子(如辅酶或金属离子)才能催化底物的酶。
酶的活性中心是指参与底物与酶结合和催化反应的特定区域,通常由氨基酸残基组成。
酶的活性中心与底物之间的亲和力决定了酶的专一性。
2. 酶的催化机制:酶促反应的催化机制是指酶如何通过降低反应的活化能来加速反应速率。
酶可以通过多种方式催化反应,包括酸碱催化、共价催化和金属离子催化等。
其中,酸碱催化是指酶通过提供或接受质子来促使反应进行;共价催化是指酶通过与底物形成共价键来催化反应;金属离子催化是指酶中的金属离子作为催化剂参与反应。
酶促反应的名词解释酶促反应是一种生物化学反应,其特点是通过酶催化作用来加速化学反应速度。
酶是一类特殊的蛋白质分子,其在生物体内起到调节和促进化学反应的作用。
本文将从酶的结构与功能、酶催化反应的机制、酶促反应的应用以及未来研究方向等几个方面对酶促反应进行解释。
一、酶的结构与功能酶是由一种或多种氨基酸序列组成的蛋白质分子,其结构多样且高度复杂。
酶分子通常由一个或多个催化活性位点组成,可以与底物结合并催化化学反应的进行。
酶具有高度的专一性,只能催化特定的底物与反应物进行特定类型的化学反应。
此外,酶还具有调节化学反应速率的功能,可以根据生物体内的需要来促进或抑制特定反应的进行。
二、酶催化反应的机制酶通过催化剂的作用来加速化学反应的速率,而不改变反应的位置平衡。
酶催化反应的机制涉及酶与底物的结合,底物在酶的作用下形成过渡态,并最终生成产物。
酶催化反应可分为两种主要机制:锁-键模型和诱导拟柔模型。
在锁-键模型中,酶通过与底物结合形成酶-底物复合物,该复合物使底物中的键的形成与断裂更容易。
酶通过减少化学反应所需的活化能,使反应速率远远超过非催化反应速率。
在诱导拟柔模型中,酶与底物结合后,酶分子会发生构象变化,适应底物的形状。
这种适应使酶的活性位点更容易结合和催化底物,从而加速了化学反应的进行。
三、酶促反应的应用由于酶具有高度的专一性和催化效率,酶促反应在生物科学、医学和工业生产等领域具有广泛的应用前景。
在生物科学领域,酶促反应被广泛应用于DNA测序、蛋白质表达和配体-受体相互作用等研究中。
通过利用酶促反应,科学家能够更好地了解生命的基本组成和功能。
在医学领域,酶促反应被用于生物分子标记和药物合成中。
例如,通过标记分子,医生可以使用酶促反应在人体内部可视化病灶位置。
此外,酶促反应还被用于合成药物,从而提高药物的活性和稳定性。
在工业生产中,酶促反应在食品、饮料和纺织等行业具有重要的应用。
通过利用酶促反应,生产商能够减少能耗和化学废物的产生,提高生产效率和产品质量。
酶的底物特异性和酶促反应速率酶是生物体内的催化剂,在许多生化反应中起着关键作用。
酶的底物特异性和酶促反应速率是酶学研究中的重要内容。
本文将对酶的底物特异性和酶促反应速率进行探讨,并分析其在生物体内的意义。
一、酶的底物特异性酶的底物特异性指的是酶对底物的选择性。
酶能够识别并结合特定的底物,并将其转化为产物。
酶的底物特异性是由酶的结构决定的。
酶的活性部位有具有特定的结构和电荷,能够与底物形成亲和力较强的结合。
酶的底物特异性可以通过“锁与钥”模型来解释。
在这个模型中,酶的活性部位就像一个锁孔,底物则是适合于这个锁孔的钥匙。
只有当底物的结构与酶的活性部位完全吻合时,才能形成稳定的酶底物复合物,从而进行催化反应。
实际上,酶的底物特异性并不是非常严格的。
一种酶可以与多种底物发生反应,但不同底物的反应速率可能不同。
酶的底物特异性受到多种因素的影响,如酶的空间构象、活性位点的氨基酸残基以及底物的结构。
二、酶促反应速率酶促反应速率是指在酶的作用下,底物转化为产物的速率。
酶促反应速率决定了酶催化的效率和生化反应的速度。
酶促反应速率可以通过酶的催化常数来衡量,常用的催化常数包括酶的最大反应速率(Vmax)和底物浓度为一半时的反应速率(Km)。
Vmax表示在酶浓度饱和的情况下,单位时间内转化的最大底物量。
Vmax取决于酶的浓度和底物浓度。
当底物浓度远远大于Km时,Vmax可以表示为一个恒定值。
而当底物浓度接近Km时,Vmax则表示为底物浓度的函数。
Km表示当反应速率达到Vmax的一半时,底物浓度的大小。
Km可以衡量酶对底物的亲和力和酶的底物特异性。
Km越小,酶对底物的亲和力越强,底物与酶的亲和力越大,Km越大,则表示酶对底物的亲和力越弱,底物与酶的亲和力越小。
酶的底物特异性和酶促反应速率在生物体内具有重要的生理学和生化学意义。
酶的底物特异性使得生物体内的化学反应能够更加高效地进行,减少了底物的能量消耗和副产物的产生。
酶促反应速率可以调节生物体内代谢途径的速度,使其适应外部环境的需求。
化学反应中的酶与酶促反应在化学反应中,酶是一种重要的催化剂。
它们能够加速酶促反应的进行,降低活化能,从而使反应更加高效。
本文将从酶的结构与功能、酶促反应的机制等方面进行讨论。
一、酶的结构与功能酶是一种特殊的蛋白质,由氨基酸组成,具有复杂的三维结构。
它们可以在生物体内特异性地催化化学反应,而不改变自身的化学性质。
酶能够与底物结合形成酶底物复合物,通过改变反应介质中底物的构象,使反应速率增加。
酶的功能主要体现在以下几个方面:1. 催化反应:酶通过提供活化能的途径,降低化学反应的活化能,从而加速反应进行。
这种催化作用可以使反应速率提高几千倍甚至百万倍。
2. 特异性:酶对特定底物有高度的选择性,只与特定的底物结合并催化特定的化学反应。
这种特异性是由酶的结构决定的。
3. 调节反应:酶可以通过调节其自身的活性,根据细胞内外的环境变化,来对化学反应进行调节。
这种调节使生物体能够适应不同的生理和环境需求。
二、酶促反应的机制酶促反应是指在酶存在的条件下,底物发生化学反应,最终生成产物。
酶促反应的机制可以分为以下几个步骤:1. 酶与底物的结合:酶与底物之间通过非共价相互作用力,如氢键、离子键、范德华力等,结合形成酶底物复合物。
2. 底物转化:酶通过改变底物的构象,使其在酶的作用下发生化学变化。
这种构象改变通常涉及底物的键长、键角等参数的变化。
3. 产物释放:酶通过进一步改变底物的构象,使之转化为产物。
产物在酶的作用下与酶解离,释放出来。
通过上述步骤,酶能够在细胞内部发挥催化作用,加速复杂的生物化学反应,从而维持细胞内的代谢平衡。
三、酶与生物反应的应用由于酶对生物反应的催化作用具有高效、特异性和选择性等优点,因此在生物技术领域得到广泛应用。
1. 生物催化:酶在工业生产中被广泛利用,例如酶制剂可以用于制备食品、药物和化妆品等。
利用酶催化反应,可以减少废物产生,提高反应效率。
2. 生物传感器:酶可以被用作生物传感器的生物元件。