从牛奶中提取酪蛋白
- 格式:doc
- 大小:26.50 KB
- 文档页数:3

牛奶中酪蛋白含量的测定牛奶是一种营养丰富的饮品,其中富含多种蛋白质,而酪蛋白是牛奶蛋白质中的主要成分之一。
准确测定牛奶中酪蛋白的含量对于评估牛奶的质量、了解其营养价值以及在相关的食品加工和研究中都具有重要意义。
酪蛋白是一种磷蛋白,在牛奶中以胶束的形式存在。
它的性质相对稳定,在一定的条件下可以从牛奶中沉淀分离出来。
目前,测定牛奶中酪蛋白含量的方法主要有以下几种:一、等电点沉淀法酪蛋白在其等电点(pH 46 48)时溶解度最低,容易沉淀析出。
实验操作时,首先将新鲜牛奶用脱脂棉过滤,以去除其中的杂质。
然后将牛奶缓慢加入到预先调节好 pH 值至 46 48 的醋酸醋酸钠缓冲溶液中,并不断搅拌。
搅拌均匀后静置一段时间,使酪蛋白充分沉淀。
接着通过离心分离的方式将沉淀的酪蛋白收集起来,用蒸馏水多次洗涤,以去除残留的乳清蛋白和其他杂质。
最后将沉淀烘干至恒重,通过称重计算出酪蛋白的含量。
这种方法的优点是操作相对简单,成本较低。
但缺点是沉淀过程中可能会有少量的乳清蛋白一同沉淀下来,导致测定结果偏高。
二、盐析法盐析是指在蛋白质溶液中加入大量的中性盐,以破坏蛋白质的水化膜并中和其电荷,从而使蛋白质沉淀析出。
对于牛奶中酪蛋白的测定,可以使用硫酸铵等盐类进行盐析。
实验时,将牛奶与一定浓度的硫酸铵溶液混合,搅拌均匀后静置一段时间,使酪蛋白沉淀。
同样通过离心、洗涤、烘干等步骤,最终得到酪蛋白的质量并计算其含量。
盐析法的优点是沉淀效果较好,能够较为有效地分离酪蛋白。
但需要注意的是,盐的浓度和使用量需要严格控制,否则可能会影响测定结果的准确性。
三、电泳法电泳是指带电粒子在电场中向着与其所带电荷相反的电极移动的现象。
利用电泳技术可以分离和测定牛奶中的酪蛋白。
首先,对牛奶样品进行预处理,使其中的蛋白质溶解并带电。
然后将处理后的样品加入到电泳槽中,施加电场。
由于酪蛋白和其他蛋白质的带电性质、分子量等不同,它们在电场中的迁移速度也不同,从而实现分离。

竭诚为您提供优质文档/双击可除酪蛋白的制备实验报告篇一:酪蛋白的制备----生化实验酪蛋白的制备一、目的1、学习从牛奶中制备酪蛋白的原理和方法。
2、掌握等电点沉淀法提取蛋白质的方法。
二、原理牛乳中的主要的蛋白质是酪蛋白,含量约为35g/L。
酪蛋白是一些含磷蛋白质的混合物,等电点为4.7。
利用等电点时溶解度最低的原理,将牛乳的ph调至4.7时,酪蛋白就沉淀出来。
用乙醇洗涤沉淀物,除去脂类杂质后便可得到纯酪蛋白。
三、材料、试剂与器具(一)材料新鲜牛奶(一)试剂1、95%乙醇1200mL2、无水乙醚1200mL3、0.2mol/Lph4.7醋酸——醋酸钠缓冲液300ml先配A液与b液A液:0.2mol/L醋酸钠溶液称naAc·3h2o54.44g,定容至2000ml。
b液:0.2mol/L醋酸溶液,称优纯醋酸(含量大于99.8%)12.0g定容至1000ml。
取A液1770ml,b液1230ml混合即得ph4.7的醋酸——醋酸钠缓冲液3000ml。
4、乙醇——乙醚混合液乙醇:乙醚=1:1(V/V)(二)器具1、离心机2、抽滤装置3、精密ph试纸或酸度计4、电炉5、烧杯6、温度计四、操作步骤(一)酪蛋白的粗提100mL牛奶加热至40℃。
在搅拌下慢慢加入预热至40℃、ph4.7的醋酸缓冲液100mL.用精密ph试纸或酸度计调ph至4.7。
将上述悬浮液冷却至室温。
离心15分钟(3000r/min)。
弃去清液,得酪蛋白粗制品。
(二)酪蛋白的纯化1、用水洗涤沉淀3次,离心10分钟(3000r/min),弃去上清液。
2、在沉淀中加入30mL乙醇,搅拌片刻,将全部悬浊液转移至布氏漏斗中抽滤。
用乙醇—乙醚混合液洗沉淀2次。
最后用乙醚洗沉淀2次,抽干。
3、将沉淀摊开在表面上,风干;得酪蛋白纯品。
(三)准确称重,计算含量和得率。
含量:酪蛋白g/100mL牛乳(g%)式中理论含量为3.5g/100mL牛乳。
五、注意事项1、由于本法是应用等电点沉淀法来制备蛋白质,故调节牛奶液的等电点一定要准确。


酪蛋白提取实验报告酪蛋白提取实验报告引言:酪蛋白是一种重要的蛋白质成分,存在于牛奶等乳制品中。
本实验旨在通过提取酪蛋白,探索其在食品工业和医药领域的应用潜力。
通过实验过程的详细描述和结果的分析,我们将深入了解酪蛋白提取的方法和效果。
实验材料与方法:1. 材料:牛奶、氯化钙、硫酸、酒精、磷酸盐缓冲液等。
2. 方法:a. 酪蛋白的沉淀:将牛奶加热至80°C,加入少量氯化钙搅拌,冷却后加入硫酸沉淀酪蛋白。
b. 酪蛋白的溶解:将酪蛋白沉淀加入磷酸盐缓冲液,搅拌溶解。
c. 酪蛋白的纯化:将溶解的酪蛋白加入酒精,离心沉淀,去除杂质。
实验过程:1. 酪蛋白的沉淀:将适量牛奶加热至80°C,加入少量氯化钙搅拌,冷却后加入硫酸,酪蛋白逐渐沉淀。
2. 酪蛋白的溶解:将沉淀后的酪蛋白加入磷酸盐缓冲液,搅拌溶解,形成均匀的溶液。
3. 酪蛋白的纯化:将溶解的酪蛋白加入酒精,离心沉淀,去除杂质,得到纯净的酪蛋白。
实验结果与讨论:通过实验,我们成功地提取到了酪蛋白,并进行了初步的纯化。
在实验过程中,我们观察到牛奶在加热后出现了沉淀,这是因为加热使酪蛋白发生凝聚而形成的。
随后,我们通过加入磷酸盐缓冲液将酪蛋白溶解,得到了均匀的溶液。
最后,通过加入酒精并进行离心,我们成功地去除了酪蛋白溶液中的杂质,得到了纯净的酪蛋白。
酪蛋白作为一种重要的蛋白质成分,具有广泛的应用潜力。
在食品工业中,酪蛋白可用于制作奶酪、酸奶等乳制品,增加其营养价值和口感。
此外,酪蛋白还可以作为食品添加剂,提高食品的稳定性和质感。
在医药领域,酪蛋白具有抗菌、抗病毒等生物活性,可以应用于药物的载体材料和生物医学领域。
然而,本实验中的提取方法仅是初步的纯化过程,酪蛋白的纯度还有待进一步提高。
在实际应用中,需要根据具体需求选择更加精细的提取和纯化方法,以获得更高纯度的酪蛋白。
此外,酪蛋白的稳定性也需要进一步研究,以确保其在不同环境条件下的应用效果。

牛奶中酪蛋白和乳糖的分离和鉴定肖丽王进(武汉大学化学与分子科学学院,2001级化学基地班)摘要:本文用实验的方法分离出牛奶的主要组成物质酪蛋白和乳糖,并用其特征反应和化学特性定性定量地检验了所分离的产物。
关键词:酪蛋白,乳糖,等电点,纸电泳,分离。
1 引言牛奶是一种营养价值丰富且易被人体吸收的物质。
现代研究表明,牛奶中所含的水,蛋白质,脂肪,糖,无机盐,维生素等都容易被人体吸收利用,除具有较高的营养价值外,对一些疾病还有一定治疗作用和保健养老作用。
酪蛋白是牛奶中的主要蛋白质,是含磷蛋白质的复杂混合物,在牛奶中以钙盐存在。
酪蛋白是两性化合物,当调节牛奶的pH值到酪蛋白的等电点(pH=4.8)时,酪蛋白呈电中性,这时酪蛋白的溶解度最小,会从牛奶中沉淀出来。
本实验利用酪蛋白的这种性质对其进行分离。
酪蛋白不溶于乙醇和乙醚,因此分离后用乙醇和乙醚洗去其中残留的脂肪。
牛奶中的糖主要是乳糖。
乳糖是一种还原性二糖,是目前唯一由哺乳动物合成的糖,以α-乳糖和β-乳糖两种同分异构体存在,在水溶液中两种乳糖可以相互转化,故水溶液有变旋光现象。
乳糖不溶于乙醇,本实验使用乙醇使它结晶,达到分离目的。
2 实验部分2.1 原料和仪器50 ml烧杯, 100 ml量筒,数字旋光异仪,蒸发皿,水浴锅,电泳仪,精密PH 试纸,简单抽滤装置。
冰HAc,95%乙醇,新鲜牛奶(伊利牌),碳酸钙,乙醚,考马斯亮蓝试剂,硫酸铜,氢氧化钠。
2.2 分离实验(1)酪蛋白的分离:步骤:取20ml新鲜牛奶于50ml烧杯中,在恒温水浴中加热到50ºC,不断搅拌下滴加10%HAc,用精密PH试纸调节牛奶的PH值至4.6~4.8(理论等电点pH=4.8,此步操作见后讨论),空气中放置一段时间冷却,之后过滤出其中的酪蛋白(滤液中加少量碳酸钙,留做下部实验用),依次用乙醇,乙醇和乙醚等体积混合液,乙醚洗涤酪蛋白,除去其中的脂肪,将其转入到表面皿上,在空气中风干后称重,得酪蛋白1.4218 g。


一、实验目的1. 掌握酪蛋白的提取方法。
2. 学习利用等电点沉淀法检测酪蛋白的含量。
3. 了解蛋白质的沉淀、溶解等性质。
二、实验原理酪蛋白是牛奶中的主要蛋白质,含量约为35g/L。
酪蛋白是一种含磷蛋白质的混合物,其等电点为4.7。
在等电点时,酪蛋白的溶解度最低,会以沉淀形式从牛奶中析出。
本实验通过调节牛奶的pH值至酪蛋白的等电点,使酪蛋白沉淀,然后通过离心、洗涤等步骤提取酪蛋白,并利用沉淀重量法检测酪蛋白的含量。
三、实验材料与试剂1. 材料:新鲜牛奶2. 试剂:- 95%乙醇- 无水乙醚- 0.2mol/L pH 4.7醋酸-醋酸钠缓冲液- 0.2mol/L氢氧化钠溶液- 0.1mol/L盐酸溶液- 精密pH试纸或酸度计- 离心机- 烧杯- 温度计- 研钵- 天平四、实验步骤1. 酪蛋白提取- 取50mL新鲜牛奶于150mL烧杯中,用热水浴加热至40℃,维持此温度,边搅拌边加入稀醋酸溶液约2mL,观察白色沉淀析出。
- 继续搅拌并使悬浊液冷却至室温,然后将混合物转入离心杯中,于3000r/min离心15min。
- 离心完毕后,弃去上清液,得到酪蛋白沉淀。
2. 酪蛋白洗涤- 将酪蛋白沉淀用少量去离子水洗涤2次,弃去上清液。
- 用95%乙醇洗涤沉淀2次,弃去上清液。
- 用无水乙醚洗涤沉淀2次,弃去上清液。
3. 酪蛋白干燥- 将洗涤后的酪蛋白沉淀置于研钵中,用研棒轻轻研磨,使酪蛋白沉淀充分干燥。
- 将干燥后的酪蛋白沉淀转移到称量瓶中,于105℃烘干2小时,取出,置于干燥器中冷却至室温,称量。
4. 酪蛋白含量测定- 取一定量的酪蛋白沉淀,加入0.1mol/L盐酸溶液,使酪蛋白溶解。
- 将溶液转移至容量瓶中,定容至刻度线,摇匀。
- 取一定量的溶液,加入0.2mol/L氢氧化钠溶液,使溶液pH值调至4.7,观察酪蛋白沉淀析出。
- 将沉淀转移至离心杯中,于3000r/min离心15min。
- 弃去上清液,称量沉淀重量,计算酪蛋白含量。


实验45 酪蛋白的制备一、实验目的掌握从牛乳中制备酪蛋白的原理和方法。
二、实验原理酪蛋白是牛乳中主要的蛋白质,它在牛乳中的含量约为每升35克。
实际上酪蛋白不是一种简单的蛋白质,而是一些含磷蛋白的混合物,酪蛋白在其等电点时溶解很低,利用这一性质,将牛乳调到PH4.8,酪蛋白就可以从牛乳中分离出来。
酪蛋白不溶于乙醇,可利用此性质从酪蛋白粗制剂中除去脂类杂质。
三、实验试剂与材料仪器(一)试剂1.牛乳2.醋酸钠缓冲液0.2M,PH4.63.乙醇(AR)95%4.乙醚()AR5.乙醇-乙醚混合液(1:1体积比)(二)仪器1.1000C温度计;2.电炉;3.细布;4.玻璃大漏斗;5.布氏漏斗(5mm);6.抽滤瓶(250ml);7.烧杯(500ml、100ml各一只);8.PH试纸活酸度计;9.量筒(500ml、100ml各一只);10.表面皿一块,玻棒一根;11.容量瓶(500ml一只);12.托盘天平;13.分析天平;14.研钵一套(¢9cm);15.离心机4000转/分;16.冰箱。
四、实验方法1.将100ml牛乳放到500ml烧杯中,加热到40℃,水浴控温。
再在搅拌下慢慢加入100ml 40℃左右醋酸缓冲溶液,调pH4.8左右,冷却至室温,(放至5分钟用细布过滤,收集沉淀)得酪蛋白粗品。
2.用蒸馏水洗去沉淀三次(每次30ml左右)。
搅碎离心10分钟,(3000转/分),弃去上清液。
3.将沉淀置于研钵中,渐加30毫升95%乙醇,静置片刻将此悬浮液倾于布氏漏斗中,抽滤,抽干后的制品移于小烧杯中,用乙醇-乙醚混合液洗二次(每次20毫升,洗一次,抽一次)最后用无水乙醚洗沉淀两次(每次10-20毫升),抽干。
4.将沉淀从布氏漏斗中移出,摊于表面皿上,烘干,得酪蛋白纯品。
5.称重计算含量和得率。
含量:酪蛋白克/100毫升牛奶(克%)得率:测得含量/理论含量×100%五.思考题1.等电点沉淀蛋白质的原理是什么?2.如果不用PH酸度计,用更简单的方法本实验是否也能进行?。

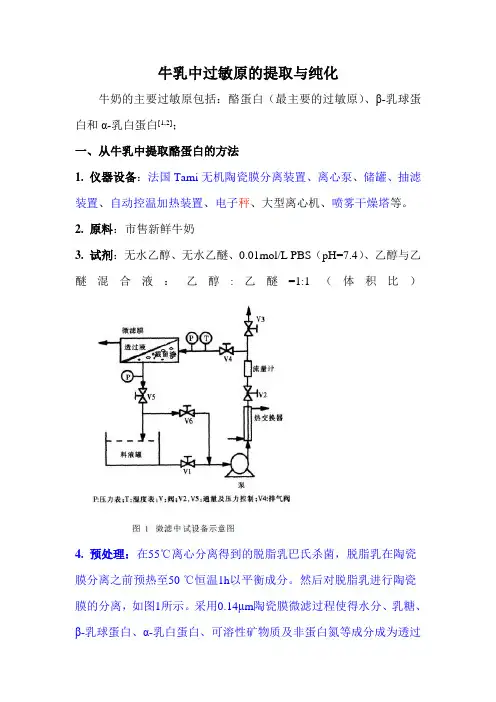
牛乳中过敏原的提取与纯化牛奶的主要过敏原包括:酪蛋白(最主要的过敏原)、β-乳球蛋白和α-乳白蛋白[1,2];一、从牛乳中提取酪蛋白的方法1. 仪器设备:法国Tami无机陶瓷膜分离装置、离心泵、储罐、抽滤装置、自动控温加热装置、电子秤、大型离心机、喷雾干燥塔等。
2. 原料:市售新鲜牛奶3. 试剂:无水乙醇、无水乙醚、0.01mol/L PBS(pH=7.4)、乙醇与乙醚混合液:乙醇:乙醚=1:1(体积比)4. 预处理:在55℃离心分离得到的脱脂乳巴氏杀菌,脱脂乳在陶瓷膜分离之前预热至50 ℃恒温1h以平衡成分。
然后对脱脂乳进行陶瓷膜的分离,如图1所示。
采用0.14μm陶瓷膜微滤过程使得水分、乳糖、β-乳球蛋白、α-乳白蛋白、可溶性矿物质及非蛋白氮等成分成为透过液。
这样,透过液用来提取β-乳球蛋白、α-乳白蛋白产品。
与此同时,截留液富集了酪蛋白粗品[3]。
5. 进一步提取:等电点沉淀法提取酪蛋白[1,4,5]原理:蛋白质在溶液中有两性电离现象。
假设某一溶液中含有一种蛋白质。
当p I=pH时该蛋白质极性基团解离的正负离子数相等,净电荷为0,此时的该溶液的pH值是该蛋白质的pI值。
某一蛋白质的p I大小是特定的,与该蛋白质结构有关,而与环境pH无关。
在此时,蛋白质之间的静电排斥力最小,溶解度最低。
利用蛋白质在pH值等于其等电点的溶液中溶解度下降的原理进行沉淀分级的方法称为等电点沉淀(isoelectric precipitation)。
操作:将预处理所得截留液加热到40℃,加入到同样40℃的PBS 中,用1mol/L HCl调节pH至4.7,此时有絮状的蛋白质沉淀析出。
将上述悬浮液冷却至室温,离心分离10min(15000r/min),除去上清液(乳清),得到酪蛋白粗制品。
二、酪蛋白的纯化[4,5]1. 用蒸馏水洗涤沉淀3次,离心10min(3000r/min),弃去上清液。
2. 在沉淀中加入3ml 95%的乙醇,搅拌片刻,将全部悬浊液转移至布氏漏斗中抽滤。
开放实验教学探索之“牛奶中酪蛋白的提取及检测”作者:曹荣月,卞筱泓,平涛,宋潇达,刘煜来源:《教育教学论坛》 2016年第21期曹荣月,卞筱泓,平涛,宋潇达,刘煜*(中国药科大学生命科学与技术学院,江苏南京210009)摘要:选拔大学一、二年级不同专业本科生,通过“牛奶中酪蛋白的提取及检测”开放实验,分别从脱脂牛奶和全脂牛奶中用盐析法提取酪蛋白,在不同干燥时间下(0h、16h、72h)称重比较粗制品收率。
通过此系列实验指导学生查阅文献、设计实验方案以及列出操作中可能出现的问题、注意事项,理解科研的意义,认识到研究性实验与教学性验证实验的不同。
掌握并拓展了相关理论知识,为培养大学生科技创新能力积累经验。
关键词:实践教学;酪蛋白的提取;开放实验;盐析法;科技创新能力中图分类号:G642.0 文献标志码:A 文章编号:1674-9324(2016)21-0271-02项目资助:中国药科大学生命科学与技术学院807奖教金;中国药科大学视频公开课(02640749);中国药科大学生物化学研究性试点课程教学改革(02420048-3);江苏省教育厅课题:江苏高校品牌专业建设工程资助项目(生物制药品牌专业,PPZY2015A057)开放实验源于20世纪60年代初期美国的物理实验教学改革,又称“开放式实验”。
1979年我国高校实验教学改革中首次提出开展“开放实验”的倡议[1],中国药科大学从2006年开始,尝试转变实验教学思路,建立符合本校实际情况的开放式实验教学模式,为不同学习水平的学生提供不同层次的实验内容,锻炼了学生的实验技能,提高了学习积极性[2]。
本项目选拔尚未开始生物化学实验的大一学生和刚刚完成生物化学相关实验课内容学习的大二学生,他们来自四年制的生科基地、生物制药、药学、食品、生物技术以及五年制临床药学等不同专业,通过此项目,引导一年级学生初步认识什么是科学研究,同时指导二年级学生如何查资料、如何写出具体实验方案,通过实际操作的过程和分析实验结果,比较教学性实验与做科学研究实验的异同点。
[精品]牛奶中酪蛋白和乳糖的分离和鉴定随着牛奶的广泛应用,对其中成分的研究越来越深入。
牛奶的主要成分包括蛋白质、乳糖、脂肪、微量元素等。
其中,蛋白质和乳糖是牛奶中的两个主要成分。
酪蛋白是牛奶中主要的蛋白质成分,而乳糖则是牛奶中独有的糖类成分。
本实验将介绍利用离心、沉淀、超滤和染色等技术,对牛奶中的酪蛋白和乳糖进行分离和鉴定的方法。
实验仪器:1. 离心机2. 沉淀管3. 超滤膜4. 热水浴5. 真空干燥装置6. 过滤纸7. 比色皿8. 比色计实验步骤:1. 样品制备取1 mL 牛奶放入离心管中,加入2 mL 85% 硫酸滴定至沉淀产生。
将沉淀离心5 min,弃去上清液,残留物称量并记录。
2. 酸解将沉淀物加入50 mL 的0.025 mol/L HCl 溶液中,放在水浴中煮沸10 min,冷却后过滤。
3. 超滤将过滤液倒入超滤装置中,以15000 rpm 的速度离心10 min,除去上清液。
4. 分离将上一步得到的膜筒用0.1 mol/L NaOH 溶液洗涤后插入新的容器中,加入适量纯水,以 5000 rpm 的速度离心10 min,除去洗涤液。
重复以上步骤,直到洗涤液 pH 值为7。
5. 紫外吸收分析取得样品过滤液后,比色皿中加入2 mL 样品和5 mL 乙醇,然后进行紫外吸收分析,记录吸收峰的波长。
结果分析:1. 酪蛋白的分离通过离心、沉淀和酸解等步骤,可将牛奶中的酪蛋白分离出来。
通过超滤和洗涤等步骤,可以得到纯的酪蛋白。
3. 酪蛋白和乳糖的鉴定通过紫外吸收分析,记录吸收峰的波长,可以鉴定出样品中酪蛋白和乳糖的含量。
总之,通过离心、沉淀、超滤和染色等技术,可以对牛奶中的酪蛋白和乳糖进行有效的分离和鉴定,提高对牛奶成分的认知。
实验题目:牛奶中酪蛋白的提取与分析实验材料:牛奶小组成员:实验时间:'~[?一:实验题目:牛奶中酪蛋白的提取与分析二:报告撰写者三、小组成员实验仪器温度计、布氏漏斗(*)、pH试纸(*)、抽滤瓶(*)水浴锅、烧杯、量筒、表面皿(*)、电子天平(*)、2个1000ml的容量瓶(*)、2张醋酸纤维薄膜(2cm×8cm 厚度120nm)成品(*)、培养皿9—10cm(*)、毛细管(*)、尺子、铅笔、单面刀片(*)、镊子、普通滤纸(*)、电泳槽、玻璃板8cm×12cm(*)、752型分光光度计(*)、细布(*)、、、的移液管、试管、试管架、四、实验材料牛奶(蒙牛特仑苏和伊利金典)五、实验试剂特仑苏400ml、金典200ml、巴比妥(*)、巴比妥钠(*)、氨基黑10B(*)、50ml甲醇AR (*)、100ml冰醋酸AR(*)、95%的乙醇250ml(*)、95%的乙醚100ml(*)、L的乙酸100ml (*)、L的乙酸钠100ml(*)、25g氢氧化钠固体(*)标准酪蛋白、15mg五水硫酸铜(*)、60mg酒石酸钾钠(*)#所需试剂配制方法:乙醇乙醚混合液的配制:10ml95%的乙醇10ml95%的乙醚乙醇钠缓冲液的配制:L的乙酸51mlL的乙酸钠49ml巴比妥钠缓冲液的配制:】巴比妥巴比妥钠染色液的配制:氨基黑10B50ml甲醇AR10ml冰醋酸AR漂洗液的配制:45ml95%乙醇AR#5ml冰醋酸AR蒸馏水透明液的配制:25ml的冰醋酸AR75ml的无水乙醇ARL氢氧化钠溶液的配制:16g的氢氧化钠固体定容至1000ml 10%氢氧化钠溶液的配制:…配制巴比妥钠缓冲液(,./L),将上述二者混合后定容于1000ml+40ml蒸馏水,混匀既得染色液配制乙醇乙醚1:1的混合液配制的乙酸钠缓冲液(l)混匀得染色液混匀得透明液5g 的氢氧化钠固体定容至50ml 双缩脲试剂的配制:15mg 五水硫酸铜60mg 酒石酸钾钠标准酪蛋白溶液A 的配制(10mg/ml ): 用L 氢氧化钠溶液配制10ml从特仑苏和金典中提取的酪蛋白样品液1、2的配制(2-9mg/ml ): 用L 氢氧化钠溶液配制10ml标准酪蛋白溶液B 的配制(1500μg/ml ): !用L 氢氧化钠溶液配制从特仑苏和金典中提取的酪蛋白样品液3、4的配制(50-1500μg /ml ): 用L 氢氧化钠溶液配制七、实验目的1. 掌握从牛奶中提取酪蛋白的方法2. 了解蛋白质分离纯化的基本办法3. 学习电泳的基本原理及掌握醋酸纤维素薄膜电泳分离酪蛋白的具体操作4. 掌握双缩脲法和紫外吸收法测定蛋白质含量的原理及操作方法并比较两种方法5. 熟悉分光光度计的原理和操作6. 比较特仑苏与金典中的酪蛋白含量 、八、实验原理酪蛋白在其等电点时静电荷为零,同种电荷的相互排斥作用消失,溶解度很低,利用这一性质,将牛乳调节到,酪蛋白就可以从牛乳中分离出来。
实验二从牛奶中提取酪蛋白
一、实验目的要求
1.学习从牛乳中制备酪蛋白的方法。
2.了解从牛奶中制取酪蛋白的原理。
二、实验原理
牛乳中的主要蛋白质是酪蛋白,含量约为3.5g/100ml。
酪蛋白是含磷蛋白质的混合物,相对密度1.25-1.31,不溶于水、醇、有机溶剂,等电点为4.7.利用等电点时溶解度最低的原理,将牛乳的pH值调至4.7时,酪蛋白就沉淀出来。
用乙醇洗涤沉淀物,除去脂质杂质后便可得到纯的酪蛋白。
三、原料与器材
鲜牛奶、恒温水浴锅、台式离心机、抽滤装置。
四、试剂
1.95%乙醇
2.无水乙醚
3.0.2mol/l的醋酸-醋酸钠缓冲液
A液(0.2mol/l的醋酸-醋酸钠溶液):称取NaAc.3H2O54.44g,定容至2000ml。
B液(0.2mol/l的醋酸-醋酸钠溶液):称取优级纯醋酸(含量大于99.8%)12.0g,定容至1000ml。
取A液1770ml与B液1230ml混合即得pH4.7的醋酸-醋酸钠缓冲液3000ml。
4.乙醇-乙醚混合液
乙醇:乙醚=1:1(体积比)。
五、操作步骤
1.将5ml牛奶置试管或小烧杯中,在水浴中加热至40℃,在搅拌下漫漫加入预热至40℃(应注意两种液体都应先预热至40℃再用),pH4.7的醋酸-醋酸钠缓冲液5ml,用精密pH试纸或酸度计调pH至4.7(用1%NaOH或10%醋酸溶液进行调整)。
观察牛奶开始有絮状沉淀出现后,保温一定时间使沉淀完全。
将上述悬浮液冷却至室温。
离心分离8min(8000r/min)或15min(2000r/min),弃去上清液,得到酪蛋白粗制品。
2.用蒸馏水洗涤沉淀3次(洗涤时将沉淀颗粒用干净吸管吹开或用毛细管的封闭一端搅开,充分洗涤),离心5min(12000r/min)或10min(3000r/min),弃去上清液。
3.在沉淀中加入3ml95%的乙醇,搅拌片刻,将全部悬浊液转移至布氏漏斗中抽滤。
用乙醇-乙醚混合液洗涤沉淀2次,最后用乙醚洗涤沉淀2次,抽干。
4.将沉淀摊开在表面皿上,风干,得酪蛋白精制品。
5.称取所获酪蛋白的质量(g)。
六、计算含量和得率:
酪蛋白含量(g/ml)=酪蛋白(g)/50m l×100%;
得率=测得含量/理论含量×100%。
七、实验注意事项:
1.离心管中装入样品后必须严格配平,否则对离心机损坏严重;
2.离心管装入样品后必须盖严,并擦干表面的水分和污物后方可放入离心机。
3.离心机用完后应拔下电源,然后检查离心腔中有无水迹和污物,擦除干净后才能盖上盖子放好保存,以免生锈和损坏。
八、思考题:
1.为什么调整溶液的pH可以将酪蛋白沉淀出来?
2.试设计一个利用蛋白质其他性质提取蛋白质的实验。
实验准备(每小组用量)
1.试剂:
(1)鲜牛奶10ml;
(2)0.2mol/l的醋酸-醋酸钠缓冲液10ml;
(3)95%的乙醇6ml;
(4)乙醇-乙醚混合液(乙醇:乙醚=1:1<体积比>)6ml;
(5)乙醚4ml;
(6)蒸馏水若干。
2.器材:
(1)恒温水浴锅;
(2)台式离心机;
(3)抽滤装置(循环水抽滤泵);
(4)精密pH试纸(2条)或酸度计;
(5)表面皿;
(6)纱布或滤纸;
(7)剪刀;
(8)毛细管或细口吸管;
(9)离心管(1.5ml,或与离心机配套)若干,总容积应大于10ml,本实验中用1.5ml离心管约10个/小组。