- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
7
EDTA: δ-pH图
HOOC2CH H
-OOC2CH
N CH2CH2 +
+ N
CH2COO-
H CH2COOH
1.0
H 6Y2+00..p 68Ka1=0H.96HY5H Y2+5+Y+ H2YpK 2- a2=1.6HYH 3-4YpKa3Y=2 4-.0 H 3Y-
分布系数
pKa4=2.67
pKƟa,2 1.6
pKƟa,3 2.0
pKƟa,4 2.67
pKƟa,5 6.16
pKƟa,6 10.26
逐级 常数
lgKƟf,1 10.26
lgKƟf,2 6.16
lgKƟf,3 2.67
lgKƟf,4 2.0
lgKƟf,5 1.6
lgKƟf,6 0.9
累积 lgβ1
lgβ2
lgβ3
lgβ4
lgβ5
H2 C CH2
N CH2
O
C
CH2 O
C
O
9
EDTA络合物的特点
广泛,EDTA几乎能与所有的金属离子形成络合物;
稳定,形成有多个五元环的螯合物;
络合比简单, 一般为1:1;
络合反应速度快,水溶性好;
EDTA与无色的金属离子形成无色的络合物,与有色的 金属离子形成颜色更深的络合物。
有色 EDTA 螯合物
H3N
NH3
lgK1Ɵ~K4Ɵ: 4.1、3.5、2.9、2.1,lgK总Ɵ= 12.6;形 成分级络合物,简单、不稳定;用作掩蔽剂、
显色剂、指示剂。
氰(CN-)量法、汞(Hg2+)量法有实际意义。 4
2.有机络合剂 (螯合物)
乙二胺 - Cu2+
三乙撑四胺 - Cu2+
H 2C H 2C
H2
H2
●
cr,e(ML2)
● ●
cr,e
(M
)c2 r,e
(L)
βnKfθ,1•Kfθ,2••Kfθn ,
cre,(M n)L cre,(M cn re,()L)
注:各级累积稳定常数将各级 cr,e(MLi)和 cr,e(M )及
cr,e(L)联系起来
13
EDTA的有关常数
离解 常数
pKƟa,1 0.9
6
水溶液酸度高时,两个羧基再接受H+,形成
HED6YT2+A在溶液中有六级解离平衡:
• H6Y2+ ≒ H+ + H5Y+ Ka1Ɵ = 10-0.9 • H5Y+ ≒ H+ + H4Y Ka2Ɵ = 10-1.6 • H4Y ≒ H+ + H3Y- Ka3Ɵ = 10-2.0 • H3Y- ≒ H+ + H2Y2- Ka4Ɵ = 10-2.67 • H2Y2- ≒ H+ + HY3- Ka5Ɵ = 10-6.16 • HY3- ≒ H+ + Y4- Ka6Ɵ = 10-10.26
螯合物
颜色
螯合物
CoY
紫红
Fe(OH)Y2-
CrY-
深紫
FeY-
Cr(OH)Y2- 蓝(pH>10) MnY2-
Cuห้องสมุดไป่ตู้2-
蓝
NiY2-
颜色
褐(pH=6)
黄
紫红
蓝绿
10
5.2 配位平衡
5.2.1 配合物的稳定常数(K, )
M + Y ≒ MY
MY≒M+Y
KfƟ(MY)=
cr,e (MY) cr,e (M)cr,e (Y)
螯合物
多核络合物
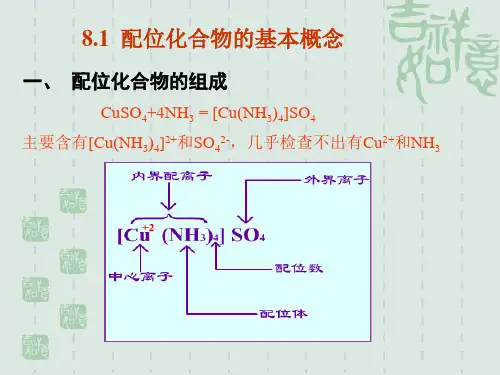
Cu(N3H )24
O
C H 2C O C H 2
H 2C N OC
CH2
O
Ca N
CH2
O
OC
C CH2 O
O
OH
[(H2O)4Fe
Fe(H2O)4]4+
OH
3
1.无机络合剂
NH3, Cl-, CN-, F-, OH- 单齿配体
Cu2+-NH3 络合物
中心离子
H3N
NH3
Cu
2+ 2+
lgβ6
常数 10.26 16.58 19.33 21.40 23.0 23.9
14
5.3 影响配位平衡的主要因素
M+ Y
OH-
L
H+
N
=
MY(主反应)
H+
OH-
M(OH)
● ● ●
ML
● ● ●
HY NY
● ● ●
M(OH)n MLn H6Y
MHY M(OH)Y 副 反 应
M
Y
(MY)
反应的平衡常数
K离解Ɵ=
cr,e (M)cr,e (Y) cr,e (MY)
P101,表5-1
➢ 讨论:
KMY↑大,配合物稳定性↑高,配合反应完全 11
络合物的逐级稳定常数 Kf,iƟ
M + L = ML 一级稳定 Kθ 常cr数 e,(ML) f,1 cre,(M cre,)(L)
ML +
L=
ML2
二级稳K定 θ 常 cre,(数 M 2)L f,2 cre,(McrL e,(L )
H2 H2
-OOCH2C
CH2COOH
乙二胺四乙酸 (H4Y)
Ethylene Diamine Tetra Acetic acid
乙二胺四乙酸二钠盐 (Na2H2Y•2H2O)
型体
溶解度 (22 ºC)
H4Y
0.2 g / L, 0.0007 mol /L
Na2H2Y •2H2O
112 g / L, 0.3 mol /L
N
N
CH2
Cu
CH2
N
N
H2
H2
lgK1Ɵ=10.6, lgK2Ɵ=9.0
lgK总Ɵ=19.6
H 2C H 2C
H2
H2
N
N
Cu
NH
NH
CH2 CH2
H 2C
CH2
lgKƟ=20.6
形成低络合比的螯合物,复杂而稳定;
滴定剂、掩蔽剂
5
3.EDTA
HOOCH2C
CH2COO-
:: ::
··
· ·
NH+ C C NH+
●
●
●
●
●
●
MLn-1
+
L
=
MLn
n级稳定 Kθ 常c数 re,(M n)L fn , cre,(M n1L )cre,(L
Kf,iƟ 表示相邻络合物之间的关系
12
累积稳定常数
β1
Kθ f,1
cre, (ML) cre, (Mc)re, (L)
β2K fθ,1 •K fθ,2cre c ,(re,M (c M re,()L • L cr)ec ,(r )e,M (M cr2 e,)(L L L ))
配位滴定法优秀课件
1
5.1 概述
➢配位滴定法: 又称络合滴定法
以生成配位化合物为基础的滴定分析方法
用于络合滴定的络合反应具备条件
(1)络合物(complex)的稳定常数足够大; (2)配位比(coordination)固定; (3)反应速度快; (4)有适当的方法指示终点。
2
分析化学中的络合物
简单配体络合物
反应的条件(表观)平衡常数
0.4
H 1 2Y2-pK2aH5 .63= 7Y6-.16H 6Y .136-
pKa6=101.02.626 Y4-
0.2
H4Y
0.0
0 2 4 6 8 10 12 14
EDTA 各种型体分布图
pH
8
4.EDTA的螯合物 Ca-EDTA螯合物的立体构型
O
H 2C
C O
C H 2C O
N
Ca O
O