TSC1转基因敲除小鼠动物模型的构建及敲除效果的初步研究
- 格式:pdf
- 大小:462.91 KB
- 文档页数:6

positivedrug(venlafaxinehydrochloride13 5mg·kg-1+diazepam0 9mg·kg-1),high(10 8g·kg-1),medium(5 4g·kg-1)andlow(2 7g·kg-1)doseofcompoundChaijinJieyutabletsgroup.Exceptcontrol,chronicunpredictablemildstresswithchronicsleepdeprivationwasusedtobuildthemodelofdepressiveinsomniarats.Thebehavioralchangesofratsweredetectedbyopenfieldtest,sucroseprefer encetestandrightingreflextest.ThecontentsofGluandGABAinhippocampusandhypothalamusofratsweredetectedbyELISA.TheproteinexpressionlevelsofGAD67,GABAARandGABABRinhippocampusandhypothalamusofratsweredetectedbyWesternblot.TheGAD67,GABAARandGABABRmRNAex pressioninhippocampusandhypothalamusofratsweredetectedbyqRT PCR.Results Comparedwithmodelgroup,thenumberofactivitiesandsucrosewaterpreferencewereimprovedbycompoundChaijinJieyutab lets;theincubationperiodoffallenasleepwasshort ened,andthesleepdurationwasextended,andtheincreaseofsleepratewascausedbysubthresholddoseofpentobarbitalsodium.Furthermore,GluandGABAcontentincreasedincompoundChaijinJieyutabletsgroupscomparedwithmodelgroup;therelativeex pressionlevelsofGAD67,GABAAR,GABABRproteinandgenedecreased.Conclusions CompoundChaijinJieyutabletscoulddevelopanti depressiveinsomniaeffect,anditsmechanismmayberelatedtothein creaseofGABAreceptorexpressioninhippocampusandhypothalamus.Keywords:compoundChaijinJieyutablets;depres siveinsomnia;hippocampus;hypothalamus;GABAAR;GABABR网络出版时间:2021-4-239:31:00 网络出版地址:https://kns.cnki.net/kcms/detail/34.1086.R.20210422.1413.048.html◇实验方法学◇TDO2基因敲除小鼠模型的建立和初步表型研究李素素,常 艳,魏 伟(安徽医科大学临床药理研究所,抗炎免疫药物教育部重点实验室,抗炎免疫药物安徽省协同创新中心,安徽合肥 230032)doi:10.3969/j.issn.1001-1978.2021.05.024文献标志码:A文章编号:1001-1978(2021)05-0730-05中国图书分类号:R 332;R322 47;R341 7;R345 47;R394 2;R977 3;R977 4摘要:目的 构建TDO2基因敲除的C57BL/6小鼠,初步研究其表型。

基因敲除小鼠的制作方法基因敲除小鼠是一种常用的遗传工具,在科学研究中被广泛应用于功能基因组学和疾病模型研究。
基因敲除是指通过特定技术手段,将小鼠体内的目标基因完全沉默或失活,从而研究该基因在发育、生理以及疾病机制中的功能。
本文将介绍基因敲除小鼠的制作方法,包括设计目标基因的敲除载体、胚胎干细胞的筛选和注射、外显子敲除策略的选择等。
1.设计目标基因的敲除载体敲除载体是嵌入目标基因的重要工具。
它通常包含正向与反向的同源臂(homology arms)以及选择标记(如抗生素抗性基因)。
同源臂的长度通常在2-5 kb之间,确保在同源重组时准确而有效地替代目标基因。
此外,敲除载体中还应该包含可诱导甲基化的Cre-loxP重组体系或者FLP-FRT重组体系,以用于后续的基因定向敲除或基因重新组装。
2.筛选胚胎干细胞胚胎干细胞是从内胚层发育而来的多潜能细胞,可以分化为整个鼠体的各种组织和器官。
敲除载体首先需要通过电转或霰粒枪等手段转染到胚胎干细胞系中。
转染后,胚胎干细胞需要进行抗生素筛选,以过滤未转染的细胞。
为了确保目标基因的敲除率,可以使用增强绿色荧光蛋白(eGFP)等标记基因,通过荧光显微镜观察转染细胞的表达情况。
3.敲除载体注射到小鼠受精卵中一旦确认胚胎干细胞中存在敲除载体,接下来就是将胚胎干细胞植入小鼠受精卵。
这个步骤一般由经验丰富的研究人员或者专业公司进行。
首先,选择合适的受精卵(通常为C57BL/6J小鼠品系),然后利用显微操作技术,将敲除载体注射到受精卵的核酸注入腔。
注射后,将受精卵转入对应营养液中培养一定时间,以期达到最佳着床率。
4.敲除鼠胚移植到配子体内经过培养后,将敲除的胚胎植入雌性激素准备好的代孕小鼠(通常为白色的株系,如ICR)。
移植后,将代孕小鼠继续养育,直至分娩。
5.验证敲除小鼠的敲除效果通过提取敲除小鼠的DNA,可以利用PCR、Southern blot和DNA测序等技术验证敲除效果。
![Tecrl敲除小鼠模型的构建方法及其应用[发明专利]](https://uimg.taocdn.com/d07774a782d049649b6648d7c1c708a1284a0ad9.webp)
专利名称:Tecrl敲除小鼠模型的构建方法及其应用
专利类型:发明专利
发明人:侯翠兰,肖婷婷,谢利剑,林舒嘉,郑钧敏,陈顺,邱庆竹申请号:CN202210041961.1
申请日:20220114
公开号:CN114480508A
公开日:
20220513
专利内容由知识产权出版社提供
摘要:本发明提供一种Tecrl敲除小鼠模型的构建方法及其应用,所述Tecrl敲除小鼠模型的构建方法为:A、根据基因敲除的靶点,设计针对Tecrl基因的sgRNA;B、将Cas9mRNA及sgRNA同时注射入实验小鼠的受精卵中,得到Tecrl基因成功敲除的F0代小鼠。
本发明首次构建了一种Tecrl敲除小鼠模型,并发现该先天的小鼠基因缺陷导致小鼠在早期的时候就会出现心脏收缩和舒张功能的受损,为研究左心功能提供了模型。
且该Tecrl敲除小鼠在肾上腺素和咖啡因的诱导下出现了多形性及双向性室速,模拟了临床上CPVT患者在运动或压力状态下出现的临床表现,为儿茶酚胺敏感性室速的病理生理机制研究提供有力的工具。
申请人:上海市儿童医院
地址:200062 上海市普陀区泸定路355号
国籍:CN
更多信息请下载全文后查看。

38基于CRISPR/Cas9技术的TRPS1基因敲除小鼠模型的构建李腾雁,刘文杰,赵宏,蔡建强*(国家癌症中心/ 国家肿瘤临床医学研究中心/ 中国医学科学院北京协和医学院肿瘤医院肝胆外科,北京 100021)李腾雁 博士研究生中国医学科学院北京协和医学院肿瘤医院肝胆外科目的:基于CRISPR/Cas9技术构建敲除TRPS1基因的杂合子小鼠,并进行鉴定。
方法: C57BL/6N小鼠自行交配后,使用Cas9/sgRNA注射受精卵的方法构建基因敲除小鼠,对可遗传的小鼠基因型进行鼠尾检测,TRPS1杂合子敲除小鼠分别与野生型小鼠交配,获得具有稳定基因型的小鼠。
结果:本实验通过使用Cas9/sgRNA注射受精卵的方法,所有繁殖小鼠经鼠尾基因型鉴定,证实成功构建了18只TRPS1基因敲除的杂合子小鼠。
结论:基于CRISPR/Cas9技术成功构建了敲除TRPS1基因的杂合子小鼠。
关键词:CRISPR/Cas9;TRPS1;结直肠癌;基因敲除小鼠摘要基金支持:国家自然科学基金(81672461) ;国家自然科学基金(81972311) ;深圳市“医疗卫生三名工程”(SZSM202011010)首都卫生发展科研专项项目(2018-1-4021);中国医学科学院医学与健康科技创新工程(2016-I2M-1-001,2017-12M-4-002) *通信作者:蔡建强************************Generation of TRPS1 knockout mice by CRISPR/Cas9-mediated gene targetingAbstractObjectives: This study aimed to construct and identify heterozygous mice knocked out of TRPS1 gene based on CRISPR/ Cas9 technology.Methods: After self-mating of C57BL/6N mice, TRPS1 knockout mice were constructed by injecting fertilized eggs with Cas9/sgRNA, and the mouse genotypes of heritable mice were detected by tail. TRPS1 heterozygous knockout mice were mated with wild-type mice to obtain mice with stable genotypes.Results: In this experiment, the fertilized eggs were injected with cas9 / sgRNA, all breeding mice were identified by tail genotype, 18 TRPS1 knockout heterozygous mice were successfully constructed.Conclusion: In this study, we successfully constructed TRPS1 knockout heterozygous mice based on CRISPR / cas9 technology, which provided a research platform for further research on the role of TRPS1 in the occurrence, development and possible liver metastasis of colorectal cancer at the animal level.Keywords: CRISPR/Cas9; TRPS1; Colorectal cancer; Gene knockout mouseLi Tengyan, Liu Wenjie, Zhao Hong, Cai Jianqiang*(National Department of Hepatobiliary Surgery, National Cancer Center/National Clinical Research Center for Cancer/ Cancer Hospital, Chinese Academy of Medical Sciences and Peking Union Medical College, Beijing 100021, China)我国结直肠癌(colorectal cancer,CRC)的发病率和死亡率均保持上升趋势。

转基因、基因敲入/敲除动物技术已经成为现代生命科学基础研究和药物研发领域不可或缺的重要技术,该技术从上世纪七八十年代诞生以来,已有近四十年的历史,经典技术如DNA原核显微注射、胚胎干细胞显微注射技术一直以来经久不衰,并逐渐从基础研究实验室转向商业模式,成为一项高度标准化的新兴产业一、技术介绍与研究进展转基因、基因敲入/敲除动物技术已经成为现代生命科学基础研究和药物研发领域不可或缺的重要技术,该技术从上世纪七八十年代诞生以来,至今已有近四十年的历史,经典技术如DNA原核显微注射、胚胎干细胞显微注射技术一直以来经久不衰,在小鼠模型构建方面日趋完善,并且如同剪切酶和抗体等常规分子生物学试剂的制备技术一样,逐渐从基础研究实验室转向商业模式,成为一项高度标准化的新兴产业,催生了数以百计的创新药物和数以千计的优秀文章。
尽管如此,传统技术仍然存在一些难以克服的缺陷,如步骤繁琐、周期漫长、成功率低、费用高昂等,而ZFN和TALEN等新技术的出现,或有可能将这一局面彻底改变。
二、同源重组技术原理基因敲除鼠技术是上世纪80年代中后期基于DNA同源重组的原理发展起来的,Capecchi和Smithies在1987年根据同源重组(homologous recombination)的原理,首次实现了ES的外源基因的定点整合(targeted integration),这一技术称为"基因打靶"(gene targeting)或"基因敲除"(gene knockout),利用这种ES的显微注射就可以制作出基因敲出小鼠(KO Mice: knockout mice);由于这一工作,Capecchi和Smithies 于2007年与Evans分享了诺贝尔医学奖。
同源重组(homologous recombination)定义:是指发生在姐妹染色单体(sister chromatin) 之间或同一染色体上含有同源序列的DNA分子之间或分子之内的重新组合。

基因敲除小鼠研究方案基因敲除小鼠研究方案一、研究目标:通过基因敲除小鼠研究,探究目标基因在小鼠发育、生长、免疫系统等方面的功能和调控机制。
二、实验设计:1. 基因敲除小鼠模型的构建:选择合适的基因敲除技术,如CRISPR/Cas9系统,通过设计合适的sgRNA(single guide RNA)序列,引导Cas9核酸酶定点切割目标基因的DNA序列。
进而引发DNA修复机制,导致目标基因的插入、缺失或突变。
将CRISPR/Cas9系统构建为可表达载体,转染入小鼠胚胎干细胞中,克隆筛选敲除成功的细胞系。
2. 小鼠胚胎干细胞培养及注射:将敲除成功的小鼠胚胎干细胞注射到早期胚胎中,制备敲除小鼠模型。
养育敲除成功的小鼠。
3. 小鼠品系和样本采集:选择合适的小鼠品系,如C57BL/6小鼠品系。
在小鼠发育、生长、免疫等关键时期,如出生后不同天数、特定时间点等,采集合适的器官或细胞样本。
4. 小鼠表型分析:对敲除小鼠与野生型小鼠进行比较,通过外观、体重、行为、生理指标等方面的观察和实验测定,分析目标基因在小鼠生长发育等方面的影响。
5. 组织学和免疫组化分析:采集目标器官样本,进行组织学和免疫组化实验。
通过病理学检测、免疫组织化学染色等方法,观察目标基因在组织结构和免疫功能调控方面的作用机制。
6. 分子生物学实验分析:采集样本进行基因表达、蛋白质表达水平和分子机制等方面的实验分析,如实时定量PCR、Western blot等方法,研究目标基因对其他基因和信号通路的影响。
7. 数据分析:对实验获得的生物学数据进行统计学和生物信息学分析,建立基因敲除小鼠模型的相关数据库,以及通过差异分析、基因功能注释等方法,进一步探究目标基因的功能和相关调控网络。
三、预期结果:通过上述研究方案,可以获得目标基因敲除小鼠模型,并通过多个方面的分析来研究该基因对小鼠生长发育、组织结构、免疫系统等方面的功能和调控机制。
预期结果包括但不限于:敲除小鼠的表型差异和诱导的特异性疾病模型;目标基因调控的重要信号通路;基因与其他相关基因间的调控网络等。


广东医学 2019 年 9 月第40 卷第 18 期 Guangdong Medical Journal Sep. 2019, Vol. 40, No. 18・2563・基石出硏究条件性骨细胞Tscl 基因敲除小鼠的初步研究:胡乐,刘文张武镐张月南方医科大学基础医学院(广东广州510515)【摘要】目的 构建骨细胞九cZ 基因条件性敲除小鼠,并进行表型鉴定,为进一步研究TSC1在骨细胞 中飽作用奠定基础。
方法 利用Tscl"和DMP\-Cre *转基因小鼠进行饲养和杂交;对繁殖产生的第1代小鼠进行基因型鉴定,获得Tscl 问-DMPl-Cre * ,待其成年后,同Tsc 严皿小鼠合笼,得到第2代小鼠,通过 PCR 鉴定出基因型为Tscl" DMP1 - Cre * ;此为本实验所需要构建模型小鼠。
应用H-E 染色、光学显微镜观察10周龄小鼠骨细胞的改变。
结果2种转基因小鼠繁殖产生的第2代小鼠基因型符合孟德尔遗传定律,交配后获得Tsc 严皿DMP1 - Cre *小鼠。
TscZ 基因通过Cre/loxP 系统被成功敲除。
结论 该方法成功构建可以在骨细胞条件性敲除九“基因的小鼠,并进行敲除后鉴定。
*国家自然科学基金青年科学基金资助(编号:31600964)△通信作者。
张武镐,E-mail : smuzhangwj @ qq. com ;刘文,E- mail : 1402241007 @ qq . com【关键词】TSC1; Cre/loxP 系统;条件性敲除;骨细胞【中图分类号】R394.3;Q812【文献标志码】ADOI : 10.13820/j. cnki. gdyx. 20186808A preliminary study of conditional osteocyte Tscl knockout mice. HU Le , LIU Wen , ZHANG Wu - ju, ZHANGYue. School of Basic Medical Sciences , Southern Medical University , Guangzhou 510515 , Guangdong , ChinaCorresponding author : ZHANG Wu -ju, E - mail : smu^iangivj@ qq. com ; LIU Wen, E - mail : 1402241007@ qq. com[Abstract ] Objective To generate and phenotypic identify osteocyte Tscl conditional knockout mice, and to lay afoundation for further study on the role of TSC1 in osteocyte. Methods心小"°〃处 and DMP1 - Cre * transgenic micewere bred and hybridized. The genotypic identification of the first generation offspring was performed , and Tscl^ox/ ~ DMP1 -Cre + mice were acquired. After crossing with Tscl fl ,>x/^ox mice, mice with Tscl^7^ DMP1 一 Cre + were identified using PCR. The morphologic changes in osteocyte of Tscl Jlox/flox DM P l - Cre + mice and wild type ( WT) mice aged 10 weekswere observed using H-E staining and optical microscope. Results The genotype of the second generation offspring re produced by two kinds of transgenic mice was in accordance with Mendel's law of inheritance , and Tscl^^ DMP1 一 Cre + mice were generated. Tscl gene was successfully knocked out by using Cre/loxp recombination system. ConclusionHomozygous mice with osteocyte Tscl gene conditional knockout are successfully generated , which serve as ideal model for functional study of TSC1.[Key words ] TSC1 ; Cre/loxP recombination system ; conditional knockout ; osteocyte哺乳动物雷帕霉素靶蛋白(the mechanistic tar get of rapamycin , mTOR )是一种至少由2个明显的 多蛋白复合体组成的高度保守的丝氨酸-苏氨酸类激酶,是调节细胞生长、代谢、增殖、凋亡的重要因素⑴。

基因敲除小鼠pc鉴一、技术介绍与研究进展敲除动物技术已经/ 基因、基因敲入转该技术从上世成为现代生命科学基础研究和药物研发领域不可或缺的重要技术,原核显史,经典技术如DNA纪七八十年代诞生以来,至今已有近四十年的历在小鼠模型构建方面日趋微注射、胚胎干细胞显微注射技术一直以来经久不衰,制备技术一样,逐渐从完善,并且如同剪切酶和抗体等常规分子生物学试剂的催生了数以百基础研究实验室转向商业模式,成为一项高度标准化的新兴产业,然存在一些难以计的创新药物和数以千计的优秀文章。
尽管如此,传统技术仍TALEN和费用高昂等,而ZFN克服的缺陷,如步骤繁琐、周期漫长、成功率低、等新技术的出现,或有可能将这一局面彻底改变。
二、同源重组技术原理同源重组的原理发展起来的,年代中后期基于DNA基因敲除鼠技术是上世纪80)homologous recombination1987年根据同源重组(在Capecchi和Smithies),这的外源基因的定点整合(EStargeted integration的原理,首次实现了),gene knockout(基因敲除)或gene targeting(基因打靶一技术称为利用这种ES的显微注射就可以制作出基因敲出小鼠(KO Mice: knockout mice);由于这一工作,Capecchi和Smithies于2007年与Evans分享了诺贝尔医学奖。
同源重组(homologous recombination)定义:是指发生在姐妹染色单体(sister chromatin) 之间或同一染色体上含有同源序列的DNA分子之间或分子之内的重新组合。
在基因敲除小鼠制作过程中,需要针对目的基因两端特异性片段设计带有相同片段的重组载体,将重组载体导入到胚胎干细胞后外源的重组载体与胚胎干细胞中相同的片段会发生同源重组,如图1所示:1.基因敲除鼠制作同源重组原理示意图图制作流程三、.基因敲除鼠制作过程示意图图2. 载体设计与构建1. Knockout根据研究项目具体情况和要求把目的基因和与细胞内靶基因特异片段同源的的载体上,成为重基因等TK )基因,如片段都重组到带有标记基因DNA (neoKnockout组的载体。
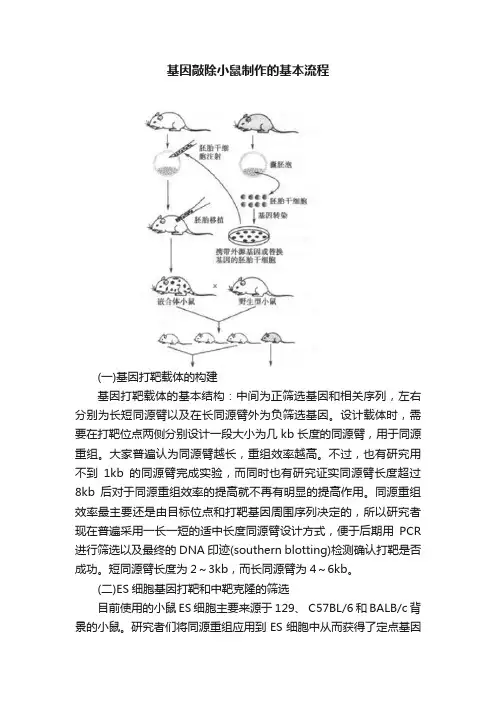
基因敲除小鼠制作的基本流程(一)基因打靶载体的构建基因打靶载体的基本结构:中间为正筛选基因和相关序列,左右分别为长短同源臂以及在长同源臂外为负筛选基因。
设计载体时,需要在打靶位点两侧分别设计一段大小为几kb长度的同源臂,用于同源重组。
大家普遍认为同源臂越长,重组效率越高。
不过,也有研究用不到1kb的同源臂完成实验,而同时也有研究证实同源臂长度超过8kb后对于同源重组效率的提高就不再有明显的提高作用。
同源重组效率最主要还是由目标位点和打靶基因周围序列决定的,所以研究者现在普遍采用一长一短的适中长度同源臂设计方式,便于后期用PCR 进行筛选以及最终的DNA印迹(southern blotting)检测确认打靶是否成功。
短同源臂长度为2~3kb,而长同源臂为4~6kb。
(二)ES细胞基因打靶和中靶克隆的筛选目前使用的小鼠ES细胞主要来源于129、 C57BL/6和BALB/c背景的小鼠。
研究者们将同源重组应用到ES细胞中从而获得了定点基因修饰的目的,通过将DNA片段导入细胞中,利用片段上的宿主细胞同源臂进行同源重组,将目的基因置换插入细胞基因组中整合表达。
在ES细胞中进行同源重组需要将打靶载体进行线性化后,通过诸如电转染(electroporation)、核转染等手段导入细胞中,研究已经证明线性化载体更有利于同源重组的发生。
目前,基因打靶事件的确定通常是首先用PCR反应筛选中靶的ES 细胞克隆。
PCR引物的设计原则是一个引物位于同源臂外,另一个引物位于载体内。
用PCR扩增同源臂短臂,成功的基因打靶克隆会有扩增产物出现。
阳性克隆还需要Southem blotting分析进一步验证。
确定正确后,用于下一步的ES细胞显微注射,一体以产生嵌合体小鼠。
(三)ES细胞克隆的胚胎显微注射和胚眙移植筛选得到的中靶细胞通过显微注射的方式注入到囊胚期胚胎的囊胚腔中,然后将囊胚移植到如假孕母鼠体内,从而产生子代嵌合小鼠。
(四)基因敲除小鼠培育嵌合小鼠需与野生型小鼠交配,以实现基因修饰生殖系传递。

敲除TSP-1对小鼠急性肝损伤保护作用的机制吴敏;冯伟珂;占一姗;王剑巧;曾金娣;李科浩;张守华;陶强;占敏【期刊名称】《广东医学》【年(卷),期】2024(45)2【摘要】目的研究敲除血小板反应蛋白1(thrombospondin 1,TSP-1)在四氯化碳(CCl_(4))所致小鼠急性肝损伤中的保护作用。
方法选取C57BL/6J小鼠16只,TSP-1基因敲除小鼠8只:C57BL/6J小鼠分为WT组和WT+CCl_(4)组,TSP-1基因敲除小鼠为TSP-1^(-/-)+CCl_(4)组;WT+CCl_(4)和TSP-1^(-/-)+CCl_(4)组给予0.5 mL CCl_(4)+9.5 mL/kg橄榄油进行腹腔注射建立急性肝损伤模型,WT组注射橄榄油10 mL/kg作为对照。
通过HE染色以及血清中丙氨酸氨基转移酶(ALT)、天冬氨酸氨基转移酶(AST)、白细胞介素-6(IL-6)和肿瘤坏死因子-α(TNF-α)观察各组小鼠肝脏损伤情况及炎症反应程度;同时检测肝组织丙二醛(MDA)和谷胱甘肽(GSH)的含量并通过免疫组化和TUNEL检测凋亡的变化。
结果敲除TSP-1对CCl4诱导的急性肝损伤具有明显的改善作用,表现为血清AST、ALT、IL-6和TNF-α的降低和肝细胞坏死的减少,以及降低MDA含量和升高GSH含量,减少肝组织中凋亡及caspase-3的表达。
结论敲除TSP-1对CCl_(4)诱导的小鼠急性肝损伤具有明显的保护作用,其机制可能与抑制炎症、氧化应激和细胞凋亡相关。
【总页数】7页(P152-158)【作者】吴敏;冯伟珂;占一姗;王剑巧;曾金娣;李科浩;张守华;陶强;占敏【作者单位】江西省儿童医院普外科;九江学院附属医院;井冈山大学附属医院【正文语种】中文【中图分类】R575;R363【相关文献】1.油橄榄叶醇提取物对D-半乳糖胺/脂多糖致小鼠急性肝损伤的保护作用及其作用机制2.赶黄草活性成分槲皮素和没食子酸对CCl4所致小鼠急性肝损伤的保护作用及机制3.护肝布祖热颗粒对酒精诱导小鼠急性肝损伤的保护作用和作用机制4.胆酸对急性酒精肝损伤小鼠的保护作用及机制研究5.SRT1720对对乙酰氨基酚诱导小鼠急性肝损伤的保护作用及其机制因版权原因,仅展示原文概要,查看原文内容请购买。
TSC1转基因敲除小鼠动物模型的构建及敲除效果的初步研究王红;蒋莉;王岩;许振凯;王威平;方航;孙鹏;白晓春【摘要】目的为探讨mTOR信号通路在骨骼发育过程中的机制作用,建立骨骼发育相关的TSC1转基因小鼠,提供稳定的动物模型.方法取8周龄健康清洁级TSC1flox/flox小鼠分别与肢芽干细胞特异性重组酶(Prx-1-Cre)小鼠、软骨细胞特异性重组酶(Col2al-Cre)小鼠及成骨细胞特异性重组酶(Osx-Cre)小鼠进行杂交.将繁殖出的小鼠继续与TSC1flox/flox小鼠回交,并对其子代小鼠的基因型进行鉴定及mTOR活性检测.结果杂交后分别获得肢芽干细胞特异性TSC1敲除小鼠、软骨细胞特异性TSC1敲除小鼠和成骨细胞特异性TSC1敲除小鼠各8只.与正常组比较,上述3种转基因小鼠p-S6均比正常组升高(P<0.05).结论本实验成功应用Cre/loxP系统构建肢芽干细胞特异性TSC1敲除小鼠、软骨细胞特异性TSC1敲除小鼠、成骨细胞特异性TSC1敲除小鼠,均提示mTOR活性增高,有明显TSC1敲除效果,为mTOR信号通路研究骨与软骨发育的机制作用提供实验基础.【期刊名称】《中国实验诊断学》【年(卷),期】2019(023)007【总页数】6页(P1239-1244)【关键词】基因敲除小鼠;骨发育;TSC1;mTOR信号通路【作者】王红;蒋莉;王岩;许振凯;王威平;方航;孙鹏;白晓春【作者单位】南方医科大学附属第三医院,广东广州 510630;广东省骨科研究院,广东广州 510630;广东省骨科医院,广东广州 510630;吉林大学第一医院急诊科,吉林长春 130021;吉林大学中日联谊医院科学研究中心,吉林长春 130033;南方医科大学,广东广州 510515;南方医科大学,广东广州 510515;南方医科大学附属第三医院,广东广州 510630;广东省骨科研究院,广东广州 510630;广东省骨科医院,广东广州 510630;中山大学肿瘤防治中心麻醉科,广东广州 510060;华南肿瘤学国家重点实验室广东广州 510060;肿瘤医学省部共建协同创新中心,广东广州 510060;南方医科大学附属第三医院,广东广州 510630;广东省骨科研究院,广东广州510630;广东省骨科医院,广东广州 510630;南方医科大学,广东广州 510515【正文语种】中文【中图分类】Q786结节性硬化复合物1(Tuberous sclerosis complex1,TSC1),是人类的一种抑癌基因,与哺乳动物雷帕霉素靶蛋白(The mammalian target of rapamycin,mTOR)有着密切的联系。
第11章1、转基因鼠的构建过程PPT-显微注射法:(1)用显微注射法将纯化的外源基因片段导入受精卵的雄原核内;(2)将微注射后经鉴定为存活的受精卵移植到同步交配的假孕母鼠的输卵管内,其中一部分移植卵能够继续生长发育成个体;(3)鉴定子代鼠中外源基因的整合和表达;(4)转基因动物品系的建立。
补充-逆转录病毒法:将插入有外源基因的逆转录病毒载体DNA,通过辅助细胞包装成高感染低毒的病毒颗粒,再感染上升期的胚胎细胞,随后将胚胎导入子宫,可发育成携带外源基因的子代动物。
补充-胚胎干细胞法:(1)分离培养ES细胞先要获取发育至一定时期的胚胎,经培养后,剥离和分散内细胞团,再行培养,最后分离,扩大培养并鉴定ES细胞;(2)在ES细胞上的基因操作通过基因打靶技术,将外源基因导入ES细胞,体外培养和筛选外源基因表达者;(3)获取囊胚细胞,作为ES细胞的移植受体;(4)通过显微操作将ES细胞注入到囊胚期胚胎的腔内,与其细胞团紧靠在一起,成为嵌合体;(5)将注射过的胚胎,经培养后筛选无发育缺损的囊胚,移植到交配第三天的假孕受体鼠子宫内,培育出转基因动物。
2、小鼠的基因敲除(gene knockout)流程基因敲除是采用同源重组的方法,用体外合成的无效基因或突变基因取代相应正常基因,再应用转基因方法孵育出转基因动物。
简:将灭活的基因导入ES细胞中,使这一灭活基因通过同源重组取代原有的目的基因,筛选到基因已定点灭活的细胞后,通过显微注射将细胞注入小鼠囊胚中。
细胞在小鼠囊胚中参与胚胎的发育,最终形成嵌合体小鼠。
由于嵌合体小鼠的一部分细胞来源于ES细胞,所以通过小鼠培育即可获得纯合子基因敲除小鼠。
繁:a.获取ES细胞b.基因载体的构建:把目的基因和与细胞内靶基因特异片段同源的DNA分子都重组到带有标记基因的载体上,此重组载体即为打靶载体。
c.将基因打靶载体通过一定的方式(常用电穿孔法)导入同源的胚胎干细胞(EScell)中,使外源DNA与胚胎干细胞基因组中相应部分发生同源重组,将打靶载体中的DNA序列整合到内源基因组中从而得以表达。
基因敲除小鼠的实验流程
基因敲除是一种常用的功能基因研究方法,通过使特定基因失去功能,从而研究该基因在生物体发育、生理功能、疾病机理等方面的作用。
在此,我将详细介绍基因敲除小鼠的实验流程。
1.设计敲除基因的策略:
2.构建敲除载体:
根据设计好的敲除策略,研究者需要构建敲除载体。
敲除载体一般包
括两个主要部分:敲除目标基因的DNA序列和荧光蛋白报告基因的DNA序列。
为了实现高效的基因敲除,敲除目标基因的DNA序列应当与目标细胞
染色体上的同源序列高度相似。
荧光蛋白报告基因的DNA序列可以用来监
测基因敲除的效果。
研究者可以使用聚合酶链式反应(PCR)等技术来合成
敲除载体的DNA序列。
3.DNA传递和胚胎干细胞培养:
4.敲除载体导入胚胎干细胞并筛选:
将构建好的敲除载体导入胚胎干细胞,可以使用电穿孔、转染等方法
将外源DNA转入胚胎干细胞。
导入后,筛选出带有敲除载体的胚胎干细胞。
研究者可以利用荧光蛋白报告基因来筛选出携带敲除基因的胚胎干细胞。
5.胚胎干细胞的胚胎注射和小鼠的获取:
将携带了敲除载体的胚胎干细胞通过微注射的方式注入小鼠早期胚胎
的内腔。
这些胚胎随后继续发育,最终产生带有敲除基因的小鼠。
6.培养和分析经过敲除的小鼠:
获得敲除基因的小鼠之后,研究者可以将其培养至成年,然后对其进行各种生理、行为等方面的分析。
通过与野生型小鼠进行比较,可以了解基因敲除对小鼠的影响和功能。
(10)申请公布号(43)申请公布日 (21)申请号 201510257151.X(22)申请日 2015.05.19C12N 15/85(2006.01)C12N 5/10(2006.01)A01K 67/027(2006.01)(71)申请人上海大学地址200444 上海市宝山区上大路99号(72)发明人文铁桥 郭健健 冯瑞丽 王娇(74)专利代理机构上海上大专利事务所(普通合伙) 31205代理人陆聪明(54)发明名称dcf1敲除小鼠模型的构建方法及其应用(57)摘要本发明涉及一种dcf1敲除小鼠模型的构建方法及其应用。
本发明涉及这一动物模型的嗅觉研究中的应用,通过食物埋藏小球实验,嗅觉偏好实验,气味躲避实验,检测dcf1敲除小鼠对于嗅觉的灵敏度、判断力和偏好性。
结果显示,dcf1敲除小鼠的嗅觉灵敏度和判断能力下降,嗅觉偏好性发生改变。
相比较于已有的嗅觉障碍小鼠模型需要人工损伤或者化学损伤造模,不仅费时费力,而且易造成小鼠的其它损伤,使用dcf1敲除小鼠模型省去了这些步骤,而且嗅觉障碍性状稳定,是适合研究嗅觉的小鼠模型。
(51)Int.Cl.(19)中华人民共和国国家知识产权局(12)发明专利申请权利要求书1页 说明书4页 附图3页CN 105039400 A 2015.11.11C N 105039400A1.一种dcf1敲除小鼠模型的构建方法,其特征在于该方法的具体步骤为:a.以pLNT质粒为母质粒,在两个BamH I酶切位点之间插入dcf1基因第一外显子Exon1的DNA片段,并在两BamH I与BamH I的外侧分别装上一个同向排列的1oxP位点;然后在该1oxP位点和Cla I 位点之间插入正筛选标记基因neo;在所述母质粒的Cla I和Kpn I酶切位点之间插入下游同源重组臂F3片段;在所述Kpn I酶切位点外侧插入负筛选标记基因PGK-TK;在所述母质粒的Sal I和Not I酶切位点之间插入上游同源重组臂F1片段,得到Not I线性化的pLNT-dcf1载体;所述的上游同源重组臂F1片段是通过扩增下列引物得到:引物1:5’ GCCCGCCTCTGCCTCCCGAG 3’引物2:5’ GGAGCCCCCAGCAATGGATA 3’;所述的第一外显子Exon1的DNA片段是通过扩增下列引物得到:引物3:5’ GCCTACCTTCAGGTGCTTGA 3’引物4:5’ GCAATTTCCGCAGGAGCAAG 3’;所述的下游同源重组臂F3片段是通过扩增下列引物得到:引物5:5’ CGGAAGTTTGTGCTGCAGGT 3’引物6:5’ AATATTGGGAC'TGCTCACTG 3’;b. 步骤a所得Not I线性化的pLNT-dcf1载体电转入小鼠胚胎干细胞(ES,129/Ola);挑选经G418和Ganeielivor筛选的阳性克隆,即得到含打靶成功基因的小鼠胚胎干细胞;c.在囊胚腔注射的前2—3天,复苏步骤b所得含打靶成功基因的小鼠胚胎干细胞;在消化细胞前4小时,换细胞培养液,将消化好的细胞悬浮于无LIF的细胞培养液中,置4"C 冰箱以备用;d.6-7周龄C57BL/6J(一种小鼠品系)雌鼠在暗周期前12小时腹腔注射孕马血清,每只10 U;48小时后再腹腔注射人绒毛膜促性腺激素,每只10 U;注射完毕,每只雌鼠与一只正常性成熟的雄鼠合笼过夜,第二天检查有阴栓的小鼠为囊胚供体,再过3天后,从子宫中取囊胚;e.选取步骤d所得囊胚中发育正常的囊胚,将15—20个步骤c所得含打靶成功基因的小鼠胚胎干细胞注入囊胚腔内;f.将步骤e所得囊胚植入2.5天的假孕母鼠的子宫,得到皮毛嵌合度大于50%的雄性嵌合体小鼠,与C57BL/6J纯系雌性小鼠交配,子代中灰色小鼠来源于生殖系嵌合的ES细胞,其中经鉴定为dcf1基因剔除杂合子的小鼠,记为F0代,与C57BL/6J纯系小鼠交配育种,得到dcf1杂合子小鼠,记为F1代;再将该F1代小鼠与EIIa-Cre小鼠交配得到dcf1杂合子小鼠,得到F2代;将该dcf1杂合子小鼠F2代雌鼠与公鼠之间交配,获得dcf1敲除纯合子小鼠,即得到dcf1敲除小鼠模型。