转基因小鼠技术
- 格式:ppt
- 大小:1.27 MB
- 文档页数:49

ROSA26mtmg报告小鼠引言ROSA26mtmg小鼠是一种在研究中广泛使用的实验动物模型。
该小鼠具有许多重要的实验特性,可用于研究多种生物学过程和疾病模型。
本文将介绍ROSA26mtmg小鼠的特点、应用领域以及使用该小鼠进行科学研究的步骤和技术。
ROSA26mtmg小鼠的特点ROSA26mtmg小鼠是一种转基因小鼠模型,具有以下特点:1.ROSA26基因位点: ROSA26基因位点是在小鼠基因组中的一个安全位点,可用于插入外源基因,而不会对小鼠的正常生理功能产生明显的影响。
2.mtmg基因: mtmg基因是一种标记基因,用于在小鼠体内标记转基因细胞或组织。
3.广泛应用: ROSA26mtmg小鼠可用于研究多个领域,例如免疫学、癌症研究、细胞标记等。
ROSA26mtmg小鼠的应用领域ROSA26mtmg小鼠在科学研究中有广泛的应用,以下是一些常见的应用领域:1.细胞标记: 将具有特定功能或表型的细胞标记为ROSA26mtmg小鼠的标记细胞,可用于跟踪这些细胞在不同生物学过程中的分布和功能。
2.疾病模型: 利用ROSA26mtmg小鼠可以构建多种疾病模型,用于研究癌症、遗传疾病、神经系统疾病等。
3.遗传工程: 利用ROSA26mtmg小鼠进行基因敲除、基因敲入等遗传操作,可以研究特定基因在发育、疾病进程中的作用。
使用ROSA26mtmg小鼠进行科学研究的步骤和技术使用ROSA26mtmg小鼠进行科学研究通常需要以下步骤和技术:1.转基因构建: 首先需要构建一个转基因载体,将目标基因插入ROSA26基因位点。
这一步通常通过体外DNA重组技术实现。
2.小鼠胚胎干细胞: 将转基因质粒导入小鼠胚胎干细胞中,通过筛选和培养,得到带有ROSA26mtmg基因的胚胎干细胞。
3.小鼠胚胎注射: 将带有ROSA26mtmg基因的胚胎干细胞注射到小鼠早期胚胎中,使其发育成为具有ROSA26mtmg基因的小鼠。
4.小鼠鉴定: 使用PCR等分子生物学技术,对小鼠进行基因型鉴定,确认ROSA26mtmg基因的存在。
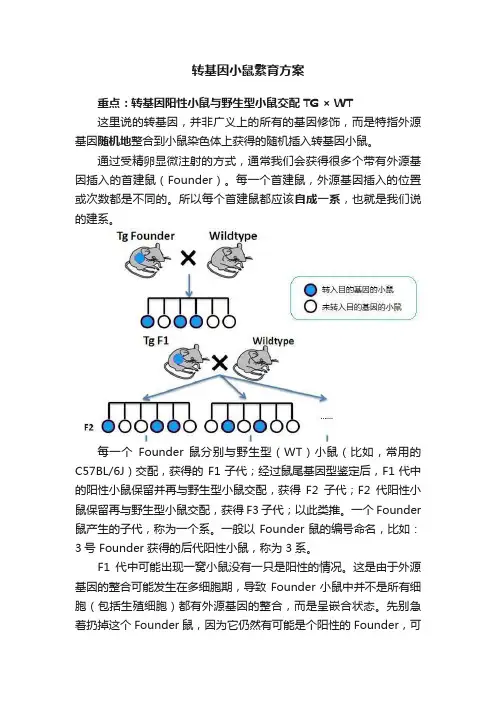
转基因小鼠繁育方案重点:转基因阳性小鼠与野生型小鼠交配TG × WT这里说的转基因,并非广义上的所有的基因修饰,而是特指外源基因随机地整合到小鼠染色体上获得的随机插入转基因小鼠。
通过受精卵显微注射的方式,通常我们会获得很多个带有外源基因插入的首建鼠(Founder)。
每一个首建鼠,外源基因插入的位置或次数都是不同的。
所以每个首建鼠都应该自成一系,也就是我们说的建系。
每一个Founder 鼠分别与野生型(WT)小鼠(比如,常用的C57BL/6J)交配,获得的F1子代;经过鼠尾基因型鉴定后,F1代中的阳性小鼠保留并再与野生型小鼠交配,获得F2子代;F2代阳性小鼠保留再与野生型小鼠交配,获得 F3子代;以此类推。
一个 Founder 鼠产生的子代,称为一个系。
一般以 Founder 鼠的编号命名,比如:3号 Founder 获得的后代阳性小鼠,称为 3系。
F1代中可能出现一窝小鼠没有一只是阳性的情况。
这是由于外源基因的整合可能发生在多细胞期,导致 Founder 小鼠中并不是所有细胞(包括生殖细胞)都有外源基因的整合,而是呈嵌合状态。
先别急着扔掉这个 Founder 鼠,因为它仍然有可能是个阳性的 Founder,可以再试着多配几窝。
除非你的 Founder 鼠多到用不完... Lucky you!还有几点需要引起注意!Founder 鼠之间不能相互交配。
通常转基因小鼠的基因型鉴定方法只能判断有无外源基因的整合(即阳性或阴性),并不能判断某特定位点的纯合或杂合。
阳性子代小鼠之间也不建议相互交配。
基因型阳性并不等于表达阳性,所以交配到F2代以上,还需要对每个系中的部分小鼠进行外源基因表达的检测,筛选到符合实验要求的转基因系。

小鼠技术的实验原理和应用1. 前言小鼠作为实验动物广泛应用于生物医学研究中,其独特的遗传特性和相对较短的生命周期使其成为模拟人类疾病和药物研发的理想模型。
本文将介绍小鼠技术的实验原理以及其在生物医学研究中的应用。
2. 小鼠技术的实验原理小鼠技术的实验原理主要包括以下几个方面:2.1 基因编辑技术基因编辑技术是通过改变小鼠基因组中特定基因的序列来研究其功能和与疾病相关的遗传变异。
常用的基因编辑技术包括:•CRISPR/Cas9系统:利用CRISPR/Cas9系统可快速、精确地编辑小鼠基因组,实现基因敲除、敲入、突变等操作。
•TALEN:类锚点酶或ZFN:针对特定的基因位点进行定点编辑,同时也可用于基因敲除和敲入等。
•RNA干扰技术:通过注射siRNA、shRNA等干扰RNA分子来抑制或沉默特定基因的表达。
2.2 基因表达和功能分析通过操纵小鼠基因表达和功能分析,可研究特定基因在生理和病理过程中的作用。
常用的技术包括:•基因过表达:通过转基因技术将外源基因导入小鼠基因组,研究其对生物学过程的影响。
•基因敲除:通过基因编辑技术敲除特定基因,研究其在小鼠中的功能损失效应。
•基因沉默:利用RNA干扰技术抑制或沉默特定基因的表达,研究其功能和作用机制。
2.3 小鼠模型的建立通过将人类疾病相关的基因突变或特定基因导入小鼠基因组,可以建立与人类疾病相关的小鼠模型。
常见的小鼠模型包括:•敲除小鼠模型:通过敲除特定基因模拟人类基因缺失的疾病。
•转基因小鼠模型:通过转基因技术将外源基因导入小鼠基因组,模拟人类遗传疾病或疾病相关基因的突变。
3. 小鼠技术的应用小鼠技术在生物医学研究中具有广泛的应用,主要包括以下几个方面:3.1 疾病研究小鼠模型可以帮助研究人类疾病的发生机制和病理生理过程。
通过造成基因突变或导入特定基因,可以模拟人类疾病,进而研究疾病的病因、发展和治疗方法。
3.2 药物研发小鼠模型不仅可以用于研究疾病的发展,还可用于评估药物疗效和安全性。

转基因小鼠和显微注射以及验证目录转基因小鼠制备实验方法 (2)Southern Blot原理及实验方法 (4)Northern Blot原理及实验方法 (6)RFLP标记 (12)1.点的多态性 (13)2.序列多态性 (14)显微注射实验操作 (14)转基因小鼠制备实验方法1、选取7~8周龄雌性小鼠,阴道口封闭,作为供体,下午3:00左右,每只小鼠腹腔注射PMSG(10 IU)。
2、 47~48小时后,每只小鼠腹腔注射HCG(0.8 IU),并与正常公鼠合笼;另取数只适龄母鼠(2月龄以上)作为受体,阴道口潮红,与结扎公鼠合笼。
3、第二天上午9:00前观察供体、受体,有精栓者拿出备用。
受体笼拿出作好隔离措施。
4、10:30左右,断颈处死供体,手术取出整个输卵管,放入透明质酸酶~0.3mg/M2液中。
显微镜下,用镊子撕开输卵管壶腹部,受精卵随同颗粒细胞即一同流出。
5、仔细观察放在透明质酸酶M2液中的受精卵,当受精卵周围的颗粒细胞脱离时,将受精卵吸出,放入M2液中洗涤,最后放在M16液中放入5% CO2,37C0培养箱培养。
6、在显微镜下观察,挑选细胞饱满,透明带清晰,雄原核清晰可见的受精卵待用。
7、安装持卵针和注射针,使其末端平行于载物台,在凹玻片的中央滴入一滴M2液,覆盖石蜡油,移入待注射的受精卵。
DNA在注射针中的气泡应在先前全部弹走。
8、在高倍镜下,将注射针轻触持卵管,使DNA缓慢流出并控制其流量;反复吹吸受精卵,使其处于最佳位置,将注射针刺入受精卵的雄原核,直至看到原核膨大即退出。
将注射过的和未注射过的受精卵上下分开放置,不致于混搅,注射完毕后,放入5% CO2,37C0培养箱培养。
9、将受体麻醉,注射计量为1%戊巴比妥钠0.01ml/g,腹腔注射。
手术取出卵巢连接输卵管,用脂肪镊固定,在显微镜下找到输卵管开口。
吸取注射后经培养成活的受精卵,吸取方法是先吸一段较长的M2,吸一个气泡,然后吸取受精卵,尽量紧密排列,再吸一段液体,吸一个气泡,再吸一段液体,共四段液体三个气泡。

人源化小鼠构建方法及应用人源化小鼠是指将人类基因或组织移植或置入小鼠中,使其具有人类的某些特性或功能。
目前,人源化小鼠主要包括两种方法:转基因小鼠和异种移植小鼠。
这些方法在医学研究中具有广泛的应用,如研究人类疾病机制、药物筛选、组织移植等方面。
转基因小鼠是通过将人类基因导入小鼠的遗传背景中,使小鼠体内表达人类基因。
这可以通过不同的方法实现,比如使用逆转录酶来制备转基因载体,然后将其导入小鼠胚胎干细胞中,使其成为转基因小鼠的一部分。
此外,还可以使用CRISPR/Cas9等基因编辑技术,直接对小鼠基因组进行编辑,以达到引入人类基因的目的。
通过转基因技术,可以研究人类基因在小鼠中的表达、功能以及相关疾病的发生机制。
例如,科学家可以通过将人类脑部相关基因导入小鼠中,研究神经发育、认知功能等方面的问题。
异种移植小鼠是将人类组织或细胞移植到小鼠体内,使其具有人类组织的特性。
这可以通过将人类的干细胞或器官移植到小鼠体内,再使其发育成熟。
例如,通过将人类胰岛细胞移植到小鼠体内,可以研究胰岛素的产生及调节机制,这对于糖尿病治疗具有重要意义。
此外,还可以将人类癌细胞移植到小鼠体内,用于研究肿瘤发生、生长机制以及药物疗效的评估。
人源化小鼠在医学研究中具有广泛的应用。
首先,在研究人类疾病机制方面,通过引入人类基因或组织,可以更好地模拟人类体内的生理和病理过程。
例如,通过转基因技术引入与阿尔茨海默病相关的人类基因,可以模拟该疾病发生的机制,从而更好地研究该病的预防和治疗。
其次,在药物筛选方面,人源化小鼠可以用于评估新药的疗效和毒副作用。
通过将人类基因或细胞引入小鼠体内,可以更准确地评估药物在人类中的药效和安全性。
此外,人源化小鼠还可以用于研究器官移植和再生医学。
通过将人类干细胞移植到小鼠体内,可以研究干细胞的分化和发育过程,从而为再生医学的研究和临床应用提供基础。
然而,人源化小鼠也存在一些问题和限制。
首先,转基因小鼠与人类的差异可能会导致研究结果的偏差。

转基因小鼠制备流程及步骤遗传的基本物质是DNA,基因是位于染色体上有遗传效应的DNA片段,对于储存在生物全套染色体中的全部遗传信息,可称其为基因组。
不同种类、不同个体的生物基因组成是不同的,对动物个体来说,非自身的基因成分属于外源基因,如果把外源基因整合或导入动物染色体基因中,这个外源基因就被称为转基因(transgene)(即转移来的基因),这种动物就是转基因动物。
下面介绍常用的受精卵原核注射法制备转基因小鼠方法。
1、选取7~8周龄雌性小鼠,阴道口封闭,作为供体,下午3:00左右,每只小鼠腹腔注射PMSG(10IU)。
2、47~48小时后,每只小鼠腹腔注射HCG(0.8 IU),并与正常雄鼠合笼;另取数只适龄雌鼠(2月龄以上)作为受体,阴道口潮红,与结扎公鼠合笼。
3、第二天上午9:00前观察供体、受体,有精栓者拿出备用。
受体笼拿出作好隔离措施。
4、10:30左右,断颈处死供体,手术取出整个输卵管,放入透明质酸酶~0.3mg/M2液中。
显微镜下,用镊子撕开输卵管壶腹部,受精卵随同颗粒细胞即一同流出。
5、仔细观察放在透明质酸酶M2液中的受精卵,当受精卵周围的颗粒细胞脱离时,将受精卵吸出,放入M2液中洗涤,最后放在M16液中放入5% CO2,37C0培养箱培养。
6、在显微镜下观察,挑选细胞饱满,透明带清晰,雄原核清晰可见的受精卵待用。
7、安装持卵针和注射针,使其末端平行于载物台,在凹玻片的中央滴入一滴M2液,覆盖石蜡油,移入待注射的受精卵。
DNA在注射针中的气泡应在先前全部弹走。
8、在高倍镜下,将注射针轻触持卵管,使DNA缓慢流出并控制其流量;反复吹吸受精卵,使其处于最佳位置,将注射针刺入受精卵的雄原核,直至看到原核膨大即退出。
将注射过的和未注射过的受精卵上下分开放置,不致于混搅,注射完毕后,放入5% CO2,37C0培养箱培养。
9、将受体麻醉,注射计量为1%戊巴比妥钠0.01ml/g,腹腔注射。
手术取出卵巢连接输卵管,用脂肪镊固定,在显微镜下找到输卵管开口。

基因工程小鼠名称解读基因工程小鼠是指通过人为干预小鼠基因组的技术手段,使其表达特定基因或缺失特定基因,从而实现对基因功能的研究和相关疾病模型的建立。
这些小鼠通常被用于研究基因功能、疾病机制、药物筛选等方面。
在基因工程小鼠的命名中,常用的方式是根据其基因改造方式或目的来命名。
以下是一些常见的基因工程小鼠名称及其解读:1. 转基因小鼠(Transgenic mice),这类小鼠是通过将外源基因导入小鼠的基因组中而得到的。
这些外源基因可以来自其他物种,如人类或其他动物。
转基因小鼠常用于研究特定基因的功能、表达模式等。
2. 敲除小鼠(Knockout mice),这类小鼠是通过人为干预使特定基因在小鼠体内失去功能的方式得到的。
一般采用基因敲除或基因靶向突变技术,使小鼠体内特定基因的表达受到抑制或完全消除。
敲除小鼠常用于研究基因的功能缺失对生理和病理过程的影响。
3. 过表达小鼠(Overexpression mice),这类小鼠是通过人为干预使特定基因在小鼠体内过度表达的方式得到的。
通过引入外源基因或增强内源基因的表达水平,使小鼠体内特定基因的表达量显著增加。
过表达小鼠常用于研究基因的过度表达对生理和病理过程的影响。
4. 突变小鼠(Mutant mice),这类小鼠是指在小鼠基因组中引入或产生突变的小鼠,突变可以是点突变、插入突变、删除突变等。
突变小鼠常用于研究特定基因突变对生理和病理过程的影响。
除了上述常见的命名方式,基因工程小鼠还可以根据具体的研究目的、基因改造技术等来命名,例如组织特异性表达小鼠、条件性基因敲除小鼠等。
需要注意的是,基因工程小鼠的命名通常是根据研究者或研究机构的需求和约定来进行的,不同研究领域和实验室可能会有不同的命名方式和规范。
总体而言,基因工程小鼠的命名旨在描述其基因改造方式、基因功能或研究目的,以便研究者能够清楚地了解其特点和应用范围。

竭诚为您提供优质文档/双击可除转基因筛选实验报告篇一:转基因小鼠鉴定实验转基因小鼠鉴定实验在刚出生产出的鼠仔中,属转基因小鼠者,约占全部仔小鼠的20%-30%。
因此,对转基因小鼠必须进行鉴定筛选。
1.转基因整合检测鉴定转基因小鼠最简单的方法是从小鼠尾尖提取基因组DnA,检测其基因型。
检测方法包括pcR和shouthern杂交。
(1)基因组DnA的提取:1)将离乳期小鼠(>4周龄)麻醉标记。
2)用一只手抓住小鼠,另一只手持消毒剪剪下约1cm 的鼠尾。
(2)pcR检测:转基因的初始筛选通常采用pcR检测技术。
该技术操作简便、快速、费用低而有效,适合大量标本的分析。
由于该技术特别敏感,可能产生假阳性结果。
因此,在操作过程中必须特别小心,避免质粒DnA或其它标本的基因组DnA的污染。
假阳性的产生对转基因小鼠的筛选工作将是致命的。
pcR实验应采用双复管,甚至三复管。
阳性结果最好用southern杂交技术进一步证实。
(3)southernblot分析:该技术虽然没有pcR技术那样敏感,且费力费时,但是避免了因污染导致假阳性结果的麻烦,可以得到目的基因整合后的基因组、整合位点数目、转基因拷贝数等的确切信息。
southernblot的实验操作参见第一章的第八节。
2.转基因表达检测转基因整合检测是确定目的基因是否整合到了小鼠的基因组中,同时可确定整合的位点和拷贝数,这在遗传学上是十分重要的。
而转基因表达检测是确定目的基因在转基因小鼠器官组织中表达的时空分布。
其检测包括RnA分析技术和蛋白质检测技术。
篇二:转基因技术综述动物转基因技术研究进展及其应用前景孙凤俊张佳谊韩广文(北京奶牛中心北京延庆102100)摘要:转基因技术作为生命科学的前沿技术之一,已经逐渐走入了人们的生活。
转基因技术可以认为是在一定程度上通过科学技术手段让其他生物、植物朝着对人类有利方向发展的技术。
本文介绍了转基因技术及其应用研究现状,并预测了未来发展前景,阐述了该技术的利弊关系,指出只有通过正确的引导和规范管理,才能很好地利用该技术,使它为人类服务。

转基因超级鼠的结论转基因技术是一种现代生物技术,通过人工干预生物基因组的方法,使得生物体的某些性状得到改变。
近年来,转基因技术被广泛应用于农业、医疗、环保等领域,其中最受关注的便是转基因食品。
然而,在科学家们的努力下,转基因技术的应用范围正在不断拓展,最新的研究成果之一就是“转基因超级鼠”。
转基因超级鼠是指经过基因改造的实验室小鼠,这些小鼠拥有超强的免疫力和抗肿瘤能力,能够对人类疾病的研究提供重要的帮助。
在这里,我们将探讨转基因超级鼠的研究成果以及其应用前景。
一、研究成果转基因超级鼠的研究始于上世纪90年代,当时科学家用基因工程技术将人类免疫系统的基因导入小鼠体内,使其免疫系统得到增强。
随着技术的不断提高,研究人员陆续开发出了多种转基因超级鼠,包括抗癌鼠、抗病毒鼠、人类免疫系统移植鼠等。
最近,一项名为“人类免疫系统移植鼠”的研究引起了广泛关注。
研究人员通过基因工程技术将人类免疫系统的基因导入小鼠体内,使其免疫系统与人类相似。
这些转基因超级鼠可以用于研究人类疾病的发病机制、疾病的治疗方法等问题。
此外,研究人员还利用转基因技术制造出了一种名为“肿瘤猎手”的超级鼠。
这种转基因超级鼠的免疫系统能够识别和攻击肿瘤细胞,从而有效抑制肿瘤的生长和扩散。
这项研究成果被认为是一种革命性的癌症治疗方法。
二、应用前景转基因超级鼠的出现,为人类疾病的研究和治疗提供了新的思路和方法。
这些转基因超级鼠可以用于研究癌症、病毒感染、自身免疫性疾病等多种人类疾病,为疾病的早期诊断和治疗提供了有力的支持。
此外,转基因超级鼠还可以用于药物研发和安全性评价,为新药的开发提供了有力的保障。
除了在医学领域的应用,转基因超级鼠还可以用于环境保护。
例如,利用转基因技术制造出的超级鼠可以用于检测环境中的有毒物质,为环境监测提供了新的方法。
然而,转基因技术的应用也面临着一些争议和挑战。
首先,转基因技术可能对生态环境造成不可逆的影响,从而引发生态风险。

转基因小鼠与基因敲出小鼠的差异
请问:转基因小鼠与基因敲出小鼠之间有什么差异呀??
最佳答案
转基因小鼠就是基因组中含有外源基因的小鼠。
它是按照预先的设计,通过细胞融合、细胞重组、遗传物质转移、染色体工程和基因工程技术将外源基因导入精子、卵细胞或受精卵,再以生殖工程技术而发育。
用以改变普通小鼠的性状.
基因敲除是基因打靶技术的一种,类似于基因的同源重组。
指外源DNA与受体细胞基因组中序列相同或相近的基因发生同源重组,从而代替受体细胞基因组中的相同/相似的基因序列,整合入受体细胞的基因组中。
此法可产生精确的基因突变,也可正确纠正机体的基因突变。
基因嵌入又称基因置换,它是利用内源基因序列两侧或外面的断裂点,用同源
序列的目的基因整个置换内源基因。
用以研究某一基因的作用.。

转基因小鼠鉴定实验
在刚出生产出的鼠仔中,属转基因小鼠者,约占全部仔小鼠的20%-30%。
因此,对转基因小鼠必须进行鉴定筛选。
1.转基因整合检测
鉴定转基因小鼠最简单的方法是从小鼠尾尖提取基因组DNA,检测其基因型。
检测方法包括PCR和Shouthern 杂交。
(1)基因组DNA的提取:
1)将离乳期小鼠(>4周龄)麻醉标记。
2)用一只手抓住小鼠,另一只手持消毒剪剪下约1cm的鼠尾。
(2) PCR检测:转基因的初始筛选通常采用PCR检测技术。
该技术操作简便、快速、费用低而有效,适合大量标本的分析。
由于该技术特别敏感,可能产生假阳性结果。
因此,在操作过程中必须特别小心,避免质粒DNA或其它标本的基因组DNA的污染。
假阳性的产生对转基因小鼠的筛选工作将是致命的。
PCR 实验应采用双复管,甚至三复管。
阳性结果最好用Southern杂交技术进一步证实。
(3) Southern blot分析:该技术虽然没有PCR技术那样敏感,且费力费时,但是避免了因污染导致假阳性结果的麻烦,可以得到目的基因整合后的基因组、整合位点数目、转基因拷贝数等的确切信息。
Southern blot的实验操作参见第一章的第八节。
2.转基因表达检测
转基因整合检测是确定目的基因是否整合到了小鼠的基因组中,同时可确定整合的位点和拷贝数,这在遗传学上是十分重要的。
而转基因表达检测是确定目的基因在转基因小鼠器官组织中表达的时空分布。
其检测包括RNA分析技术和蛋白质检测技术。
MMTV-PyMT转基因小鼠模型介绍
基因敲除小鼠是什么?是否就是我们平日所说的实验室用的小白鼠?其实小鼠有很多种,小白鼠只是其中一种,通常普通的小白鼠多被药厂用作临床试验,而基因敲除的小鼠,则用于更尖端的生物医学研究。
基因敲除小鼠技术原理:是先在小鼠的胚胎干细胞上通过基因重组的办法进行基因修饰——就是将胚胎干细胞中的靶向基因改掉,然后将“修饰”后的胚胎干细胞植入小鼠的早期胚胎,生成嵌合体小鼠。
这种嵌合体小鼠长大后,体内同时存在被“修饰”过的基因和未被“修饰”的基因。
下面是,MMTV-PyMT转基因小鼠介绍
MMTV-PyMT转基因小鼠是一种人类乳腺癌动物模型。
该小鼠使用MMTV-LTR驱动多瘤病毒中间T抗原(PyMT)在小鼠乳腺组织的表达,使小鼠出现乳腺肿瘤的表型。
可用于研究乳腺肿瘤的发生、发展及转移,及乳腺肿瘤相关药物的筛选。
转基因小鼠制备实验方法1、选取7~8周龄雌性小鼠,阴道口封闭,作为供体,下午3:00左右,每只小鼠腹腔注射PMSG(10 IU)。
2、 47~48小时后,每只小鼠腹腔注射HCG(0.8 IU),并与正常公鼠合笼;另取数只适龄母鼠(2月龄以上)作为受体,阴道口潮红,与结扎公鼠合笼。
3、第二天上午9:00前观察供体、受体,有精栓者拿出备用。
受体笼拿出作好隔离措施。
4、10:30左右,断颈处死供体,手术取出整个输卵管,放入透明质酸酶~0.3mg/M2液中。
显微镜下,用镊子撕开输卵管壶腹部,受精卵随同颗粒细胞即一同流出。
5、仔细观察放在透明质酸酶M2液中的受精卵,当受精卵周围的颗粒细胞脱离时,将受精卵吸出,放入M2液中洗涤,最后放在M16液中放入5% CO2,37C0培养箱培养。
6、在显微镜下观察,挑选细胞饱满,透明带清晰,雄原核清晰可见的受精卵待用。
7、安装持卵针和注射针,使其末端平行于载物台,在凹玻片的中央滴入一滴M2液,覆盖石蜡油,移入待注射的受精卵。
DNA在注射针中的气泡应在先前全部弹走。
8、在高倍镜下,将注射针轻触持卵管,使DNA缓慢流出并控制其流量;反复吹吸受精卵,使其处于最佳位置,将注射针刺入受精卵的雄原核,直至看到原核膨大即退出。
将注射过的和未注射过的受精卵上下分开放置,不致于混搅,注射完毕后,放入5% CO2,37C0培养箱培养。
9、将受体麻醉,注射计量为1%戊巴比妥钠0.01ml/g,腹腔注射。
手术取出卵巢连接输卵管,用脂肪镊固定,在显微镜下找到输卵管开口。
吸取注射后经培养成活的受精卵,吸取方法是先吸一段较长的M2,吸一个气泡,然后吸取受精卵,尽量紧密排列,再吸一段液体,吸一个气泡,再吸一段液体,共四段液体三个气泡。
除较长的那段液体,其余的液体大致1cm 左右,气泡0.2cm左右。
将移植管口插入输卵管口,轻轻将移植管内的液体吹入,看到输卵管壶腹部膨大并清晰地看到三个气泡,即移植成功。
LacZ小鼠模型是一种常用于研究基因表达和转录调控的实验动物模型。
它是通
过转基因技术将一种称为LacZ的报告基因插入小鼠的染色体中所创造的。
LacZ基因来自大肠杆菌(Escherichia coli),它编码一种叫做β-galactosidase的
酶。
在小鼠模型中,LacZ基因的DNA序列通常与启动子和调控元件相结合,以确保这个基因能够在特定条件下被准确地表达。
LacZ基因的特点是它能够将β-galactosidase酶表达成遗传标记物,可以通过在细胞或组织中检测到这种酶的活性来间接测量目标基因的表达水平。
β-galactosidase酶能够水解含有联卡糖(lactose)或产乳糖(lactose)苷基的底物,生成蓝色的产物。
因此,在LacZ小鼠模型中,如果目标基因的启动子与LacZ基因连接,并在特定条件下活化,则该细胞或组织中就会产生β-galactosidase酶,而表现为蓝色。
研究人员可以利用组织染色或细胞荧光显微镜等技术来观察和定量测量LacZ基因在小鼠模型中的表达情况。
这可以帮助研究人员了解目标基因在不同组织、不同发育阶段或不同环境条件下的表达模式和调控机制。
总之,LacZ小鼠模型是一种利用转基因技术将LacZ报告基因插入小鼠基因组中的实验动物模型,通过观察和测量LacZ基因的表达情况,可以间接反映目标基因在细胞和组织中的表达水平和调控机制。
小鼠cre原理小鼠cre原理是一种重要的基因编辑技术,可以用于特定类型细胞中的基因靶向突变,从而为研究人员提供了一种有力的工具来研究基因在生物体中的功能以及与疾病相关的变化。
本文将从小鼠cre原理的背景、实施方法以及应用前景等方面进行阐述。
一、背景小鼠cre原理来源于细菌λ噬菌体的遗传遗传系统,通过融合细菌λ噬菌体cre基因与特定的转基因小鼠中的目标基因,可以在特定类型细胞中实现基因靶向突变。
cre酶是一类重组酶,可以通过结合特定的DNA序列(loxP位点)来切割DNA链,从而引发DNA重组并导致基因突变。
二、实施方法小鼠cre原理的实施需要进行两个主要步骤:建立转基因小鼠和使用小鼠cre酶进行基因突变。
1. 建立转基因小鼠首先,通过克隆技术将cre基因与目标基因进行融合,形成一个新的重组DNA序列。
然后,将这个重组DNA序列导入胚胎干细胞中,通过胚胎解剖学的方法将这个重组DNA序列导入小鼠胚胎中。
最后,将转基因胚胎植入母鼠子宫中进行孕育,从而获得转基因小鼠。
2. 使用小鼠cre酶进行基因突变在获得转基因小鼠后,研究人员可以通过激活cre酶来实现基因突变。
首先,在特定类型细胞中表达cre酶,使其与目标基因的loxP位点结合。
当loxP位点两端的DNA链被切割后,就可以进行DNA重组。
研究人员可以通过不同的重组方式来实现目标基因的突变,如基因敲除、基因拼接、基因位点交换等。
三、应用前景小鼠cre原理的应用前景十分广阔。
通过这种技术,研究人员可以实现特定类型细胞中目标基因的突变,从而深入研究基因在生物体中的功能和相互作用。
此外,小鼠cre原理还可以用于模拟人类疾病的基因突变,从而研究疾病的发生机制、治疗方法以及相关药物的筛选等方面。
小鼠cre原理不仅在基础科学研究中有重要意义,还在医学研究和药物研发领域发挥着重要作用。
通过对特定基因的靶向突变,可以深入研究基因的功能和相互作用,为疾病的预防和治疗提供有力的依据。
cre重组酶转基因小鼠原理
CRE recombinase (CRE) 重组酶是一种生物学工具,用于在基因组中定向地编辑和改变基因序列。
它通过识别并损伤两个特定的DNA 目标序列(称为LoxP 序列)来实现这一目的。
CRE 重组酶转基因小鼠是通过将CRE 重组酶基因插入到小鼠基因组中来实现的。
这些小鼠称为CRE 转基因小鼠。
这些小鼠可以用来研究基因编辑和基因疾病,以及药物研发。
在CRE 重组酶转基因小鼠中,CRE 重组酶基因可以被插入到特定基因的启动子区域中,这样CRE 重组酶就能在特定组织或细胞中表达。
这种基因敲除或基因编辑的方法称为条件型基因敲除。
例如,在一种常见的CRE 重组酶转基因小鼠中,CRE 重组酶基因被插入到肝脏中的基因启动子区域中,这样只有在肝脏细胞中才能表达CRE 重组酶。
这种小鼠可以用来研究肝脏疾病的基因编辑疗法。
CRE 重组酶转基因小鼠还可以用来研究其他器官和组织的基因编辑疗法,如心脏、肺、肠、脑等。
这些小鼠也可以用来研究各种疾病的基因编辑疗法,如癌症、遗传性疾病等。
总之, CRE重组酶转基因小鼠是一种重要的生物学工具, 可以用来研究基因编辑和基因疾病,以及药物研发。
它能够在特定组织或细胞中实现基因敲除或基因编辑,进而探究基因对疾病的影响。
CRE重组酶转基因小鼠原理是通过将CRE重组酶基因插入到小鼠基因组中,这样就能在特定组织或细胞中表达CRE重组酶。
CRE重组酶能识别并损伤两个特定的DNA目标序列(称为LoxP序列),实现在基因组中定向地编辑和改变基因序列。
这样就能在特定组织或细胞中实现基因敲除或基因编辑,进而探究基因对疾病的影响。
小鼠人源化模型的建立及其应用近年来,疾病研究领域的新突破源源不断,而其中小鼠人源化模型的建立和应用更是备受关注,成为当前研究的重要方向。
本文将简要介绍小鼠人源化模型的建立方法及其应用,以期为相关科研人员提供帮助。
一、小鼠人源化模型的建立方法人体疾病的研究中,经常需要研究许多保护机制、生化通路和药物效果等重要的生理过程。
而小鼠人源化模型的建立方法主要分为以下两种。
1、转基因小鼠转基因小鼠即通过外源性基因转移技术,将人类基因植入小鼠的基因组中,使其具有与人体相似的生理功能和代谢途径。
这种方法可以实现体内药效评价,例如癌症药物的耐受性测定。
2、人源化小鼠人源化小鼠是将人体的组织和细胞植入到小鼠体内,从而实现人体功能的模拟。
这种方法可以有效模拟肝、胰岛、中枢神经系统等人体组织和器官,用于药物毒理学和人体生理学研究中。
二、小鼠人源化模型的应用1、药物筛选小鼠人源化模型可用于新药物的筛选,通过比较小鼠人源化模型与人体组织的相似度,使药物的疗效得到更客观的评估。
不仅能够预测药物的药效,还可以预测药物的毒性,避免药物的不良反应。
2、疾病研究小鼠人源化模型可以模拟大部分人类疾病,例如肿瘤、血液病、感染病等。
通过对小鼠人源化模型的研究,可以更好地理解疾病的发病机制并寻求新的治疗方法。
3、再生医学小鼠人源化模型可以应用于再生医学的研究,如实现胰岛细胞的移植、肝细胞的再生等。
通过小鼠人源化模型的建立,可以更好地探究人体的再生机制,有望为再生医学的发展提供新的思路和方法。
4、医学教育小鼠人源化模型可以用于医学教育中,帮助医学生更好地理解疾病的发病机制和药物治疗的实践。
通过模拟人体生理状况,医学生可以更好地理解并应用相关医学知识。
三、小鼠人源化模型的局限性小鼠人源化模型具有许多优点,但其中也存在一些局限性。
例如,在转基因小鼠中,不同基因的作用和相互作用需要进一步研究。
在人源化小鼠中,人体组织在小鼠体内的存活时间和制备难度也是局限性之一。