第十三章羧酸不饱和取代羧酸
- 格式:ppt
- 大小:322.50 KB
- 文档页数:61




第十六章 不饱和羧酸和取代羧酸§1. 不饱和酸酸1. α,β-不饱和羧酸的制法⑴ 卤代酸去卤化氢α-卤代酸酯在碱性试剂存在下脱去卤化氢,生成α,β-不饱和羧酸酯。
例如:CH 3(CH 2)92CH 3CH 3Br160~170C H 3C(H 2C)9HC 2CH 3CH 3⑵ 芳香醛的缩合① Knoevenagel 反应: 芳醛在含少量的六氢吡啶的吡啶催化下,与丙二酸一起回流,直接得到α,β-不饱和羧酸。
b5E2RGbCAP C 6H 5CHO + CH 2(CO 2H)2pyridinepiperidine,110C,1hC 6H 5HC CHCO 2H + CO 2 + H 2O②Perkin 反应:C 6H 5CH=O +C O O H 3C C OCH 332-+C 6H 5HC CHCO 2H2. α,β-不饱和羧酸的反应① 1,4-加成H 2C OHXO2CH 2CO 2H)2② 与共轭二烯烃反应+CO 2CH 2CH 3§2 卤代酸1. 卤代酸的制法①α-卤代酸用郝尔-沃耳霍德-泽林斯基反应制备,例如:CH 2OHBr,NBSCHCCl O CHCOR O Br②β-卤代酸由α,β-不饱和羧酸与卤代氢的加成得到:RHC CHCOH O+ HXRCHCH 2COOH2. 卤代酸的反应α-卤代酸及其衍生物中路原子在羰基的影响下,活性增强,容易与各种亲核亲核试剂起反应,生成α-取代羧酸。
p1EanqFDPw ClCH 2O+ Nu -NuCH 2COR O+ Cl -Nu - = HO - ,-CN , -NHR'§3. 醇 酸羧酸分子中饱和碳原子上有羟基的称谓醇酸。
一般根据其来源命名 如:CH 3CH(OH)COOHC 6H 5CH(OH)COOHHOOCH(OH)CH2COOHHOOCCH(OH)CH(OH)COOHHOOCCH 2COH(COOH)CH 2COOH乳酸扁桃酸苹果酸酒石酸柠檬酸1. 醇酸的性质和反应:醇酸分子中含有两个或两个以上的能参与氢键形成的官能团。






第十三章羧酸1. 羧酸的分类自然界存在的脂肪中,含有大量的高级的一元饱和羧酸,因此一元饱和羧酸亦称为脂肪酸。
羧酸在自然界广泛存在,而且对人类生活非常重要,如食用的醋,就是2%的醋酸;日常使用的肥皂,是高级脂肪酸的钠盐;食用的油,是羧酸甘油脂。
2. 羧酸的物理性质低级脂肪酸是液体,可溶于水,具有刺鼻的气味。
中级脂肪酸也是液体,部分地溶于水,具有难闻的气味。
高级脂肪酸是蜡状固体。
无味,在水中溶解度不大。
羧酸沸点高,是因为羧羰基氧的电负性较强,使电子偏向氧,可以接近质子,所以能形成二缔合体。
所有的二元酸都是结晶化合物。
在脂肪二元酸中,单数碳原子的二元酸比少一个碳的双数碳原子的二元酸溶解度大、熔点低,因为单数的二元酸,-COOH 在同一侧。
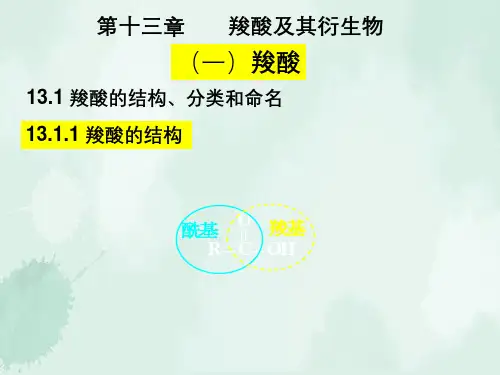
(P 132类比烷烃)3. 羧酸及羧酸盐的结构在羧酸分子中,羧基碳原子以sp 2杂化轨道分别与烃基和两个氧原子形成3个σ键,这3个σ键在同一个平面上,剩余的一个p 电子与氧原子形成π键,构成了羧基中C=O 的π键,但羧基中的-OH 部分上的氧有一对未共用电子,可与π键形成p-π共轭体系。
由于p-π共轭,-OH 基上的氧原子上的电子云向羰基移动,O-H 间的电子云更靠近氧原子,使得O-H 键的极性增强,有利于H 原子的离解。
所以羧酸的酸性强于醇。
当羧酸离解出H沸点:羧酸>醇>醛酮>烃/醚 羧酸:氢键、二缔合体 醇:氢键醛酮:偶极矩大烃/醚:无氢键、偶极矩小后,p-π共轭更加完全,键长发生平均化,-COOˉ基团上的负电荷不再集中在一个氧原子上,而是平均分配在两个氧原子上。
4.羧酸的反应——主要在羧基和α-H上进行(1)酸性羟基氧上的孤电子对可以通过与碳氧双键的共轭,使氧上的电子云向碳氧双键转移,这样的结果是:①使氢氧键之间的电子云进一步向羟基氧原子转移,使氢正离子更易离去;②使形成的羧酸根负离子因电荷分散而更加稳定。
在这样的离域体系中,负电荷分散在两个氧上,形成一个具有4电子三中心的离域π分子轨道,即连个碳氧键的键长相等,为等价的。